miR-548f-5p在急性StanfordA型主动脉夹层患者中的表达及临床意义*
杨立斌,杨 旭,谢林泽,王霁阳,周晓娟,杨 鹏
(云南大学附属医院心血管外科,云南 昆明 650021)
急性Stanford A型主动脉夹层(Type A aortic dissections,TAAD)发病急、病死率高。未经手术,发病24小时内病死率每小时增加1%~2%[1,2]。有发病率上升及年轻化趋势[3],探索其发生及病理改变机制,具有重要意义。
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)功能失调为TAAD可能发病机制之一[4]。在信号转导、基因转录和表观遗传修饰影响下,VSMCs从收缩型转变为合成型,获得再增殖能力,合成与分泌大量细胞因子[5,6],促进胶原蛋白沉积和弹性蛋白降解,导致主动脉壁细胞外基质(extracellular matrix,ECM)变性,降低血管壁强度及弹性,促进主动脉夹层(aortic dissections,AD)发展[5]。
研究表明环状RNA(circRNA)/微小RNA-548f-5p(microRNA-548f-5p,miR-548f-5p)/α-平滑肌肌动蛋白(smooth muscle α-actin,α-SMA)轴调节参与VSMCs表型转化[7],本研究探索miR548f-5p在TAAD患者中的表达及临床意义。现报道如下。
1 资料与方法
1.1 一般资料
选取2020年1月-2020年12月云南大学附属医院TAAD患者10例为观察组,男8例,女2例;年龄41~62(54.6±6.0)岁。冠心病行冠状动脉旁路移植术患者10例为对照组,男7例,女3例;年龄44~62(52.9±5.2)岁。
TAAD组纳入标准:主动脉全程CT血管成像(computer tomography angiography,CTA)、血管造影、核磁血管成像(Magnetic Resonance Angiography,MRA)或心脏彩超确诊为A型主动脉夹层的术前患者,患者和/或家属自愿参与本研究;排除标准:临床资料不完整、标本采集不达标,认知功能障碍。对照组纳入标准:经冠状动脉造影确诊为冠心病,行冠状动脉旁路移植术治疗的患者,患者自愿参与本研究;排除标准:合并主动脉夹层,合并马方综合征(Marfan’s syndrome,MS)、埃勒斯-当洛综合征(Ehlers-Danlos syndrome,EDS)、特纳综合症(Tuner syndrome,TS)、主动脉二叶瓣畸形、家族性主动脉瘤等基因遗传性疾病,合并大动脉炎。本研究经云南大学附属医院医学伦理委员会批准,严格按实验方案进行,并获得所有受试者签署的知情同意书。
1.2 主要试剂与仪器
主要试剂:TRIZOL试剂;RNA酶抑制剂;SuperScriptTM III Reverse Transcriptase、2.5 mM dNTP混合液;2X PCR master mix;α-SMA抗体;HRP标记山羊抗兔IgG;苏木精、山羊血清等。
主要设备:洁净工作台、电热恒温水槽、Gene Amp PCR System 9700、Primer 5.0、QuantStudio5 Real-time PCR System、石蜡切片机、显微镜拍照系统等。
1.3 方法
1.3.1 主动脉壁组织的采集及处理
术中取2组患者主动脉组织,进行RNA提取液浸泡及10%福尔马林固定制备蜡块。
1.3.2 circRNA与miRNA实时定量PCR
取组织标本,Trizol RNA抽提及质检,反转录得到cDNA。反应体系为20 μL,反应条件:95℃,10min;40个PCR循环[95℃,10秒;60℃,60秒(收集荧光)],行2%琼脂糖凝胶电泳,mi-RNA选用 U6为内参照,circRNA选用β-actin为内参,相对表达水平用2-△△CT表示,见表1。
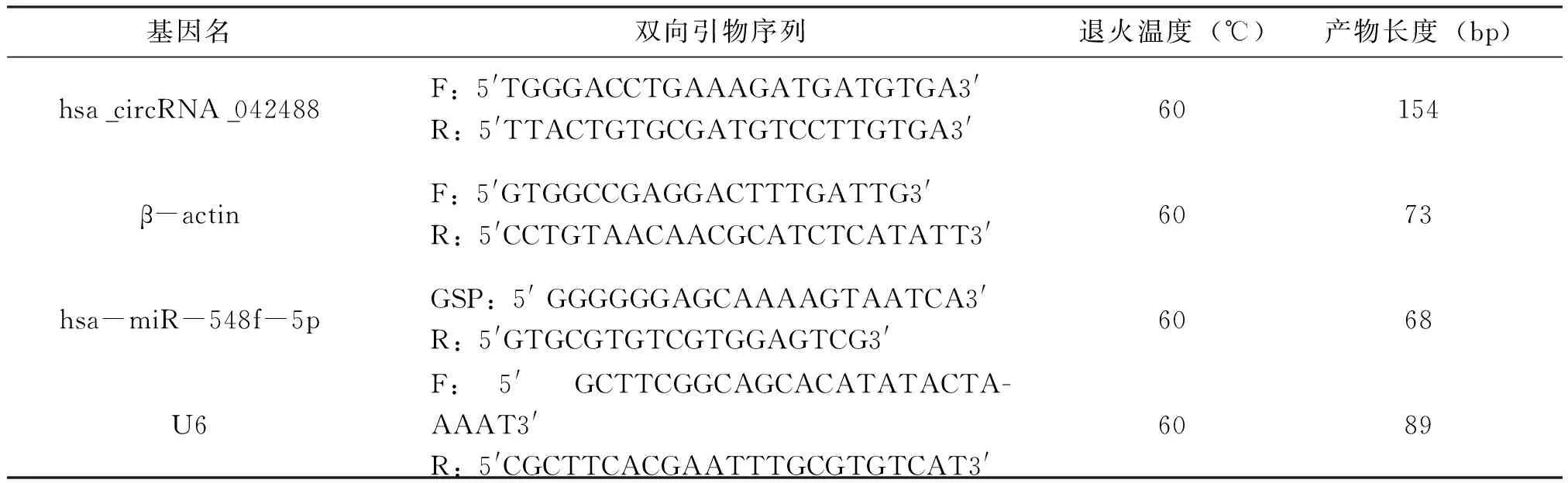
表1 基因名、引物序列、退火温度、产物长度
1.3.3 免疫组化检测主动脉壁组织样本中α-SMA表达,见表1。
2 结果
2.1 一般临床资料,见表2。

表2 研究对象一般临床资料
2.2 纳入样本情况
circRNA与miRNA实时定量PCR每组10个样本,TAAD组1样本因RNA质量检测未通过,未纳入研究;血清中α-SMA表达测定随机选择TAAD组5个样本,对照组5个样本;血管壁组织α-SMA表达测定随机选择TAAD组2个样本,对照组2个样本。
2.3 生物信息预测miR-548f-5p可能结合的circRNA
使用Arraystar Human CircRNA 芯片数据库预测miR-548f-5p可能结合的circRNA,见表3。
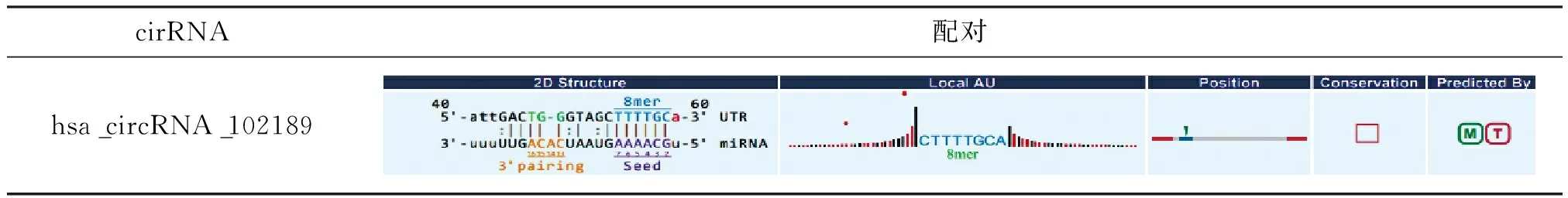
表3 miR-548f-5p可能结合的circRNA
在miR-548f-5p上游预测circRNA中,随机选择了hsa_circRNA_042488进行验证。
2.3 引物特异性的验证及miR-548f-5p、hsa_circRNA_042488表达水平的比较
图1、图2熔融曲线图均为单峰,表明引物靶特异性。主动脉壁组织 miR-548f-5p对照组相对表达量为0.7750±0.23492-△△CT,TAAD组相对表达量为0.4056±0.1791-△△CT,TAAD组miR-548f-5p表达水平较对照组显著下调(P<0.01,见图3)。主动脉壁组织hsa_circRNA_042488对照组相对表达量为1.335±0.7533-△△CT,TAAD组相对表达量为1.242±1.348-△△CT,TAAD组hsa_circRNA_042488表达水平较对照组无显著差异(P=0.85457,见图4)。
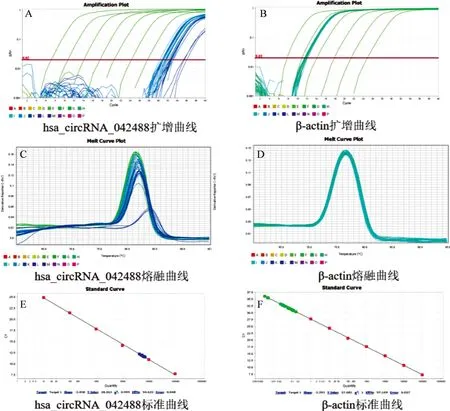
图2 hsa_circRNA_042488及β-actin的熔解曲线及扩增曲线图
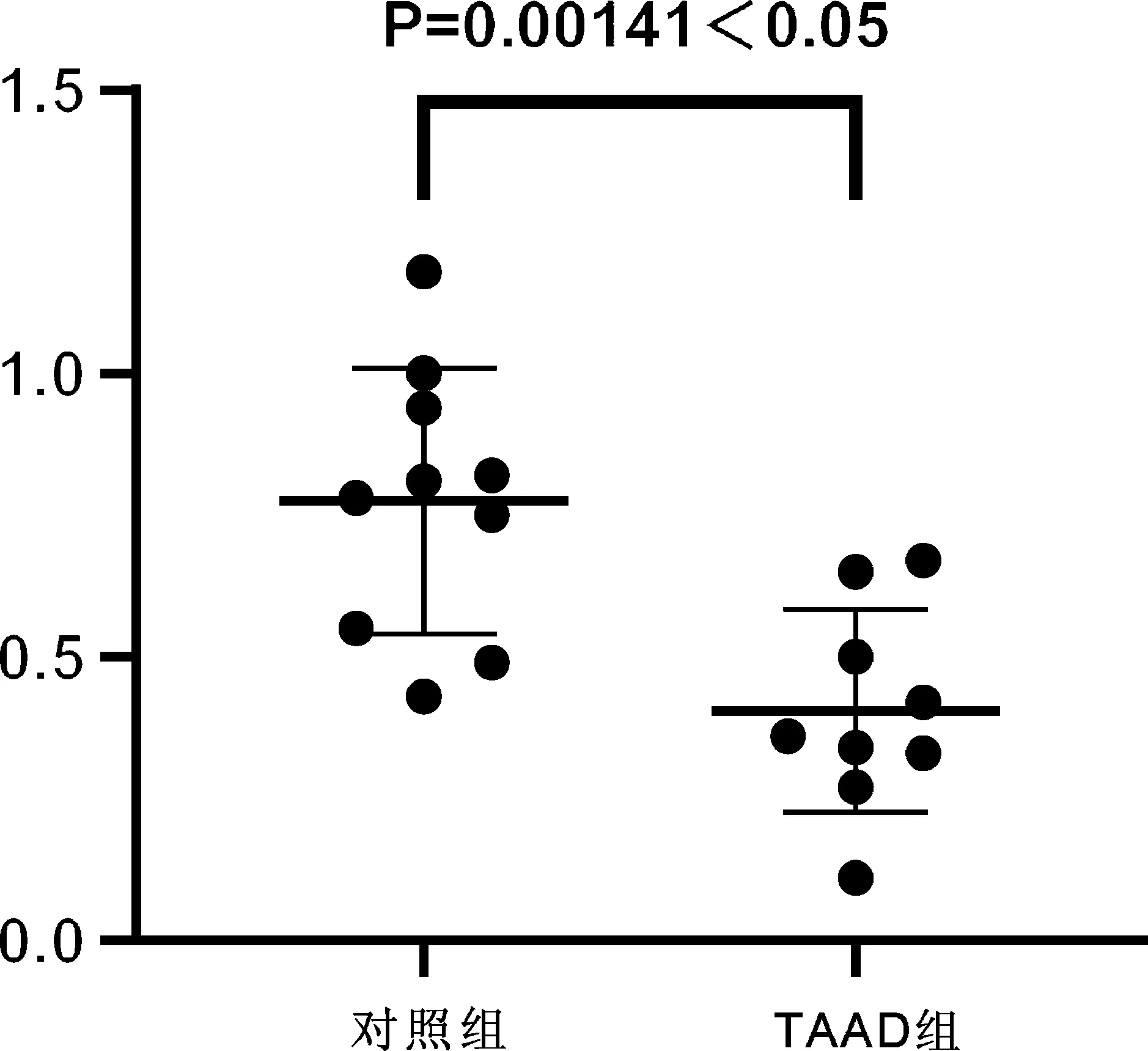
图3 对照组与TAAD组主动脉壁组织miR-548f-5p表达水平比较
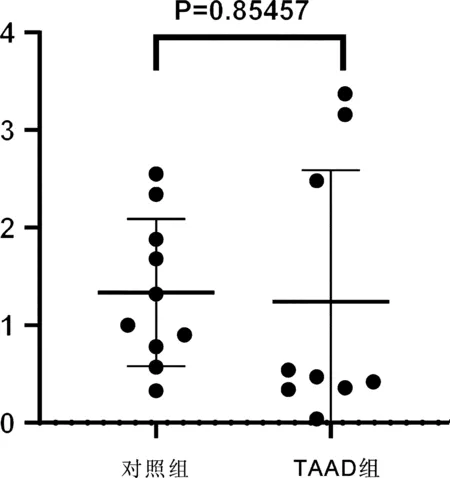
图4 TAAD组与对照组主动脉壁组织hsa_circRNA_042488表达水平比较
2.4 主动脉壁组织样本中α-SMA的表达
免疫组化提示,TAAD的α-SMA在主动脉壁组织中表达水平降低,见图5。

图5 免疫组化法检测α-SMA在主动脉壁组织中的表达
3 讨论
急性主动脉夹层已能快速诊断,但发生机制、生物分子模型、早期诊断标记物尚不明确[1]。circRNA→miRNA→mRNA调节疾病模式构建,可以分析疾病调节的RNA和目标基因,确定诊断和治疗疾病的关键遗传生物标志物,促进疾病的研究进展[8]。
miRNA通过靶向mRNA 的3′-非编码区(3′-UTR)降低 mRNA 的稳定性或者抑制 mRNA 的翻译,进而负调控靶基因的表达[9]。而circRNA 包含大量 miRNA的结合位点,可作为竞争性内源性RNA,通过碱基互补海绵吸附miRNA,调控其靶基因。circRNA呈闭合环状结构,不具有 5′末端帽子和3′末端多聚 A 尾结,核酸外切酶不易将其降解[5],更能稳定存在于细胞内及细胞外液中[10,11],并表现出空间特异性和时间特异性[11];且多数属于内源性非编码 RNA[13,14],其中一些通过 miRNA 反应元件与 miRNA 相互作用,调节靶基因表达。多项研究表明miRNA调节VSMCs表型转化,并因此导致AD的发展。如Yang K等[15]人研究表明,miR-31-5p 显著抑制心肌素(VSMCs 收缩表型的决定因素)水平并加重病理性 VSMCs 表型转换和主动脉瘤/夹层形成,这种作用因醛脱氢酶 2(ALDH2)抑制,ALDH2缺乏与患者和小鼠的主动脉夹层风险较低有关,支持 ALDH2和miR-31-5p 作为 AAD 治疗的新靶点。Huang等[16]人证实AD患者miR-145表达下调,其通过靶向SMAD3(miR-145的靶基因,参与TGF-β通路),诱导VSMC的增殖,迁移和凋亡。Yu Y等[17]发现miR-30a的过度表达可能通过靶向下调赖氨酰氧化酶、弹性蛋白促进了主动脉夹层的发展。Meisheng Zou等[18]人的研究揭示了人类主动脉夹层中数百种不同表达的circRNA,结果表明hsa_circRNA_101238可能抑制TAD中hsa-miR-320a的表达和增加MMP9的表达。
Sun等[7]人的研究表明,circACTA2海绵吸附miR-548f-5p,减轻其对α-SMA表达的抑制,从而上调α-SMA表达,促进人主动脉平滑肌细胞中的应力纤维形成和细胞收缩,但在夹层中尚未报道。本研究应用qRT-PCR检测TAAD患者与对照组动脉壁组织中miR-548f-5p表达水平,发现miR-548f-5p表达在主动脉夹层中显著下调,与主动脉夹层的病变密切相关,miR-548f-5p有可能成为新的TAAD诊断分子标志物。对通过生信分析miR-548f-5p可能结合的hsa_circRNA_042488进行TAAD 组与对照组表达水平比较,发现无显著差异,需增加样本量排除偏倚。后续,可扩大样本对可能成环的其他circRNA进行分别验证。
综上所述,TAAD是一种与多种因素有关的疾病,miR-548f-5p表达在主动脉夹层中显著下调,与主动脉夹层的病变密切相关,有可能成为新的TAAD诊断分子标志物,可能参与主动脉夹层VSMCs表型转化。可行生物信息学分析进一步预测下游的靶基因,亦可对上游可能成环的其他circRNA进一步验证,建立 circRNA/microRNA/mRNA 相互关系图,于动物模型或人类AD 组织中鉴定和验证。

