曲妥珠单抗对乳腺癌患者肝毒性和胃肠道不良反应的Meta分析*
李亚佳,刘玲艳,杨平雄,黄艳华,何功浩△
(1.大理大学药学院,云南 大理 671000;2.解放军联勤保障部队第九二〇医院临床药学科,云南 昆明 650032)
乳腺癌(breast cancer,BC)是严重危害人体健康的恶性肿瘤之一,据2020年流行病学调查显示,全球有226万例BC患者,是最致命的妇女恶性肿瘤[1,2]。此外,BC有多种分型,预后也不尽相同,临床上约有30%的BC患者是人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性,有低分化、侵袭性强、远处转移率高等生物学特点,且临床治疗难度大,总体生存率低[3]。目前临床上针对HER2阳性BC患者,酪氨酸激酶抑制剂(Tyrosine kinase inhibitors,TKI)靶向药物曲妥珠单抗(Trastuzumab,TRA)具有较好疗效。然而随着TRA用药时间的延长和广泛应用,其安全问题尤为值得关注。此外有研究表明TKI靶向药物的肝毒性和胃肠道反应是其主要的副作用[4],但迄今为止关于TRA单用或与之联合用药治疗HER2阳性BC引起的肝毒性和胃肠道不良反应风险的报道较少且研究结果仍存在较大争议[5-10],因此,本文拟进行全面的Meta分析与评价,期望为TRA的临床合理应用提供更多参考依据,现报道如下。
1 资料和方法
1.1 纳入与排除标准
纳入标准:(1)研究类型:国内外公开发表的中英文随机对照试验(randomized controlled trial,RCT);(2)研究对象:组织病理学确诊为HER2阳性BC患者;(3)干预措施:实验组为TRA单用或与其他化疗药物联用,对照组为不使用TRA治疗;(4)结局指标:丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate amino transferase,AST)升高的发生率,腹泻、呕吐、恶心不良反应发生率。排除标准:(1)综述、会议论文、个案报道、信件及动物实验;(2)无上述任何一项结局指标,数据不完整,无法获取全文的研究;(3)重复发表的研究;(4)纳入了其他肿瘤患者的研究。
1.2 检索策略
检索PubMed、Cochrane Library、Embase、Web of Science、中国知网及万方数据库自建库至2022年3月15日,以“HER2 positive breast cancer”、“Trastuzumab”、“Adverse reaction”为英文检索词,以“HER2阳性乳腺癌”、“曲妥珠单抗”、“不良反应”为中文检索词,并追踪相关引文。
1.3 筛选文献和资料提取
由两名研究者按上述标准独立进行筛选,发生分歧时征求第三人意见。提取的数据包括第一作者、发表年份、试验组和对照组样本量、试验组与对照组使用药物、结局指标。
1.4 质量评价
采用Cochrane偏倚风险评估工具对纳入文献的质量进行评价,包括随机序列的产生、分配隐藏、盲法、结局评估的盲法、结果数据的完整性、选择性结局报告和其他偏倚七项,每项均分为“高风险偏倚”“低风险偏倚”和“不清楚”[11]。
1.5 统计学方法
使用RevMan5.3软件进行Meta分析,相对危险度(relative risk,RR)作为计数资料的统计量,95%置信区间(Confidence interval,CI)作为效应量。采用Q检验和I2检验进行异质性分析,若各研究间无显著异质性(P>0.05,I2<50%),使用固定效应模型进行分析;反之则采用随机效应模型。此外,使用敏感性分析评价结果的稳定性;漏斗图评价发表偏倚。
2 结果
2.1 检索结果
初检纳入1179篇潜在相关文献,剔除300篇重复文献,根据纳入与排除标准,通过阅读标题和摘要排除188篇文献后,对剩余文献进行全文阅读,最终纳入23项研究,见图1。
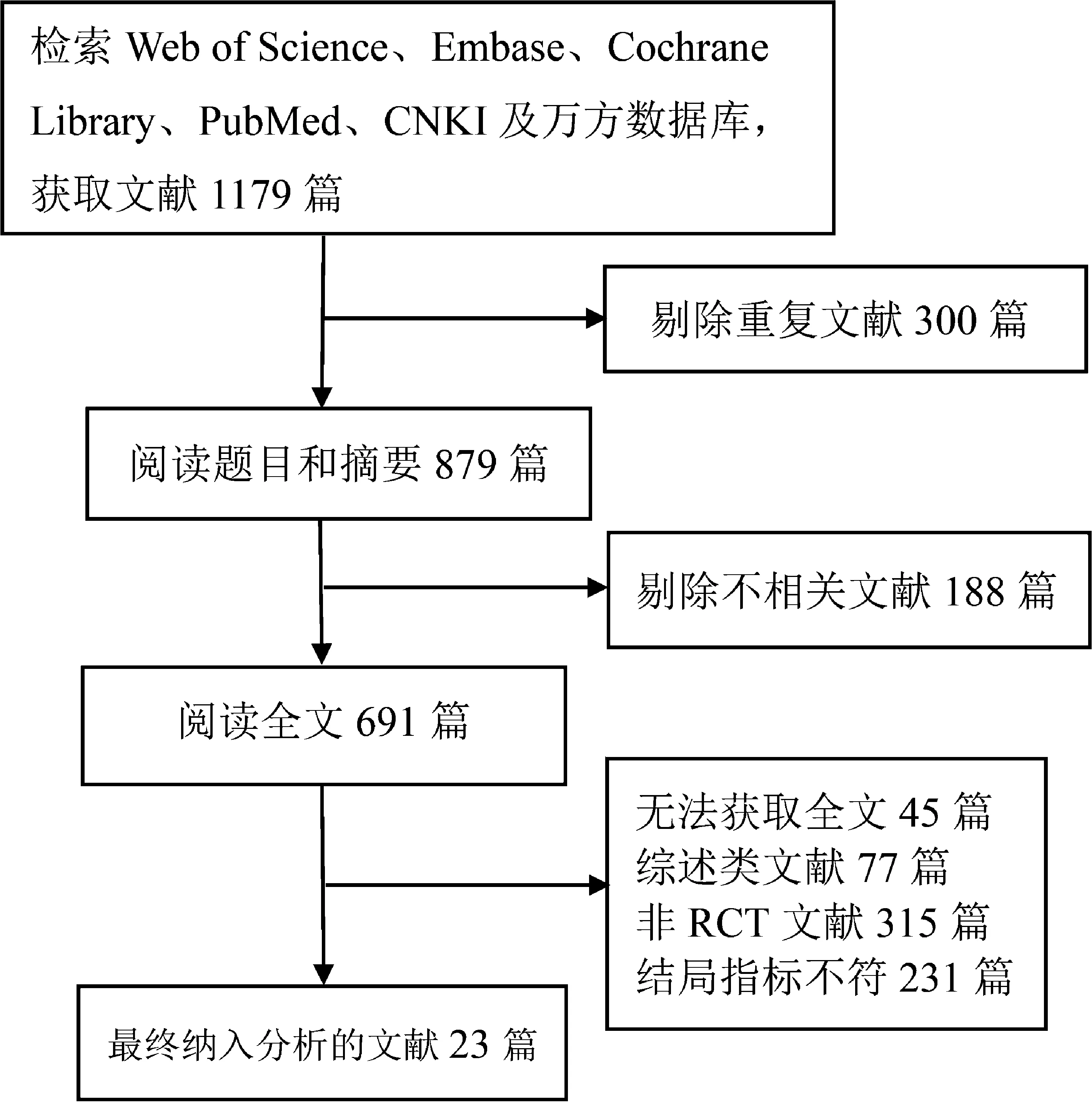
图1 文献筛选流程图
2.2 纳入研究的基本信息和质量评价
共纳入23项RCT研究[5-10,12-28],14173例患者,6项单用TRA研究和17项联合用药研究见表1。23项都描述了随机序列产生的方法,2项描述了分配隐藏;7项对研究者和受试者实施盲法,18项在结局评估时使用盲法,17项结局数据完整,14项未选择性报告结果,20项无法确定是否存在他偏倚来源,见图2。
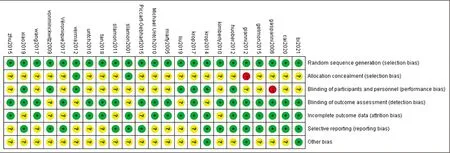
图2 偏倚风险图
2.3 TRA对ALT的影响
4项研究报道了ALT升高。结果表明,TRA组ALT升高发生率显著高于对照组(RR=1.90,95%CI(1.52,2.38),P<0.001)。亚组分析表明TRA单独用药组(RR=1.90,95%CI(1.52,2.37),P<0.001)ALT升高发生率显著高于对照组,而联合用药组则无统计学意义,见图3。敏感性分析提示在剔除异质性较高的文献Krop2017后,差异仍有统计学意义(P<0.001),表明分析结果相对稳定,见表2。

表2 敏感性分析结果
2.4 TRA对AST的影响
4项研究报道了AST升高。结果表明,TRA组AST升高发生率显著高于对照组(RR=2.18,95%CI(1.79,2.65),P<0.001),见图4。

图4 TRA对AST影响的森林图
2.5 TRA对腹泻的影响
24项研究报道了腹泻发生率。结果表明,TRA组和对照组比较腹泻发生率差异无统计学意义。亚组分析表明,TRA单独用药组(RR=0.34,95%CI(0.24,0.47),P<0.001)腹泻发生率显著低于对照组,而联合用药组(RR=1.25,95%CI(1.05,1.50),P<0.01)腹泻发生率显著高于对照组,见图5。敏感性分析提示结果相对稳定,见表2。
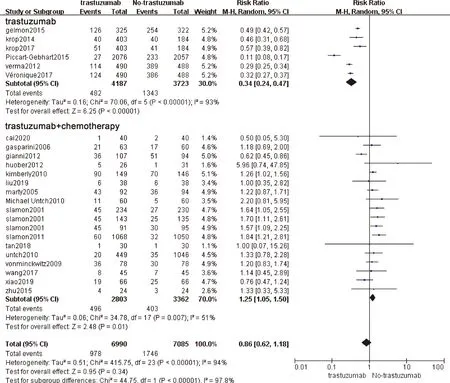
图5 TRA对腹泻影响的森林图
2.6 TRA对恶心的影响
16项研究报道了恶心发生率。合并结果及亚组分析均表明TRA组与对照组比较恶心发生率差异无统计学意义见图6。敏感性分析提示联合用药组分析结果相对稳定;而单独用药组剔除异质性较高的文献Krop2017后,差异有统计学意义(P=0.006),提示分析结果不稳定,见表2。

图6 TRA对恶心影响的森林图
2.7 TRA对呕吐的影响
16项研究报道了呕吐的发生率。合并结果及亚组分析均表明TRA组与对照组比较恶心发生率差异无统计学意义,见图7。敏感性分析提示联合用药组分析结果相对稳定;而单独用药组剔除异质性较高的文献Krop2017后,差异有统计学意义(P<0.001),提示分析结果不稳定性,见表2。

图7 TRA对呕吐的影响
2.9 发生偏倚
本研究对≥10篇的恶心、腹泻和呕吐3个结局指标进行发表偏倚风险评估,漏斗图中心线左右两侧散点的分布均存在不均匀情况,提示存在一定发表偏倚,见图8。
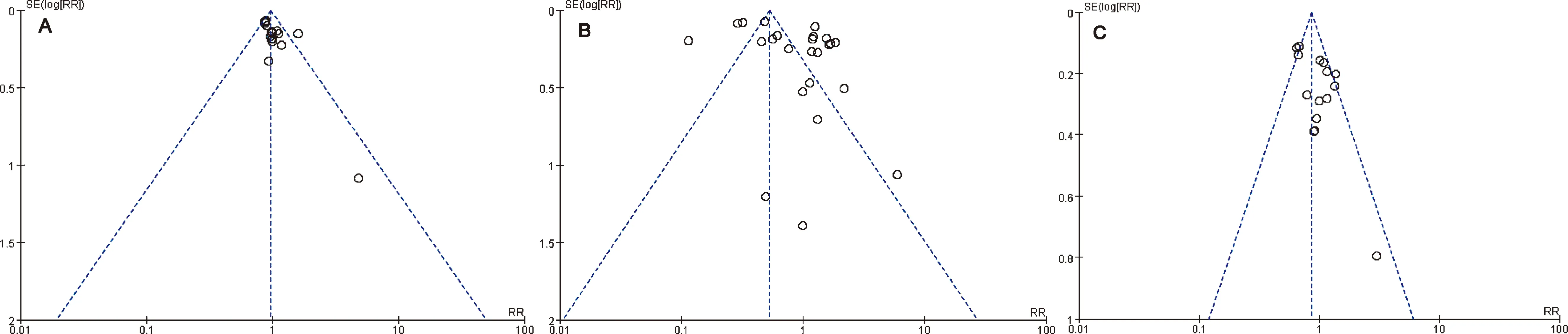
图8 TRA对(A-C)恶心、腹泻、呕吐影响的漏斗图
3 讨论
TRA是治疗BC的主要靶向药物,可显著改善HER2阳性BC患者生存率及预后[29]。据笔者所知,这是目前TRA治疗HER2阳性BC患者安全性评估中样本量最大的Meta分析。
肝毒性分析中,TRA单独用药组与对照组相比,ALT和AST升高的发生率明显增加,而联合用药组与对照组相比,ALT升高发生率没有显著性差异。有研究报道其肝毒性的机制可能是由于TRA与其他免疫球蛋白G抗体一样,可通过网状内皮系统清除[28];另一种可能的机制是TRA通过HER2直接靶向肝细胞,促进TRA诱导产生肝毒性[30]。因此临床医师在今后的临床实践中要更加注意优化TRA的用药流程及用药周期,并注意监测肝功能。
胃肠道不良反应分析中,结果显示TRA单独用药组腹泻发生率显著低于对照组;而联合用药组腹泻发生率显著高于对照组,恶心和呕吐的发生率无统计学差异。据报道TRA与正常细胞上HER2受体的相互作用会导致胃肠道不良反应的发生[31],这种与正常细胞上HER2受体的相互作用可能是胃肠道不良反应的发生机制。总体上,TRA与恶心、呕吐的发生相关性不大,但也应注意胃肠道不良反应的发生。
本研究也存在一定的局限性:(1)研究样本差异较大、不同组间使用对照药物不同,用药方案的剂量和时间等这些混杂因素可能影响最终结果的判断;(2)本文纳入肝毒性的研究较少,研究结果可能存在偏倚,因此还需要更加全面、客观的大样本RCT来进行验证。
综上所述,在使用TRA治疗HER2阳性BC患者过程中,应严密监测患者肝功能和胃肠道不良反应,根据需要及时调整药物的用量或停止使用,未来应积极寻找可能的方法来预防或减轻TRA引起的肝毒性和胃肠道不良反应,以最大限度地减轻患者痛苦。

