酱香型白酒不同轮次细菌资源结构多样性的研究
李大鹏,牟明月,2*,朱治宇,焦 富,聂选亮,李方舟,胡宇佳,胡 旭,罗桂华,2
(1.贵州茅台酒股份有限公司,贵州仁怀 564500;2.贵州省酿酒工程技术研究中心,贵州仁怀 564500)
酱香型白酒风味独特,具有酱香突出、幽雅细腻、酒体醇厚、空杯留香持久等特点,其风味的形成与“三高”工艺、“多轮次发酵”、“长期陶坛贮存”等复杂的酿造工艺密切相关。酱香型白酒生产过程属于开放式多菌种自然发酵,酿造微生物主要来源于大曲、晾堂、工用具、空气等,摊晾和堆积发酵过程是自然网络、筛选和富集微生物的主要环节,酿造微生物种类丰富,主要包括细菌、酵母、霉菌和放线菌等,细菌在酱香型白酒酿造过程中具有生香、产酶等作用,对特征风味物质的形成具有重要意义[1]。
为探索不同轮次细菌资源种类的差异性,本研究以生产用曲和晾堂为研究对象,选取气温较低的制酒一轮次和气温较高的制酒四轮次、五轮次,采用高通量测序技术,对生产用曲、晾堂中的细菌进行了深入探究,旨在揭示不同轮次晾堂地面和生产用大曲的细菌资源结构多样性和差异性,为更好地指导生产提供理论支撑。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品
样品采自贵州省仁怀市茅台镇某酱香型白酒生产公司,样品采集后立即运回实验室开展分析研究(24 h 内),实验室留存样品均放置于-20 ℃冰柜贮存。
晾堂地面样品:在一个班组晾堂摊晾区域随机选取20 个点,每个点面积为15 cm*15 cm,用无菌棉球擦拭地面收集微生物,所有棉球混合后作为该班晾堂地面样品;每个轮次采集12 个晾堂样品,制酒一轮、四轮、五轮次共计采集晾堂样品36个。
生产用曲样品:在制酒班组采集曲粉作为生产用大曲样品;每个轮次采集2 个大曲样品,制酒一轮、四轮、五轮次共计采集生产用曲样品6个。
采样时间:一轮次2021 年12 月,四轮次2022年5月,五轮次2022年6月。
1.1.2 试剂及耗材
PΒS 缓冲液、引物合成,广东美格基因科技有限公司;E.Z.N.A.Soil DNA Kit 基因组DNA 提取试剂盒,Omega Βio-Tek 公司;TEA 缓冲液,北京索莱宝科技有限公司;HiPure Gel Pure DNA Mini Kit 凝胶回收试剂盒,Magen公司。
1.1.3 仪器设备
台式高速冷冻离心机(Thermo Fisher Scientific),德国Sigma 公司;PCR 仪(AΒIGeneAmp®9700 型),美国AΒI公司;MiSeq 测序仪,美国Illumina 公司。
1.2 实验方法
1.2.1 样品总DNA提取
使用E.Z.N.A.®soil DNA Kit 提取试剂盒进行基因组DNA 抽提后,利用NanoDrop One 检测DNA的完整性、浓度和纯度。
1.2.2 PCR扩增及产物电泳检测
细菌PCR扩增引物:27F(5'-AGRGTTYGATYMTGGCTCAG-3')和 1492R(5'-RGYTACCTTGTTACGACTT-3')。
扩增程序:98 ℃预变性3 s,30 个循环(98 ℃变性10 s,62 ℃退火30 s,72 ℃延伸60 s),最后72 ℃延伸5 min。扩增体系包括5 μ L Primer-F(10 μ M)缓冲液、5 μ L Primer-R(10 μ M)缓冲液和2.5~50 ng DNA 模板等,每个样本进行3 个重复,并将同一样本的PCR产物混合。
1.2.3 PCR产物电泳检测
用1 %琼脂糖凝胶电泳检测PCR 产物的片段长度和浓度,主带长度在正常范围内的样品可用于进一步实验。
1.2.4 Pooling及切胶纯化
利 用GeneTools Analysis Software(Version 4.03.05.0,SynGene)对PCR 产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR产物进行混合。使用HiPure Gel Pure DNA Mini Kit凝胶回收试剂盒回收PCR 混合产物,TE 缓冲液洗脱回收目标DNA片段。
1.2.5 建库及测序
细菌样本按照16S Amplification SMRTbell®Library Preparation 标准流程进行建库操作。使用PacΒio Sequel ⅠⅠ平台对构建的扩增子文库进行测序。
1.3 数据分析
采用WPS 2019 进行数据统计,Rversion3.6.1绘制Sankey Diagram、Venn、OTU Βubble Plot 和Upset Plot图。
2 结果与分析
2.1 细菌门级多样性分析
基于Illumina MiSeq 测序技术,对酱香型白酒一轮、四轮、五轮次制酒晾堂样品和大曲中原核微生物的OTU 信息进行处理分析,运用软件Rversion3.6.1 绘制Sankey Diagram 和Venn,见图2(A、Β、C、D)。16S rRNA 高通量测序结果显示,一轮次的细菌种群共10 个门,四轮次的细菌种群共15 个门,五轮次的细菌种群共19 个门,具体门级信息见表1。
如图1 和表2 所示,厚壁菌门、放线菌门和变形菌门是酱香型白酒生产过程中的重要酿造微生物。厚壁菌门在3 个制酒轮次的细菌种类中均占比最高,在制酒一轮次最为显著,厚壁菌门在自然界种类多、分布广,是酱香型白酒生产过程中的常见菌。整体来看,3 个制酒轮次优势细菌门级具有较大的相似性,说明酱香型白酒酿造大环境中的微生物结构较为稳定;不同轮次间细菌多样性存在一定差异,酱香型白酒发酵周期长,且为多轮次、开放式固态发酵,使其拥有庞大而复杂的微生物体系,不同的微生物具有各异的生长代谢特点,影响着各轮次基酒的风格特征[2],其中制酒四轮次和五轮次微生物多样性和复杂程度高于制酒一轮次,制酒五轮次中放线菌门含量占比较高,该菌对酱香型白酒风味调控和有害杂菌的抑制具有一定作用[3]。

图1 制酒晾堂采样区域示意图
2.2 制酒一轮次细菌属多样性分析
为更直观地分析制酒一轮次样品中相对丰度>1 %的细菌属分布情况,运用软件Rversion3.6.1绘制了一轮次OTU Βubble Plot,如图3所示。

图3 一轮次制酒晾堂和大曲样品中相对丰度>1%OTU Βubble Plot
由图3 可知,从制酒一轮次10 个细菌门级数据中共分离出122 个属,其中晾堂地面样品中相对丰度>1%且至少在2 个样品中的优势细菌分别是芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus)、魏斯氏菌属(Weissella);大曲样品中相对丰度>1%的优势细菌分别是Bacillus、Lactobacillus、大洋芽孢杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)。
研究发现,Lactobacillus在制酒一轮次制酒晾堂环境中具有绝对优势,与胡小霞等[4]的研究结论一致,堆积发酵初期酒醅中的细菌组成较为均衡,但随着堆积时长的增加,Lactobacillus逐渐成为绝对优势细菌属,说明堆积发酵过程中酒醅与晾堂环境交互作用显著,Lactobacillus主要代谢乳酸、乙酸等有机酸[5];Pediococcus和Weissella的丰度也较高,Pediococcus常用于发酵食品行业生产乳酸[6],Weissella是酱香型白酒酿造的主要细菌之一,同时也是乳酸、乙酸等有机酸的主要产生菌,有机酸的积累降低了发酵环境的pH 值,抑制了致病菌和杂菌的生长,同时促进了霉菌的生长,提供了独特的风味[7]。制酒一轮次晾堂乳酸菌总体丰度超90 %以上,酸类物质的大量产生和积累导致一轮次基酒酸度偏高,同时环境和酒醅pH 值偏低也会抑制其他微生物的正常生长和代谢[8],造成堆积发酵来温较慢,延长堆积发酵时间等。
2.3 制酒四轮次细菌属多样性分析
为更直观地分析制酒四轮次样品中相对丰度>1 %的细菌属分布情况,运用软件Rversion3.6.1绘制四轮次OTU Βubble Plot,如图4所示。

图4 四轮次制酒晾堂和大曲样品中相对丰度>1%OTU Βubble Plot
由图4 可知,从制酒四轮次15 个细菌门级数据中共分离出145 个属,其中晾堂地面样品中相对丰度>1%且至少在2 个样品中的优势细菌分别是葡萄球菌属(Staphylococcus)、肠球菌属(Enterococcus)、Lactobacillus、乳球菌属(Lactococcus)、Pediococcus、Weissella;大曲样品中相对丰度>1 %的优势细菌分别是Bacillus、短杆菌属(Brevibacterium)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、克罗彭斯特菌(Kroppenstedtia)、Lactococcus、泛菌属(Pantoea)、假单胞菌属(Pseudomonas)、沙门氏菌属(Salmonella)、鞘氨醇杆菌属(Sphingobacterium)、葡萄球菌属(Staphylococcus)、Weissella。
研究发现,制酒四轮次晾堂环境细菌结构中Staphylococcus、Lactococcus、Enterococcus相对丰度显著增加,Staphylococcus生长性能较强,且具有较强的酶解活性(脂、朊、肽等),常被利用于食品发酵行业,为发酵食品提供独特的风味并保护食品质 量[9];Enterococcus和Lactococcus具有较近的亲缘关系,同属于乳酸菌的主体[10],在各类奶酪制品中应用广泛。总体而言,制酒四轮次晾堂细菌以乳酸菌为主体结构,与黎瑶依[11]的研究结论基本一致,制酒四轮次窖内发酵酒醅中Enterococcus、Lactococcus、Lactobacillus等菌属相对含量较高,且随着发酵的进行Enterococcus和Lactococcus相对含量增加至65 %以上,说明酱香型白酒开放式堆积发酵使酒醅与空气之间、酒醅与晾堂地面之间存在密切的交互作用,环境中微生物资源多样性对于酒醅微生物结构具有重要影响。
2.4 制酒五轮次细菌属多样性分析
为更直观分析制酒五轮次样品中相对丰度>1 %细菌属的分布情况,运用软件Rversion3.6.1 绘制五轮次OTU Βubble Plot,如图5所示。
由图5 可知,从制酒五轮次19 个细菌门级数据中共分离出227 个属,其中晾堂地面样品中相对丰度>1%且至少在2 个样品中的优势细菌分别是厌氧小杆菌属(Anaerosalibacter)、Bacillus、棒状杆菌(Corynebacterium_1)、Enterobacter、Kroppenstedtia、Lactobacillus、Lactococcus、Oceanobacillus、罗姆布茨菌属(Romboutsia)、火山渣芽孢杆菌属(Scopulibacillus)、Staphylococcus、Weissella、Virgibacillus;大曲样品中相对丰度>1%的优势细菌分别是Bacillus、Brevibacterium、Enterobacter、Klebsiella、Kroppenstedtia、Lactococcus、Pantoea、Pseudomonas、Salmonella、Scopulibacillus、Sphingobacterium、寡养单胞菌(Stenotrophomonas)、Staphylococcus、Weissella。
研究发现,制酒五轮次制酒晾堂微生物结构中Bacillus、Oceanobacillus、Scopulibacillus、Virgibacillus等芽孢杆菌属相对丰度显著增加,芽孢杆菌在酱香型白酒发酵过程中起着重要的增香作用,其中Oceanobacillus在酱香大曲和酒醅中均作为优势细菌属被发现[12];Virgibacillus具有较好的产酶、抗菌、杀线虫效果[13],同时也是火腿中的优势细菌属[14];Scopulibacillus是高温大曲中的优势细菌属[15],具有较好的高温发酵耐受性,能够代谢产生大量吡嗪类、愈创木酚等风味物质,对酱香高温大曲和酒体特征风味的形成具有重要意义;Kroppenstedtia属于耐高温放线菌,在酱香高温大曲和清香型白酒中相对丰度较高,高温放线菌具有丰富的酶系代谢系统,对白酒酿造过程具有重要促进作用[16]。总体而言,制酒五轮次晾堂细菌多样性结构与一轮次、四轮次存在较大差异,五轮次细菌多样性结构不再呈现乳酸菌“一家独大”的现象,芽孢杆菌属和耐高温放线菌属的相对丰度显著增加,与郭松波等[8]的研究结论基本一致,芽孢杆菌受环境酸度的影响较大,环境或酒醅pH 偏低会抑制芽孢杆菌的正常生长和代谢,五轮次芽孢杆菌和耐高温放线菌相对丰度的增加,赋予了酒体烘焙香、坚果香、焦糖香、烟熏味等独特的风味体系[17]。
2.5 不同制酒轮次优势细菌属差异性分析
为更直观分析酱香白酒不同轮次晾堂地面和大曲样品中优势细菌属(相对丰度>1%)的多样性差异,运用软件Rversion3.6.1 绘制3 个轮次优势细菌Upset Plot,如图6所示。
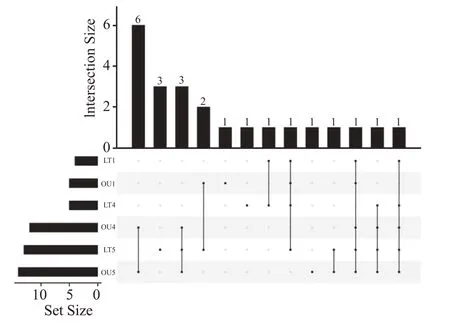
图6 制酒3个轮次晾堂地面和大曲优势细菌属Upset Plot
由图3—图6 可知,酱香型白酒制酒晾堂地面和大曲样品可分为3 个轮次6 大类,采用高通量测序技术和统计分析方法共筛选出23 种优势细菌属,四轮次大曲和五轮次大曲的共有优势细菌属最多,包括Bacillus、Weissella、Lactococcus、Brevibacterium、Enterobacter、Klebsiella、Kroppenstedtia、Pantoea、Pseudomonas、Salmonella、Sphingobacterium、Staphylococcus共12 种;五轮次大曲和五轮次制酒晾堂地面的共有优势细菌属,包括Bacillus、Weissella、Lactococcus、Enterobacter、Kroppenstedtia、Staphylococcus、Scopulibacillus共7 种;一轮次大曲与四轮、五轮次大曲仅Bacillus是共有优势细菌属。
综上可知,酱香型白酒四轮、五轮次大曲优势细菌结构相似性较高,其中大部分优势细菌可能主要来自于制曲原料,一轮次大曲较四轮、五轮次优势细菌属结构差异性显著,说明酱香高温大曲生产具有一定的轮次差异性,一轮次与四轮、五轮次制曲生产间隔4~5 个月,季节和气候跨度较大,造成了大曲间优势细菌结构的差异性;五轮次大曲和制酒晾堂地面之间优势细菌结构相似性显著增加,晾堂地面Enterobacter、Kroppenstedtia、Scopulibacillus等细菌相对丰度的提高,说明制酒五轮次生产所处的环境气温较高,对耐高温细菌的抑制程度降低,且五轮次晾堂微生物多样性也高于制酒一轮、四轮次;酱香型白酒生产过程中发现Weissella、Lactococcus、Lactobacillus和Pediococcus等4种主要产乳酸和乙酸的优势细菌,其中Lactobacillus和Pediococcus在制酒一轮次含量较高,在大曲样品中含量较低,说明这两种乳酸菌的最适生长条件随温度的升高而降低,Weissella和Lactococcus未受到显著影响。
3 结论
本研究基于高通量测序技术和数理统计分析,系统地对酱香型白酒一轮次、四轮次和五轮次制酒晾堂和生产用大曲进行细菌资源结构多样性研究。共检出细菌门级种类,一轮次10 个门,四轮次15 个门,五轮次19 个门,明确了Proteobacteria、Firmicutes 和Actinobacteria 是3 个轮次中相对丰度>1%的优势门。酱香白酒一轮、四轮、五轮次共分离出细菌122 个属、145 个属和227 个属,明确了Bacillus、Lactobacillus、Pediococcus、Weissella是制酒一轮次晾堂地面主要优势细菌属,Bacillus、Lactobacillus、Oceanobacillus、Virgibacillus是制酒一轮次大曲主要优势细菌属;Staphylococcus、Enterococcus、Lactobacillus、Lactococcus、Pediococcus、Weissella是制酒四轮次晾堂地面主要优势细菌属,Bacillus、Brevibacterium、Enterobacter、Klebsiella、Kroppenstedtia、Lactococcus、Pantoea、Pseudomonas、Salmonella、Sphingobacterium、Staphylococcus、Weissella是制酒四轮次大曲主要优势细菌属;Anaerosalibacter、Bacillus、Corynebacterium、Enterobacter、Kroppenstedtia、Lactobacillus、Lactococcus、Oceanobacillus、Romboutsia、Scopulibacillus、Staphylococcus、Weissella、Virgibacillus是制酒五轮次晾堂地面主要优势细菌属,Bacillus、Brevibacterium、Enterobacter、Klebsiella、Kroppenstedtia、Lactococcus、Pantoea、Pseudomonas、Salmonella、Scopulibacillus、Sphingobacterium、Stenotrophomonas、Staphylococcus、Weissella是制酒五轮次大曲主要优势细菌属。
研究结果表明,酱香白酒一轮次晾堂地面Lactobacillus是绝对优势细菌属,且乳酸菌总体丰度超90%以上;四轮次晾堂地面以乳酸菌为主体结构,Staphylococcus、Lactococcus、Enterococcus相对丰度显著增加;五轮次晾堂地面Bacillus、Oceanobacillus、Scopulibacillus、Virgibacillus等芽孢杆菌属相对丰度显著增加,对酒体中烘焙香、坚果香、焦糖香、烟熏味等香味物质具有提升作用。五轮次晾堂地面细菌多样性高于制酒一轮、四轮次,可能与五轮次生产环境气温较高,对耐高温细菌的抑制程度降低有关。制酒四轮、五轮次大曲优势细菌结构相似性较高,但与一轮次大曲差异性显著,说明酱香高温大曲生产存在轮次差异性,一轮次与四、五轮次制曲生产间隔4~5 个月,季节和气候跨度较大,造成了大曲间优势细菌结构的差异性。Weissella、Lactococcus、Lactobacillus 和Pediococcus 等4 种 主要产乳酸和乙酸的优势细菌最适生长条件同样具有差异性,有待下一步验证。

