汞胁迫对蔬菜土壤细菌和真菌群落结构及丰度的影响
王喜英 赵辉 卢志宏 谭智勇 宋希娟
摘要:汞(Hg)是一种广泛存在于土壤环境中的全球污染物之一,土壤微生物对汞胁迫的敏感性强于动植物,可从微生物角度为蔬菜土壤汞污染生态风险评估提供科学依据。采用盆栽试验,应用荧光定量PCR和高通量测序(Illumina HiSeq)技术,分析对照(CK)、低浓度汞(T1)、中浓度汞(T2)和高浓度汞(T3)胁迫处理下蔬菜土壤hgcA基因数量、细菌数量、真菌数量和群落结构变化特征。结果表明,T1处理增加细菌和hgcA基因数量,分别比CK、T2和T3提高了37.48%和 12.01%、57.31%和 19.37%、88.85%和14.82%。汞胁迫降低了真菌数量,其中T2处理降低最显著。T3处理降低了土壤细菌群落α多样性指数(丰富度和多样性),T1处理降低了土壤真菌群落α多样性指数(丰富度和多样性)。土壤细菌门水平上,共获得18个类群,其中放线菌门、变形菌门和绿弯菌门为优势类群,且在不同处理间差异极显著。T2和T3处理分别显著增加了变形菌门和放线菌门相对丰度。绿弯菌门相对丰度均表现随汞浓度增加逐渐递减的趋势。土壤真菌门水平上,共获得9个类群,其中子囊菌门、被孢菌门和担子菌门为优势类群,其相对丰度共占真菌群落的94.64%。随着汞浓度增加,子囊菌门相对丰度递增,被孢菌门相对丰度递减。担子菌门在 T1 处理中最高(5.40%)。土壤pH值、铵态氮含量、硝态氮含量和全汞含量与土壤细菌数量、细菌和真菌群落结构有显著关系。综上,汞胁迫对蔬菜土壤hgcA基因、细菌和真菌数量有显著影响,高汞胁迫造成了土壤细菌多样性减少,细菌和真菌群落结构和组成发生变化,而细菌群落对汞胁迫的敏感性强于真菌。
关键词:汞;蔬菜土壤;hgcA基因;细菌;真菌;高通量测序
中图分类号:S182文献标志码:A
文章编号:1002-1302(2023)14-0229-11
汞是一种危险和持久性的环境污染物,可在大气中转化和长距离运输,最终在食物链中积累,危害人类身体健康。在农业生产中,施用的化肥、石灰、污泥、肥料、除草剂和杀菌剂等,已经成为土壤汞的重要来源之一[1]。汞在土壤中的毒性高度依赖于其化学种类,甲基汞化合物被认为是毒性最大的物种[2]。土壤汞的甲基化主要通过环境中微生物转化而成,hgcA作为汞甲基化生物标志物,常用来评估土壤中潜在汞甲基化微生物[3]。土壤微生物可以快速响应土壤环境胁迫变化,对土壤污染程度具有重要的指示作用[4-5]。研究表明,微生物对重金属胁迫比植物更敏感[4]。关于汞对土壤微生物影响的研究很少,且更多集中在细菌群落[6-9]。在重金属污染物胁迫下,微生物數量减少甚至死亡,或变成抗性优势群[10]。在重金属污染土壤中,强耐受性微生物相对丰度增加,敏感微生物逐渐减少,土壤生态系统逐渐退化,并出现新物种[11]。Harris-Hellal等研究表明,在低汞浓度(0.1 mg/kg)条件下,土壤微生物群落变化不明显,在高汞浓度(20 mg/kg)下土壤微生物群落功能多样性和遗传结构发生变化[12]。Xie等研究发现,随着汞浓度的增加,土壤中革兰氏阳性菌与革兰氏阴性菌比例逐渐增加[13]。Frossard等通过研究不同汞浓度(0.32、3.2、32 μg/g)对森林土壤细菌和真菌群落的影响,发现最高汞浓度造成微生物群落结构和多样性变化[14]。Wang等研究表明,在高浓度汞处理下,随培养时间增加,微生物群落丰富度逐渐下降,而低浓度汞和中低浓度汞对土壤微生物群落均匀性影响不大[11]。Liu等评估汞污染对水稻土壤细菌多样性的影响,发现在中等汞浓度下细菌多样性最高,表明中等干扰下生物多样性达到峰值[15]。Rajapaksha等研究认为真菌通常比细菌对重金属更耐受[16]。然而,关于汞对土壤真菌数量和群落结构的影响及其驱动因素,尚缺乏深入的研究。
蔬菜已经成为人们饮食必不可少的食物之一。汞成为菜地污染最严重的重金属之一[17]。白菜在我国种植面积广泛,对金属富集作用强于其他非叶蔬菜,对生态系统和人类构成了更大威胁[18]。目前,汞对土壤细菌和真菌群落结构的影响更多集中在水稻和森林等植物[15,19],同时,关于hgcA基因丰度的研究更多的是在厌氧环境[20-22],但在蔬菜土壤等非厌氧环境中研究较少。因此,本研究采用盆栽试验,应用荧光定量PCR和Miseq高通量测序,研究汞胁迫下蔬菜(白菜)土壤hgcA基因数量、细菌和真菌数量、群落组成及其环境驱动因素,揭示土壤微生物对汞胁迫的响应机制,从微生物角度为蔬菜汞胁迫的生态评估及生物预警提供科学依据。
1 材料与方法
1.1 供试土壤
土壤样品采集于贵州省铜仁市碧江区(109°13′12″E,27°47′30″N)典型菜地黄壤土。从表层0~20 cm收集新鲜土壤去除植物残体砾石等,风干后过2 mm筛用作盆栽试验。土壤基本理化性质:pH值为6.56,有机碳含量为17.05 g/kg,全氮含量为1.63 g/kg,速效钾含量为46.59 mg/kg,速效磷含量为16.92 mg/kg和全汞含量为0.331 mg/kg。
1.2 试验设计
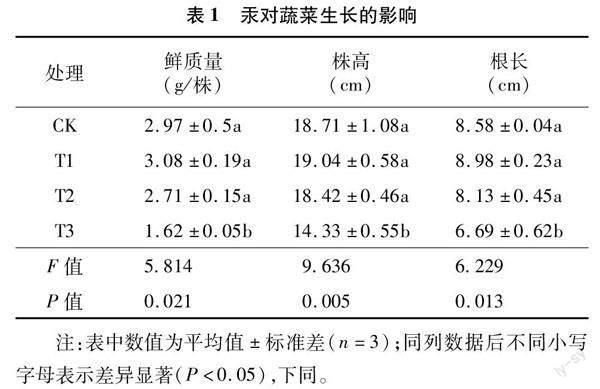
以HgCl2为汞源,设置4个汞浓度组(0、1、10、50 mg/kg),分别代表对照(CK)、低汞(T1)、中汞(T3)和高汞(T3)浓度污染土壤。每个处理重复3次,共计12个处理,将土壤样品混合均匀后,装入高21 cm、上口直径21 cm 塑料盆中,盆栽用土 5 kg。为保持添加的汞趋于均匀稳定且被土壤充分吸附,土壤老化时间为90 d,同时保持土壤含水量在60%。老化结束后,栽种试验于2021年4月在铜仁学院温棚进行,供试小白菜品种购自天津市宏丰蔬菜研究有限公司。每盆栽种10粒,白菜出苗后,每盆留苗4株。白菜生长期间管理水平一致,为避免水中汞进入,均采用蒸馏水浇灌,同时保持土壤田间持水量为60%。在白菜生长60 d时,进行植株和土壤样品采集。白菜测量鲜质量、株高和根长等指标(表1)。土样采集后,去除植物根系并过2 mm筛后,分为2份,1份用于土壤铵态氮和硝态氮含量测定,其余风干土壤用于全汞含量和理化指标分析;1份-20 ℃冰箱保存用于土壤微生物分析。
1.3 测定项目及方法
1.3.1 土壤全汞含量和理化指标测定
土壤全汞(THg)含量采用王水水浴消化,原子荧光光度计测定[23]。参照鲍士旦的《土壤农化分析》对土壤理化指标进行测定[24]:采用电位法测定pH值;采用重铬酸钾氧化法测定有机碳(SOC)含量;采用凯氏定氮法测定全氮(TN)含量;采用靛酚蓝比色法测定铵态氮(NH+4-N)含量;采用酚二磺酸比色法測定硝态氮(NO-3-N)含量;采用碳酸氢钠浸提-钼锑抗比色法测定速效磷(AP)含量;采用乙酸铵提取-火焰光度法测定速效钾(AK)含量。
1.3.2 土壤DNA提取
采用DNA提取试剂盒(Omega,GA,USA),按照试剂盒步骤进行提取。用核酸定量仪(NanoDrop ND-2000)对DNA浓度和纯度进行检测。
1.3.3 土壤细菌、真菌、hgcA基因荧光定量PCR
利用实时荧光定量PCR(qPCR)技术对细菌(16S rRNA)、真菌(ITS)、hgcA基因丰度进行分析,细菌16S rRNA基因的 V3-V4区扩增引物为338F(5′-ACTCCTACGGGAGGCAGCAC-3′)与519R(5′-GGACTACNNGGGTATCTAAT-3′)[19]。真菌ITS扩增引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)[25];hgcAF(5′-GCCAACTACAAGMTGASCTWC-3′)与hgcAR(5′-CCSGCNGCRCACCAGACRTT-3′)[26]。每个PCR扩增样品重复3次,通过Minipre Kit获得样品质粒,根据样品质粒的标准曲线,分别计算基因拷贝数。
1.3.4 高通量测序
采用2%琼脂糖凝胶电泳检测PCR产物。利用Illumina MiSeq平台对细菌16S rRNA、真菌ITS进行测序(上海派森诺生物科技有限公司)。对原始数据进行质量控制后,在97%相似度水平下进行OTU划分和归并。应用RDP-classifier分别在16S rRNA和真菌ITS数据库中对97%相似水平的OTU代表序列进行分类注释。使用Mothur软件分别对细菌和真菌群落的α多样性指数进行分析。
1.4 数据分析
采用SPSS 21.0统计软件对土壤全汞含量和理化性质、hgcA基因数量、细菌和真菌数量、群落α多样性指数、群落组成相对丰度进行方差分析和显著性检验(P<0.05);使用SPSS 21.0和R软件进行相关性分析。使用R软件进行土壤细菌和真菌群落结构聚类分析、主坐标分析和冗余分析。
2 结果与分析
2.1 土壤全汞含量和理化性质
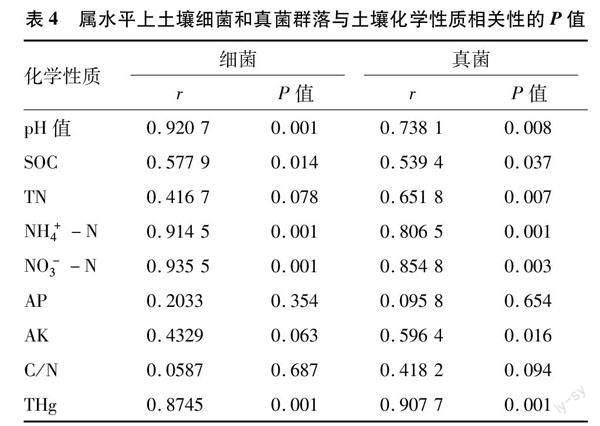
随汞浓度增加,土壤全氮和铵态氮含量总体呈现递增趋势,其中CK处理的全氮含量分别与T1、T2和T3差异显著;CK处理的铵态氮含量分别与T2和T3差异显著。汞浓度增加,导致土壤pH值趋于中性且T3处理显著高于其他处理。土壤有机碳含量在T1和T2处理均小于CK,但T3处理显著增加。硝态氮含量随汞浓度增加呈递减趋势,且CK分别与T2和T3之间差异显著。土壤速效磷、速效钾含量和C/N 比均是CK处理最高。土壤全汞含量大小顺序为T3>T2>T1>CK,且T2和T3分别与T1和CK之间差异显著(表2)。
2.2 土壤细菌、真菌和hgcA基因丰度
由图1可知,细菌16S rRNA基因丰度在不同处理中差异显著。不同汞浓度下细菌16S rRNA基因拷贝数为1.35×109~2.54×109/g干土,且相互之间差异显著。T1处理显著增加了细菌数量,比CK提高了37.48%。T2和T3处理显著低于CK,分别比CK降低了12.61%和19.79%。真菌ITS基因拷贝数为0.83×108~1.99×108/g干土。汞添加降低了真菌数量,CK处理中真菌ITS基因拷贝数高于其他处理,与T1处理差异不显著,分别是T2和T3处理的2.39倍和1.48倍。各处理土壤中均检测出hgcA基因,范围为6.9×105~8.24×105/g干土。hgcA基因拷贝数随汞浓度增加而有所不同,在T1处理最高,与CK差异不显著,与T2和T3差异显著。
为明确汞污染下蔬菜土壤细菌16S rRNA、真菌ITS和hgcA基因拷贝数差异的影响因素,分别与土壤理化性质进行相关性分析(图2)。细菌16S rRNA基因拷贝数分别与土壤pH值、铵态氮含量呈极显著负相关关系;与有机碳、速效磷和总汞含量呈显著负相关关系;与硝态氮含量呈极显著正相关关系。真菌ITS基因拷贝数与全氮含量呈显著负相关关系;与碳氮比呈显著正相关。hgcA基因拷贝数与土壤pH值呈显著负相关关系。
2.3 土壤细菌和真菌测序结果及其α多样性指数
由表3可知,土壤细菌和真菌覆盖度均在0.98以上,测序结果可以真实反映各处理土壤微生物群落特征。土壤细菌和真菌中CK、T1、T2和T3获得质控后序列数分别为88 856(116 967)、83 655(110 772)、84 090(112 434)和88 335(113 698)。土壤细菌OTUs随汞浓度增加逐渐减少。CK处理土壤细菌和真菌OTUs均最多,分别为3 781、622个;土壤细菌CK处理与T3之间差异显著;土壤真菌CK处理分别与T1、T2和T3之间差异显著。说明汞浓度增加改变了蔬菜土壤细菌和真菌OTUs水平上的物种组成,且土壤真菌变化更加明显。
土壤细菌α多样性指数均大于真菌。随汞浓度增加,土壤细菌Chao1指数和ACE指数均表现出先增加后降低趋势,表明低汞浓度有利于土壤细菌群落丰富度增加。 T3处理Chao1指数和ACE指数均显著低于其他处理,说明土壤细菌丰富度受到高浓度汞污染的影响严重。Shannon指数和Simpson指数变化趋势相同,随汞浓度增加逐渐降低;其中,CK、T1和T2处理之间变化不明显,T3处理显著低于其他处理。土壤真菌α多样性指数均是T2处理最高,其中Chao1指数、ACE指数和Shannon指数是T1处理最小,且T2与CK和T3之间差异不明显,T2与T1差异显著。Simpson指数随汞浓度增加表现先增加后降低趋势,且T2与CK差异显著。可知,低汞胁迫对土壤细菌群落的多样性和丰富度有促进作用,对土壤真菌群落的多样性和丰富度有抑制作用。
相关性分析结果(图2)表明,土壤细菌Chao1指数、ACE指数、Shannon指数和Simpson指数分别与土壤pH值、铵态氮和总汞含量呈极显著负相关关系,与硝态氮含量呈极显著正相关关系,与速效钾含量呈显著正相关关系。Chao1指数和ACE指数与有机碳含量呈显著负相关关系。Chao1指数与速效磷含量呈显著负相关关系。Shannon指数和Simpson指数分别与有机碳含量呈极显著负相关关系。土壤真菌Chao1指数与速效磷含量呈显著正相关关系。Simpson指数与碳氮比呈显著负相关关系。
2.4 土壤细菌和真菌群落组成
通过对汞胁迫下蔬菜土壤样品OTUs进行归类,土壤细菌得到18个门、50个纲、114个目、172个科和262个属。土壤真菌得到9个门、20个纲、47个目、91个科和139个属。在细菌门水平上,将平均相对丰度<1%类群归类为其他,得到6个类群(图3-a),分别为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)和厚壁菌门(Firmicutes),其中放线菌门、变形菌门、绿弯菌门、酸杆菌门和芽单胞菌门在不同处理之间有极显著差异(P<0.01)。放线菌门(59.56%~68.99%)、变形菌门(16.67%~19.43%)和绿弯菌門(3.95%~7.22%)为优势菌门,占细菌总类群相对丰度的84.96%~89.62%。放线菌门相对丰度在T3处理中最高,分别是CK、T1和T2的1.13倍、1.16倍和1.15倍。变形菌门相对丰度随汞浓度增加表现先增加后减少,在T2处理最高(19.43%),T3处理最低(16.67%)。绿弯菌门和酸杆菌门相对丰度均表现出随汞浓度增加逐渐递减,在T3处理最低(3.95%和3.01%),分别比CK降低了45.21%和50.2%。芽单胞菌门在T1处理最高(4.43%),T3处理最低(2.92%)。厚壁菌门相对丰度在不同处理中差异不显著,CK最低(1.91%),T2处理最高(2.51%)。在属水平上,得到相对丰度在1%以上的10个类群(图3-c),分别为链丝菌属(Streptomyces)、小单孢菌属(Micromonospora)、类诺卡氏菌属(Nocardioides)、Subgroup_6、芽单胞菌属(Gemmatimonas)、67-14、KD4-96、Gaiella、滨田氏菌属(Hamadaea)和Marmoricola。其中,链丝菌属、小单孢菌属和类诺卡氏菌属为优势菌属,相对丰度分别为2.42%~27.42%、5.72%~8.17%和4%~6.6%。随汞浓度增加,链丝菌属相对丰度显著增加,T1、T2和T3分别是CK的1.31倍、3.85倍和11.44倍。小单孢菌属相对丰度在T3处理显著高于其他处理,比CK增加了20.86%。汞添加降低了类诺卡氏菌属相对丰度,其中T3处理降低幅度最大,且与其他处理之间差异极显著。
在门水平上,真菌群落相对丰度达到1%以上的类群有3个,分别为子囊菌门(Ascomycota,平均相对丰度80.94%)、被孢菌门(Mortierellomycota,平均相对丰度10.33%)和担子菌门(Basidiomycota,平均相对丰度3.37%)(图3-b)。随汞浓度增加,子囊菌门相对丰度递增,被孢菌门相对丰度递减。子囊菌门和被孢菌门在不同汞浓度处理中差异极显著,子囊菌门相对丰度在T3处理最高(91.92%),分别比CK、T1和T2增加了28.7%、17.22%和12.09%。被孢菌门相对丰度在T1、T2和T3处理中,分别比CK减少了30.37%、42.04%和98.51%。担子菌门相对丰度随汞浓度增加表现为先增加后减少趋势,大小顺序为T1>CK>T2>T3。属水平上,相对丰度大于1%的类群为镰刀菌属(Fusarium)、被孢霉属(Mortierella)、扁孔腔菌属(Lophiostoma)、螺旋聚孢霉属(Clonostachys)、小不整球壳属(Plectosphaerella)和圆孢霉属(Staphylotrichum),且不同处理间差异显著(图3-d)。其中,镰刀菌属和被孢霉属为优势类群,相对丰度分别为12.78%~33.26%和0.27%~18.94%。镰刀菌属相对丰度随汞浓度增加显著递增,T1、T2和T3分别比CK增加了30.75%、46.32%和162.25%。被孢霉属相对丰度在汞添加处理中均小于CK(18.94%),T3处理最低(0.27%)。汞添加显著增加了扁孔腔菌属和螺旋聚孢霉属相对丰度,其中扁孔腔菌属相对丰度在T2处理最高(6.33%),螺旋聚孢霉属在T3处理最高(7.31%)。汞添加降低了小不整球壳属和圆孢霉属相对丰度,汞浓度越高抑制作用越强。
2.5 土壤细菌和真菌群落的层次聚类和PCoA分析
汞胁迫下土壤细菌和真菌的层次聚类树如图4所示。不同处理土壤细菌和真菌群落结构差异明显。土壤细菌和真菌除T1外,其他处理3个重复聚类在一起。其中,CK和T1处理之间距离较近。T3与CK和T1处理之间距离较远。PCoA分析进一步证实了汞胁迫处理土壤细菌和真菌群落结构差异明显。PCoA1和PCoA2对细菌和真菌群落分别解释了总变异的43.5%(24.8%)和14.3%(23.5%)(图5)。CK、T1和T2距离较近,说明土壤细菌和真菌群落结构相似度较高。T3和其他处理在不同象限内,T3与CK、T1和T2相距较远,说明高浓度汞胁迫对土壤细菌和真菌群落影响最大。
2.6 土壤细菌和真菌群落结构与环境因子的关系
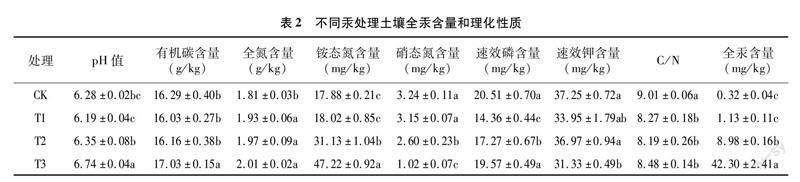
本研究在土壤细菌和真菌属水平上与土壤理化性质进行了冗余分析(图6)。RDA1和RDA2分别解释了土壤细菌群落变异的93.52%和3.09%,前两轴解释了总变异的96.61%。RDA1和RDA2分别解释了土壤真菌群落变异的82.13%和7.55%,前两轴解释了总变异的89.68%。由表4可知,土壤pH值、铵态氮含量、硝态氮含量和全汞含量对细菌和真菌群落结构有极显著影响,有机碳含量对细菌和真菌群落结构有显著影响,全氮含量对真菌群落结构有极显著影响, 速效钾含量对真菌群落结构有显著影响。
3 讨论与结论
3.1 汞胁迫对蔬菜土壤细菌、真菌和hgcA基因丰度的影响
重金属污染由于降解性低,给土壤带来了严重的环境恶化问题,通过功能干扰、蛋白质变性或细胞膜破坏影响微生物生长和代谢,抑制微生物活性,导致土壤微生物总量下降[8]。
本研究土壤细菌数量(CK除外)随汞浓度增加表现递减趋势,与Zheng等研究结果[19]一致。T1处理土壤细菌数量显著高于其他处理,可能由于低浓度汞处理蔬菜土壤pH值较低,降低了汞的生物利用度和甲基化,对土壤钾和磷的释放有促进作用,有利于植物生长[27-28]。植物长势好,根系分泌物多,可以促进细菌数量增加[29]。Frossard等研究也认为,小于3.2 mg/kg的汞浓度对土壤细菌数量没有显著抑制作用[14]。本研究T1处理的汞浓度较低,对植物生长和土壤细菌还未起到抑制作用,说明该汞浓度未超过阈值。相关性分析表明,土壤细菌数量与总汞含量呈负相关,Hg污染抑制微生物生长,与Liu等研究结果[30]一致。然而,Liu等研究认为,长期来看,水稻土壤细菌数量与总汞含量没有显著相关性[15],这可能与本研究开展的是短期汞胁迫试验有关。本研究中,随汞浓度增加土壤真菌数量下降,这与许多重金污染下所得结果[14,31]一致。汞污染下细菌数量远高于真菌,有可能细菌与真菌竞争营养,从而对真菌群落产生更大生存压力[31]。T3处理真菌数量高于T2,说明真菌对高浓度汞污染具有更大抵抗力。Zheng等研究也认为,許多真菌可以忍受高浓度汞污染,通过排出有机酸与土壤中金属形成复合物,从而降低重金属毒性[19]。
本研究hgcA基因基因拷贝数为 6.9×105~8.24×105/g干土,远低于周心劝等关于水稻田的研究结果[20],可能与hgcA基因主要是在厌氧条件下形成有关。总汞含量与hgcA丰度没有显著相关,与Liu等研究结果[32]一致,但与Vishnivetskaya等研究结果[33]不一致,这可能与取样环境、植物类型和土壤类型等因素有关。T1处理hgcA基因数量高于其他处理,可能与土壤pH值有关,由于pH值直接影响汞在土壤中的溶解度。Liu等研究认为,在碱性环境中可能不适合含汞甲基化hgcA基因的微生物存活,当土壤处于酸性条件下时,汞的甲基化程度增强,导致汞的生物利用度增加,然而,当pH值过低时,大量腐殖酸会影响汞的生物利用度或甲基供体转移,降低汞的甲基化[3]。
3.2 汞胁迫对蔬菜土壤细菌和真菌多样性的影响
微生物多样性是评估土壤生态系统功能的重要指标[27]。本研究土壤细菌α多样性指数(CK除外)均随汞含量增加而减少,与Vishnivetskaya等研究结果[33]一致。Crognale等研究认为,短期重金属污染对土壤微生物数量、丰富度和多样性产生负面影响[34]。土壤细菌Chao1指数和ACE指数在低汞浓度中最高,然后随汞浓度增加逐渐下降,表明土壤微生物群落丰富度逐渐下降,丰富度受到高汞浓度影响严重。这种趋势很可能是由于低浓度汞的存在刺激抗金属物种生长,汞浓度增加导致许多敏感物种死亡,最终导致微生物遗传多样性下降[35]。土壤细菌Shannon指数和Simpson指数在对照、低汞浓度和中汞浓度下变化不显著,但高汞浓度下明显改变了Shannon指数和Simpson指数,与Liu等研究结果[15]相似。这种原因可能是随汞浓度增加,不能适应高汞浓度的微生物数量逐渐减少甚至死亡。
Rieder等研究表明,真菌比细菌对长期重金属污染更有抵抗力,真菌对汞的反应不如细菌强烈[36]。本研究中,随汞浓度增加,真菌Chao1指数、ACE指数、Shannon指数和Simpson指数表现先增后减少趋势,与Frossard等研究结果[37]一致。该结果也支持了中度干扰假说,表明中等汞浓度可提高真菌多样性[38]。前人研究认为,汞污染通过影响土壤理化性质间接影响真菌多样性,土壤理化性质是土壤微生物多样性的重要驱动因素,汞在调节土壤真菌丰度和多样性方面具有重要性[39]。Durand等研究表明,在受汞污染胁迫的矿区,土壤真菌多样性与汞浓度呈负相关关系[40]。然而,本研究中没有发现汞对真菌多样性有显著影响,与Frossard等研究结果[37]一致。目前,关于这一现象的原因尚未明确,可能是由于土壤真菌群落对汞的预适应性,真菌耐汞类群的改变或者低汞生物利用导致缺乏汞毒性[41]。
3.3 汞胁迫对蔬菜土壤细菌和真菌群落结构的影响
Wang等研究认为,重金属汞进入土壤将对土壤微生物群落结构和功能产生严重影响[11]。本研究结果也表明,汞导致土壤细菌和真菌群落组成发生变化,存在剂量相关效应,这与之前研究结果[19,42]一致。土壤细菌和真菌群落结构发生变化,可能因重金属汞添加引起土壤金属敏感生物数量减少,耐抗微生物数量增加,导致微生物群落组成发生变化[43]。
本研究中,细菌群落中放线菌门、变形菌门和绿弯菌门为优势菌门,与前人研究结果[19,44]一致。放线菌门在动植物残体分解过程中起着重要作用,有利于土壤氮转化,可产生抗生素减少病原微生物侵害[45]。放线菌门相对丰度在高汞浓度下显著增加,说明放线菌门对汞污染具有耐受性。相关研究已经证明放线菌门对重金属污染具有耐受性[46],可能与阻力机制及沉淀-溶解平衡有关,限制了土壤游离金属离子的动态变化[47]。Barkay等研究认为,放线菌门对汞具有耐受性,主要与其含有耐汞基因(merA)有关[48]。变形菌门具有固氮、代谢和利用光合作用存储能量的作用[49]。本研究中,变形菌门相对丰度在中等汞浓度最高,高汞浓度最低,可能与中度干扰或应激假说有关[15]。由此可知,变形菌门对汞具有一定耐受性,当汞浓度超过一定阈值,将导致其数量减少或者死亡。变形菌门的耐受能力可能有3个方面原因,一是汞可以被吸附在微生物活细胞或死细胞中,从而降低有效汞对其影响[43];二是变形菌门含有merA基因,merA编码汞还原酶,可将汞离子还原为元素汞[50];三是通过外排系统挤出重金属离子、通过含硫醇分子进行分离以及还原为具有降低毒性的氧化状态[51]。绿弯菌门含有绿色色素,具有降解纤维素作用,与地上生物量呈显著正相关关系[52]。本研究绿弯菌门相对丰度随汞浓度增加显著降低,一方面可能由于地上蔬菜生物量总体随汞浓度增加逐渐减少,土壤中纤维素减少,不利于绿弯菌门生长。另一方面,绿弯菌门中没有脂质外膜和专门的分泌系统,对汞较敏感,其生长易受汞抑制[53]。
op de Beeck等研究表明,重金屬污染对土壤真菌群落结构变化具有重要影响[54]。本研究子囊菌门、被孢菌门和担子菌门为优势类群,与Zhang等研究结果[55]相似。子囊菌门被认为是降解木质纤维素的重要真菌,广泛存在于农田土壤。子囊菌门相对丰富随汞胁迫加剧呈增加趋势,说明对高浓度汞污染具有更大耐受性,可能由于子囊菌为腐生菌,能降解土壤有机质[56],在高汞浓度胁迫下土壤有机碳最多,从而有利于子囊菌门相对丰度增加。目前,关于子囊菌门对重金属污染的应激反应机制研究较少。随汞浓度增加,被孢菌门和担子菌门相对丰度总体表现递减趋势。担子菌门能适应较低养分环境,具有降解纤维素和木质素的能力[57]。汞浓度增加,土壤全氮和铵态氮等养分增加,蔬菜生物量减少,蔬菜残体及木质素较少,不利于担子菌门生长。在重金属胁迫下,担子菌群酶活性受到抑制[58],也导致担子菌门相对丰度减少。
本研究通过RDA分析探讨了土壤细菌和真菌群落与土壤理化性质之间的相关性,揭示了微生物群落受特定土壤理化性质的影响。土壤细菌和真菌群落与土壤pH值、铵态氮、硝态氮和总汞含量有显著相关性。许多研究也表明,土壤pH值和重金属含量对微生物群落结构有显著影响[31,59]。土壤pH值通过影响金属离子溶解度和流动性在土壤重金属的积累中起着重要作用,决定土壤养分的生物有效性,同时H+与溶解金属之间的配体竞争,导致重金属迁移率和生物利用度增加[45]。Wen等研究表明,模拟酸雨可增加土壤溶液中重金属可溶性含量,增加重金属的环境风险[60]。一些敏感和耐受性菌群丰度随土壤pH值增加而变化,土壤pH值通过影响重金属形态和可用性,从而导致生态毒性的变化[61]。
低汞浓度处理提高了土壤细菌和hgcA基因数量。高汞浓度胁迫显著降低了土壤细菌群落α多样性指数。汞浓度越高,对微生物群落结构影响越大,真菌对汞的敏感性弱于细菌。放线菌门和子囊菌门对汞污染具有耐受性,绿弯菌门和被孢菌门对汞污染敏感。低汞浓度对担子菌门有促进作用,中等汞浓度对变形菌门有促进作用。土壤pH值、铵态氮、硝态氮和汞含量是影响土壤细菌和真菌群落变化的主要因素。然而,关于汞对蔬菜土壤细菌和真菌群落的影响机制需开展长期的定点和多蔬菜种类研究。
参考文献:
[1]Natasha,Shahid M,Khalid S,et al. A critical review of mercury speciation,bioavailability,toxicity and detoxification in soil-plant environment:ecotoxicology and health risk assessment[J]. Science of the Total Environment,2020,711:134749.
[2]Clarkson T W. The toxicology of mercury[J]. Critical Reviews in Clinical Laboratory Sciences,1997,34(4):369-403.
[3]Liu X,Ma A Z,Zhuang G Q,et al. Diversity of microbial communities potentially involved in mercury methylation in rice paddies surrounding typical mercury mining areas in China[J]. MicrobiologyOpen,2018,7(4):e00577.
[4]Shuaib M,Azam N,Bahadur S,et al. Variation and succession of microbial communities under the conditions of persistent heavy metal and their survival mechanism[J]. Microbial Pathogenesis,2021,150:104713.
[5]Ji H B,Zhang Y,Bararunyeretse P,et al. Characterization of microbial communities of soils from gold mine tailings and identification of mercury-resistant strain[J]. Ecotoxicology and Environmental Safety,2018,165:182-193.
[6]李昌鑫. 燃煤电厂周边环境中汞的溯源研究及其对微生物多样性的影响[D]. 杭州:浙江大学,2020:24-30.
[7]刘振京. 土壤汞对植物生长和微生物群落的生物学效应研究[D]. 北京:北京化工大学,2019:27-40. [HJ*3]
[8]Száková J,Havlí[KG-*5]c[DD(-1*2/3][HT6]ˇ[DD)]ková J,S[DD(-*1][HT6]ˇ[DD)][KG-*5]ípková A,et al. Effects of the soil microbial community on mobile proportions and speciation of mercury (Hg) in contaminated soil[J]. Journal of Environmental Science and Health(Part A),2016,51(4):364-370.
[9]Salam L B,Shomope H,Ummi Z,et al. Mercury contamination imposes structural shift on the microbial community of an agricultural soil[J]. Bulletin of the National Research Centre,2019,43(1):163.
[10] Yao X F,Zhang J M,Tian L,et al. The effect of heavy metal contamination on the bacterial community structure at Jiaozhou Bay,China[J]. Brazilian Journal of Microbiology,2017,48(1):71-78.
[11]Wang L,Wang L,Zhan X Y,et al. Response mechanism of microbial community to the environmental stress caused by the different mercury concentration in soils[J]. Ecotoxicology and Environmental Safety,2020,188:109906.
[12]Harris-Hellal J,Vallaeys T,Garnier-Zarli E,et al. Effects of mercury on soil microbial communities in tropical soils of French Guyana[J]. Applied Soil Ecology,2009,41(1):59-68.
[13]Xie X M,Liao M,Ma A L,et al. Effects of contamination of single and combined cadmium and mercury on the soil microbial community structural diversity and functional diversity[J]. Chinese Journal of Geochemistry,2011,30(3):366-374.
[14]Frossard A,Hartmann M,Frey B. Tolerance of the forest soil microbiome to increasing mercury concentrations[J]. Soil Biology and Biochemistry,2017,105:162-176.
[15]Liu Y R,Wang J J,Zheng Y M,et al. Patterns of bacterial diversity along a long-term mercury-contaminated gradient in the paddy soils[J]. Microbial Ecology,2014,68(3):575-583.
[16]Rajapaksha R M C P,Tobor-Kapon M A,Bth E. Metal toxicity affects fungal and bacterial activities in soil differently[J]. Applied and Environmental Microbiology,2004,70(5):2966-2973.
[17]崔曉峰,李淑仪,丁效东,等. 珠江三角洲地区典型菜地土壤与蔬菜重金属分布特征研究[J]. 生态环境学报,2012,21(1):130-135.
[18]Wang B H,Chu C B,Wei H W,et al. Ameliorative effects of silicon fertilizer on soil bacterial community and pakchoi (Brassica chinensis L.) grown on soil contaminated with multiple heavy metals[J]. Environmental Pollution,2020,267:115411.
[19]Zheng L G,Li Y,Shang W Q,et al. The inhibitory effect of cadmium and/or mercury on soil enzyme activity,basal respiration,and microbial community structure in coal mine-affected agricultural soil[J]. Annals of Microbiology,2019,69(8):849-859.
[20]周心劝. 稻田土壤中微生物群落对甲基汞积累的影响[D]. 重庆:西南大学,2019:31-39.
[21]Liu Y R,Yu R Q,Zheng Y M,et al. Analysis of the microbial community structure by monitoring an Hg methylation gene (hgcA) in paddy soils along an Hg gradient[J]. Applied and Environmental Microbiology,2014,80(9):2874-2879.
[22]Abdelmageed Y,Miller C,Sanders C,et al. Assessing microbial communities related to mercury transformations in contaminated streambank soils[J]. Water,Air,& Soil Pollution,2021,232(1):31.
[23]李仲根,冯新斌,何天容,等. 王水水浴消解-冷原子荧光法测定土壤和沉积物中的总汞[J]. 矿物岩石地球化学通报,2005,24(2):140-143.
[24]鲍士旦. 土壤農化分析[M]. 3版.北京:中国农业出版社,2000:25-114.
[25]Chen B S,Du K Q,Sun C,et al. Gut bacterial and fungal communities of the domesticated silkworm (Bombyx mori) and wild mulberry-feeding relatives[J]. The ISME Journal,2018,12(9):2252-2262.
[26]Christensen G A,Wymore A M,King A J,et al. Development and validation of broad-range qualitative and clade-specific quantitative molecular probes for assessing mercury methylation in the environment[J]. Applied and Environmental Microbiology,2016,82(19):6068-6078.
[27]Bowles T M,Acosta-Martínez V,Calderón F,et al. Soil enzyme activities,microbial communities,and carbon and nitrogen availability in organic agroecosystems across an intensively-managed agricultural landscape[J]. Soil Biology and Biochemistry,2014,68:252-262.
[28]许跃奇. 重金属Hg在烟草中的吸收积累规律及生物炭消减效应研究[D]. 郑州:河南农业大学,2015:19-27.
[29]高雪峰,韩国栋. 短花针茅根系分泌物对荒漠草原土壤细菌群落及土壤养分的影响[J]. 中国草地学报,2021,43(6):76-84.
[30]Liu Y R,Delgado-Baquerizo M,Bi L,et al. Consistent responses of soil microbial taxonomic and functional attributes to mercury pollution across China[J]. Microbiome,2018,6(1):183.
[31]Deng L J,Zeng G M,Fan C Z,et al. Response of rhizosphere microbial community structure and diversity to heavy metal co-pollution in arable soil[J]. Applied Microbiology and Biotechnology,2015,99(19):8259-8269.
[32]Liu Y R,Johs A,Bi L,et al. Unraveling microbial communities associated with methylmercury production in paddy soils[J]. Environmental Science & Technology,2018,52(22):13110-13118.
[33]Vishnivetskaya T A,Hu H Y,Van Nostrand J D,et al. Microbial community structure with trends in methylation gene diversity and abundance in mercury-contaminated rice paddy soils in Guizhou,China[J]. Environmental Science(Processes & Impacts),2018,20(4):673-685.
[34]Crognale S,DAnnibale A,Pesciaroli L,et al. Fungal community structure and As-resistant fungi in a decommissioned gold mine site[J]. Frontiers in Microbiology,2017,8:2202.
[35]Vig K,Megharaj M,Sethunathan N,et al. Bioavailability and toxicity of cadmium to microorganisms and their activities in soil:a review[J]. Advances in Environmental Research,2003,8(1):121-135.
[36]Rieder S R,Frey B. Methyl-mercury affects microbial activity and biomass,bacterial community structure but rarely the fungal community structure[J]. Soil Biology and Biochemistry,2013,64:164-173.
[37]Frossard A,Donhauser J,Mestrot A,et al. Long-and short-term effects of mercury pollution on the soil microbiome[J]. Soil Biology and Biochemistry,2018,120:191-199.
[38]Connell J H. Intermediate-disturbance hypothesis[J]. Science,1979,204(4399):1345.
[39]Delgado-Baquerizo M,Reith F,Dennis P G,et al. Ecological drivers of soil microbial diversity and soil biological networks in the Southern Hemisphere[J]. Ecology,2018,99(3):583-596.
[40]Durand A,Maillard F,Foulon J,et al. Environmental metabarcoding reveals contrasting belowground and aboveground fungal communities from poplar at a Hg phytomanagement site[J]. Microbial Ecology,2017,74(4):795-809.
[41]Durand A,Maillard F,Foulon J,et al. Interactions between Hg and soil microbes:microbial diversity and mechanisms,with an emphasis on fungal processes[J]. Applied Microbiology and Biotechnology,2020,104(23):9855-9876.
[42]Meharg A A. The mechanistic basis of interactions between mycorrhizal associations and toxic metal cations[J]. Mycological Research,2003,107(11):1253-1265.
[43]雷雷佳,刘 俊,刘卫国,等. 工业园周边土壤重金属污染特征及潜在生态风险评价[J]. 江苏农业科学,2021,49(16):227-233.
[44]Franois F,Lombard C,Guigner J M,et al. Isolation and characterization of environmental bacteria capable of extracellular biosorption of mercury[J]. Applied and Environmental Microbiology,2012,78(4):1097-1106.
[45]Wang Q F,Jiang X,Guan D W,et al. Long-term fertilization changes bacterial diversity and bacterial communities in the maize rhizosphere of Chinese Mollisols[J]. Applied Soil Ecology,2018,125:88-96.
[46]Luo L Y,Xie L L,Jin D C,et al. Bacterial community response to cadmium contamination of agricultural paddy soil[J]. Applied Soil Ecology,2019,139:100-106.
[47]Haferburg G,Kothe E. Microbes and metals:interactions in the environment[J]. Journal of Basic Microbiology,2007,47(6):453-467.
[48]Barkay T,Miller S M,Summers A O. Bacterial mercury resistance from atoms to ecosystems[J]. FEMS Microbiology Reviews,2003,27(2/3):355-384.
[49]商麗荣,万里强,李向林. 有机肥对羊草草原土壤细菌群落多样性的影响[J]. 中国农业科学,2020,53(13):2614-2624.
[50]Mller A K,Barkay T,Hansen M A,et al. Mercuric reductase genes (merA) and mercury resistance plasmids in High Arctic snow,freshwater and sea-ice brine[J]. FEMS Microbiology Ecology,2014,87(1):52-63.
[51]Harichová J,Karelová E,Pangallo D,et al. Structure analysis of bacterial community and their heavy-metal resistance determinants in the heavy-metal-contaminated soil sample[J]. Biologia,2012,67(6):1038-1048.
[52]Podosokorskaya O A,Kadnikov V V,Gavrilov S N,et al. Characterization of Melioribacter roseus gen.nov.,sp.nov.,a novel facultatively anaerobic thermophilic cellulolytic bacterium from the class Ignavibacteria,and a proposal of a novel bacterial phylumIgnavibacteriae[J]. Environmental Microbiology,2013,15(6):1759-1771.
[53]Sutcliffe I C. Cell envelope architecture in the Chloroflexi:a shifting frontline in a phylogenetic turf war[J]. Environmental Microbiology,2011,13(2):279-282.
[54]op de Beeck M,Ruytinx J,Smits M M,et al. Belowground fungal communities in pioneer Scots pine stands growing on heavy metal polluted and non-polluted soils[J]. Soil Biology and Biochemistry,2015,86:58-66.
[55]Zhang H L,Zheng X Q,Bai N L,et al. Responses of soil bacterial and fungal communities to organic and conventional farming systems in East China[J]. Journal of Microbiology and Biotechnology,2019,29(3):441-453.
[56]Beimforde C,Feldberg K,Nylinder S,et al. Estimating the Phanerozoic history of the Ascomycota lineages:combining fossil and molecular data[J]. Molecular Phylogenetics and Evolution,2014,78:386-398.
[57]Zhao S C,Qiu S J,Xu X P,et al. Change in straw decomposition rate and soil microbial community composition after straw addition in different long-term fertilization soils[J]. Applied Soil Ecology,2019,138:123-133.
[58]Baldrian P,in der Wiesche C,Gabriel J,et al. Influence of cadmium and mercury on activities of ligninolytic enzymes and degradation of polycyclic aromatic hydrocarbons by Pleurotus ostreatus in soil[J]. Applied and Environmental Microbiology,2000,66(6):2471-2478.
[59]Wang N N,Zhang S H,He M C. Bacterial community profile of contaminated soils in a typical antimony mining site[J]. Environmental Science and Pollution Research,2018,25(1):141-152.
[60]Wen F,Hou H,Yao N,et al. Effects of simulated acid rain,EDTA,or their combination,on migration and chemical fraction distribution of extraneous metals in Ferrosol[J]. Chemosphere,2013,90(2):349-357.
[61]Deng S Q,Ke T,Li L T,et al. Impacts of environmental factors on the whole microbial communities in the rhizosphere of a metal-tolerant plant:Elsholtzia haichowensis Sun[J]. Environmental Pollution,2018,237:1088-1097.
收稿日期:2022-07-20
基金項目:贵州省教育厅自然科学项目(编号:黔教合KY字[2020]163);铜仁学院博士科研启动基金(编号:tyxyDH2002、tyxyDH1603);绿色农药与农业生物工程教育部重点实验室开放基金(编号:黔教合KY字[2019]036);铜仁学院硕士点及学科建设研究子项目(编号:trxyxwdxm-027);贵州省科技项目(编号:黔科合SY字[2014]3035)。
作者简介:王喜英(1981—),女,河南汝南人,硕士,讲师,主要从事生物化学及生物信息学分析。E-mail:810315971@qq.com。
通信作者:赵 辉,博士,教授,主要从事土壤微生态及作物栽培研究。E-mail:yancao504@163.com。

