基于MIMIC数据库分析阴离子间隙对成人急性心肌梗死患者预后的预测价值
盛海莹,陆建红,陈亦莉
心血管疾病是导致患者死亡的主要原因,主要为急性心肌梗死(AMI)或脑卒中,对于合并心源性休克患者,往往预后更差[1]。既往较为明确的诊断AMI 的特异性指标有心电图及肌钙蛋白等,但其对预后的评估缺乏循证学证据。有学者研究了脑钠肽、肌钙蛋白、超敏C 反应蛋白、红细胞分布宽度、miRNAs 和中性粒细胞与淋巴细胞比值等一系列反应AMI 患者预后指标[2-4],但终未得出统一的结论。因此寻找一种简单快速、经济实用的标志物显得尤为重要。阴离子间隙(AG)指的是血清中未测定的阴离子和未测定的阳离子之间的差值,通常用于辅助识别代谢性酸中毒的原因[5]。高水平AG 不仅与急性胰腺炎[6]、肾脏疾病[7]等预后相关,还与多种心血管疾病的不良结局间存有关联[8]。为此,本研究通过研究AG与AMI患者全因死亡间的关系,分析其在评价此类患者不良预后中的临床意义和价值,报道如下。
1 资料与方法
1.1 一般资料 采用回顾性队列研究方法,选取美国重症监护医学信息数据库(MIMIC-Ⅲv1.4)2001年6 月至2012 年10 月重症监护室(ICU)住院的成人AMI 患者资料。该数据库是一个开放型公共数据库,得到了贝斯以色列女执事医疗中心和麻省理工学院的机构审查委员会的批准。提取数据人员参与培训,获得使用和下载数据库的权限证书(ID:42303155)。本研究采用PostgreSQL 软件登录MIMIC-Ⅲ数据库,并用结构化查询语言代码获取所有研究数据。
纳入标准:(1)符合AMI 国际疾病分类编码(ICD-9),(2)有ICU 住院记录,(3)年龄≥18 岁;排除标准:(1)ICU 住院时间<24 h 或24 h 内死亡者,(2)重复入住ICU者,(3)关键研究数据缺失或遗漏者。1.2 方法 根据随访90 d 情况将患者分成生存组(n=1 300)和死亡组(n=263)。根据受试者工作特征曲线(ROC)得出最佳cut-off 值,根据最佳cut-off 值分为低AG组(<15.50 mmol/L)和高AG组(≥15.50 mmol/L)。主要研究结局为AMI 患者30 及90 d 全因死亡率。模型一未控制任何混杂因子;模型二控制了年龄、性别、序贯器官衰竭估计评分、高血压、冠心病、高脂血症、心脏骤停、充血性心力衰竭、心源性休克等混杂因子;模型三在模型二的基础上控制了经皮冠状动脉介入治疗(PCI)、冠脉造影检查、红细胞分布宽度(RDW)、白细胞、血红蛋白、肌酐、血糖、血钾、血总钙、血磷、国际标准化比值(INR)及总住院时间等混杂因子。
1.3 统计方法 应用Stata 14.0 和SPSS 23.0 统计软件进行分析。计量资料先行正态性检验,若符合正态分布,以均数±标准差表示,组间比较采用t 检验;若不符合正态分布,以中位数(四分位数)表示,组间比较采用Mann-Whitney U 检验;计数资料用百分比表示,并采用2检验。采用ROC 曲线分析AG预测AMI 患者90 d 全因死亡的价值,并得出最佳cut-off 值。根据最佳cut-off 值绘制Kaplan-Meier 生存曲线,并用log-rank 检验比较两组间全因死亡率情况。采用单因素及多因素Cox 回归模型及限制性立方样条(RCS)分析AG 是AMI 患者不良预后的关系。P <0.05 表示差异有统计学意义。
2 结果
2.1 临床基线特征比较 最终纳入成年AMI 患者1 563 例,平均年龄(67.9±14.0)岁,序贯器官衰竭估计(SOFA)评分(3.78±3.13)分。与存活组比较,死亡组患者年龄,SOFA 评分,血AG,白细胞,RDW,肌酐,血糖,血钾,血磷,INR,女性、心脏骤停、充血性心力衰竭及心源性休克比例较高,ICU 住院时间和总住院时间延长;但血红蛋白,血总钙,碳酸氢根,经皮冠状动脉介入治疗(PCI)、冠脉造影检查、高血压、冠心病及高脂血症比例较低(均P <0.05),见表1。

表1 两组一般临床资料比较
2.2 AG 对AMI 患者90 d 全因死亡预测的ROC 曲线 AG 预测AMI 患者90 d 全因死亡的曲线下面积(AUC)为0.708(95%CI0.673 ~0.743,P<0.05),敏感度为61.977%,特异度为71.385%,最佳预测的cut-off 值为15.50 mmol/L,见图1。
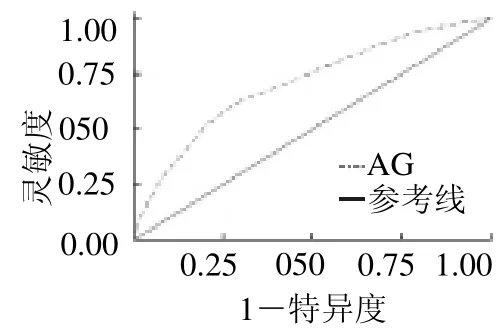
图1 AG 对AMI 患者90 d 全因死亡预测的受试者工作特征曲线
2.3 KM 生存曲线分析 根据最佳cut-off 值绘制Kaplan-Meier 生存分析,结果表明高AG 组30 和90d累积生存率较低AG组明显降低,且差异有统计学意义(log-rank2=95.790、114.940,均P<0.05),见图2。
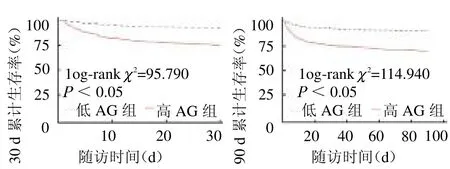
图2 两组AMI 患者30(左)和90 d(右)Kaplan-Meier 生存曲线
2.4 AG 与AMI 患者预后的关系
2.4.1 Cox 回归模型 AG≥15.50 mmol/L 是30 和90 d 全因死亡的风险因素(HR=3.719、3.578,均P <0.05);在控制混杂因子后,模型二、模型三均显示AG≥15.50 mmol/L 是30 和90 d全因死亡的风险因素(均P <0.05),见表2。
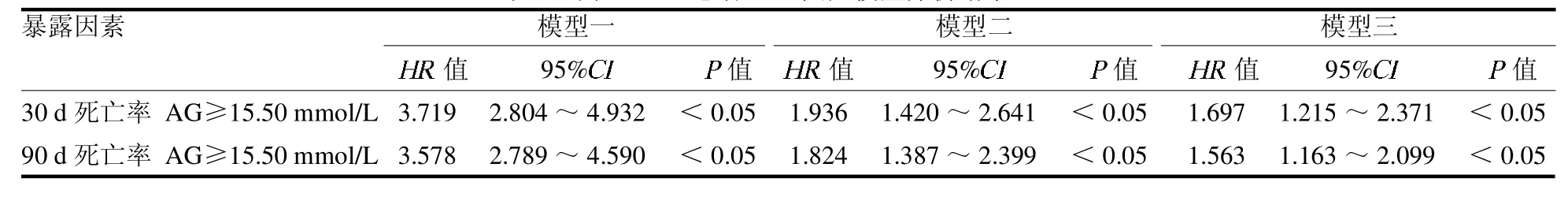
表2 两组AMI 患者Cox 回归模型分析结果
2.4.2 相关性及RCS 分析 AG 与AMI 患者90 d全因死亡风险呈正相关(r=0.27,P <0.05)。进一步RCS 分析示:AG(分为5 个区间)与AMI 患者90 d全因死亡风险呈线性趋势相关(2=7.550,P>0.05)。当AG 为14.01 mmol/L 时,其HR 约为1,见图3。

图3 AMI患者血清AG与90 d全因死亡风险的相关性
3 讨论
电解质和酸碱平衡紊乱常见于危重以及其他住院患者,而代谢性酸中毒是危重症患者最常见的酸碱平衡紊乱类型[9]。研究报道,代谢性酸中毒与新冠病毒感染[10]、肝硬化[11]等重症患者死亡有关。因此,加强重症患者代谢性酸中毒的相关性研究具有一定的临床价值。近年来,AG 作为一种血清学指标,因其计算简便而备受临床医务人员的关注。张骁等[12]研究显示,血AG≥11.15 mmol/L 与急性冠脉综合征患者随访1 年期间发生主要不良心血管事件有关,对该类患者不良预后的早期评估具有较高的临床价值(AUC 为0.824)。另有研究报道,高AG 与脓毒症[13]、脑梗死[14]及心跳骤停[15]等疾病的严重程度或/和预后间也存有相关性。
AMI 是临床上一种常见的急症,有时会伴随着严重并发症,如心跳呼吸骤停、休克、卒中及呼吸衰竭等[16]。为此,对AMI 代谢特征的研究,有助于此类疾病的早期预防和治疗。AMI 发生后,往往伴随着无氧呼吸和严重炎症反应,同时厌氧呼吸和磷酸戊糖途径可增加机体内乳酸和二氧化碳浓度,从而导致酸中毒[17]。因此,AG 可能与AMI 患者的病情严重程度或预后间存有关联;但目前关于不同AG水平与AMI 患者临床预后的文献甚少。有研究表明,血清AG 升高是全因死亡的独立和强有力的预测因子[18]。近期一项回顾性临床研究显示,与不稳定型心绞痛患者相比,AMI 患者AG 值明显升高;AG水平不仅与院内心力衰竭程度呈正相关,而且是此类患者发生心功能损害的独立预测因子[12]。而本研究对象与上述不同,为在ICU 住院的AMI 患者,通过探讨入ICU 时不同水平AG 在预测此类患者短期预后的临床价值,结果发现AG 预测AMI 患者90d全因死亡的AUC 为0.708,最佳cut-off 值为15.50 mmol/L。高AG 组30 和90 d 累积生存率较低AG组明显降低(均P <0.05),且AG 增高(≥15.50 mmol/L)是AMI 患者30 和90 d 全因死亡的独立危险因子。
本研究是一个大样本临床研究(1 563 例),随访时间相对较长(90 d),结果具有一定的可信度。但也存在一些不足之处:(1)它是一项回顾性的单中心临床研究,且数据均来自国外AMI 患者;(2)该数据库中并没有提供AMI 患者Killip 分级具体信息。因此,未来需要更多前瞻性研究来进一步证实研究结论。
综上所述,入ICU 时AG 升高与AMI 患者不良预后相关,AG 增高(≥15.50 mmol/L)是此类患者近期死亡的独立危险因子,它可作为病情严重及不良临床结局的重要预测指标。临床工作人员应更加关注此类患者,以期尽早干预,改善其预后。

