杏鲍菇废弃菌渣中D-氨基葡萄糖盐酸盐的制备工艺及生物学活性分析
张倩如,吴启赐, ,薛 钰,林志超,黄家福,吕昊坤,彭 伟,潘裕添,林进妹
(1.闽南师范大学菌物产业福建省高校工程研究中心,福建漳州 363000;2.闽南师范大学化学化工与环境学院,福建漳州 363000)
D-氨基葡萄糖盐酸盐(D-glucosamine hydrochloride,GAH)是甲壳素或壳聚糖的重要衍生物[1-3],是人体及动物体内关节组织中糖蛋白的天然成分,分布于人体所有组织,由葡萄糖氨基化内源性生物合成[4]。GAH 具有消炎、解毒、抗菌、防腐等作用,亦可作为治疗骨关节疼痛的药物[5-9],在医学、化妆品、食品等领域都有着广泛的应用前景。GAH 的制备方法包括酸水解法、酶解法及微生物发酵法[10]。其中酸解法操作简单,成本较低,适合工业化生产,但其生产易受原料的季节和产地的限制;酶解法绿色环保,但生产工艺复杂,酶制剂作用时间普遍较长,生产成本较高,较难实现工业化;微生物发酵法条件温和,原材料不受资源限制,但微生物工程代谢改造困难,代谢副产物多,从而抑制产物积累。针对当前应用最广的酸解法,废弃虾蟹壳中甲壳素是制备GAH 的主要原料[10],也有一些其他来源,如蝉蜕[11]、桑蚕蛹[12]、柠檬酸发酵废渣[13]、糙皮侧耳固体发酵料[14]等,但这些原料因为来源或产品质量问题而限制其规模化生产。虾蟹壳酸解制备的GAH 产品质量较差,通常伴有鱼腥味,重金属、砷和灰分含量也容易超标,生产高纯度GAH 的成本很高。因此,寻找新原料新工艺生产高品质的GAH 产品具有重要意义。
杏鲍菇(Pleurotus eryngii)是目前中国继双孢蘑菇之后栽培规模最大的食用菌之一,产品主要用于鲜售,而鲜售的商品菇仅占子实体总重量的70%左右,尚有30%的杏鲍菇子实体剩余物被丢弃或低价出售[15]。这些杏鲍菇子实体剩余物含有大量菌丝体和其他营养物质,同样具有可深度开发的价值[10]。在食用菌精深加工研究中,人们尤其关注占据细胞干重20%以上的细胞壁物质[16-17],包括研究其物质组成与结构,以及其是否具备特殊可应用于人类健康或疾病治疗的生物学功能,因此杏鲍菇菌丝体细胞壁中的主要结构物质“甲壳素-β-葡聚糖(Chitin-β-Glucan)”也成为GAH 制备的重要研究对象之一,目前已引起产业的高度关注。
本文针对杏鲍菇产业发展过程中的废弃菌渣(主要为子实体剩余物)去向问题,研究了来源于杏鲍菇废弃菌渣的GAH 制备工艺、产品质量及其对斑马鱼胚胎发育的影响,旨在为GAH 生产提供新原料和新制备工艺,同时也为提高杏鲍菇产业剩余物的综合利用价值提供理论依据。
1 材料与方法
1.1 材料与仪器
杏鲍菇废弃菌渣 杏鲍菇鲜品产自福建漳州(2022 年7 月采收),由福建科人生物科技有限公司采购,切除70%的子实体用于鲜销或制备罐头,剩余的子实体部分即为废弃菌渣;D-氨基葡萄糖盐酸盐标准品(纯度≥99%) 美国Sigma 公司;活性炭广东汕头市西陇化工厂;乙酰丙酮和对二甲氨基苯甲醛 分析纯,上海瑞硕化工有限公司;野生型TU 品系斑马鱼 清华大学孟安明课题组;地高辛标记的tgfβ1a、tgfβ2探针采用体外合成的方法,所采用的相关试剂购自Roche 公司;其余试剂均为市售分析纯。
Senco R1002B 旋转蒸发仪 上海申生科技有限公司;Centrifuge 5810R 高速冷冻离心机 Eppenddorf;LG-0.2 型真空冷冻干燥机 沈阳航天新阳速冻设备制造有限公司;EV322 旋转蒸发仪 北京莱伯泰科仪器股份有限公司;UV-2102PCS 型紫外可见分光光度计 Unico 公司;WXG-4 圆盘旋光仪 上海浦东光学仪器厂;360 型傅里叶红外光谱仪 美国Nicolet 仪器公司;Agilent 1200 高效液相色谱仪和XCT 液相色谱-质谱联用仪HPLC-MS 美国Agilent公司;JM-L65 胶体磨 温州强忠机械科技有限公司;板框过滤器 廊坊市顶天轻工机械有限公司;BS124S 电子分析天平 德国赛多利斯;SMZ18 体视显微镜 日本Nikon 公司。
1.2 实验方法
1.2.1 原料预处理 原料预处理过程如下:杏鲍菇废弃菌渣切碎后用胶体磨粉碎,在100 ℃下水煮2 h,冷却后经板框过滤;滤液用于提取杏鲍菇多糖,残渣用2%的NaOH 回流煮沸2 h(液固比为4 mL/g)以除去蛋白质,冷却压滤,残渣水洗至中性;再用1%的HAc 煮沸2 h(液固比为4 mL/g),冷却压滤,残渣水洗至中性,干燥粉碎,即得预处理残渣。
1.2.2 酸水解制备GAH 工艺 准确称取0.5 g 预处理残渣,加入一定浓度的盐酸溶液,控制液固比、温度和时间进行冷凝回流提取,冷却抽滤得滤液,并加入适量纯水洗涤滤渣,合并滤液与洗涤液,经旋转蒸发浓缩至三分之一体积,以去除大部分盐酸,再定容至100 mL 测定GAH 含量。
1.2.3 单因素实验
1.2.3.1 盐酸浓度对GAH 得率的影响 设置水解时间3 h,水解温度95 ℃,液固比4 mL/g,考察盐酸浓度(质量百分浓度分别为12%、18%、24%、30%和36%)对GAH 得率的影响。
1.2.3.2 水解时间对GAH 得率的影响 设置盐酸浓度36%,水解温度95 ℃,液固比4 mL/g,考察水解时间(分别为2、3、4、5 和6 h)对GAH 得率的影响。
1.2.3.3 水解温度对GAH 得率的影响 设置盐酸浓度36%,水解时间3 h,液固比4 mL/g,考察水解温度(分别为60、70、80、90 和100 ℃)对GAH 得率的影响。
1.2.3.4 液固比对GAH 得率的影响 设置盐酸浓度36%,水解时间3 h,水解温度95 ℃,考察液固比(分别为3、4、5、6 和7 mL/g)对GAH 得率的影响。
1.2.4 响应面试验 根据单因素实验得到的最优参数,以GAH 得率(Y)为考察指标,盐酸浓度(A),水解时间(B)、水解温度(C)及液固比(D)为自变量,应用Box-Behnken Design 进行响应面法优化,试验设计见表1。
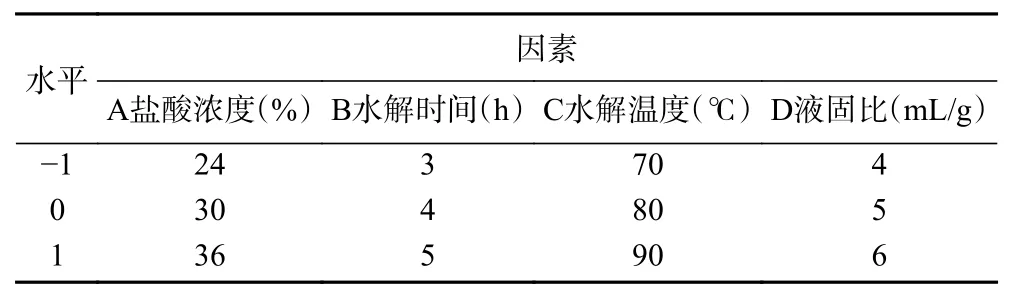
表1 Box-Behnken 设计响应面法优化GAH制备工艺的因素水平Table 1 Factors and levels of GAH preparation process by Box-Behnken design-response surface method
1.2.5 GAH 纯化
1.2.5.1 活性炭脱色 准确称取20 g 预处理原料,按1.2.2 方法的最优参数进行水解。水解液中加入2%活性炭,在80 ℃脱色2 h,冷却抽滤,除去活性炭,得到澄清GAH 脱色液。
1.2.5.2 粗结晶 将GAH 脱色液进行真空旋转蒸发浓缩,待浓缩瓶内出现大量晶体时停止浓缩,将浓缩液与晶体转移至烧杯,加入过量95%乙醇并冷却至4 ℃,过滤的滤渣为GAH 粗结晶。
1.2.5.3 重结晶 将GAH 粗结晶溶解于少量热水中,趁热过滤,并加入无水乙醇,持续搅拌1 h,冷却至4 ℃,过滤得GAH 晶体,冻干得白色结晶粉末,即为GAH 纯化样品。
1.2.6 GAH 得率测定 参照文献[18]中的Elson-Morgan 法进行GAH 含量测定,标准曲线为:y=0.0129x+0.1002;R2=0.9935,并按照下列公式计算GAH 得率。
式中:m 为样品中GAH 质量,g;m0为预处理残渣质量,g。
1.2.7 HPLC-MS 分析 HPLC 色谱条件:精确配制5.0 mg/mL 的GAH 标准品和纯化样品,HPLC 检测方法参照美国药典方法略做修改[19],即采用Stable Bond C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-0.05%磷酸溶液(调pH3.0)(40/60)为流动相,检测波长195 nm,柱温30 ℃,流速1.0 mL/min,进样量20 μL。
MS 条件:采用电喷雾负离子模式(ESI-),毛细管电压为3.0 kV,离子源温度为120 ℃,脱溶剂气为N2,脱溶剂温度为350 ℃,脱溶剂气流速为750 L/h,碰撞气为高纯Ar,离子检测模式为多反应离子监测,质荷比(m/z)扫描范围为90~620。
1.2.8 FT-IR 分析 采用KBr 压片法对样品进行傅立叶变换红外光谱(FT-IR)分析[20],将10 mg 该样品置于玛瑙钵中,以1/100 的比例加入干燥的KBr 粉末,研磨均匀,经压片机2 t 压力压成透明薄片,在波数4000~400 cm-1范围内进行16 次红外光谱扫描,观察谱峰情况。
1.2.9 GAH 产品的理化指标分析 GAH 纯化样品的理化指标分析参照美国药典43-国家处方集38(USP43-NF38)中Glucosamine hydrochloride 的杂质限量检测方法执行[19]。其中Cl-和SO42-含量测定参照USP43-NF38 通则(221)执行;pH 测定参照通则(791);比旋光度测定参照通则(781S);灰分测定参照通则(281);As 含量测定参照通则(211)。
1.2.10 GAH 纯化样品对斑马鱼胚胎发育的影响收集受精后0.75 h 以内(单细胞时期)的胚胎,按60 枚/组分为六组,分别用浓度为0、0.1%、0.2%、0.3%、0.4%和0.5%(w/v)的GAH 纯化样品溶液持续处理72 h。每12 h 更换一次培养液,同时挑出死亡胚胎或畸形严重导致发育停滞的胚胎。收集72 h时期的幼鱼,观察其整体发育情况,重点观察胚胎的心脏是否有畸形水肿或充血,以及黑色素、黄色素的堆积情况。根据实验中出现的不同表型进行分类,如正常型即野生型,较轻微的异常表型I 型,明显的异常表型II 型,每个实验组根据这三种表型的比例进行统计分析得出百分比图堆积图。
1.2.11 原位杂交试验 收集受精后0.75 h 以内(单细胞时期)的胚胎,分别用浓度为0、0.05%、0.1%和0.3%(w/v)的GAH 纯化样品溶液处理胚胎24 h,每一组的胚胎数不少于12 枚。待胚胎发育至24 h,采用蛋白酶脱膜,再用4%多聚甲醛固定过夜,次日将固定的胚胎用甲醇进行梯度脱水,直至换成100%的甲醇。本研究通过原位杂交检测tgfβ1a和tgfβ2的时空表达,整胚原位杂交方案是在标准实验步骤的基础上进行了修改[21-22],在杂交温度、杂交时间进行了微调,如杂交温度改为60 ℃,杂交时间延长至16 h。染色之后的胚胎泡在甘油中4 ℃保存待拍照。原位杂交的胚胎用带有数码摄头的尼康SMZ18 体式显微镜拍照,图像使用Photoshop 软件处理。
1.3 数据处理
所有实验做3 次平行,所有数据均用平均值表示。采用GraphPad Prism 8 软件进行统计学分析,利用One-Way ANOVA 对数据进行检验,显著性水平设为0.05。利用Design-Expert 13 软件做响应面优化设计及分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 盐酸浓度对GAH 得率的影响 如图1A 所示,盐酸浓度对杏鲍菇残渣的水解影响很大。随着盐酸浓度的增加,GAH 得率呈现先增加后下降的趋势,在盐酸浓度为30%时,GAH 得率最高为19.40%。适宜浓度的盐酸有利于杏鲍菇甲壳素酰胺键的破坏,进而释放出GAH。当盐酸浓度较低时,酰胺键难以被打开,导致水解不完全[12],随着盐酸浓度的增加,水解效果越加明显。然而,当盐酸浓度过高时,水解溶液的粘壁炭化现象也更加显著,影响了水解效率,因此GAH 得率反而没有提升。
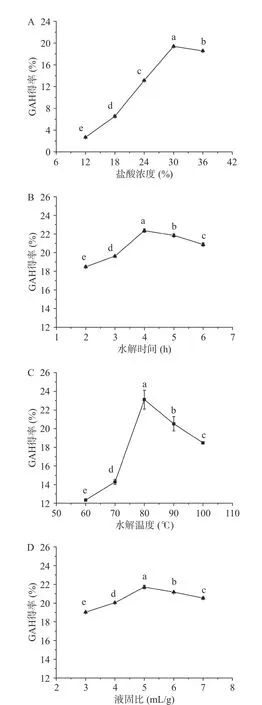
图1 不同提取因素对GAH 得率的影响Fig.1 Effects of different extraction factors on the yields of GAH
2.1.2 水解时间对GAH 得率的影响 如图1B 所示,水解时间对于GAH 得率有一定的影响。在一定的温度下,随着反应时间的延长,杏鲍菇残渣被逐步水解,GAH 含量逐渐增加,在反应4 h 时GAH 得率达到最大值为22.37%。随着时间的继续延长,得率开始逐步下降,可能是因为反应时间过长使得GAH又发生复合与再分解反应[23]。因此,4 h 为水解的最佳时间。
2.1.3 水解温度对GAH 得率的影响 如图1C 所示,温度对GAH 得率有显著影响。随着温度的升高,GAH 得率明显提高,在温度达到80 ℃时,GAH 得率最高为23.11%,进一步提高温度,GAH 得率反而下降。温度是影响水解反应的重要因素,反应温度越高,越有利于水解反应的发生。但是试验过程发现,温度过高,水解得到的样品溶液颜色加深,可能是氧化和焦化等副反应导致副产物增多[24]。另一方面,温度越高,盐酸的挥发性越强,也可能导致GAH 得率下降。
2.1.4 液固比对GAH 得率的影响 如图1D 所示,液固比对水解反应影响较小,随着液固比的增大,GAH 得率变化范围较小。当液固比为5 mL/g 时GAH 得率最高达21.71%。盐酸作为水解催化剂[12],用量过少,则水解反应不充分,且水解速率慢,产率低;但盐酸用量过高,既增加成本和能耗,产率也没明显提高。
2.2 响应面试验结果
根据单因素实验结果,采用Box-Behnken Design进行响应面优化设计,结果见表2。
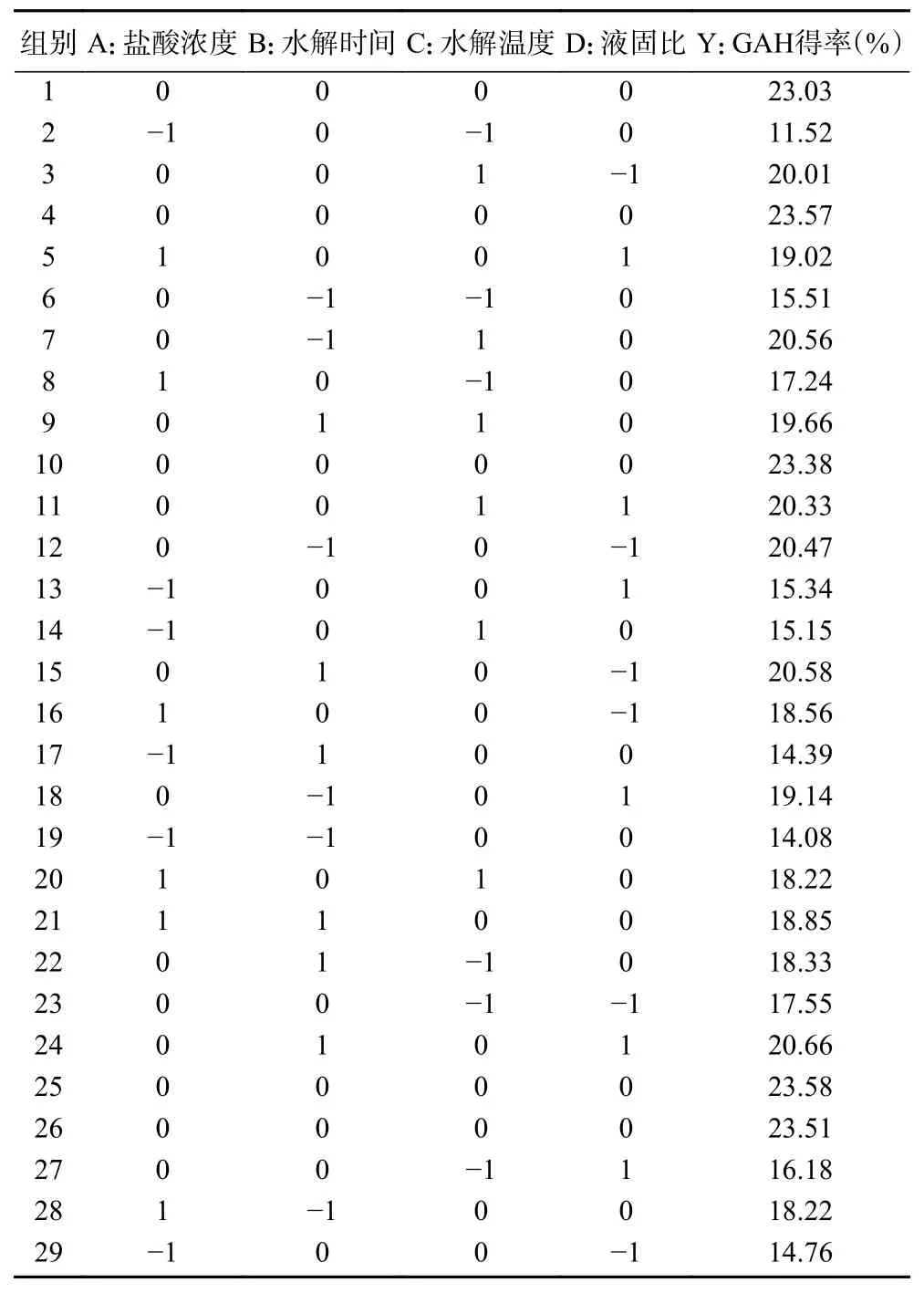
表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken design and results
2.2.1 模型的建立和显著性检验 利用Design-Expert 13 软件对表2 数据进行二次回归拟合分析,得到盐酸浓度(A)、水解时间(B)、水解温度(C)及液固比(D)与GAH 得率(Y)之间的回归方程为:
回归模型的方差分析及显著性分析见表3。
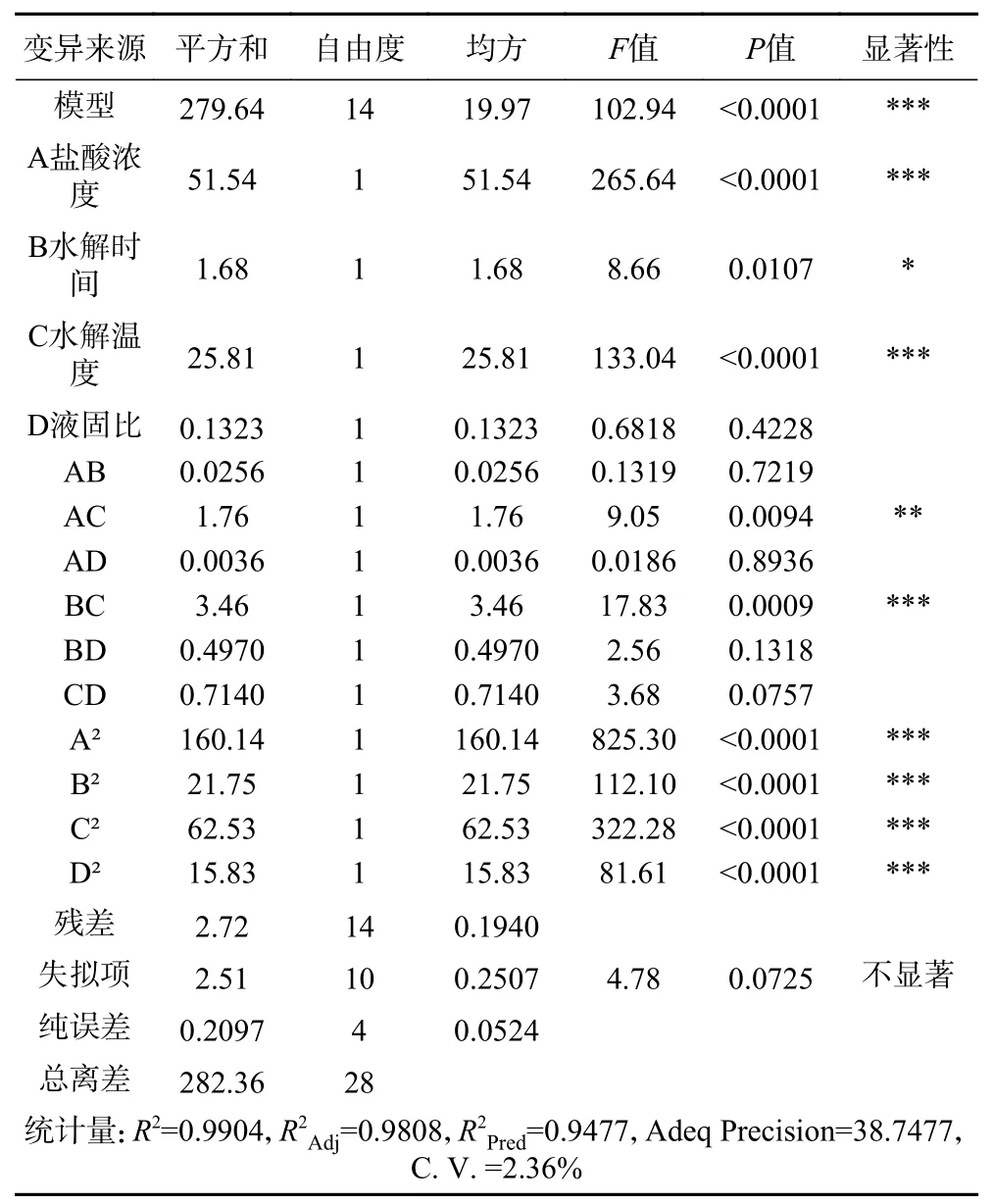
表3 回归模型的方差分析及显著性检验Table 3 Variance analysis and significance test of the regression model
F值越大和P值越小越能代表相关系数的显著性[25-26]。由表3 可知,该回归模型的F值102.94,P值<0.0001,表明回归模型极显著;失拟项P>0.05,说明差异不显著;变异系数C.V.为2.36%(<10%),表明实验的可信度和精确度高。模型相关系数R2为0.9904,说明该模型拟合度高,可预测实际试验中99.04%的结果。校正决定系数R2Adj=0.9808 和预测决定系数R2Pred=0.9477 比较高且数值相近,即差值低于0.2,表明回归模型能充分解释本工艺过程[26-27]。精密度(Adeq Precision=38.7477)是有效信号与噪声的比值,大于4 视为合理。因此,可以用此模型来解释和预测杏鲍菇下脚料酸解制备工艺的各影响因素对GAH 得率的影响。
根据P值可以看出模型中一次项中A 和C 对响应值影响极显著(P<0.0001),B 对响应值影响显著(P<0.05),D 对响应值影响不显著(P>0.05)。交互项中BC 对响应值影响极显著(P<0.001),AC 对响应值影响较显著(P<0.01),其余四组交互项对GAH 的得率无显著影响。二次项中A2、B2、C2和D2对响应值影响均极显著(P<0.0001)。因此,影响GAH 得率的因素依次为盐酸浓度(A)>水解温度(C)>水解时间(B)>液固比(D)。
2.2.2 响应面分析 响应面曲面的坡度和等高线图的性状可反映该因素交互作用对GAH 得率影响的强弱程度[28-29]。盐酸浓度、水解时间、水解温度及液固比对GAH 得率的影响如图2 所示。
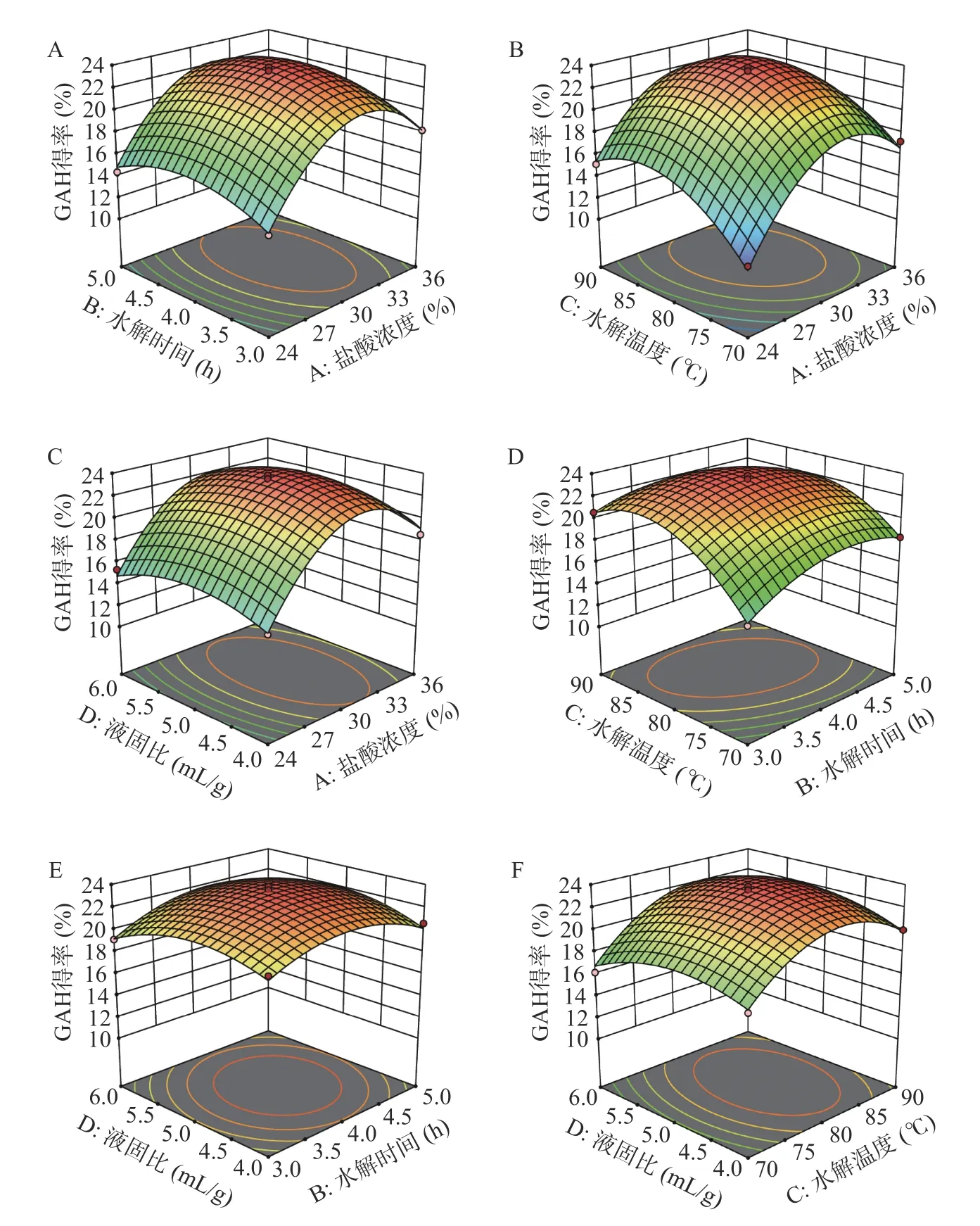
图2 各因素对GAH 得率的交互作用响应面图Fig.2 Response surface diagrams of the interaction of different factors to the GAH yields
由图2B 可知,盐酸浓度和水解温度交互项响应面坡度较陡,对应的等高线比较密集,且呈椭圆形,说明两者交互作用对GAH 得率有显著影响,并且当盐酸浓度较低时,GAH 得率随着温度的升高先上升后下降;当盐酸浓度较高时,GAH 得率随着温度的升高而呈现先升后降的趋势。此外,水解温度和水解时间的交互作用(图2D)也呈现类似的变化趋势,对GAH 得率影响显著。
盐酸浓度和水解时间/液固比交互响应面坡度较平缓(图2A 和图2C),虽然等高线呈椭圆形,但是在盐酸浓度一定时,随着水解时间/液固比的增加GAH 得率变化不大,说明其交互作用对GAH 得率无显著影响。液固比和水解时间交互响应面坡度更加平缓(图2E),而且等高线呈圆形,说明两者交互作用对GAH 得率无显著影响。水解温度和液固比交互响应面坡度平缓(图2F),等高线也呈椭圆形,但是比较稀疏,而且在水解温度一定时,随着液固比的增加GAH 得率变化不大,说明液固比对GAH 得率的影响相对较小。
2.2.3 最佳工艺的确定及验证 根据回归模型可得酸水解制备GAH 的最佳工艺条件为:盐酸浓度31.17%、时间4.05 h、温度82.07 ℃、液固比5 mL/g,在此条件下GAH 得率最高,理论值为23.78%。为验证上述回归模型的准确性,本文根据实际试验情况对理论最佳工艺条件进行调整:盐酸浓度31%、时间4 h、温度82 ℃、液固比5 mL/g。经3 次重复试验后,得到的GAH 得率为23.61%,与理论值差异不显著。由此证明试验模型合理有效,并且GAH 得率显著高于文献报道的5.23%[23]。
2.3 HPLC-MS 分析
2.3.1 HPLC 分析 由图3 可知,GAH 纯化样品与标准品的出峰时间(分别为1.192 min 和1.185 min)基本相同,而且峰形对称,无其他杂质峰。并且,在浓度相同情况下,GAH 纯化样品和标准品的主峰峰面积占比分别为97.83%和95.96%,意味着GAH 纯化样品的纯度是标准品的101.9%。
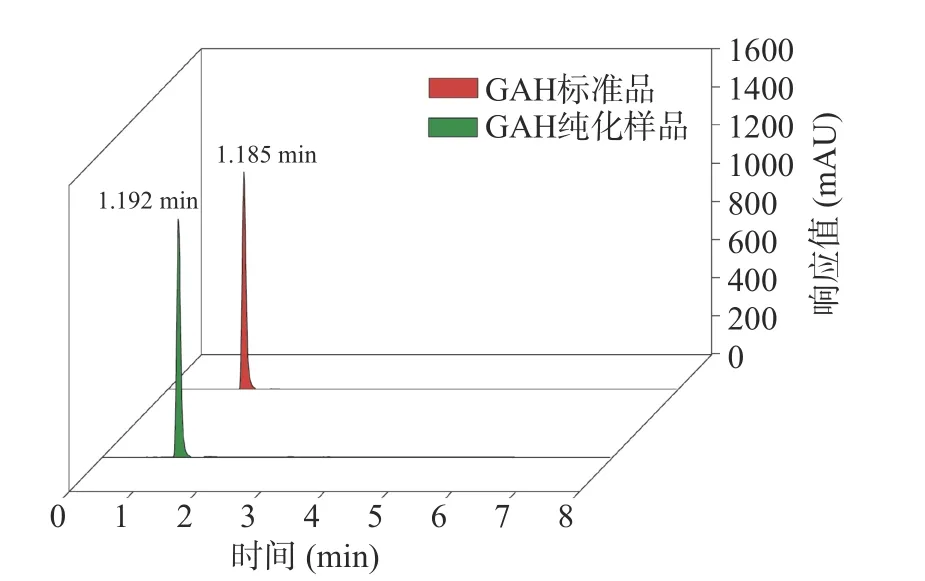
图3 GAH 纯化样品HPLC 图Fig.3 HPLC chromatogram of GAH-purified sample
2.3.2 MS 分析 图4 为GAH 标准品和纯化样品的MS 谱图,经比较发现,二者有极高的相似度,均在低质谱区出现了丰度最大的碎片离子(质荷比m/z为214.1),可能是GAH 失去一个H+的[M-H+]碎片离子,因此,推测该化合物的分子量为215.1,结果与文献报道一致[30]。
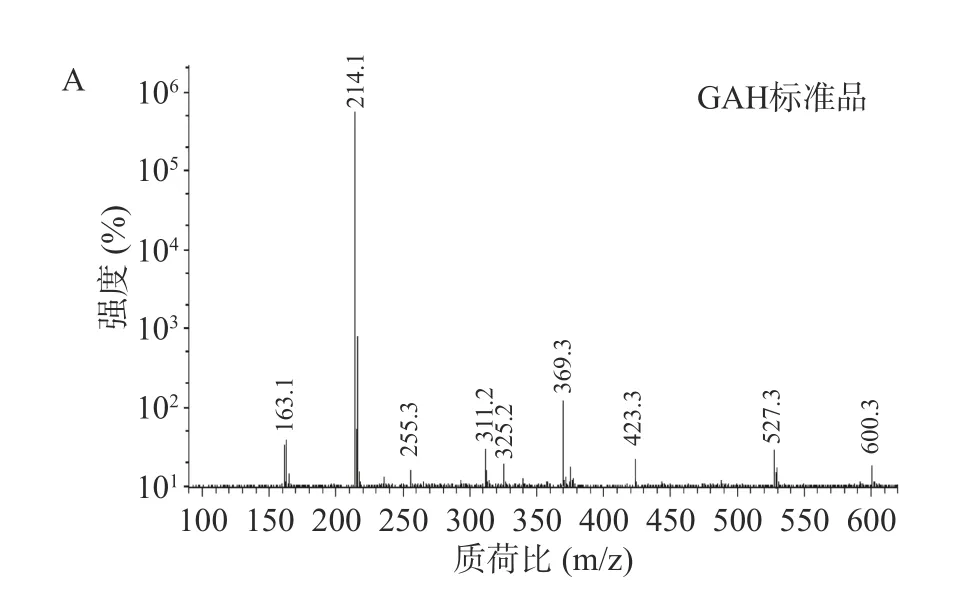
图4 GAH 纯化样品MS 图Fig.4 Mass spectrogram of GAH-purified sample
2.4 FT-IR 分析
据文献[24,30]报道显示,3292 cm-1是N-H 键的伸缩振动,2943 cm-1是C-H 键的伸缩振动,1616 cm-1是N-H 键的面内弯曲振动、1065 cm-1是C-N 键的伸缩振动,912 cm-1N-H 键的面外弯曲振动。GAH纯化样品与标准品的红外光谱图如图5 所示,二者均在3292、2943、1616、1065 和912 cm-1附近存在特征吸收峰,说明本工艺制备的GAH 纯化样品与标准品红外图谱基本吻合。
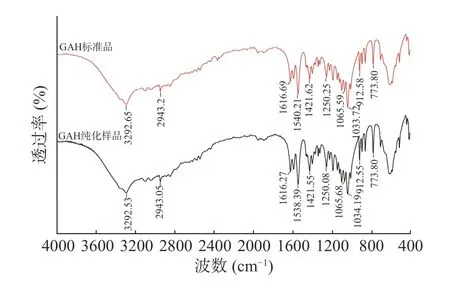
图5 GAH 纯化样品红外光谱图Fig.5 Infrared spectrum of GAH-purified sample
2.5 GAH 产品主要指标分析
GAH 纯化样品各种理化指标如表4 所示,pH为4.1,比旋光度为+72.0°,符合美国药典USP43-NF38 的要求。并且,重金属砷仅为0.21 μg/g,明显低于药典的限量标准。此外,Cl-含量为16.42%,SO42-含量低于0.002%;灰分和干燥失重分别为0.04%和0.89%。因此,GAH 纯化样品的各项指标均符合甚至优于USP43-NF38 的规定,尤其在砷含量方面具有更明显的优势。
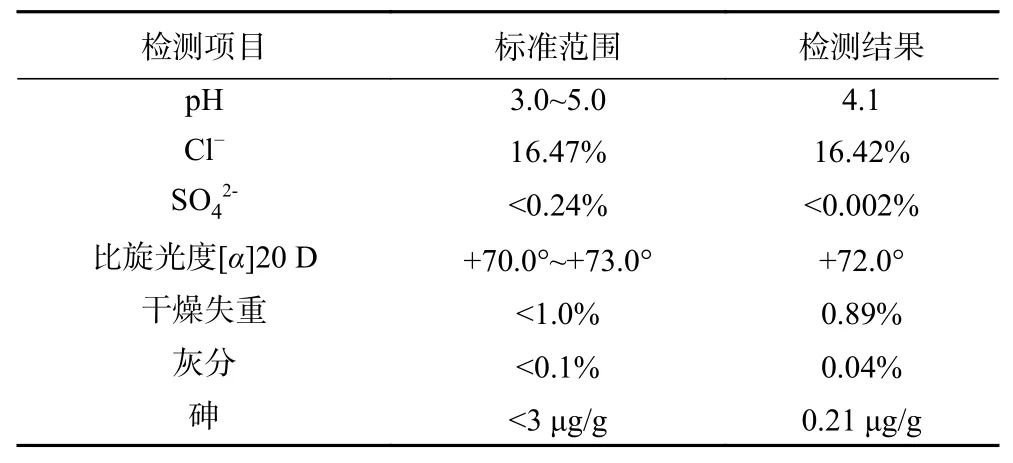
表4 GAH 纯化样品主要理化指标Table 4 Main physical and chemical indexes of GAH-purified sample
2.6 GAH 对斑马鱼胚胎发育的影响
斑马鱼由于基因背景与哺乳动物相似、胚胎体表透明便于观察、繁殖量大、发育快速等特点,被广泛应用于疾病模型构建和高通量药物筛选研究,近年来斑马鱼胚胎常被用于环境毒理测试中,是优良的模式动物。利用这个模式动物,我们前期的研究表明,双孢蘑菇来源的GAH 对斑马鱼骨骼发育及损伤修复有良好的治疗效果,效果甚至优于临床常见的抗骨质疏松药物阿仑膦酸钠[31-32]。因此,本文同样利用斑马鱼动物模型来初步探索杏鲍菇来源GAH 的毒性及生物活性。首先采用1.2.10 的给药方法进行处理,检测了不同GAH 浓度对斑马鱼胚胎发育的影响,结果表明,不同浓度下的GAH 能导致胚胎心脏发育出现不同程度的异常,不仅如此,GAH 对斑马鱼胚胎黑色素和黄色素的发育都有明显的抑制作用。依据表型的严重程度将其分为三类,其中正常表型为野生型;较轻微的异常表型I 型表现为心包肿大,背部及卵黄处的色素堆积有轻微减少;严重的异常表型II 型表型为心包肿大、轻微出血,体表色素堆积明显减少(图6A)。随着GAH 浓度升高,收集的斑马鱼数量逐渐减少,可能是因为高浓度会导致胚胎死亡,通过对每一组中不同表型的胚胎数量进行统计分析发现,中高浓度下(0.3~0.5%)的GAH 引发的胚胎发育异常比例都超过50%以上(图6B)。
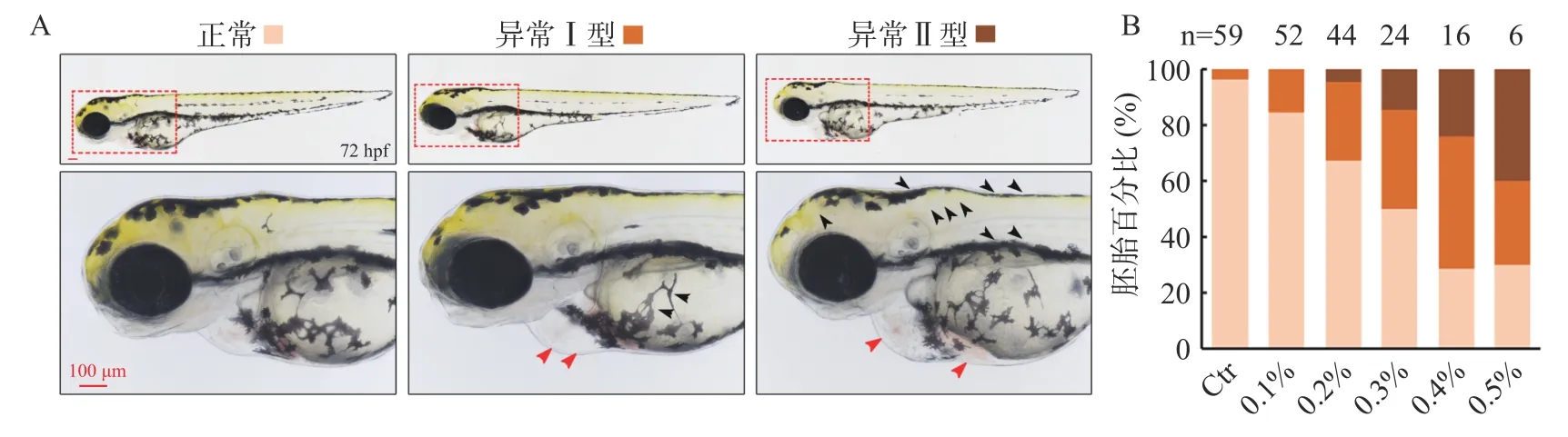
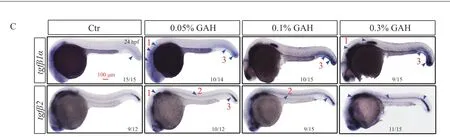
图6 GAH 纯化样品对斑马鱼胚胎发育的影响Fig.6 Effects of GAH-purified sample on embryonic development of zebrafish
TGF-β信号通路几乎存在于所有多细胞动物中且在进化上高度保守,对生物体胚胎发育、成熟及疾病进展都具有重要的功能。斑马鱼中存在4 个tgfβ配体,即tgfβ1a、tgfβ1b、tgfβ2 和tgfβ3。斑马鱼胚胎在0.05%、0.1%和0.3%的GAH 纯化样品浸泡24 h 后,通过整胚原位杂交检测tgfβ1a 和tgfβ2 的mRNA 时空分布(图6C),结果表明:与对照组(Ctr)相比,处理组中60%以上的胚胎tgfβ1a、tgfβ2mRNA的表达水平明显上调,尤其是0.3%浓度下,上述基因在端脑、前端神经系统、脊索以及尾部的表达强度明显增加,初步提示GAH 对TGF-β信号通路及调控的生理过程可能具有促进作用。
综上,GAH 可能通过影响Tgf-β信号通路成员的mRNA 表达影响斑马鱼胚胎的早期发育,揭示以杏鲍菇为原料制备的GAH 具有值得探究的生物活性。
3 结论
本文研究了以杏鲍菇废弃菌渣为原料的GAH制备工艺、质量指标及其对斑马鱼胚胎发育的影响。酸解制备GAH 的最优工艺参数为:盐酸浓度31%、时间4 h、温度82 ℃、液固比5 mL/g,在此条件下GAH 得率为23.61%。HPLC-MS、FT-IR 和相关理化指标分析结果显示,GAH 纯化样品纯度为标准品的101.9%,分子量为215.1,红外谱图与标准品基本吻合,各项质量指标均符合甚至优于USP43-NF38 质量标准,其中砷含量仅0.21 μg/g。斑马鱼实验结果表明,不同浓度GAH 会引起斑马鱼胚胎不同程度的发育异常,中高浓度(0.3%~0.5 %)的GAH 引发的斑马鱼胚胎发育异常比例超过50%,且0.3%的GAH 对TGF-β信号通路具有明显的促进作用。
本研究充分利用杏鲍菇废弃菌渣制备GAH,既为GAH 生产提供了一种高效制备方法,也为传统的GAH 制备开辟新的原材料来源,还为中国杏鲍菇产业占据30%的剩余物开拓了其他应用途径。本研究的研究方法对促进杏鲍菇产业多元化良性发展具有重要的参考价值,但在研究中仍存在因使用盐酸的而带来的环境问题,后期研究将集中于盐酸替代试剂的研究,或通过构建连续制备工艺以减少盐酸用量。

