磷酸三钙去除U(Ⅵ)的性能与机理研究
赵凯鑫,高 琼,田 强,晏敏皓,黄 毅,*
1.西南科技大学 环境友好能源材料国家重点实验室,四川 绵阳 621010;2.西南科技大学 材料与化学学院,四川 绵阳 621010
核能作为一种经济、可持续发展的能源,已被广泛应用于民用发电领域[1]。铀是核反应堆涉及的重要元素,在铀矿开采和加工、核燃料组件制造、乏燃料后处理等过程中均会产生一定量含U(Ⅵ)废液[2-3]。然而,U(Ⅵ)的放射毒性强、半衰期长,一旦泄漏至生物圈,将会对人类健康和生态环境造成严重损害[4]。当前,处理含U(Ⅵ)废液的主要方法有离子交换法[5]、化学沉淀法[6]、膜处理法[7]、溶剂萃取法[8]、吸附法[9]等;其中,吸附法因其工艺简单、成本较低和适用性广等优点而被广泛关注。
目前,用于含U(Ⅵ)废水处理的吸附材料主要包括有机吸附材料(离子交换树脂[10]、纤维素[11]、壳聚糖[12]、有机骨架[13]、聚丙烯腈[14]、腐殖酸[15]等)和无机吸附材料(活性炭[16]、蒙脱石[17]、沸石[18]、二氧化硅[19]、羟基磷灰石[20]等)。上述有机、无机吸附材料通常在pH≥5的水溶液中对U(Ⅵ)具有最佳的吸附性能,但在较强酸性(pH<5)条件下吸附材料的化学稳定性和吸附性能却难以兼得[21]。
为了解决该问题,马磊等[21]采用氟磷灰石对U(Ⅵ)进行吸附处理,其研究结果表明:在pH=3的酸性条件下,氟磷灰石对U(Ⅵ)具有较高的吸附容量(655.17 mg/g),并且在pH≥3的环境中具有较好的化学稳定性。然而,氟磷灰石(Ca10(PO4)6F2)吸附U(Ⅵ)的过程中会引入氟离子(F-)。含氟的氟化物已被世界卫生组织(WHO)认定为是对人类健康具有潜在危害的物质[22]。氟磷灰石与磷酸三钙均属于磷酸盐物质,与含氟的氟磷灰石(Ca10(PO4)6F2)相比,磷酸三钙(Ca3(PO4)2)是一种完全无氟的磷酸盐。此外,目前国外尚未见有关磷酸三钙去除U(Ⅵ)的报道,国内也鲜有报道。
广州大学彭燕等[23]采用磷酸三钙对铀矿下游水系沉积物中的铀进行处理,其研究结果表明,磷酸三钙不仅能够显著降低污染沉积物中铀的活动性,还能有效地降低沉积物中铀的危害。然而,该研究工作只对磷酸三钙去除铀的相关机理进行了理论推测,并未进行深入系统的实验研究。
为了探明磷酸三钙去除铀矿周边水体中U(Ⅵ)的相关机理,本工作拟先采用固相法[24]合成磷酸三钙粉末,并利用X射线衍射仪(XRD)、傅里叶转换红外光谱仪(FTIR)、扫描电子显微镜(SEM)和比表面积分析仪(BET)对其理化特性进行表征;其次,系统研究pH、固液比、吸附时间、U(Ⅵ)初始浓度、吸附温度等因素对磷酸三钙吸附U(Ⅵ)性能的影响;最后,利用吸附动力学、等温吸附、吸附热力学模型,并借助XRD、FTIR、X射线光电子能谱(XPS)、SEM、能谱仪(EDS)、电感耦合等离子体发射光谱仪(ICP-OES)等表征手段进一步揭示磷酸三钙吸附U(Ⅵ)的相关机理。
1 实验部分
1.1 试剂与仪器
碳酸钙(CaCO3)、磷酸氢二铵((NH4)2HPO4)、硝酸镍(Ni(NO3)2·6H2O),分析纯,国药集团化学试剂有限公司;盐酸(HCl)、氨水(NH3·H2O)、乙醇(C2H5OH)、硝酸锌(Zn(NO3)2·6H2O)、硝酸钡(Ba(NO3)2),分析纯,成都市科隆化学品有限公司;偶氮胂Ⅲ(C22H18As2N4O14S2,纯度≥95%),东京化成工业株式会社;硝酸铀酰(UO2(NO3)2·6H2O),分析纯,湖北楚盛威化工有限公司;硝酸铬(Cr(NO3)3·9H2O),分析纯,上海阿拉丁生化科技有限公司;硝酸铜(Cu(NO3)2·3H2O),分析纯,成都市科龙化工试剂厂。
D/max-1400型X射线衍射仪(XRD),日本理学;SPECTRUM ONE型傅里叶转换红外光谱仪(FTIR),美国珀金埃尔默;Autosorb-IQ型比表面积分析仪(BET),美国康塔;UV-1800型紫外可见分光光度计,日本岛津;Ultra55型高分辨冷场发射扫描显微镜(SEM)分析系统,带有Oxford IE 450X-Max80型能量色散X射线光谱仪(EDS),德国卡尔蔡司;Thermo Scientific K-Alpha型X射线光电子能谱(XPS)、iCAP6500型电感耦合等离子体发射光谱仪(ICP-OES)、XL200型台式pH值测试仪,美国赛默飞世尔;QM-3SP2型行星式球磨机,南京南大仪器;KF1400型箱式电阻炉,南京博蕴通仪器;SHZ-82A型气浴恒温振荡器,常州江南实验仪器;TG16-WS型高速离心机,常州金坛良友仪器;MS3000型激光粒度仪,英国马尔文。
1.2 磷酸三钙粉末的制备
以CaCO3与(NH4)2HPO4为合成原料,根据化学反应方程式(1),采用固相反应法[24]合成磷酸三钙(Ca3(PO4)2)。具体合成方法如下:按Ca/P摩尔比=1.5,称取CaCO3和(NH4)2HPO4;然后,按氧化锆小球∶无水乙醇∶合成原料质量比=4∶7∶4的比例,放入行星式球磨机中进行球磨6 h(转速350 r/min),球磨后的浆体在80 ℃恒温干燥箱中进行12 h烘干处理,烘干后的粉末放入箱式电阻炉中进行煅烧(升温速率10 ℃/min,煅烧温度1 473 K,保温时间3 h),煅烧后的粉末在玛瑙研钵中研磨5 min,最终获得磷酸三钙粉末。
2(NH4)2HPO4+3CaCO3=
Ca3(PO4)2+4NH3+3CO2+3H2O
(1)
1.3 吸附实验
以磷酸三钙粉末作为吸附U(Ⅵ)的材料,探究pH、固液比、吸附时间、U(Ⅵ)初始浓度、吸附温度等因素对磷酸三钙吸附U(Ⅵ)性能的影响。吸附实验的具体操作如下:首先,按照文献[21]绘制U(Ⅵ)的标准曲线;然后,称取UO2(NO3)2·6H2O配制一定初始浓度(ρ0=40、80、120、160、200 mg/L)的铀溶液,利用盐酸(HCl)、氨水(NH3·H2O)将铀溶液调节至指定pH值(pH=2.0、2.3、2.5、2.7、2.8、2.9、3.0、4.0、5.0、6.0);加入一定量的磷酸三钙(固液比=0.04、0.1、0.2、0.3、0.4、0.5、0.6 g/L),超声1 min后放入恒温振荡箱(T=303、308、313、318、323 K)进行吸附实验,振荡频率为170 r/min;吸附时间t为5、10、20、30、60、120、180 min;吸附实验结束后,将试管放入离心机中离心1 min(转速8 000 r/min),取1 mL上清液,利用偶氮胂Ⅲ分光光度法[25]测试上清液中U(Ⅵ)的浓度。利用式(2)、(3)计算磷酸三钙对U(Ⅵ)的平衡吸附容量qe和去除率R′。
(2)
(3)
式中:qe为吸附平衡时磷酸三钙对U(Ⅵ)的吸附容量,mg/g;R′为磷酸三钙对U(Ⅵ)的去除率;ρ0为U(Ⅵ)初始质量浓度,mg/L;m为磷酸三钙的质量,g;ρe为吸附平衡时U(Ⅵ)的质量浓度,mg/L;V为铀溶液体积,L。
1.4 溶解性实验
为了探究磷酸三钙吸附U(Ⅵ)前后的溶解性,将25 mg的磷酸三钙和25 mg吸附U(Ⅵ)后的磷酸三钙分别置于25 mL的水溶液中(pH=2.0、3.0、4.0、5.0、6.0),然后放入308 K的恒温振荡箱中振荡180 min,振荡频率为170 r/min;振荡结束后,将溶液放入离心机中离心1 min(8 000 r/min),取上清液待测;采用ICP-OES测试上清液中Ca2+和U的浓度,分析吸附U(Ⅵ)前后的磷酸三钙在不同pH水溶液中的溶解性。
1.5 共存离子吸附实验

表1 共存离子溶液中各金属离子初始浓度Table 1 Initial concentration of metal ions in coexisting ion solutions
(4)
(5)

2 结果与讨论
2.1 磷酸三钙的表征


图1 煅烧温度1 473 K和保温时间3 h条件下合成的磷酸三钙粉末XRD图谱(a)、SEM图(b)、FTIR图谱(c)及氮气吸附脱附曲线(d)Fig.1 XRD pattern(a), SEM image(b), FTIR spectrum(c), and nitrogen adsorption desorption curve(d) of synthetic tricalcium phosphate powder under 1 473 K for 3 h
2.2 磷酸三钙对U(Ⅵ)的去除性能


(a):计算条件:ρ0=120 mg/L,ρ(Cl-)=35.45 mg/L,T=308 K;(b):固液比0.1 g/L,吸附时间120 min,ρ0=120 mg/L,T=308 K图2 在不同pH水溶液中的种态分布图(a)以及不同pH下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率(b)Fig.2 Species distribution of in solution with different pH values(a), equilibrium adsorption capacity and removal ratio of U(Ⅵ) by tricalcium phosphate under different pH conditions(b)
2.2.2固液比对磷酸三钙吸附U(Ⅵ)的影响 图3为不同固液比下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率。如图3所示,当固液比为0.04 g/L时,磷酸三钙对U(Ⅵ)的平衡吸附容量达到最大值(1 297.71 mg/g);随着固液比增加,其平衡吸附容量逐渐降低;当固液比从0.04 g/L提升到0.1 g/L时,其去除率从43.26%增至82.94%;当固液比从0.1 g/L增至0.6 g/L时,其去除率逐渐进入平台期,这可能是由于磷酸三钙吸附U(Ⅵ)存在吸附极限值,该现象符合吸附材料吸附重金属离子的一般规律[30]。由于固液比为0.1 g/L时,磷酸三钙对U(Ⅵ)兼具较高平衡吸附容量(995.25 mg/g)和去除率(82.94%),因此选择0.1 g/L为后续吸附实验固液比。

pH=3.0,吸附时间120 min,ρ0=120 mg/L,T=308 K图3 不同固液比下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率Fig.3 Equilibrium adsorption capacity and removal ratio of U(Ⅵ) by tricalcium phosphate under different solid-liquid ratios
2.2.3吸附时间对磷酸三钙吸附U(Ⅵ)的影响 图4(a)为不同吸附时间下磷酸三钙对U(Ⅵ)的吸附量和去除率。由图4(a)可知,当吸附时间是60 min时,磷酸三钙对U(Ⅵ)的吸附反应基本达到平衡,其吸附量和去除率分别增至999.25 mg/g和83.27%。因此,本工作选择60 min作为后续吸附实验的吸附时间。图4(b)与图4(c)为磷酸三钙吸附U(Ⅵ)的准一级和准二级动力学模型拟合图,其拟合公式分别为式(6)和式(7)。

pH=3.0,固液比0.1 g/L,ρ0=120 mg/L,T=308 K图4 不同吸附时间下磷酸三钙对U(Ⅵ)的吸附量和去除率(a),准一级动力学模型拟合图(b)以及准二级动力学模型拟合图(c)Fig.4 Adsorption capacity and removal ratio of U(Ⅵ) by tricalcium phosphate under different adsorption times(a), fitting picture of pesudo-first-order kinetic model(b), and fitting picture of pesudo-second-order kinetic model(c)
ln(qe-qt)=lnqe-k1t
(6)
(7)
其中:t为吸附时间,min;qe为吸附平衡时磷酸三钙对U(Ⅵ)的吸附容量,mg/g;qt为t时刻磷酸三钙对U(Ⅵ)的吸附量,mg/g;k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g/(mg·min)。表2为磷酸三钙吸附U(Ⅵ)的准一级和准二级动力学模型拟合参数。由表2可知,由于其准二级动力学模型拟合相关系数(r2=0.995)大于准一级动力学模型拟合相关系数(r2=0.979);因此,磷酸三钙对U(Ⅵ)的吸附更符合准二级动力学模型,表明在磷酸三钙吸附U(Ⅵ)的过程中主要以化学吸附为主[31]。

表2 准一级和准二级动力学模型拟合参数Table 2 Fitting parameters of pesudo-first-order and pesudo-second-order kinetic models
2.2.4铀初始浓度对磷酸三钙吸附U(Ⅵ)的影响 图5(a)为不同U(Ⅵ)初始浓度下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率。如图5(a)所示:随着U(Ⅵ)初始浓度增加,磷酸三钙对U(Ⅵ)的平衡吸附容量逐渐增大、去除率逐渐减小。当U(Ⅵ)初始质量浓度为40 mg/L时,去除率达到最大值(88.17%),平衡吸附容量为最小值(352.67 mg/g);然而,当U(Ⅵ)初始质量浓度为200 mg/L时,去除率为最小值(70.25%),平衡吸附容量达到最高值(1 405.08 mg/g);由于U(Ⅵ)初始质量浓度为120 mg/L时,磷酸三钙对U(Ⅵ)兼具较高的平衡吸附容量(999.25 mg/g)和去除率(83.27%),因此选择120 mg/L作为后续吸附实验的U(Ⅵ)初始质量浓度。图5(b)与图5(c)为磷酸三钙吸附U(Ⅵ)的Langmuir和Freundlich等温吸附模型拟合图,其拟合公式分别为式(8)和式(9)。

pH=3.0,固液比0.1 g/L,吸附时间60 min,T=308 K图5 不同U(Ⅵ)初始浓度下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率(a)、Langmuir等温吸附模型拟合图(b)以及Freundlich等温吸附模型拟合图(c)Fig.5 Equilibrium adsorption capacity and removal ratio of U(Ⅵ) by tricalcium phosphate under different initial U(Ⅵ) concentrations(a), fitting picture of Langmuir isotherm adsorption model(b), and fitting picture of Freundlich isotherm adsorption model(c)
(8)
(9)
其中:qe为吸附平衡时磷酸三钙对U(Ⅵ)的吸附容量,mg/g;KL为Langmuir模型吸附平衡常数,L/mg;qm为单层饱和吸附容量,mg/g;ρe为吸附平衡时U(Ⅵ)的质量浓度,mg/L;KF为Freundlich模型吸附平衡常数,(mg/g)·(mg/L)-1/n;n为吸附强度相关常数。表3为磷酸三钙吸附U(Ⅵ)的Langmuir和Freundlich等温吸附模型拟合参数。由表3可知,由于其Langmuir拟合相关系数(r2=0.993)大于Freundlich拟合相关系数(r2=0.944),因此磷酸三钙对U(Ⅵ)的吸附更符合Langmuir等温吸附模型,表明在磷酸三钙吸附U(Ⅵ)的过程中主要以单层吸附为主[32]。

表3 Langmuir和Freundlich等温吸附模型拟合参数Table 3 Fitting parameters of Langmuir and Freundlich isothermal adsorption model
2.2.5吸附温度对磷酸三钙吸附U(Ⅵ)的影响 图6(a)为不同吸附温度下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率。由图6(a)可知,随着吸附温度的升高,磷酸三钙对U(Ⅵ)的吸附容量和去除率在不断增大。考虑到环境温度和实验安全问题,选择308 K作为吸附实验的吸附温度。图6(b)是磷酸三钙对U(Ⅵ)的吸附热力学模型拟合图,热力学模型拟合公式如式(10—12)。

pH=3.0,固液比0.1 g/L,吸附时间60 min,ρ0=120 mg/L图6 不同温度下磷酸三钙对U(Ⅵ)的平衡吸附容量和去除率(a)以及吸附热力学模型拟合图(b)Fig.6 Equilibrium adsorption capacity and removal ratio of U(Ⅵ) by tricalcium phosphate under different adsorption temperatures(a), and fitting picture of adsorption thermodynamic model(b)
(10)
(11)
ΔG=ΔH-TΔS
(12)
其中:V为铀溶液体积,L;m为磷酸三钙的质量,g;ρ0为U(Ⅵ)初始质量浓度,mg/L;ρe为吸附平衡时U(Ⅵ)的质量浓度,mg/L;K为热力学平衡常数,L/g;ΔS为熵变,J/(mol·K);ΔH为焓变,J/mol;R为理想气体常数,8.314 J/(mol·K);ΔG为Gibbs自由能变,J/mol;T为吸附温度,K。
表4为磷酸三钙吸附U(Ⅵ)的吸附热力学模型拟合参数。由表4可知,ΔH>0表明磷酸三钙吸附U(Ⅵ)为吸热反应;ΔG<0表明磷酸三钙吸附U(Ⅵ)是自发反应过程;吸附温度越高,ΔG越小,表明磷酸三钙对U(Ⅵ)吸附倾向随着吸附温度的升高而增强[33]。

表4 吸附热力学模型拟合参数Table 4 Fitting parameters of adsorption thermodynamic model
综合pH、固液比、吸附时间、U(Ⅵ)初始浓度、吸附温度等因素的影响实验结果,在后续的磷酸三钙对U(Ⅵ)的去除机理研究中,选择的优化吸附条件如下:pH=3.0、固液比0.1 g/L、吸附时间60 min、U(Ⅵ)初始质量浓度120 mg/L、吸附温度308 K。
2.3 磷酸三钙对U(Ⅵ)的去除机理
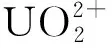

图7 磷酸三钙吸附U(Ⅵ)前后的XRD图谱(a)及FTIR光谱(b)Fig.7 XRD patterns(a) and FTIR spectra(b) of tricalcium phosphate before and after adsorption of U(Ⅵ)
2.3.2XPS分析 图8(a)是磷酸三钙吸附U(Ⅵ)前后的XPS图谱。由图8(a)可知,磷酸三钙吸附U(Ⅵ)前后均有Ca、P、O元素,吸附U(Ⅵ)后的磷酸三钙表面还出现U的特征峰(U5d、U4f、U4d),表明U(Ⅵ)被成功吸附到磷酸三钙表面上。图8(b)为磷酸三钙吸附U(Ⅵ)后U4f的XPS图谱。由图8(b)可知,382.08 eV和392.88 eV分别对应U(Ⅵ)特征的U4f7/2和U4f5/2反对称伸缩振动双峰,该结果表明,在磷酸三钙吸附U(Ⅵ)后,U(Ⅵ)的价态没有发生改变,并未发生氧化还原反应[34]。

图8 磷酸三钙吸附U(Ⅵ)前后的XPS图谱(a)以及磷酸三钙吸附U(Ⅵ)后U4f的XPS图谱(b)Fig.8 XPS spectra of tricalcium phosphate before and after adsorption of U(Ⅵ)(a), and XPS spectra of U4f after adsorption of U(Ⅵ) by tricalcium phosphate(b)
2.3.3SEM-EDS分析 图9(a、b)分别为磷酸三钙吸附U(Ⅵ)后SEM图及Spectrum 23位点EDS能谱图。图9(c、d)分别为磷酸三钙吸附U(Ⅵ)后SEM图及Spectrum 24位点EDS能谱图。表5为磷酸三钙吸附U(Ⅵ)后的表面化学元素含量。由图9(a)可知,吸附U(Ⅵ)后磷酸三钙Spectrum 23位点表面被针状物质所覆盖;如图9(b)所示,该针状物质由Ca、P、O、U四种元素组成;由表5可知,Spectrum 23位点针状物质的Ca、P、O、U原子百分比接近于准钙铀云母(Ca(UO2)2(PO4)2·6H2O)理论原子百分比。由图9(c)可知,位于Spectrum 24位点的物质是光滑平整的颗粒;如图9(d)所示,该光滑平整的颗粒由Ca、P、O三种元素组成;由表5可知,Spectrum 24位点光滑平整颗粒的Ca、P、O原子百分比接近于磷酸三钙(Ca3(PO4)2)的理论原子百分比。上述实验结果表明,磷酸三钙吸附U(Ⅵ)后表面存在磷酸三钙(Ca3(PO4)2)和准钙铀云母(Ca(UO2)2(PO4)2·6H2O)两种晶相,该结果与磷酸三钙吸附U(Ⅵ)后XRD结果(图7(a))一致。

图9 磷酸三钙吸附U(Ⅵ)后Spectrum 23位点SEM图(a)、Spectrum 23位点EDS图谱(b)、Spectrum 24位点SEM图(c)及Spectrum 24位点EDS图谱(d)Fig.9 Spectrum 23 site SEM image(a), Spectrum 23 site EDS spectrum(b), Spectrum 24 site SEM image(c), and Spectrum 24 site EDS spectrum(d) of tricalcium phosphate after adsorption of U(Ⅵ)

表5 磷酸三钙吸附U(Ⅵ)后表面化学元素含量Table 5 Surface chemical element content of tricalcium phosphate after adsorption of U(Ⅵ)
2.3.4磷酸三钙吸附U(Ⅵ)前后的溶解性 图10(a)为磷酸三钙在不同pH水溶液中的溶解性。由图10(a)可知:在pH=2.0时,磷酸三钙溶解出的Ca2+浓度(溶解度)达到最大值(319.33 mg/L);在pH=3.0时,溶解出的Ca2+的浓度减小至30.25 mg/L;在pH>3.0时,溶解出的Ca2+浓度均保持较低水平。图10(b)为吸附U(Ⅵ)后的磷酸三钙在不同pH水溶液中的溶解性。由图10(b)可知,在pH=2.0时,吸附U(Ⅵ)后的磷酸三钙溶解出较高浓度的Ca2+(76.57 mg/L);当pH由2.0增至6.0时,溶液中的Ca2+浓度逐渐降低至5.17 mg/L;此外,在pH=2.0时,吸附U(Ⅵ)后的磷酸三钙溶解出较高浓度的U元素(28.07 mg/L);然而,在pH≥3.0时,溶解出的U元素浓度基本趋近于零;由于U元素主要来自吸附U(Ⅵ)后的磷酸三钙表面新产生的准钙铀云母(Ca(UO2)2(PO4)2·6H2O),因此该实验结果表明,准钙铀云母(Ca(UO2)2(PO4)2·6H2O)在pH≥3.0水溶液中具有较好的稳定性。

25 mg磷酸三钙和25 mg吸附U(Ⅵ)后磷酸三钙分别置于25 mL水溶液中,pH=2.0~6.0,T=308 K图10 磷酸三钙(a)和吸附U(Ⅵ)后的磷酸三钙(b)在不同pH水溶液中的溶解性Fig.10 Solubility of tricalcium phosphate(a) and tricalcium phosphate absorbed with U(Ⅵ)(b) in aqueous solution with different pH values



2.4 共存离子吸附实验结果
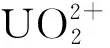

金属离子初始浓度见表1,pH=3.0,固液比0.1 g/L,吸附时间180 min,吸附温度308 K图11 共存离子溶液中磷酸三钙对各金属离子的平衡吸附容量和去除率Fig.11 Equilibrium adsorption capacity and removal ratio of tricalcium phosphate for various metal ions in coexisting ion solutions

表6 共存离子溶液中磷酸三钙对各金属离子的选择性吸附参数Table 6 Selective adsorption parameters of tricalcium phosphate for various metal ions in coexisting ion solutions
3 结 论
本工作以碳酸钙和磷酸氢二铵为原料,采用固相法合成了磷酸三钙粉末,并探究其对U(Ⅵ)的吸附性能与机理,研究结果表明:
(1) 在pH=3.0、固液比0.1 g/L、吸附时间60 min、U(Ⅵ)初始质量浓度为120 mg/L、吸附温度308 K的条件下,磷酸三钙对U(Ⅵ)的平衡吸附容量达到999.25 mg/g;
(2) 磷酸三钙去除U(Ⅵ)的反应符合准二级动力学模型(化学吸附)与Langmuir吸附模型(单层吸附),吸附过程为自发吸热的过程;

(4) 在共存离子(Cr3+、Ni2+、Cu2+、Zn2+、Ba2+)溶液中,磷酸三钙对U(Ⅵ)仍具有较好的去除性能和较强的选择吸附能力。
由此可以看出,磷酸三钙是一种有应用前景的可用于处理含U(Ⅵ)废水的吸附材料。

