玉米籽粒突变体crk4的基因克隆与等位性分析
李萌园 张文成 高 勇 秦永田 薄仕榕 宋琨洋 汤继华 付志远,*
玉米籽粒突变体的基因克隆与等位性分析
李萌园1张文成2高 勇1秦永田2薄仕榕1宋琨洋1汤继华1付志远1,*
1河南农业大学农学院 / 省部共建小麦玉米作物学国家重点实验室 / 河南粮食作物协同创新中心, 河南郑州 450046;2鹤壁市农业科学院, 河南鹤壁 458030
籽粒突变体是克隆籽粒发育关键基因并解析其遗传调控机制的重要材料。()是育种选系过程中发现的籽粒突变体, 与野生型相比, 其籽粒灌浆差、粒重和发芽率显著降低。遗传分析表明该突变由单个隐性核基因控制, 图位克隆将该基因定位于玉米5号染色体614 kb的物理区间内, 该区间包含11个在籽粒中表达的蛋白编码基因。序列分析表明,基因的第2个外显子上存在一个由C碱基缺失造成的特异的终止突变。编码金属-烟酰胺转运蛋白(Metal-nicotianamine transporter,), 是已报道的籽粒突变体的等位基因。等位性测验结果表明,是/的一个新的等位突变体。的鉴定为阐明基因调控玉米籽粒发育的分子机制提供了新的种质资源。
玉米; 籽粒突变体;; 图位克隆;
玉米是我国重要的食用、饲用和工业原料。玉米产量对保障我国粮食安全有重要意义, 而籽粒是决定玉米产量高低和品质优劣的重要器官。因此, 对籽粒发育与灌浆关键基因进行克隆和功能研究, 不仅有助于阐明玉米籽粒发育形成的分子机制, 还能为高产优质玉米育种提供基因资源。
胚和胚乳是玉米籽粒的重要组成部分, 是双受精的产物, 其中, 三倍体胚乳是营养物质的主要储存组织, 二倍体胚是关键的生殖器官[1]。因此, 克隆并阐明控制籽粒发育的关键基因能够为玉米产量的提高提供重要理论基础。现阶段, 已克隆的籽粒发育关键基因主要有以下几种类型: 参与碳水化合物转运的基因[2]、调控淀粉合成的基因[3-6]、影响蛋白质积累的基因[7-9]以及影响线粒体组装和活性的基因[10-15]。此外, 参与糖类物质转运的基因也是影响籽粒发育的一类重要基因, 如参与种子萌发过程中糖的运输, 为淀粉生物合成提供葡萄糖[2]。转运蛋白是一种完整的膜蛋白, 是植物体内物质运输的重要元件。研究发现多个转运蛋白家族参与植物代谢物稳态的调控, 如糖转运蛋白、金属元素转运蛋白等。糖转运蛋白家族包括单糖转运蛋白(MST)家族、蔗糖转运蛋白(SUT)家族、硝酸盐转运蛋白1/多肽转运蛋白(NRT1-PTR)家族等[16-19]。除此之外还有可以运输金属元素的转运蛋白, 如CRT/COPT类型的转运蛋白、P型重金属ATPase、寡肽转运蛋白(OPT)家族等, CRT/COPT家族成员包含3个跨膜结构域, 而且是高度特异的铜转运蛋白; P型重金属ATPase可以运输铜、锌、锰等离子; 寡肽转运蛋白(OPT)家族成员有助于铁、铜、锌、镍、镉、锰的运输[20-22]。是玉米发现的第1个YSL类寡肽转运蛋白, 能够将根部从土壤中吸收的铁元素, 远距离运输至植物的其他部位并重新分配[20]。在水稻生殖发育过程中表达, 参与籽粒中铁元素的运输[23]。尽管现有的研究已在很大程度上丰富了籽粒发育的遗传机理, 但籽粒发育是一个复杂的生物学过程, 需要以籽粒突变体为材料挖掘更多的调控基因。
本研究以玉米育种选系过程中发现的籽粒突变体为试验材料, 通过遗传分析、图位克隆和等位性测验明确其候选基因是编码金属-烟酰胺转运蛋白的/基因。作为/基因的一个新的等位突变体, 为解析调控籽粒发育分子机理提供了新的遗传材料。
1 材料与方法
1.1 试验材料
以育种选系过程中发现的籽粒自然突变体及其与常规自交系Mo17组配的F2分离群体为试验材料。等位性测验所用突变体由中国科学院大学陈化榜教授课题组提供。
1.2 表型鉴定和遗传分析
统计成熟F2分离果穗上的突变籽粒和野生型籽粒的数目, 通过卡方测验明确突变性状是否为单基因控制的突变。对同一F2分离果穗上的野生型和突变籽粒的粒长、粒宽、粒厚(=10)和百粒重(=100)进行量化分析, 每个样本5个生物学重复。
1.3 图位克隆
采用SLS法提取Mo17、及F2分离群体中的突变籽粒和野生型籽粒的基因组DNA, 等摩尔数混合构建显性池(10个野生型籽粒)和隐性池(10个突变籽粒)。利用均匀分布于玉米10条染色体的276对InDel (Insertion/Deletion)标记, 对Mo17、、显性池和隐性池进行连锁分析。在初步定位的基础上, 扩大作图群体并继续开发新的连锁标记, 对目的基因进行精细定位(表1)。PCR扩增体系(10 μL)为: 2×Master Mix 5 μL、上游和下游引物(10 μmol L–1)各0.5 μL、20 ng μL–1基因组DNA 1 μL、超纯水3 μL。PCR扩增程序为: 95℃预变性3 min, 95℃变性30 s, 65℃退火30 s, 72℃延伸45 s, 8个循环, 每个循环退火温度降1℃, 95℃变性30 s, 58℃退火30 s, 72℃延伸45 s, 28个循环, 72℃延伸10 min。PCR产物在4%的琼脂糖凝胶上电泳检测。

表1 基因定位引物

(续表1)
1.4 候选基因预测与等位性测验
以B73参考基因组(http://www.maizegdb.org/)为对照, 对候选区段内的基因进行注释。候选区间内有2个已报道的影响籽粒大小的基因和, 利用30 μL的PCR反应体系对其DNA序列进行扩增, 体系包含2×Plus Master MixII 15 μL、上游和下游引物(10 μmol L–1)各1.2 μL、基因组DNA 2 μL、超纯水10.6 μL; PCR扩增程序为: 95℃预变性3 min; 95℃变性30 s, 58℃退火30 s, 72℃延伸120 s, 35个循环; 72℃延伸10 min。根据PCR产物和克隆测序结果, 初步确定在中具有特异核苷酸变异的基因为目的基因。利用该基因的已知突变体材料与进行等位性测验, 通过表型统计、卡方测验和测序分析明确二者是否为等位基因的突变。
2 结果与分析
2.1 crk4的表型分析
与野生型籽粒相比,的籽粒小且皱缩(图1- A), 其粒长、粒宽和粒厚分别是野生型籽粒的97.2%、90.4%和68.1% (图1-B, C), 导致其百粒重仅有野生型籽粒的33% (图1-D)。为明确突变籽粒的内部结构变化, 对成熟籽粒进行纵切和横切观察, 发现的胚较野生型小、胚乳较野生型少, 尤其是硬质胚乳显著减少(图1-E, F)。胚和胚乳的异常往往影响种子的萌发, 进一步的种子萌发试验表明,籽粒发芽率为23.3%, 较野生型降低75.9% (图1-G)。综上表明,突变造成胚和胚乳发育异常, 进而影响种子的粒重和发芽率。

图1 crk4的表型分析
A: Mo17×F3分离果穗, 红色箭头表示籽粒, 标尺为1 cm; B: 野生型和的代表性籽粒比较, 标尺为1 cm; C: 野生型和籽粒的粒长、粒宽、粒厚比较; D: 野生型和的百粒重比较, 5次重复; E: 野生型和籽粒的纵切比较, 标尺为1 cm; F: 野生型和籽粒的横切比较, 标尺为1 cm; G: 野生型和籽粒的芽率比较。柱状图均以平均值±标准误差表示, *: 差异显著性水平< 0.05; **: 差异显著性水平< 0.01; ***: 差异显著性水平< 0.001。
A: segregation ears of Mo17×F3. The red arrows indicatekernels; bar: 1 cm. B: the comparison WT andkernels; bar: 1 cm. C: the comparison of kernel length, width, and thickness between WT and. D: the comparison of 100-kernel weight between WT andwith five replicates. E: the comparison of the longitudinal section between WT andkernels; bar: 1 cm. F: the comparison of the transverse section between WT andkernels; bar: 1 cm. G: the comparison of germination rate between WT and. Values are represented as means ± SEs on histogram, *:< 0.05; **:< 0.01; ***:< 0.001.
2.2 crk4的遗传分析及基因定位
对Mo17与的F2分离果穗进行统计分析, 发现分离果穗上正常籽粒和突变籽粒均符合3∶1的孟德尔分离比(表2), 说明的籽粒突变是由单个隐性核基因控制。
采用BSA (Bulk segregant analysis, 集团分离分析方法), 通过对276对InDel标记进行连锁分析, 将目的基因初步定位于5号染色体上的InDel标记S09840和S10118之间。在此区间内开发新的标记, 通过多态性筛选和连锁分析鉴定到15对连锁标记(表1), 进一步利用2641个突变籽粒将目标区间缩小至标记5-41和873-1之间的614 kb的物理区间内(图2-A)。
2.3 候选基因分析
玉米B73参考基因组中, 614 kb的物理区间内共有11个在籽粒中表达且有注释的蛋白编码基因(表3)。其中,和是已报道的2个与籽粒发育相关的基因。(U6 biogenesis like1, Ubl1)编码一个玉米2H磷酸二酯酶超家族的RNA外切酶, 该酶显著影响小核RNA (SnRNA) U6的水平和3'末端组成, 其功能丧失造成mRNAs剪接缺陷[25];(Metal-nicotianamine transporter, YSL2/Sh4-shrunken4)编码金属-烟胺转运蛋白, 该转运蛋白控制铁元素的积累进而影响糊粉细胞特性和淀粉合成[24]。因此, 分别利用(2271 bp)特异的5对引物和(2989 bp)特异的4对引物对其DNA进行全长测序(表4)。序列比对结果表明,的基因序列在野生型和之间无多态性, 而的基因序列在野生型和之间仅存在位于第2个外显子上的一个C碱基的缺失, 该碱基缺失造成移码突变(图2-B), 导致编码的氨基酸提前终止, 丧失561个氨基酸结构域, 产生包含氨基酸的截短蛋白(图2-C)。与HapMap2比对后发现该碱基缺失是特异的, 故将作为控制籽粒突变表型的目的基因。

表2 F2分离果穗的籽粒表型统计
χ20.05=3.84.
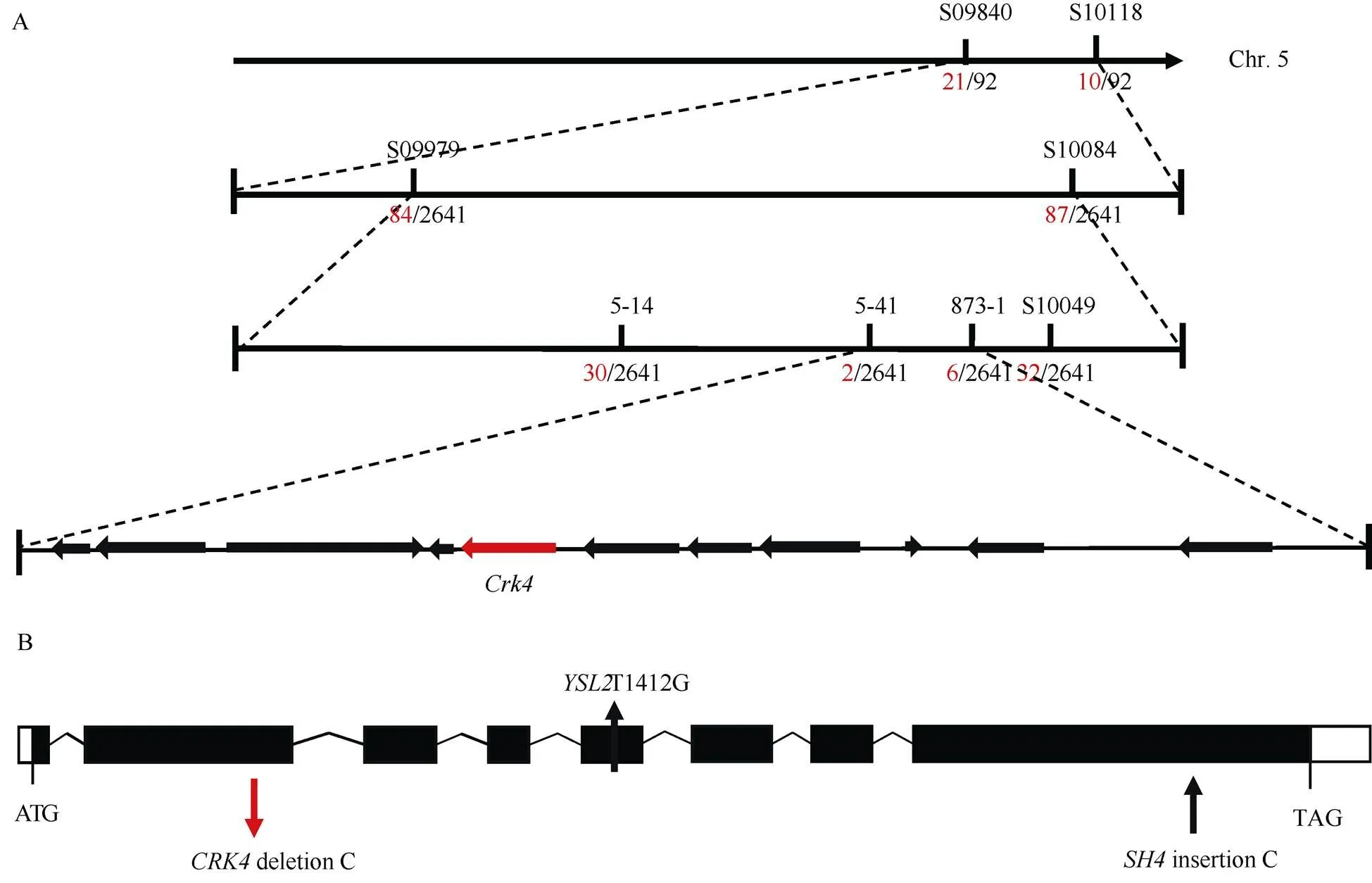
(图2)
A:的图位克隆, 红色数字代表交换单株的数目, 黑色数字代表群体大小;最终定位在5号染色体的614 kb的范围内, 11个基因在籽粒中表达, 其中红色箭头表示目的基因; B:基因结构示意图, 其中黑框表示外显子, 黑线表示内含子, 红色箭头表示的突变位点, 黑色箭头依次表示等位突变体,的突变位点; C: CRK4蛋白的结构域示意图。
A: map-based cloning of. The red number represents recombinants, and black number represents the population size. Theis localized within a 614 kb interval on chromosome 5, containing 11 genes expressed in kernels. The target gene is indicated with red color. B: the schematic diagram of the structure ofgene. Black box represents exon, black line represents intron, red arrow indicates the mutation site in, and black arrow indicates the mutation site in allelic mutants ofand. C: the schematic diagram of the CRK4 protein with the conserved domains.

表3 候选区间内的基因注释

表4 候选基因测序引物
2.4 crk4与ysl2的等位性测验和突变位点验证
为验证是否是导致籽粒突变的目的基因, 将基因的杂合子与杂合子进行正反交。杂交结果显示, 正交果穗和反交果穗上均出现1/4的类突变籽粒(图3-A, B, C), 且突变籽粒均包含在和中的2个突变位点(图3-D), 说明与二者的突变表型是连锁的,与是基因的等位突变。因此,是造成籽粒突变的目的基因。

图3 crk4与ysl2的等位测验
A:×杂交果穗上的籽粒性状, 标尺为1 cm; B:×杂交后代果穗上的籽粒性状, 标尺为1 cm; C:×和×杂交果穗上的籽粒分离统计; D~E: 正反交果穗上突变籽粒的测序结果, D为中的突变位点检测, E为中的突变位点检测。
A: kernels on/+×/+ hybrid ears, bar: 1 cm. B: kernels on/+×/+ hybrid ears, bar: 1 cm. C: segregation statistics of kernels on/+×/+ and/+×/+ hybrid ears. D–E: mutation sequencing ofin mutant kernels from ears of double heterozygotes ofand. D is forinand E is forin.
3 讨论
是玉米籽粒自然突变材料, 与野生型相比, 突变籽粒的胚和胚乳明显变小, 在粒长、粒宽、粒厚以及发芽率等方面显著降低。图位克隆和测序分析发现可能是的目的基因, 该基因编码包含14个跨膜结构域的金属-烟胺转运蛋白, 是Yellow stripe-like (YSL)类转运蛋白, 属于寡肽转运蛋白(OPT)家族[25-27]。
已报道的基因突变体有2种: 一是突变体,的第5个外显子上一个由T到G的单碱基突变导致亮氨酸转化为精氨酸; 二是突变体,的第8个外显子上一个C碱基的插入导致蛋白翻译提前终止。与已报道的突变方式不同, 本研究发现的突变体在的第2个外显子上缺失1个碱基C, 造成蛋白翻译导致提前终止, 产生失去Metal- nicotianamine transporter YSL-like结构域的截短蛋白, 限制其正常功能的发挥, 是的一种新的突变类型。
突变体的主要特征是胚乳塌陷、胚小,基因突变阻断了胚乳中铁的转运, 在调节籽粒中铁的分布和发育方面起关键作用, 影响蛋白质、淀粉的积累和线粒体的正常功能, 最终导致籽粒变小[26]。突变体以籽粒淀粉缺乏为特征, 表现为胚乳缩小、糊粉层和淀粉胚乳发育不良,是糊粉细胞发育和胚乳淀粉积累所必需的, 调控糊粉细胞的发育, 影响淀粉胚乳细胞的正常功能, 此外,还参与调节铁在胚和胚乳之间的分配[25,28-29]。的典型特征是胚和胚乳塌陷, 淀粉含量显著减少。淀粉合成主要发生在淀粉体中, 而淀粉体是一种富含铁的细胞器, 高水平的铁积累是维持胚乳细胞中淀粉体正常活性所必需的[30-31]。因此,的籽粒胚和胚乳缺陷可能也是由铁的积累减少引起的。综上表明, 玉米/基因的不同突变方式, 可能会导致籽粒中淀粉含量产生明显差异; 适度提高该基因的表达水平, 有利于促进胚和胚乳发育, 提高铁元素的积累, 从而增加籽粒的产量。因此挖掘调控胚和胚乳中铁元素分配的关键基因的不同等位突变能够为籽粒发育遗传研究提供更多的材料, 为高产玉米新品种培育提供基因资源。
4 结论
本研究鉴定到/基因的一个新的等位突变体, 该突变体的胚和胚乳发育异常, 成熟籽粒皱缩, 百粒重和发芽率显著降低。遗传分析表明由单个隐性核基因控制, 图位克隆和等位性测验结果表明/是控制该突变的目的基因, 该基因第2个外显子上一个C碱基缺失产生的终止突变是造成突变表型的核心变异。的发现是解析调控胚乳发育分子机制的新的遗传材料。
[1] Russell S D. Double fertilization. In: Russell S D, Dumas C, eds. International Review of Cytology. Academic Press, 1992. pp 357–388.
[2] Sosso D, Luo D P, Li Q B, Sasse J, Yang J L, Gendrot G, Suzuki M, Koch K E, McCarty D R, Chourey P S, Rogowsky P M, Ross-Ibarra J, Yang B, Frommer W B. Seed filling in domesticated maize and rice depends on sweet-mediated hexose transport., 2015, 47: 1489–1493.
[3] Chourey P S, Nelson O E. The enzymatic deficiency conditioned by themutations in maize., 1976, 14: 1041–1055.
[4] Bhave M R, Lawrence S, Barton C, Hannah L C. Identification and molecular characterization ofcDNA clones of maize., 1990, 2: 581–588.
[5] Qiao Z Y, Qi W W, Wang Q, Feng Y N, Yang Q, Zhang N, Wang S S, Tang Y P, Song R T.regulates zein gene transcription through interaction with., 2016, 12: e1005991.
[6] Zhang X, Mogel K J H V, Lor V S, Hirsch C N, Vries B D, Kaeppler H F, Tracy W F, Kaeppler S M. Maize() is a gene affecting endosperm starch metabolism., 2019, 116: 20776–20785.
[7] Schmidt R J, Burr F A, Burr B. Transposon tagging and molecular analysis of the maize regulatory locus., 1987, 238: 960–963.
[8] Zhang Z Y, Dong J Q, Ji C, Wu Y R, Messing J. NAC-type transcription factors regulate accumulation of starch and protein in maize seeds., 2019, 116: 11223–11228.
[9] Li C B, Yue Y H, Chen H J, Qi W W, Song R T. Thetranscription factor regulates 27-kD γ-zein gene transcription during maize endosperm development., 2018, 30: 2402–2424.
[10] Li X J, Zhang Y F, Hou M M, Sun F, Shen Y, Xiu Z H, Wang X M, Chen Z L, Sun S S M, Small I, Tan B C.encodes a pentatricopeptide repeat protein required for mitochondrial nad7 transcript editing and seed development in maize () and rice ()., 2014, 79: 797–809.
[11] Chen X Z, Feng F, Qi W W, Xu L M, Yao D S, Wang Q, Song R T.encodes a PPR protein that affects-splicing of mitochondrial nad4 intron 1 and seed development in maize., 2017, 10: 427–441.
[12] Dai D W, Luan S C, Chen X Z, Wang Q, Feng Y, Zhu C G, Qi W W, Song R T. Maizeencodes a P-type PPR protein that affects-splicing of mitochondrialintron 1 and seed development., 2018, 208: 1069–1082.
[13] Ren R C, Wang L L, Zhang L, Zhao Y J, Wu J W, Wei Y M, Zhang X S, Zhao X Y.is a P-type pentatricopeptide repeat (PPR) protein responsible for the-splicing of nad4 in maize mitochondria., 2020, 62: 299–313.
[14] Qi W W, Lu L, Huang S C, Song R T. Maizeencodes mitochondrial ribosomal protein L9 and is required for seed development., 2019, 180: 2106–2119.
[15] Qi W W, Yang Y, Feng X Z, Zhang M L, Song R T. Mitochondrial function and maize kernel development requires, a pentatricopeptide repeat protein involved in nad1 mRNA splicing., 2017, 205: 239–249.
[16] Klepek Y S, Geiger D, Stadler R, Klebl F, Landouar-Arsivaud L, Lemoine R, Hedrich R, Sauer N.POLYOL TRANSPORTER5, a new member of the monosaccharide transporter-like superfamily, mediates H+-Symport of numerous substrates, including myo-inositol, glycerol, and ribose., 2005, 17: 204–218.
[17] Buttner M. The monosaccharide transporter(-like) gene family in., 2007, 581: 2318–2324.
[18] Schulz A, Beyhl D, Marten I, Wormit A, Neuhaus E, Poschet G, Büttner M, Schneider S, Sauer N, Hedrich R. Proton-driven sucrose symport and antiport are provided by the vacuolar transporters SUC4 and TMT1/2., 2011, 68: 129–136.
[19] Lalonde S, Wipf D, Frommer W B. Transport mechanisms for organic forms of carbon and nitrogen between source and sink., 2004, 55: 341–372.
[20] Curie C, Panaviene Z, Loulergue C, Dellaporta S L, Briat J F, Walker E L. Maizeencodes a membrane protein directly involved in Fe(III) uptake., 2001, 409: 346–349.
[21] Roberts L A, Pierson A J, Panaviene Z, Walker E L.expanded roles for the maize iron-phytosiderophore transporter., 2004,135: 112–120.
[22] Schaaf G, Ludewig U, Erenoglu B E, Mori S, Kitahara T, von Wirén N.functions as a proton-coupled symporter for phytosiderophore- and nicotianamine-chelated metals., 2004,279: 9091–9096.
[23] Koike S, Inoue H, Mizuno D, Takahashi M, Nakanishi H, Mori S, Nishizawa N K.is a rice metal-nicotianamine transporter that is regulated by iron and expressed in the phloem., 2004, 39: 415–424.
[24] Li J K, Fu J J, Chen Y, Fan K J, He C, Zhang Z Q, Li L, Liu Y J, Zheng J, Ren D T, Wang G Y. The U6 biogenesis-like 1 plays an important role in maize kernel and seedling development by affecting the 3' end processing of U6 snRNA., 2017, 10: 470–482.
[25] He Y H, Yang Q, Yang J, Wang Y F, Sun X L, Wang S, Qi W W, Ma Z Y, Song R T.is a mutant allele ofthat affects aleurone development and starch synthesis in maize., 2021, 218: iyab070.
[26] Zang J, Huo Y Q, Liu J, Zhang H R, Liu J, Chen H B. Maizeis required for iron distribution and development in kernels., 2020, 71: 5896–5910.
[27] Yen M R, Tseng Y H, Saier Jr M H. Maize, an iron-phytosiderophore uptake transporter, is a member of the oligopeptide transporter (OPT) family., 2001, 147: 2881–2883.
[28] Tsai C Y, Nelson O E. Mutations at thelocus in maize that produce three altered phosphorylases., 1969, 61: 813–821.
[29] Doehlert D C, Kuo T M. Sugar metabolism in developing kernels of starch-deficient endosperm mutants of maize., 1990, 92: 990–994.
[30] Roschzttardtz H, Conéjéro G, Divol F, Alcon C, Verdeil J L, Curie C, Mari S. New insights into Fe localization in plant tissues., 2013, 4: 350.
[31] Hannah L C, Boehlein S. Maize kernel development. In: Larkins B A, ed. Biosynthesis in Maize Endosperm. Boston, MA: CABI, 2017. pp 149–159.
Map-based cloning and allelic analysis of gene controlling maize kernel mutant
LI Meng-Yuan1, ZHANG Wen-Cheng2, GAO Yong1, QIN Yong-Tian2, BO Shi-Rong1, SONG Kun-Yang1, TANG Ji-Hua1, and FU Zhi-Yuan1,*
1National Key Laboratory of Wheat and Maize Crop Science / Collaborative Innovation Center of Henan Grain Crops / College of Agronomy, Henan Agricultural University, Zhengzhou 450046, Henan, China;2Hebi Academy of Agricultural Sciences, Hebi 458030, Henan, China
Kernel mutants are the important materials for cloning genes related to grain development and analyzing their genetic regulation mechanism.(crumpled kernel 4) is a kernel mutant identified in the course of maize breeding and selection. Compared with the wild type,showed significantly lower in grain filling, grain weight, and germination rate. Genetic analysis showed that the mutant was controlled by a single recessive nuclear gene, which was mapped to a 614 kb physical distance on chromosome 5 by map-based cloning. In the 614 kb interval, 11 protein-coding genes were expressed in kernel. Sequence analysis revealed that there was a-specific termination mutation in the second exon ofgene, which is caused by the deletion of C base.encoded the metal-nicotianamine transporter (/), which had been reported as the target gene of kernel mutant. The allelism test indicated thatwas a new allele mutant of/. The identification ofprovided a new germplasm for elucidating the molecular regulation mechanism ofon seed development in maize.
maize; kernel mutant;; map-based cloning;
10.3724/SP.J.1006.2023.33004
本研究由河南省重点研发与推广专项(科技攻关)项目(232102111080)资助。
This study was supported by the Key Technology Research and Development Program of Henan Province (232102111080).
付志远, E-mail: fuzhiyuan2004@163.com
E-mail: 18839774957@163.com
2023-01-14;
2023-04-17;
2023-04-24.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20230424.0928.006.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

