玉米GST31基因的克隆与表达分析
孙兰兰 麻荣慧 薛 飞 杨慕菡 徐洪乐 苏旺苍 鲁传涛 吴仁海
玉米基因的克隆与表达分析
孙兰兰 麻荣慧 薛 飞 杨慕菡 徐洪乐 苏旺苍 鲁传涛 吴仁海*
河南省农业科学院植物保护研究所/ 河南省农作物病虫害防治重点实验室, 河南郑州 450002
为探究基因的序列特征及除草剂与安全剂对基因表达模式的影响, 本研究以玉米品种“郑单958”为试验材料, 利用反转录PCR (RT-PCR)技术克隆该基因, 分析其核苷酸和编码蛋白序列特性, 并利用实时荧光定量PCR (qRT-PCR)技术研究其在玉米根茎叶以及除草剂烟嘧磺隆(nicosulfuron, NS)和安全剂双苯噁唑酸(isoxadifen-ethyl, IE)单施和共施24 h、48 h的表达情况。结果显示:编码序列(CDS)长为765 bp, 可编码一个分子式为C1276H2021N331O353S4, 氨基酸大小为254个氨基酸, 分子量为27.78 kD, 等电点为6.60的稳定疏水性蛋白。该蛋白主要定位于细胞质, 且无信号肽和跨膜结构, 含有保守的GST_C_Tau结构域和GST_N_Tau结构域, 属于Tau亚家族, 与扫帚黍() GSTU17蛋白具有较高的相似性。蛋白互作预测结果显示, ZmGST31与10个蛋白存在互作, 其中包括2个谷胱甘肽合成酶(glutathione synthetase)和5个谷胱甘肽过氧化物酶(glutathione peroxidase)。启动子区含有大量的光响应和多种激素响应相关元件。qRT-PCR结果显示在玉米苗期不同部位中均有表达, 其中根中表达量最高, 其次是叶片, 茎最低。除草剂烟嘧磺隆和安全剂双苯噁唑酸处理均能诱导基因在玉米的地上部分中表达, 其诱导作用在处理24 h时最强。本研究表明,的表达受除草剂烟嘧磺隆与安全剂双苯噁唑酸调控, 可能在玉米除草剂毒性降解或安全剂介导的除草剂毒性降解中发挥重要作用。
玉米;; 生物信息学分析; 表达模式
谷胱苷肽硫转移酶, 又称谷胱苷肽-S-转移酶(glutathione-S-transferase, GST), 是催化谷胱苷肽(glutathione, GSH)与疏水、亲电的化合物结合并发生亲电取代反应的一类多功能蛋白酶, 广泛存在于动物、植物以及微生物中[1-2]。GST蛋白包含一个保守的氨基端(N端)结构域和一个多变的羧基端(C端)结合域。N端丝氨酸(Ser)残基的羟基可与GSH蛋白的巯基形成氢键, 从而使GSH离子化并产生稳定的硫醇盐阴离子, 驱动GST的结合、过氧化酶和异构化酶的反应[3]。C端结合域能够结合相对应的底物并催化相关生化反应[4]。基于GST基因结构、序列特征、免疫特性等特点, 可将植物GST分为Phi(φ)、Tau(τ)、Theta(θ)、Zeta(ζ)、Lambda(λ)、DHAR (dehydroascorbate reductases)、EF1Bγ和TCHQD (tetrachlorohydroquinone dehalogenase) 8个亚家族[5],其中Phi型、Tau型、Lambda型和DHAR型为植物特有。Phi型和Tau型与其他亚家族相比, 成员多且含量丰富[6]。植物GST主要定位于细胞质, 少数分布于叶绿体、微体、细胞核和质外体中[3,7]。
植物GST最早在玉米(L.)中被发现[8], 其主要功能是催化有害物质的亲电子基团与GSH偶联, 增加有害物质疏水性使其易于穿越细胞膜, 分解后排出体外, 从而达到解毒的目的[9]。研究发现, 玉米GST可以促进体内GSH与阿特拉津(Atrazine)[8]、异丙甲草胺(Metolachlor)和甲草胺(Alachlor)等除草剂[1]的轭合, 消除其对玉米的毒性。此外, 在小麦(L.)、高粱((L.) Moench)、烟草(L.)等作物中均发现GST活性与其对除草剂抗性密切相关[10]。随后, GST相继被证明在植物次生代谢、信号转导及逆境响应等生物学过程中发挥重要作用[11]。研究表明, GST功能缺失导致矮牵牛(hort. ex Vilm.)中一些可见色素转运受阻[12]。除此之外, 拟南芥()[13]、葡萄(L.)、[14]、荔枝(Sonn.)[15]以及苹果(Mill.)[16]等均被证明与花青苷的积累相关。并且, 在拟南芥中, 转入大豆((L.) Merr.)基因, 能够明显提高拟南芥的耐盐性[17]。
玉米是世界重要的粮食、饲料和工业原料作物。在生产过程中, 田间杂草与其争夺水、光和肥料等, 严重危害玉米的种植[18]。化学药剂防除仍是目前玉米生产中治理杂草的主要措施, 同时也是增加产量、节约成本的关键技术[19]。烟嘧磺隆(nicosulfuron, NS)是一种磺酰脲类内吸传导型除草剂, 可通过植物的根、茎、叶吸收, 并经木质部和韧皮部向上和向下传导, 通过抑制杂草体内乙酰乳酸合成酶(acetolactate synthase, ALS)的活性, 阻碍缬氨酸、亮氨酸和异亮氨酸等支链氨基酸的合成, 进而抑制细胞分裂, 使杂草紫化、黄化、退绿, 最终死亡[20]。烟嘧磺隆在玉米杂草防控中应用广泛[21-22]。然而, 研究表明, 烟嘧磺隆可以通过相同的电子传递系统促进ROS的产生, 从而加速植物体的生理生化损伤, 对玉米产生药害。在一系列的解决除草剂的药害方案中, 增施安全剂的方式备受关注[23-25]。其中, 双苯噁唑酸(Isoxadifen-Ethyl, IE)已被证明可以显著增强玉米对烟嘧磺隆的耐受性[26]。并且, 双苯噁唑酸处理能够增强玉米中GST的活性, 从而加快有毒物质的代谢[27]。前期研究中, 本课题组发现一个受双苯噁唑酸和烟嘧磺隆处理显著诱导的玉米基因()[28]。为进一步揭示功能, 本试验以玉米品种“郑单958”为材料对该基因进行克隆和生物信息学分析, 并研究其在根茎叶以及不同烟嘧磺隆和双苯噁唑酸处理时间下的表达模式, 为该基因的后续功能研究奠定基础。
1 材料与方法
1.1 试验材料及处理
玉米种子(郑单958)在25℃浸种12 h, 使玉米吸足水分后, 于27℃催芽24 h至露白。挑选大小、颜色一致的种子, 播种于直径8.3 cm的塑料盆中, 塑料盆内放入肥力一致的土壤。每盆播种10粒左右。将塑料盆放入人工气候箱内, 光照周期12 h, 光照强度150 μmol m–2s–1(飞利浦TLD36W/865荧光灯管), 培养温度白天26℃、夜晚21℃, 相对湿度70%, 培养期间每天浇水。播种后7 d待玉米生长至一叶一心时期进行药剂处理。试验设4个处理, 分别为药剂处理对照(二甲基甲酰胺、乳化剂7218及蒸馏水溶剂对照混合液) (CK), 双苯噁唑酸33 mg L–1(IE)烟嘧磺隆150 mg L–1(NS), 双苯噁唑酸33 mg L–1+烟嘧磺隆150 mg L–1(IE+NS), 每个处理重复3次。处理前每盆内留取长势一致的玉米5株。将供试盆栽玉米植株参照Schulte和Köcher[29]的方法进行处理。用微量移液枪取50 µL不同浓度的药液滴至玉米叶芯。药剂处理前玉米根茎叶不同部位分别取样。对照组、双苯噁唑酸、烟嘧磺隆、双苯噁唑酸+烟嘧磺隆在处理0、24和48 h时取整株地上部分。取样后用液氮速冻, 存放于–80℃冰箱备用, 用于RNA提取。
1.2 ZmGST31基因克隆
使用Total RNA Isolation Kit (Beibei Biotech, China)试剂盒提取RNA。以RNA为模板, 使用R212- HiScript II 1st Strand cDNA Synthesis Kit (+gDNA wiper) (Vazyme, 中国)试剂盒逆转录获得cDNA。从NCBI (https://www.ncbi.nlm.nih.gov/)下载获得基因() CDS序列。根据下载序列设计基因扩增引物(ZmGST31-F: 5′-ATGT CACGACTCACGACGACGGAAAC-3′, ZmGST31-R:5′-CTTGGCGGGAGCATTGATAG-3′)。使用Phanta Max Super-Fidelity DNA Polymerase kit扩增, 25 µL PCR体系为: 2× Phanta Max buffer (2×) 12.5 µL; dNTP Mix (10 mmol L–1) 0.5 µL; 模板cDNA 1 µL, 上下游引物(10 µmol L–1)各1 µL; Phanta Max Super-Fidelity DNA Polymerase 0.5 µL; ddH2O 8.5 µL。PCR反应程序为: 95℃预变性3 min; 95℃变性15 s, 60℃退火30 s, 72℃延伸30 s, 35个循环, 72℃延伸5 min。使用1.2%琼脂糖凝胶电泳检测PCR产物, 胶回收纯化后使用pGM-T克隆试剂盒(TIANGEN, 中国)进行TA克隆, 挑取克隆菌液送至生工生物工程股份有限公司(上海)进行测序验证。
1.3 ZmGST31及其编码蛋白生物信息学分析
参考Ma等[30]方法对及其编码蛋白进行生物信息学分析: 使用ExPASy (https://web. expasy.org/protparam/)网站预测ZmGST31蛋白理化性质; TMHMM Server v. 2.0 (http://www.cbs.dtu.dk/ services/TMHMM/)网站用于预测ZmGST31跨膜结构; SOPMA (http://npsa-prabi.ibcp.fr/)预测ZmGST31二级结构; SWISS-MODEL (https://swissmodel. expasy.org/)预测ZmGST31三级结构; CELLO v.2.5 (http://cello.life.nctu.edu.tw/) ZmGST31亚细胞定位预测; MEME (http://meme-suite.org/)预测ZmGST31保守基序; SignalP 3.0 Server (http://www.cbs.dtu.dk/ services/SignalP/)预测ZmGST31信号肽; CDD (https://www.ncbi.nlm.nih.gov/cdd)预测ZmGST31结构域。使用STRING (https://string-db.org/)在玉米数据库中进行ZmGST31互作蛋白预测。从NCBI下载其他物种GST氨基酸序列, 使用MEGA-X软件[31]将ZmGST31与其他植物GST氨基酸序列采用邻接法(Neighbor-Joining, NJ)在默认参数下构建进化树。并从NCBI网站下载基因起始密码子上游2000 bp序列提交至在线网站PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子区顺式作用元件(-acting elements)预测。
1.4 基因表达分析
使用PrimeScript RT reagent Kit with gDNA Eraser (perfect real time) (TaKaRa, 日本)反转录试剂盒反转录获得定量用cDNA, 稀释5倍用于后续试验。根据基因的CDS序列设计定量引物(ZmGST31-qF: 5′-TACGTCGACGACAAGCTGC-3′; ZmGST31-qR: 5′-GGACCTTGGCCTTGTCCAG-3′)。以GAPDH (GAPDH-qF: 5′-CCATCACTGCCACACA GAAAAC-3′, GAPDH-qR: 5′-AGGAACACGGAAGG ACATACCAG-3′)为内参基因[32]。使用TB Green Premix Ex(TaKaRa, 日本)在Applied Biosystems QuantStudio 6 Flex 实时定量PCR仪(Thermo Fisher Scientific, 美国)上进行qPCR验证。10 µL体系包含TB Green Premix ExII (Tli RNaseH Plus) (2×) 5 µL, ddH2O 3.2 µL, 模板cDNA 1 µL, 上下游引物各0.4 µL。反应条件为: 95℃ 5 min, 95℃ 5 s, 60℃, 30 s, 40个循环, 3次生物重复, 3次技术重复。使用2–ΔΔCT法计算其相对表达量。IBM SPSS Statistics 21软件进行显著性分析(<0.05), 使用GraphPad Prism 6.01绘图。
2 结果与分析
2.1 ZmGST31基因克隆
利用RT-PCR技术对目的条带进行扩增, 获得的产物经电泳检测约为750 bp (图1)。测序结果显示该条带长度为765 bp, 与玉米B73基因组的CDS序列一致, 基于基因组注释, 将其命名为。
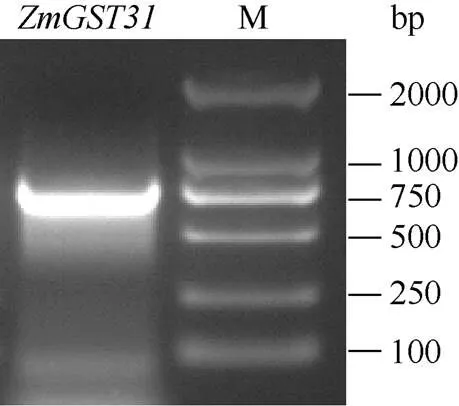
图1 ZmGST31 cDNA扩增产物电泳检测结果
M: DL2000标记。M: DL2000 marker.
2.2 蛋白理化性质分析
ExPASy预测显示ZmGST31分子式为C1276H2021N331O353S4; GST31蛋白中缬氨酸(Val, V)、丙氨酸(Ala, A)和亮氨酸(Leu, L)的含量较高, 分别为30个(11.8%)、28个(11.0%)和28个(11.0%), 只含有1个半胱氨酸(Cys, C), 不含有吡咯赖氨酸(Pyl, O),硒代半胱氨酸(Sec, U)。ZmGST31氨基酸大小为254 aa; 分子量为27.78 kD; 等电点为6.60; 不稳定指数为30.77; 亲水性系数为0.189, 说明其属于稳定的疏水性蛋白。该蛋白无跨膜结构和信号肽。亚细胞定位预测结果显示该蛋白主要定位于细胞质。蛋白质二级结构预测显示ZmGST31由α-螺旋(55.91%)、无规则卷曲(28.35%)、延伸链(12.60%)和β-折叠(3.15%)组成(图2-A)。蛋白质三级结构预测显示该蛋白与拟南芥同源基因结构相似度为38.50% (图2-B)。
2.3 蛋白结构域和基序预测
预测结果显示ZmGST31蛋白C端113~238 aa为保守的GST_C_Tau结构域, N端28~101 aa为保守的GST_N_Tau结构域(图3), 推测其属于GST Tau亚家族。并且ZmGST31蛋白包含17种保守基序, 分别命名为Motif1~Motif17 (表1和图4)。
2.4 蛋白互作预测
使用STRING在玉米蛋白质数据库中在线预测ZmGST31潜在互作蛋白(图5)。预测结果显示, ZmGST31共与10个蛋白互作, 其中, 与2个谷胱甘肽合成酶(Glutathione synthetase)的互作系数为0.693; 与1-Cys酶类PER1 (1-Cys peroxiredoxin PER1)互作系数为0.655; 与5个谷胱甘肽过氧化物酶(Glutathione peroxidase)和可能是磷脂过氧化氢谷胱甘肽过氧化物酶6蛋白(Probable phospholipid hydroperoxide glutathione peroxidase 6)的互作系数均为0.652; 与谷胱甘肽脱氢抗坏血酸还原酶2前体(Glutathione dehydroascorbate reductase2 precursor)互作系数为0.650。

图2 ZmGST31蛋白二级结构(A)与三级结构(B)
蓝色h: α-螺旋; 绿色t: β-折叠; 橙色c: 无规则卷曲; 红色e: 延伸链。
Blue h: the alpha helix; Green t: the beta turn; Orange c: the random coil; Red e: the extended strand; B: the tertiary structure analysis.

图3 ZmGST31保守结构域
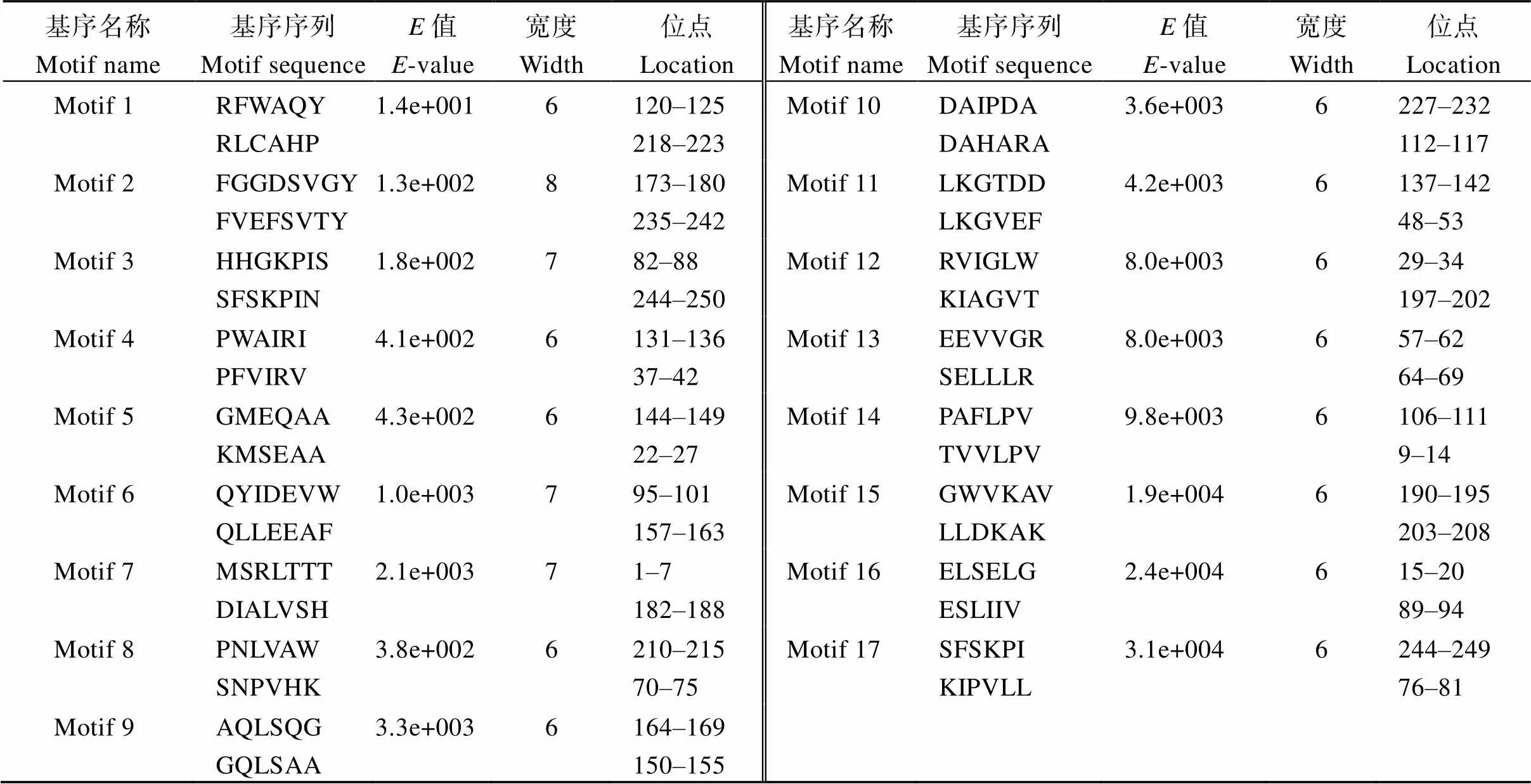
表1 ZmGST31蛋白基序

图4 ZmGST31蛋白基序LOGO
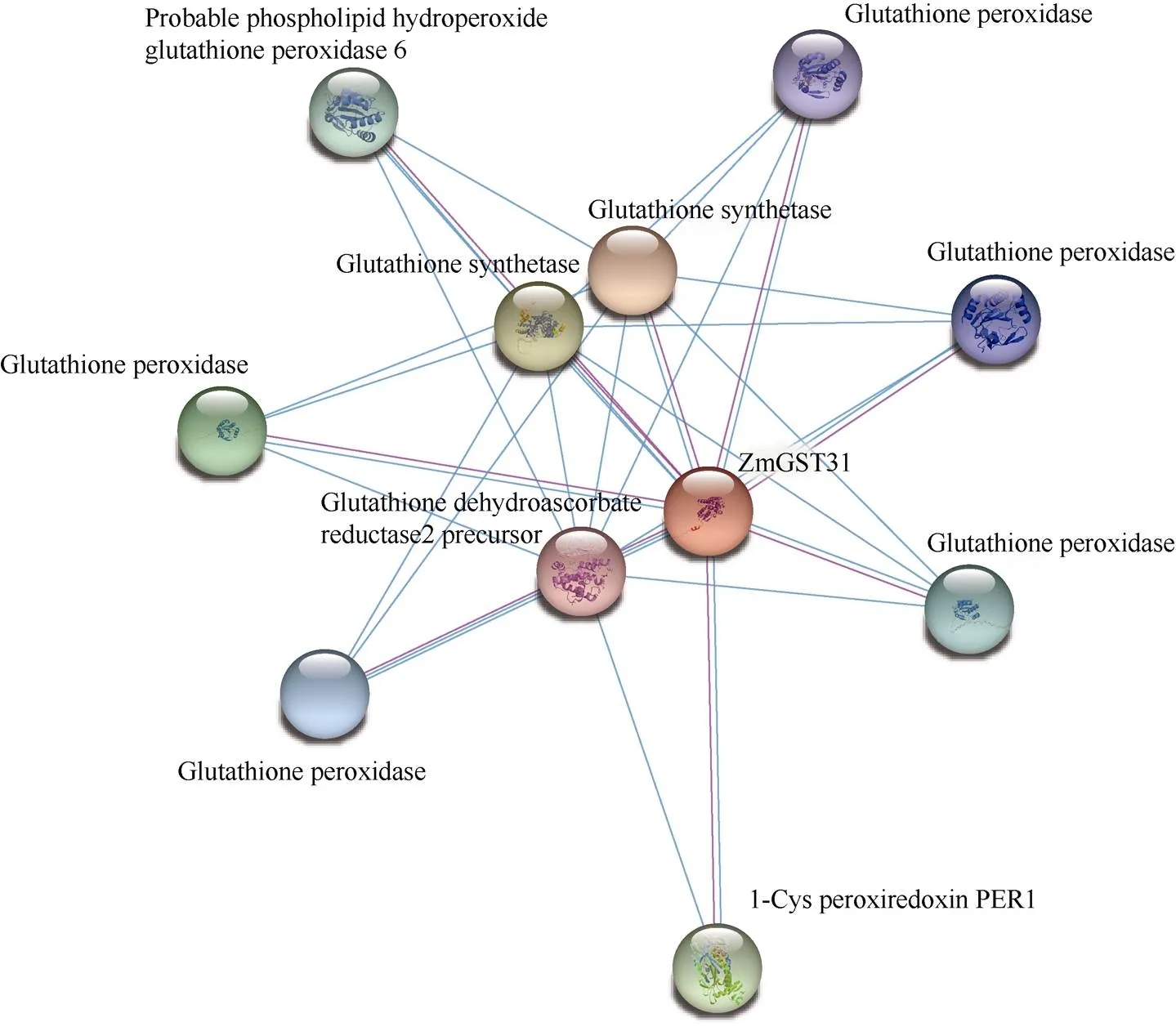
图5 ZmGST31蛋白互作网络模型
2.5 序列比对与进化树分析
蛋白序列比对结果显示: ZmGST31与扫帚黍() GSTU17 (OEL27753.1)蛋白序列相似度最高, 为89.87%; 与高粱()、狗尾草()、谷子()、黍()、南荻()的GST蛋白相似度均高于80%; 与硬直黑麦草()、大麦()、短花稻()、小麦()以及福尼奥小米()的蛋白相似度分别为65.81%、65.81%、70.74%、68.24%和79.57%。与粳稻(Group)、籼稻(Group)、拟南芥()以及稗()蛋白相似度分别为41.20%、45.37%、39.17%和46.26%。对15个物种的GST蛋白进行系统进化树的构建, 分析结果显示ZmGST31与扫帚黍GSTU17 (OEL27753.1)蛋白亲缘关系最近, 接下来是高粱GSTU17 (XP_ 002465036.1), 其次分别是谷子、黍、南荻、狗尾草等(图6)。
2.6 启动子区顺式作用元件分析
启动子区除了TATA-box、CAAT-box等核心元件以外, 还含有大量的光响应元件、激素响应元件以及分生组织元件、厌氧诱导元件等特异性表达的相关元件。激素响应元件中, 茉莉酸甲酯响应相关元件最多(8个, CGTCA元件), 其次是生长素响应相关元件(3个, TGA元件), 脱落酸响应相关元件数为2个(ABRE元件) (表2)。
2.7 ZmGST31在不同组织部位和处理下的表达模式
qRT-PCR结果显示,在根中表达量最高, 其次是叶片(约为根的26.11%), 在茎中表达水平最低(约为根的9.57%) (图7-A)。在对照组处理24 h和48 h的相对表达量相较于0 h显著增加, 其表达量分别是0 h的8.46倍和8.57倍(图7-B); 在药剂处理24 h后, 与对照组相比, 双苯噁唑酸+烟嘧磺隆处理组中相对表达量增加, 其表达量是对照组的1.60倍; 双苯噁唑酸处理组与烟嘧磺隆处理组中相对表达量显著增加, 双苯噁唑酸处理组表达量是对照组的2.63倍, 烟嘧磺隆组是对照组的2.00倍(图7-C)。而在药剂处理48 h后, 双苯噁唑酸+烟嘧磺隆处理组与双苯噁唑酸处理组的相对表达量与对照组持平, 而烟嘧磺隆处理组的相对表达量升高, 其表达量分别是对照组, 双苯噁唑酸组, 双苯噁唑酸+烟嘧磺隆组的1.60、1.59和2.21倍(图7-D)。
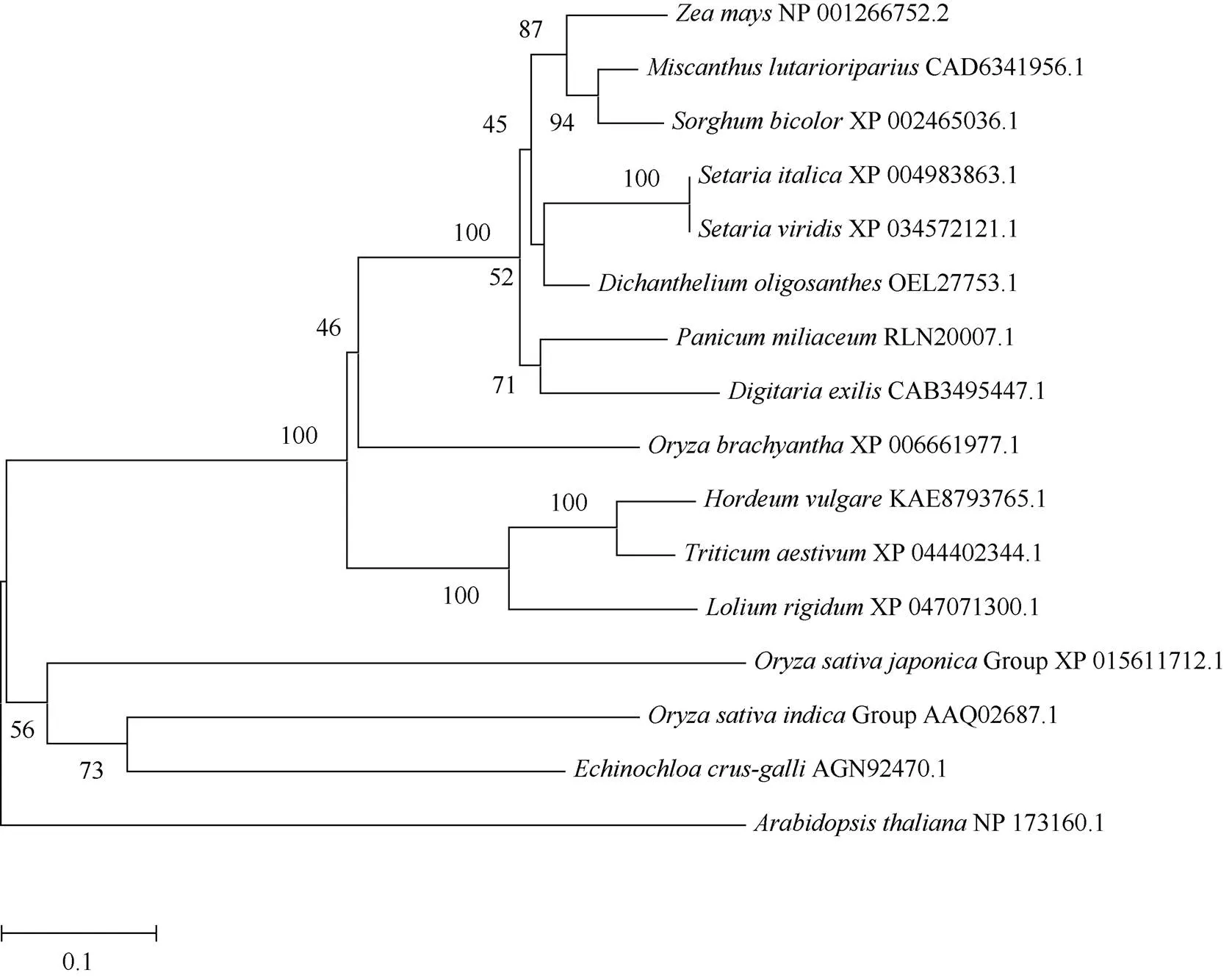
图6 GST蛋白系统进化树

表2 ZmGST31启动子顺式作用元件分析
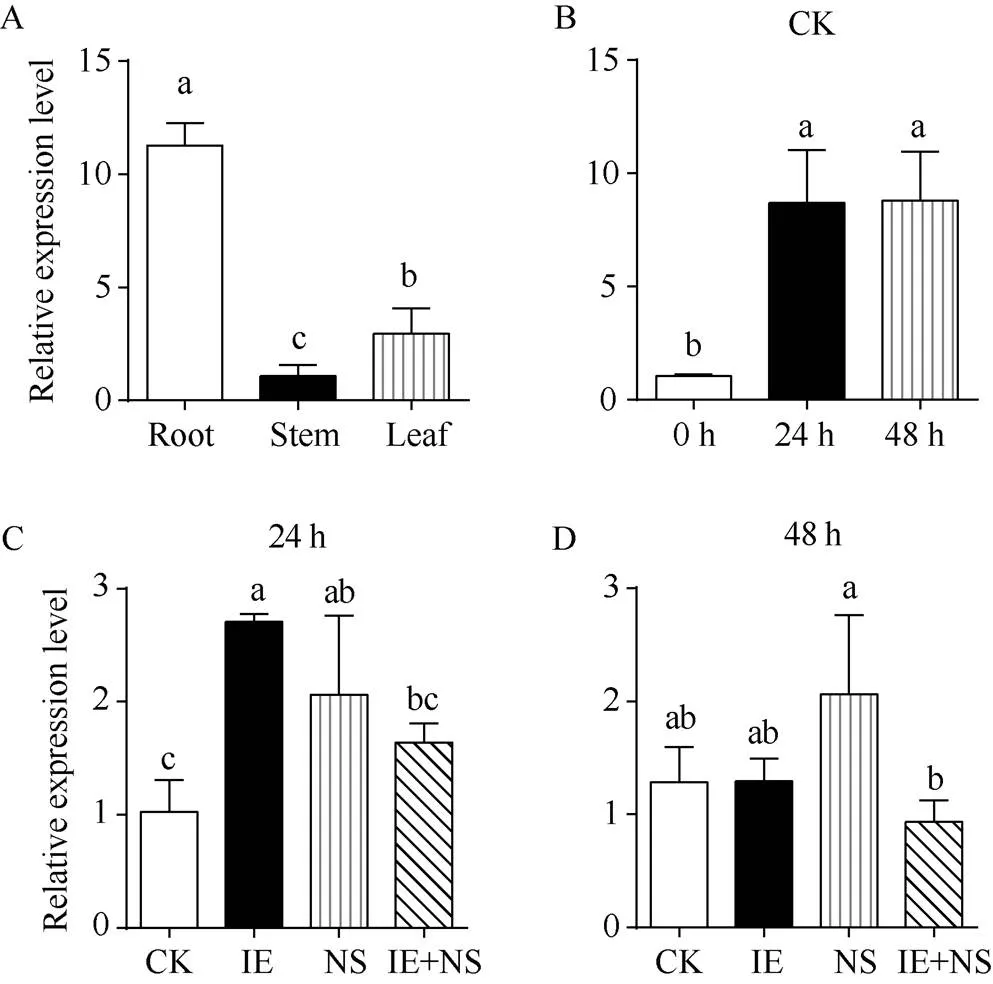
图7 不同组织部位与不同处理下ZmGST31相对表达量
A: 根、茎、叶中相对表达量。B: 对照组(CK)处理0 h、24 h和48 h相对表达量。C: 对照组(CK)、双苯噁唑酸(IE)、烟嘧磺隆(NS)、双苯噁唑酸+烟嘧磺隆(IE+NS)处理24 h相对表达量。D: 对照组(CK)、双苯噁唑酸(IE)、烟嘧磺隆(NS)、双苯噁唑酸+烟嘧磺隆(IE+NS)处理48 h相对表达量。所有数据显示为3个重复的平均值±标准偏差, 各栏上方不同的小写字母代表了不同处理间在< 0.05时的差异显著。
A: the relative expression pattern ofgenes in roots, stems, and leaves. B: the relative expression pattern ofat 0, 24, and 48 h after CK treatment. C: the relative expression pattern ofat 24 h after Control (CK), Isoxadifen-Ethyl (IE), Nicosulfuron (NS), and Isoxadifen-Ethyl + Nicosulfuron (IE+NS) treatments. D: the relative expression pattern ofat 48 h after the control (CK), Isoxadifen-Ethyl (IE), Nicosulfuron (NS), and Isoxadifen-Ethyl + Nicosulfuron (IE+NS) treatments. All data are means ± standard deviations (SDs) of three replicates. Different lowercase letters above the columns represent significant difference at< 0.05.
3 讨论
安全剂对于植物除草剂药害缓解的主要途径是增强除草剂代谢[33], 其代谢通路通常包括3个阶段: 激活(Activation)、结合(Conjugation)和运输(Transportation)[34]。GST主要参与结合阶段, GST催化GSH与异源化合物结合生成水溶性偶联物。最后产生的无毒或低毒的化合物被转运到液泡或细胞壁,进行下一步的降解, 从而达到解毒的目的[35]。玉米GST家族共有42个家族成员, 其中5个已被证明参与除草剂反应[9]。在本研究中, 我们从“郑单958”玉米品种中克隆获得CDS长为765 bp 的基因, 经过氨基酸序列比对及保守结构域分析发现, ZmGST31与其他物种GST蛋白结构相似, 具有典型的Tau型GST蛋白N端及C端结构域, 推测其属于植物特有的Tau亚家族。GST不同亚细胞定位以及其功能具有一定的特性。先前的研究表明, 大量可溶性GST定位于细胞质中, 而少量存于细胞核中或细胞外[3]。在拟南芥中, GSTT定位于质体和细胞核, 属于GSH氧化物酶类, 主要参与植物氧化胁迫反应[36]; GSTZ定位于细胞质, 其功能依赖于GSH, 参与植物酪氨酸代谢[37]; DHAR定位于细胞质和叶绿体, 具有巯基转移酶活性并参与抗坏血酸循环[38]。在本研究中, 亚细胞定位结果显示ZmGST31定位于细胞质中。细胞质是细胞的代谢中心。在胞质中, Tau型GST的主要功能是与包括杀虫剂、除草剂在内的异生素结合, 形成的化合物可被谷胱甘肽泵识别并进行跨膜转运到液泡中, 从而解除这些异生素毒性, 推测ZmGST31的细胞质定位与其除草剂解毒功能相关。
通过对基因启动子序列分析发现, 其启动子区包含多个激素及逆境响应元件, 推测该基因多种逆境胁迫响应中发挥着重要作用。安全剂介导的植物抗除草剂的分子机制逐渐被阐明,基因在除草剂介导的解毒过程中发挥着重要作用[9]。本研究利用qRT-PCR方法对其在安全剂双苯噁唑酸以及除草剂烟嘧磺隆处理下的表达水平进行了分析,结果发现, 在处理24 h后, 该基因的表达受双苯噁唑酸以及烟嘧磺隆的诱导。这与Rossini等[39]在玉米及Andrews等[40]在大豆中的研究结果基本一致。而在处理48 h后, 双苯噁唑酸、烟嘧磺隆和双苯噁唑酸+烟嘧磺隆处理组中表达量与对照组相比, 均无显著差异。前期试验发现, 相较于除草剂与安全剂处理24 h, GST活性在处理48 h后显著降低[27],并且和相对表达量在除草剂与安全剂处理48 h后无显著差异[28], 该结果与本试验结果一致, 这表明双苯噁唑酸和烟嘧磺隆对的诱导作用在处理24 h时最强。另外,基因的表达具有组织特异性, 其在不同植物或同一植物的不同部位中的表达量均有所不同。例如玉米和在根系中的表达高于地上部分, 而只在根系中表达[1]。本研究发现的表达具有明显的组织特异性, 其在根中的表达量显著高于叶片与茎中, 这与水稻GST基因的表达一致[41], 暗示其在应对逆境胁迫时主要的发生部位是根系。
4 结论
本研究从玉米中克隆得到基因, 该基因cDNA全长为765 bp, 编码254个氨基酸, 相对分子量为27.78 kD, 等电点为6.60, 无跨膜结构以及信号肽, 预测结果显示该蛋白定位于细胞质。ZmGST31属于Tau亚家族, 与扫帚黍GSTU17亲缘关系最近, 且与10个蛋白存在互作。其启动区含有大量的光响应和多种激素响应等元件。基因在玉米根中表达量最高, 其次是叶片, 茎最低, 并且其表达量受安全剂双苯噁唑酸以及除草剂烟嘧磺隆调控, 推测可能在玉米除草剂毒性降解或安全剂介导的除草剂毒性降解中发挥重要作用。该研究为解析该基因功能提供理论基础; 为玉米抗除草剂遗传改良提供候选基因。然而,更完善的基因功能仍需要更深入的分析验证。
[1] Dixon D P, Cummins L, Cole D J, Edwards R. Glutathione-mediated detoxification systems in plants., 1998, 1: 258–266.
[2] Nutricati E, Miceli A, Blando F, De Bellis L. Characterization of twoglutathione S-transferases., 2006, 25: 997–1005.
[3] Dixon D P, Davis B G, Edwards R. Functional divergence in the glutathione transferase superfamily in plants: identification of two classes with putative functions in redox homeostasis in., 2002, 277: 30859–30869.
[4] Edeards R, Dixon D P. Gluthione Transferases and Gamma- glutamyl Transpeptidases. USA: Academic Press, 2005. pp 169–186.
[5] Liu Y J, Han X M, Ren L L, Yang H L, Zeng Q Y. Functional divergence of the glutathione S-transferase supergene family inreveals complex patterns of large gene family evolution in land plants., 2013, 161: 773–786.
[6] Lallement P A, Brouwer B, Keech O, Hecker A, Rouhier N. The still mysterious roles of cysteine-containing glutathione transferases in plants., 2014, 5: 192.
[7] Cottingham C K, Hatzios K K, Meredith S. Influence of chemical treatments on glutathione S-transferases of maize with activity towards metolachlor and cinnamic acid., 1998, 53: 973–979.
[8] Shimabukuro R H, Frear D S, Swanson H R, Walsh W C. Glutathione conjugation., 1971, 47: 10–14.
[9] 郭玉莲, 陶波, 郑铁军, 李宝英, 翟喜海, 潘亚清. 植物谷胱甘肽S-转移酶(GSTs)及除草剂解毒剂的诱导作用. 东北农业大学学报, 2008, 39(7): 136–139. Guo Y L, Tao B, Zheng T J, Li B Y, Zhai X H, Pan Y Q. Inducement action of plant GSTs and herbicides antidotes., 2008, 39(7): 136–139 (in Chinese with English abstract).
[10] Timmerman K P. Molecular characterization of corn glutathione S-transferase isozymes involved in herbicide detoxication., 1989, 77: 465–471.
[11] Jepson I, Lay V J, Holt D C, Bright S W, Greenland A J. Cloning and characterization of maize herbicide safener-induced cDNAs encoding subunits of glutathione S-transferase isoforms I, II and IV., 1994, 26: 1855–1866.
[12] Mueller L A, Goodman C D, Silady R A, Walbot V. AN9, a petunia glutathione S-transferase required for anthocyanin sequestration, is a flavonoid-binding protein., 2000, 123: 1561–1570.
[13] Kitamura S, Shikazono N, Tanaka A.is involved in the accumulation of both anthocyanins and proanthocyanidins in., 2004, 37: 104–114.
[14] Conn S, Curtin C, Bézier A, Franco C, Zhang W. Purification, molecular cloning, and characterization of glutathione S-transferases (GSTs) from pigmentedL. cell suspension cultures as putative anthocyanin transport proteins., 2008, 59: 3621–3634.
[15] Hu B, Zhao J T, Lai B, Qin Y H, Wang H C, Hu G B.is an anthocyanin-relatedgene inSonn., 2016, 35: 831–843.
[16] Jiang S H, Chen M, He N B, Chen X L, Wang N, Sun Q G, Zhang T L, Xu H F, Fang H C, Wang Y C, Zhang Z Y, Wu S J, Chen X S. MdGSTF6, activated by MdMYB1, plays an essential role in anthocyanin accumulation in apple., 2019, 6: 40.
[17] Chan C, Lam H M. A putative lambda class glutathione S-transferase enhances plant survival under salinity stress., 2014, 55: 570–579.
[18] 彭学岗. 玉米田革命性杂草解决方案. 湖北植保. 2014, (3): 63–64. Peng X G. Revolutionary weed solutions for corn fields., 2014, (3): 63–64 (in Chinese).
[19] 浦军, 黄吉美, 扬眉. 不同除草剂对玉米田的防效及产量影响. 特种经济动植物, 2022, 25(10): 36–37. Pu J, Huang J M, Yang M. Effectiveness of different herbicides on corn fields and yield., 2022, 25(10): 36–37 (in Chinese).
[20] Liu X M, Bi B, Xu X, Li B H, Tian S G, Wang J P, Zhang H, Wang G Q, Han Y J, McElroy J S. Rapid identification of a candidate nicosulfuron sensitivity gene () in maize (L.) via combining bulked segregant analysis and RNA-seq., 2019, 132: 1351–1361.
[21] Williams B J, Harvey R G. Effect of nicosulfuron timing on wild-proso millet () control in sweet corn ()., 2000, 14: 377–382.
[22] Ferguson J E, Rhodes A M, Dickinson D B. The genetic of sugary enhancer (), an independent modifier of sweet corn ()., 1978, 69: 377–380.
[23] Davies J, Caseley J C. Herbicide safeners: a review., 1999, 55: 1043–1058.
[24] Hatzios K K, Burgos N. Metabolism-based herbicide resistance: regulationby safeners., 2004, 52: 454–467.
[25] Abu-Qare A W, Duncan H J. Herbicide safeners: uses, limitations, metabolism, and mechanisms of action., 2002, 48: 965–974.
[26] Sun L L, Wu R H, Su W C, Gao Z G, Lu C T. Herbicide safeners increase waxy maize tolerance to nicosulfuron and affect weed control., 2016, 6: 386–393.
[27] Sun L L, Wu R H, Su W C, Gao Z G, Lu C T. Physiological basis for isoxadifen-ethyl induction of nicosulfuron detoxification in maize hybrids., 2017, 12: e0173502.
[28] Sun L L, Xu H L, Su W C, Xue F, An S H, Lu C T, Wu R H. The expression of detoxification genes in two maize cultivars by interaction of isoxadifen-ethyl and nicosulfuron., 2018, 129: 101–108.
[29] Schulte W, Köcher H. Tembotrione and combination partner isoxadifen-ethyl-mode of herbicidal action., 2009, 62: 35–52.
[30] Ma R H, Tian N, Wang J S, Fan M L, Wang B, Qu P Y, Xu S Y, Xu Y B, Cheng C Z, Lyu P T. Genome-wide identification and characterization of banana Ca2+-ATPase genes and expression analysis under different concentrations of Ca2+treatments., 2022, 23: 11914.
[31] Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X: molecular evolutionary genetics analysis across computing platforms., 2018, 35: 1547–1549.
[32] 姜婷, 苏乔, 安利佳. 多重胁迫下玉米实时定量PCR内参基因的筛选与验证. 植物生理学报, 2015, 51: 1457–1464. Jiang T, Su Q, An L J. Screening and validation of reference genes of qPCR in maize under multiple stresses., 2015, 51: 1457–1464 (in Chinese with English abstract).
[33] Riechers D E, Kreuz K, Zhang Q. Detoxification without intoxication: herbicide safeners activate plant defense gene expression., 2010, 153: 3–13.
[34] Delye C. Unravelling the genetic bases of non-target-site-based resistance (NTSR) to herbicides: a major challenge for weed science in the forthcoming decade., 2013, 69: 176–187.
[35] Jugulam M, Shyam C. Non-target-site resistance to herbicides: recent developments., 2019, 8: 417.
[36] Dixon D P, Edwards R. Selective binding of glutathione conjugates of fatty acid derivatives by plant glutathione transferases., 2009, 284: 21249–21256.
[37] Reumann S, Quan S, Aung K, Yang P, Manandhar-Shrestha K, Holbrook D, Linka N, Switzenberg R, Wilkerson C G, Weber A P, Olsen L J, Hu J P. In-depth proteome analysis ofleaf peroxisomes combined withsubcellular targeting verification indicates novel metabolic and regulatory functions of peroxisomes., 2009, 150: 125–143.
[38] Basantani, M K, Srivastava A. Plant glutathione transferases: a decade falls short., 2007, 85: 443–456.
[39] Rossini L, Frova C, Enrico Pè M, Mizzi L, Gorla M S. Alachlor regulation of maize glutathione S-transferase genes., 1998, 60: 205–211.
[40] Andrews C J, Cummins I, Skipsey M, Grundy N M, Jepson I, Townson J, Edwards R. Purification and characterisation of a family of glutathione transferases with roles in herbicide detoxification in soybean (L.), selective enhancement by herbicides and herbicide safeners., 2005, 82: 205–219.
[41] Soranzo N, Sari Gorla M, Mizzi L, De Toma G, Frova C. Organisation and structural evolution of the rice glutathione S-transferase gene family., 2004, 271: 511–521.
Cloning and the relative expression pattern ofgene in maize
SUN Lan-Lan, MA Rong-Hui, XUE Fei, YANG Mu-Han, XU Hong-Le, SU Wang-Cang, LU Chuan-Tao, and WU Ren-Hai*
Henan Key Laboratory of Crop Pest Control, Institute of Plant Protection, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China
To investigate the sequence characteristics of thegene and the relative expression pattern under herbicide and safener application,gene was cloned from maize variety ‘Zhengdan 958’ by using Reverse Transcription PCR (RT-PCR). A series of bioinformatics analyses were performed subsequently to reveal its nucleotide and coding protein sequence characteristics. Real-time fluorescence quantitative PCR (qRT-PCR) was used to study its relative expression level in root, stem, and leaf with the application of Nicosulfuron (NS) and Isoxadifen-Ethyl (IE) for 24 hours and 48 hours. The results showed that the coding sequence (CDS) ofwas 765 bp, which encoded an stable hydrophobic protein with molecular formula of C1276H2021N331O353S4, amino acid size of 254 aa, molecular weight of 27.78 kD, and isoelectric point of 6.60. The protein was mainly localized in the cytoplasm and had no signal peptide and transmembrane structure. Based on the conserved GST_C_Tau and GST_N_Tau structural domain, it was suggested to be a member of the Tau subfamily. ZmGST31 had higher homology withGSTU17 protein. Protein-protein interaction prediction result showed that ZmGST31 could interact with ten proteins, including two glutathione synthetases and five Glutathione peroxidase proteins. The promoter region ofcontaind a large number of-acting elements such as light response and hormone response. qRT-PCR results revealed thatwas expressed in different parts of maize seedlings, with the highest expression in roots, followed by leaves, and stems. The relative expression ofgene in the aboveground part of maize could be induced by the nicosulfuron and isoxadifen-ethyl, the induction effect was the strongest at 24 hours. In conclusion, the relative expression level ofwas regulated by herbicide Nicosulfuron and safener Isoxadifen-Ethyl and might play an important role in herbicide toxicity degradation or safener-mediated herbicide toxicity degradation in maize.
L.;; bioinformatics analysis; the relative expression pattern
10.3724/SP.J.1006.2023.23080
本研究由河南省自然科学基金青年科学基金项目(212300410171), 河南省农业科学院自主选题项目(2022ZC36)和河南省科技研发计划联合基金项目(222301420109)资助。
This study is supported by the Science Foundation of Henan Province, China (212300410171), the Independent Topic Selection Project of Henan Academy of Agricultural Sciences (2022ZC36), the Joint Fund for Scientific and Technological Research and Development of Henan (222301420109).
吴仁海, E-mail: renhai.wu@163.com
E-mail: sll30711034@163.com
2022-12-12;
2023-02-21;
2023-03-02.
URL: https://kns.cnki.net/kcms/detail//11.1809.S.20230301.1504.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

