含Pm21基因的次级易位创制及鉴定
张蓝月 罗江陶 范超兰 李亚洲 姜 博 陈 雪 陈雪姣 袁中伟 甯顺腙 张连全 刘登才,* 郝 明,*
含基因的次级易位创制及鉴定
张蓝月1,**罗江陶2,**范超兰1李亚洲1姜 博1陈 雪1陈雪姣1袁中伟1甯顺腙1张连全3刘登才3,*郝 明1,*
1四川农业大学小麦研究所, 四川温江 611130;2四川省农业科学院作物研究所, 四川锦江 610066;3西南作物基因资源发掘与利用国家重点实验室, 四川温江 611130
小麦-簇毛麦6VS.6AL易位携带抗白粉病基因, 对我国小麦抗白粉病育种做出了重要贡献。本文对162份四川小麦品种(系)的55K SNP芯片数据分析表明, 25份含6VS.6AL易位染色体, 占15.4%。重组位置和单倍型分析表明, 这些材料的6VS.6AL均为着丝点易位、具有单一来源。根据系谱分析, 92R178为最原始的供体材料。利用由诱导6VS/6AS部分同源重组形成的, 含基因的初级易位6VS-6AS.6AL和6AS-6VS.6AL为亲本, 创制了1个含基因、6VS片段大幅减小的6AS-6VS-6AS.6AL次级易位。根据中国春参考基因组, 该次级易位的2个重组位点, 分别位于6A染色体53.1~53.8 Mb和90.7~92.2 Mb之间, 易位片段大小在36.9~39.1 Mb之间。分子细胞学鉴定表明,诱导外源易位的同时, 小麦自身的内源染色体也发生了大量易位, 这影响易位系的遗传稳定和育种利用。为了解决这个问题, 建议将基因突变系以杂合的形式进行长期保存。同时, 在利用诱导小麦-外源易位的过程中, 尽量减少纯合状态下的繁殖世代, 以减少小麦内源染色体易位。育种利用时, 应尽快消除小麦内源易位。
小麦; 簇毛麦; 白粉病; 6VS.6AL易位;基因; 小片段易位系
白粉病是危害小麦生产的重要真菌病害。利用抗病基因, 选育推广抗病品种是防治小麦白粉病的经济有效途径。簇毛麦(, 2=14, VV)是小麦抗病改良的重要三级基因源。到目前为止, 已从中鉴定命名了4个抗白粉病基因, 包括位于6VS的、5VS的、2VL的和1VS的[1-4]。其中,是全生育期广谱抗白粉病基因。南京农业大学以6VS.6AL易位的形式将该基因导入小麦, 创制了“92R系列”材料, 分发给育种家, 加速了其育种利用, 已有一大批携带的小麦品种被审定和推广应用[5-10]。除了抗白粉病, 6VS.6AL易位材料对种子蛋白质含量和千粒重也有正向作用, 前者可能与6VS上的基因有关[11]。
导入外源染色体片段, 可能会引入目标基因以外的不利基因, 造成连锁累赘。遗传分析表明, 6VS.6AL易位染色体在雄配子中的传递效率相对较低[12]。6VS.6AL易位染色体还携带分蘖减少、株高增加等不利性状[13-15]。创制6VS/6AS小片段易位, 可能会进一步促进基因的育种利用效率。
小片段易位引入的外源片段小, 降低了不利连锁基因导入的可能性。Sears教授以基因操作为工具, 建立了定向创制小片段易位的“两步法”染色体工程技术体系[16]。第一步, 创制基因纯合、目标外源染色体(臂)和小麦部分同源染色体(臂)均呈单存在的双单体, 对其后代进行筛选, 获得含小麦-外源重组的初级易位系。第二步, 筛选出含目标基因且易位方向相反的两个初级易位, 即一个易位的外源片段靠近着丝粒方向、另一个易位的外源片段靠近端粒方向。通过杂交, 将两个初级易位聚合在同一背景, 同时引入基因, 2个含目标基因的共享外源染色体区段发生同源重组, 即可获得含目标基因且外源染色体片段大幅减小的插入型次级易位。只要获得在不同位点发生重组的初级易位, 就可以根据需要, 设计并定向创制具有不同插入大小的次级易位。Lukaszewski和Cowger[17]利用该方法, 将插入到6AS亚端部。
本研究以课题组前期利用基因诱导6VS/6AS重组创制的初级易位系为材料[18], 创制含基因的插入型次级小片段易位系, 为基因的育种利用提供新材料。同时, 探讨应用基因进行染色体工程操作及相关衍生材料利用过程中应注意的问题。
1 材料与方法
1.1 试验材料
6VS/6AS初级易位系1-56和1-73, 为本课题组前期以中国春突变系(CS)和6VS.6AL易位系PM99915-1作为亲本材料, 通过基因诱导6VS和6AS部分同源重组的方法创制而来[18]。1-56携带初级易位6VS-6AS.6AL, 该易位染色体命名为C_6VS/6AS_VA-1; 1-73携带初级易位6AS-6VS.6AL,该易位染色体命名为C_6VS/6AS_AV-1。2个初级易位均携带基因。普通小麦品种蜀麦830 (SM830)和蜀麦969 (SM969)是本课题组利用人工合成小麦为亲本选育审定的普通小麦新品种。
1.2 分子标记检测
基因组DNA的提取采用常规CTAB法。6VS/ 6AS近着丝粒和近端部特异性共显性KASP分子标记CV/CA和TV/TA的引物序列和PCR检测方法, 参见Zhang等[18];显性标记Xwgc2049、显性标记Xwgc2111的引物序列参见Gyawali等[19];基因的特异分子标记CINAU-NLR1的引物序列参见Xing等[20]。所有引物由成都擎科生物技术有限公司合成。PCR产物检测使用1.5%的琼脂糖凝胶电泳。
小麦16K高通量液相SNP芯片用于检测创制的6AS-6VS-6AS.6AL次级易位和初级易位6AS- 6VS.6AL (C_6VS/6AS_AV-1)的重组断裂位置。芯片检测工作由博瑞迪生物有限公司完成。理论上, 如果6VS和6AS发生了部分同源重组, 则被6VS片段替换的对应6AS片段区间会显示出高频率的分子标记缺失, 据此判断重组发生的位置。165份四川小麦品种(系)群体的55K SNP芯片数据从Ye等[21]发表的论文中获取。与基于测序的16K液相芯片不同, 55K SNP芯片基于探针杂交荧光信号来判断分型结果, 背景荧光信号阈值的选择, 可能会影响缺失标记和杂合标记的准确性(特别是涉及外源染色体的时候), 因此在鉴定6VS.6AL易位品种(系)过程中, 我们不仅关注高频率标记缺失区段, 同时还关注了高频率杂合区段。后续的分析和画图使用WPS和R包ggplot2 (v3.3.5)完成。
1.3 细胞学检测
为了检测6VS相关易位系, 提取的簇毛麦基因组DNA, 利用Atto550 NT labeling kit (Jena Bioscience, 德国)试剂盒标记后, 作为基因组原位杂交(GISH)探针。普通小麦中国春基因组DNA经高温蒸汽打断后作为封组。为了进行A和D双色基因组原位杂交, 分别提取乌拉尔图小麦和节节麦的基因组DNA, 然后分别用Atto550 NT labeling kit (Jena Bioscience, 德国)和Atto488 NT labeling kit (Jena Bioscience, 德国)试剂盒标记, 作为探针。经高温蒸汽打断的拟斯卑尔脱山羊草基因组DNA作为封组。原位杂交流程参见范超兰等[22]。
寡序列探针Oligo-pSc119.2和Oligo-pTa535用于检测易位系的染色体组成。荧光探针由成都擎科生物科技有限公司合成。FISH检测的流程和方法参见Zhao等[23]。原位杂交图片采集使用装备了DP80相机的奥林巴斯BX63荧光显微镜完成。
2 结果与分析
2.1 四川小麦品种(系)群体中6VS.6AL易位的鉴定
为了分析四川小麦品种(系)群体中的6VS.6AL易位频率和来源, 我们重新分析了Ye等[21]获得的165份四川小麦55K SNP芯片数据。位于6A染色体的SNP标记有2457个, 提取出这165份小麦的6A染色体分型结果后发现, 其中有3份材料的分型结果较差, 未用于后续分析。分析发现, 有25份品种(系) (表1)在6AS短臂的0.1~283.3 Mb区段内(IWGSC v1.0)存在高频率的标记显示为杂合(图1)。25份材料在该区段内的杂合标记平均占比为68.6% (56.6%~70.6%), 极显著高于另外137份材料的3.5% (1.5%~25.2%), 表明这些25份材料可能为6VS.6AL易位系, 占15.4%。比较Hu等[10]对四川小麦品种(系)的细胞学鉴定结果, 有19份在2个研究中共有。其中, 14份材料的细胞学结果也支持它们是6VS.6AL易位系, 但另外5份材料细胞学显示为非易位系, 2个实验结果的不一致可能由于试验样品有误或这些品种本身属于杂合群体导致, 具体原因还需进一步验证。
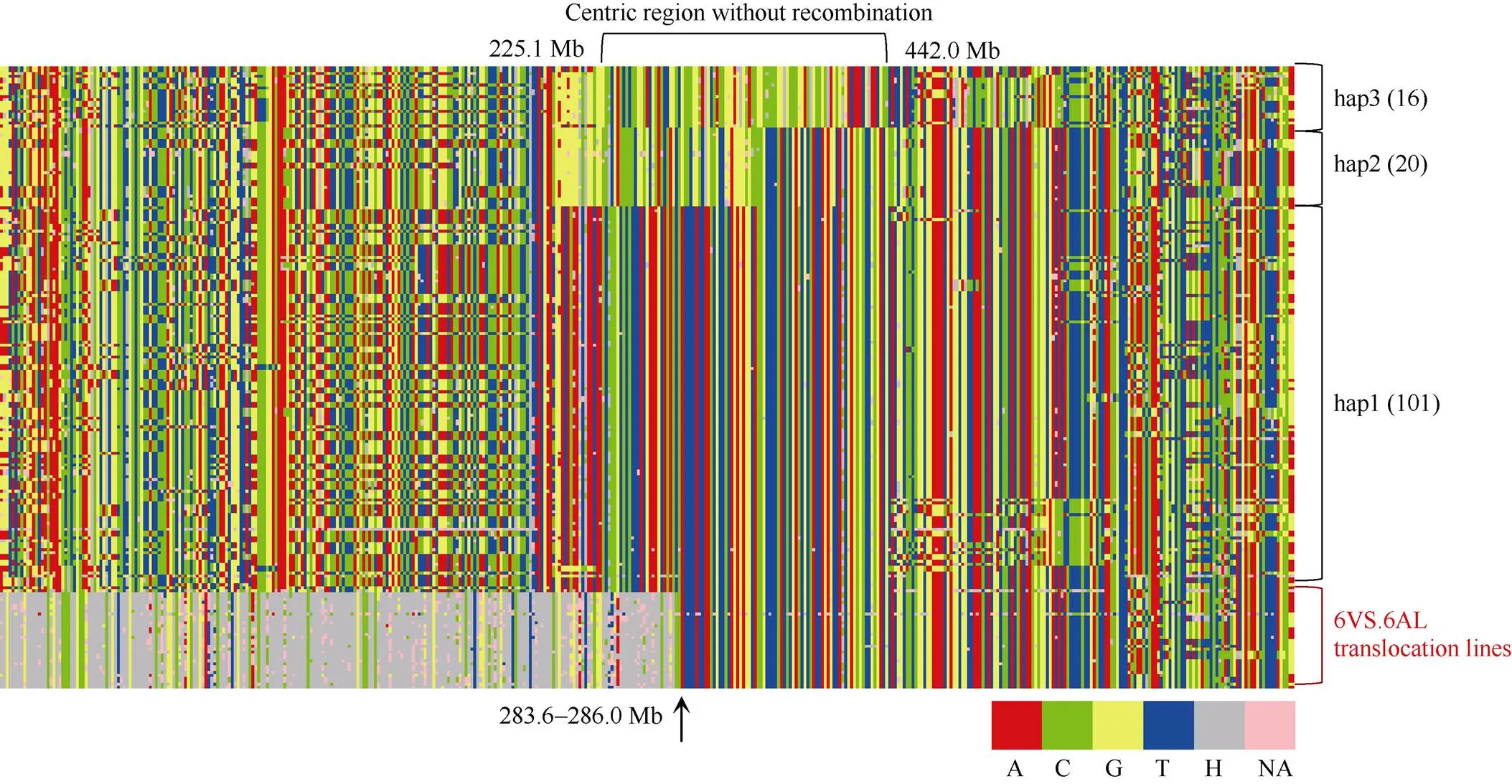
图1 162份四川小麦6A (6VS.6AL)染色体基因型
图中每一行代表1个品种(系); 每一列代表1个标记, 标记按照IWGSC v1.0参考基因组6A短臂至长臂的顺序从左向右排列。每个标记的分型结果分别按照A (红色)、C (绿色)、G (黄色)、T (蓝色)、杂合H (灰色)、缺失NA (粉色)表示。Hap1~3代表近着丝粒无重组区划分的单倍型, 括号里面数字代表归属该单倍型的品种(系)数。箭头示在IWGSC v1.0参考基因组上的位置。
Each row represents a cultivar (line); each column represents a marker. The markers are arranged from left to right according their physical location on the Chinese spring reference genome of IWGSC v1.0. Markers are labeled in red with a genotype of A, in green with a genotype of C, in yellow with a genotype of G, in blue with a genotype of T, in grey with a genotype of heterozygote, and in pink with a genotype of missing. Hap1–3 represent haplotypes of centric region without recombination. Number in the bracket represents the cultivar (lines) number. Arrow points out the physical position on IWGSC v1.0.
根据分子标记结果, 所有25份材料6VS.6AL易位的断裂-融合点均相同, 由位于6A染色体283.3和286.0 Mb的2个标记界定, 表明这些6VS.6AL易位染色体可能具有单一来源。为进一步验证该推测, 进一步分析了6A(6VS.6AL)的近着丝区域, 137份非6VS.6AL易位系品种(系)的近着丝点区域属于重组缺乏区(225.1~442.0 Mb) (图1)。基于该区域的分型结果, 可以将137四川小麦分成3种单倍型, 分别有101 (hap1)、20 (hap2)和16 (hap3)份材料。25份6VS.6AL易位系品种(系)全部属于hap1类型(依据286.0~442.0 Mb区段单倍型判断), 且相互间不存在多样性。因此, 无论从易位的断点位置, 还是着丝粒区域的单倍型来看, 四川小麦品种(系)中的6VS.6AL易位属于单一起源的臂间易位。从系谱信息推断(表1), “92R178”可能是这些6VS.6AL易位的最原始供体材料。
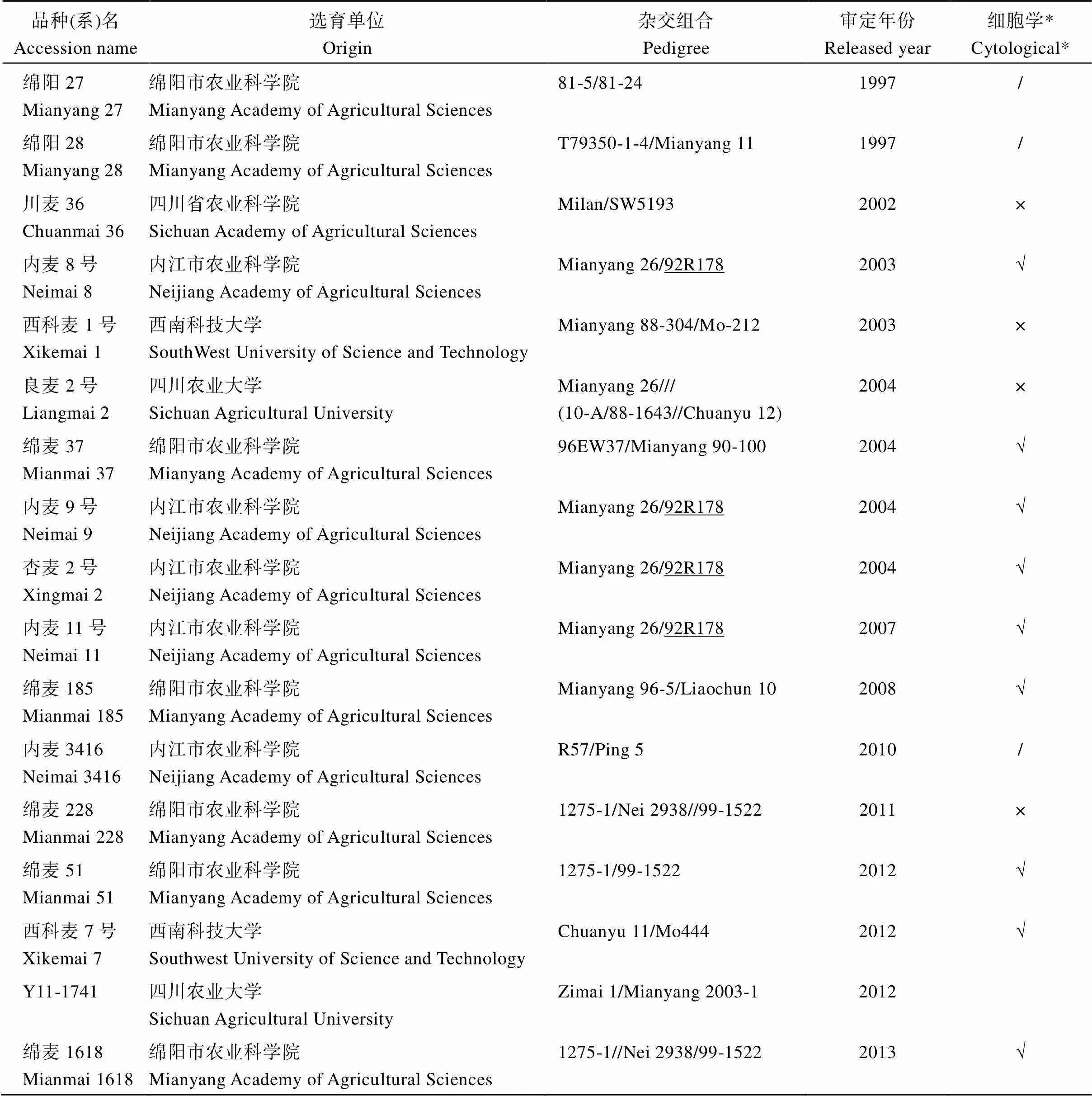
表1 25份携带6VS.6AL易位的四川小麦品种(系)

(续表1)
*细胞学结果引自Hu等[10]。“/”表示该材料没有细胞学结果; “√”表示该材料细胞学鉴定为6VS.6AL易位系; “×”表示该材料细胞学鉴定为非6VS.6AL易位系。
* Cytological results were extracted from Hu et al.[10]“/” indicates that the material has no cytological results; “√” indicates that the material is cytologically identified as a 6VS.6AL translocation line. “×” indicates that the material is cytologically identified as a non-6VS.6AL translocation line.
2.2 创制含Pm21基因的6AS-6VS-6AS.6AL次级小片段易位
6VS/6AS初级易位系1-56和1-73均为杂合, 染色体组成分别为6A’+6VS-6AS.6AL’和6VS.6AL’+ 6AS-6VS.6AL’[18]。它们分别与小麦品种蜀麦830和蜀麦969杂交, 经CV/CA和TV/TA分子标记和细胞学鉴定, 分别获得携带C_6VS/6AS_VA-1 (6VS- 6AS.6AL)和C_6VS/6AS_AV-1 (6AS-6VS.6AL)初级易位的F1杂种HM782-15和HM780-7 (图2-A)。功能标记鉴定表明, HM782-15和HM780-7均含有基因(图2-B)。两株F1杂交, 获得12粒杂交种子。以/基因分子标记、CV/CA和TV/TA分子标记筛选, 获得1株基因纯合且同时携带C_6VS/6AS_VA-1和C_6VS/6AS_AV-1初级易位的植株HM887-9。HM887-9自交获得超过400颗种子。取其中73颗种子发芽, 经CV/CA和TV/TA分子标记筛选, 获得2株疑似携带6AS-6VS-6AS.6AL次级易位的后代, 分别命名为Rec32和Rec50。簇毛麦为探针的GISH鉴定表明, Rec32和Rec50的染色体组成分别为6VS-6AS.6AL’+6AS-6VS-6AS.6AL’ (图2-C)和6AS-6VS.6AL’+6AS-6VS-6AS.6AL’ (图2-D)。因此, 成功获得含基因的次级易位, 将该次级易位命名为C_6VS/6AS_AVA--1 (Rec32和Rec50中的次级易位染色体相同)。同时, 还获携带经重组恢复为6VS.6AL易位的后代2株, 细胞学鉴定同样验证了其真实性(图2-E)。上述结果表明, 在基因的限制下, 2个初级易位共享的6VS区段, 按设计发生了同源重组(图2-F)。
2.3 高通量分子标记鉴定6AS-6VS-6AS.6AL次级易位重组位置
携带次级易位C_6VS/6AS_AVA--1的Rec50和初级易位C_6VS/6AS_AV-1纯合的HM887- 9-51送公司进行16K SNP芯片分析, 共获得14,878个位点的SNP分型结果, 其中位于6A的有738个。如图3所示, C_6VS/6AS_AVA--1次级易位的2个部分同源重组断点位置分别位于6A染色体53.1~53.8 Mb和90.7~92.2 Mb, 估算外源易位片段大小为36.9~39.1 Mb之间(以中国春IWGSC v1.0基因组的6A为参考); C_6VS/6AS_AV-1初级易位的2个重组断点位置分别位于6A染色体的53.1~53.8 Mb和285.6~286.8 Mb, 估算外源易位片段大小为231.8~233.7 Mb之间。C_6VS/6AS_AVA--1与C_6VS/6AS_AV-1近端部断点位置相同, 证明了C_6VS/6AS_AVA--1易位来源于初级易位C_ 6VS/6AS_VA-1和C_6VS/6AS_AV-1之间的同源重组交换。根据C_6VS/6AS_AVA--1的重组断点可以知道, C_6VS/6AS_VA-1 (1~56)初级易位中的6VS片段大小为90.7~92.2 Mb之间。因此, 次级易位C_6VS/6AS_AVA--1中的6VS片段大小(36.9~39.1 Mb)相较于2个初级易位C_6VS/6AS_ VA-1 (90.7~92.2 Mb)和C_6VS/6AS_AV-1 (231.8~ 233.7), 分别减小了约59%和84%。所以, 通过有目的地挑选初级易位, 借助共享外源片段的同源重组, 能够创制出外源片段显著减小的次级易位。
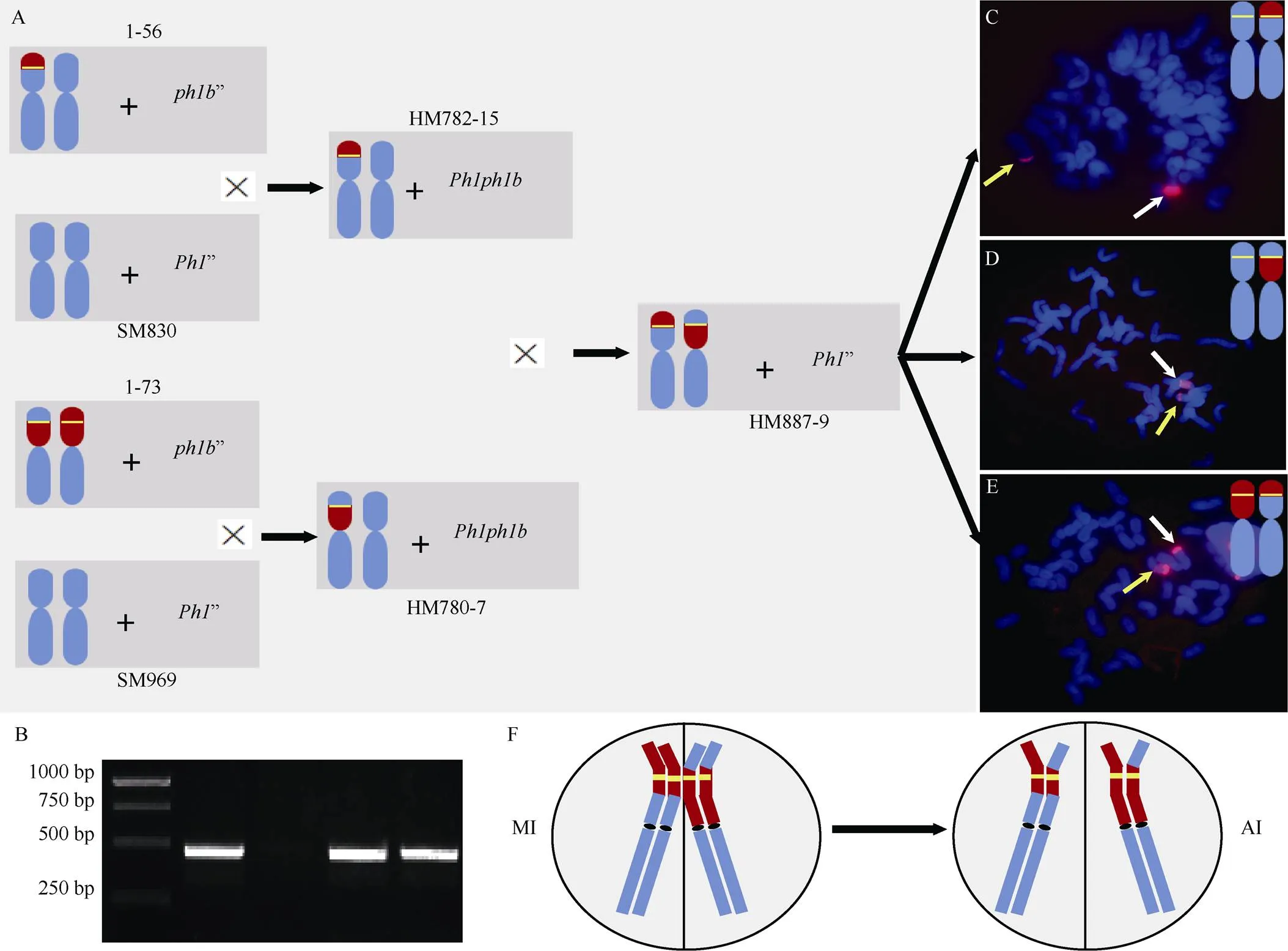
图2 6VS/6AS次级易位创制流程及细胞学鉴定
A: 利用6VS/6AS易位创制次级易位的杂交和筛选流程; B:特异标记CINAU-NLR1标记鉴定(从左至右, 依次为marker、Pm99915-1、CS、HM782-15和HM780-7); C: 次级易位系Rec32的基因组原位杂交鉴定结果; D: 次级易位系Rec50的基因组原位杂交鉴定结果; E: 6VS/6AS初级易位重组重新形成6VS.6AL易位系的基因组原位杂交鉴定结果; F: 初级易位配对重组形成次级易位示意图。MI: 减数分裂中期I; AI: 减数分裂后期I。6VS染色体臂或片段在模式染色体中用红色填充表示, 6A染色体或片段用蓝色填充表示, 黄色短横线则代表基因。黄色箭头指示经同源重组形成的次级易位C_6VS/6AS_AVA--1或6VS.6AL臂间易位, 白色箭头指示未参与重组的初级易位。
A: the crossing and selecting diagram to induce 6VS/6AS secondary translocation using their primary translocation; B: the confirmation the presence ofgene using its specific marker CINAU-NLR1 (from left to right: marker, Pm99915-1, CS, HM782-15, HM780-7); C: genomichybridization (GISH) pattern of secondary translocation line Rec32; D: GSIH pattern of secondary translocation line Rec50; E: GISH pattern of 6VS.6AL translocation lines formed by homologous recombination between two 6VS/6AS primary translocation; F: the diagram of how primary translocation pair and exchange to generate secondary translocation. MI: metaphase I of meiosis; AI: anaphase I of meisosis. 6VS chromosome arm or fragment was filled in red, 6A chromosome or fragment in blue. Yellow line representsgene. Yellow arrows represent C_6VS/6AS_AVA--1 or 6VS.6AL. White arrows represent primary translocation without recombination.
分子标记显示, Rec50的3D染色体在363.6~ 505.8 Mb区段和7D染色体在91.1~629.8 Mb区段存在大片段的缺失, 而5A染色体端部的0~19.6 Mb区段存在一个相对小的片段缺失, 暗示这几条染色体可能存在结构变异或易位(图3)。
2.4 非目标易位检测
高通量分子标记显示Rec50次级小片段易位系中可能还存在内源小麦染色体结构变异或易位。为此, 我们结合双色GISH和FISH对Rec50的染色体组成进行了进一步的鉴定。如图4所示, Rec50含有42条完整或易位染色体和1个A基因组染色体片段。Rec50中存在至少11个6VS/6AS目标染色体臂以外的小麦染色体间重组(图4中白色箭头所示)。其中, 除2个发生在6B和6A之间(6BL/6AL), 其余均发生自A-D基因组染色体间。16K芯片显示存在染色体片段缺失的5A和7D染色体, 分别以5BS-5AS.5AL (1对)和7DS-7AS.7AL (1对)的形式存在; 而3D的片段缺失由两对3D/3A间易位(1对3DS.3DL-3AL和1对3AS.3AL-3DL)导致。
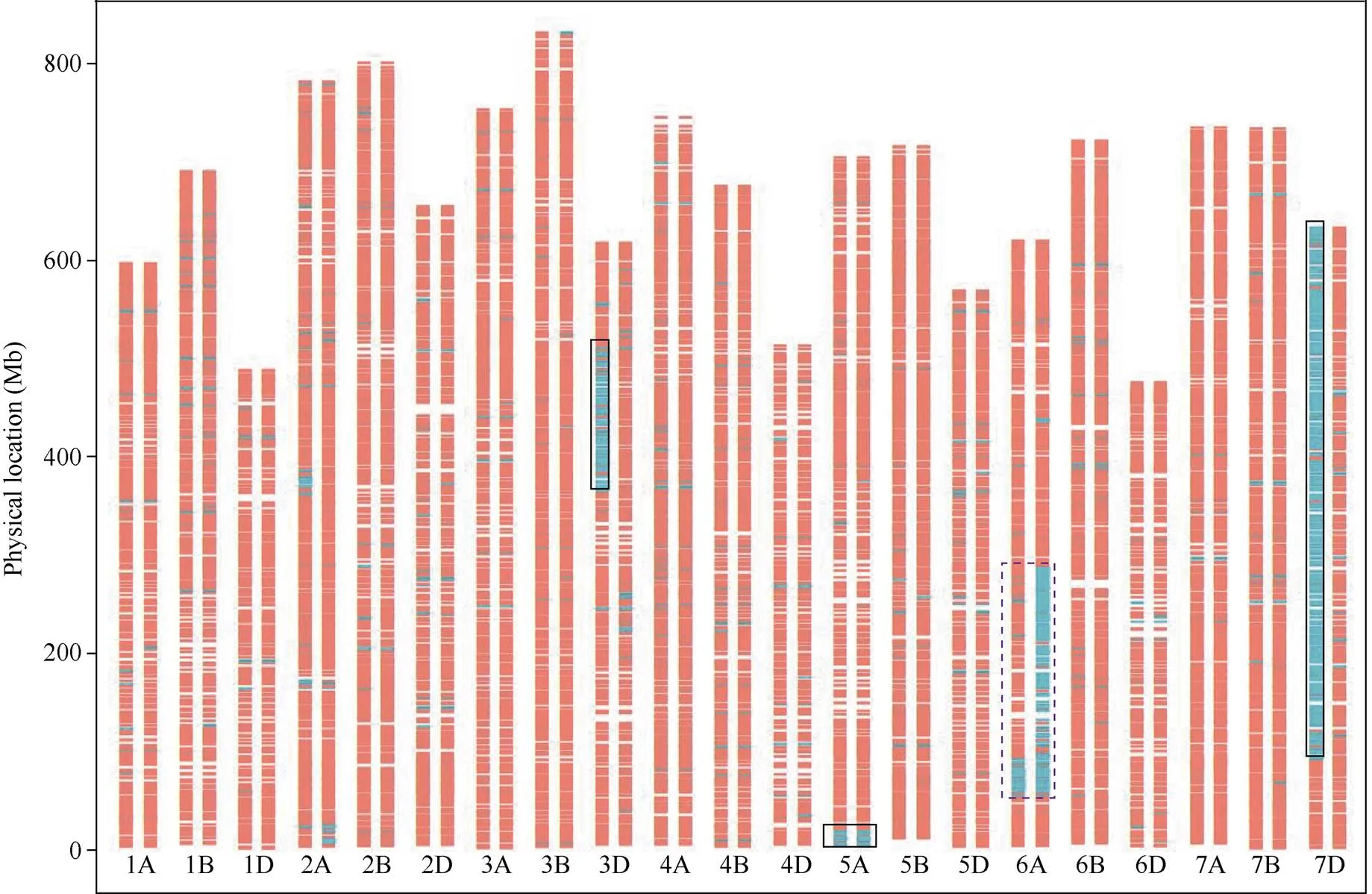
图3 Rec50和HM887-9-51的16K缺失标记分布图
图中每个染色体的左边表示Rec50, 右边表示HM887-9-51。缺失标记位置用绿色表示, 非缺失标记用红色表示。实线框指示非目标小麦内源结构变异染色体区段, 虚线框指示目标次级和初级易位缺失6AS片段。
Chromosomes on the left are from Rec50, right from HM887-9-51. Missing marker locations are labeled in green, others in red. The solid boxes indicate the deletion regions on nontarget wheat endogenous chromosomes. The dotted box indicates the deletion 6AS fragments on target primary and secondary recombined chromosome.
同时, 次级易位C_6VS/6AS_AVA--1的长臂还携带1个B基因组染色体片段, 可能来源于6B, 推测次级易位的存在形式是6AS-6VS-6AS.6AL- 6BL。
3 讨论
本研究表明, 四川小麦品种(系)利用的6VS.6AL染色体为单一来源的着丝点易位。Hu等[10]利用荧光原位杂交发现, 四川小麦6VS.6AL易位的6AL长臂上存在杂交信号多态性, 但对应的6VS臂上不存在多态性, 也表明其可能具有单一的来源。重组断点的位置(相同来源的小麦-外源易位具有相同的重组位置)及断点附近的DNA序列单倍型(小麦-外源重组位点附近的重组会受到抑制)是判断易位染色体来源的重要指标。根据CENH3 CHIP-seq结果, 6A染色体着丝粒区域大致位于中国春1.0参考基因组的283.3~288.7 Mb和290.7~292.5 Mb区段[24]。55K SNP芯片数据表明, 四川小麦品种(系)中6VS.6AL易位具有相同的断裂-融合位置, 位于283.3~286.0 Mb之间, 因此其为一个标准的着丝粒断裂-融合臂间易位。着丝粒区域属于重组冷区。本研究发现四川小麦品种(系) 6A染色体(不包括6VS.6AL易位系), 225.1~442.0 Mb跨着丝粒区域可分为截然不同的3种单倍型, 且相互之间完全缺乏重组(图1)。所有6VS.6AL易位品种(系)的286.0~ 442.0 Mb区段单倍型与单倍型I相同, 进一步说明四川小麦中的6VS.6AL易位染色体具有单一的起源。结合系谱分析来看, 92R178很有可能是四川小麦品种群体中6VS.6AL易位的最原始供体。
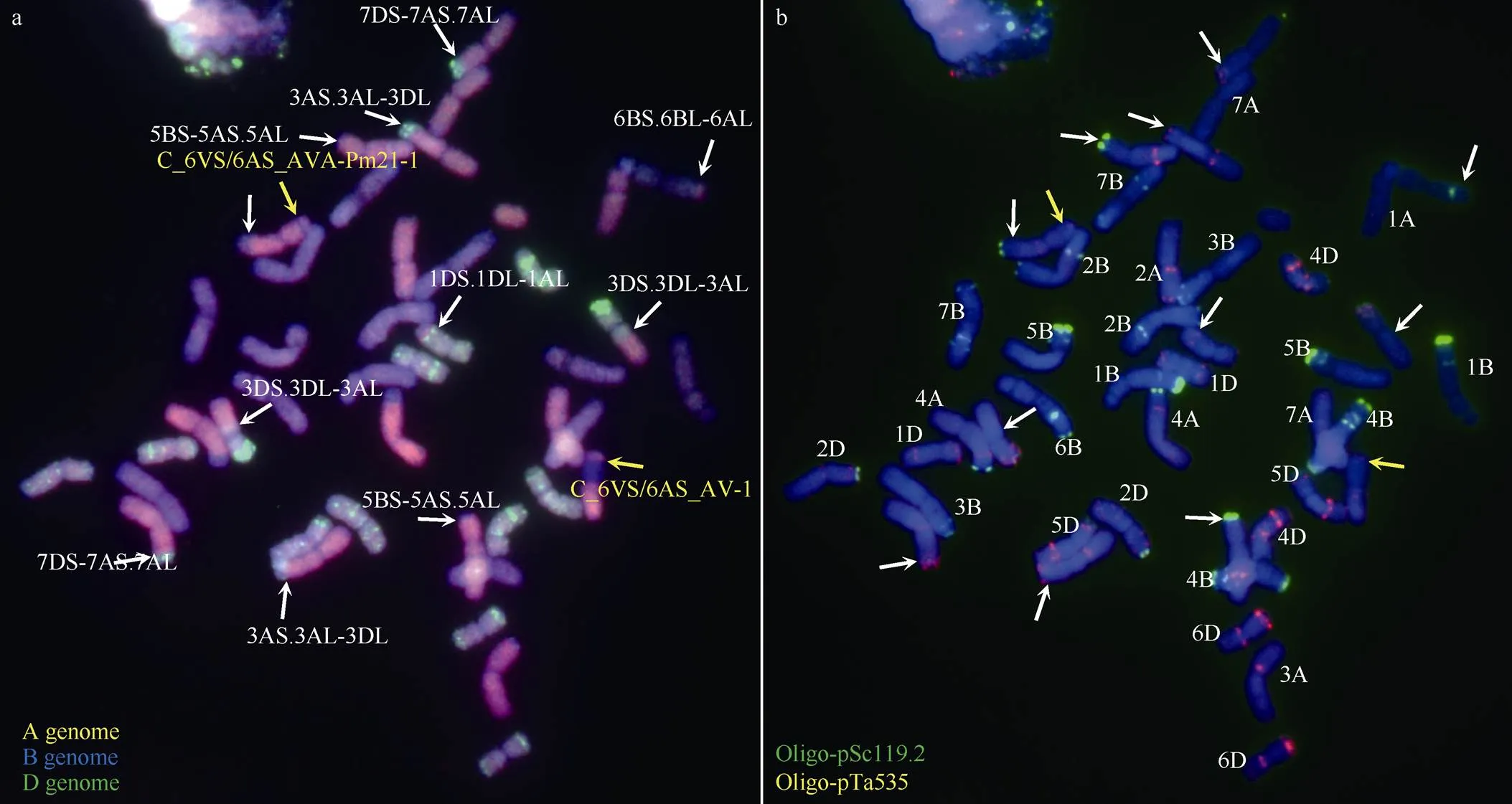
图4 Rec50染色体组成鉴定
a: 基因组原位杂交鉴定。A基因组标记为粉红色, B基因组标记为蓝色, D基因组标记为绿色。b: 荧光原位杂交鉴定。探针Oligo-pSc119.2标记为绿色, Oligo-pTa535标记为粉红色。白色箭头指示6VS/6AS目标染色体臂以外的小麦染色体间重组, 红色箭头指示6VS/6AS目标初级和次级重组染色体。
a: genomichybridization on the root-tip chromosomes from A (pink), B (blue), and D (green) genomes. b: the fluorescencehybridization using Oligo-pSc119.2 (green) and Oligo-pTa535 (pink) as the probes. White arrows indicate the nontarget wheat endogenous recombination chromosomes. Red arrows indicate the target primary and secondary 6VS/6AS recombined chromosomes.
本研究为基因的育种利用提供了新材料。基因(6VS.6AL)的发现和利用历史已经超过30年, 至今仍然保持优良的白粉病抗性[1,9]。克隆表明,基因编码CC-NBS-LRR抗病蛋白[20,25], 这为转基因利用基因进行抗白粉病育种奠定了基础。然而, 转基因小麦在生产中仍然被限制使用。因此,基因的育种利用, 在相当长的时间内仍然依赖于染色体工程材料。整臂6VS.6AL易位是目前基因育种利用的主要形式, 然而6VS携带有导致小麦分蘖数减少和株高增加的不利性状[13-15]。创制含基因的小片段易位是提高其育种利用效率的重要途径。在前期创制的6VS-6AS.6AL (参与重组的6VS片段大小约为90.7~92.2 Mb; 以中国春6A染色体为参考)和6AS-6VS.6AL (参与重组的6VS片段大小约为231.8~233.7 Mb; 以中国春6A染色体为参考)初级易位基础上, 本研究通过基因诱导共享6VS片段同源重组, 创制了一个6VS片段大幅减小的6VS/6AS插入型次级易位, 参与重组的6VS片段大小约36.9~39.1 Mb (以中国春6A染色体为参考, 53.1~53.8 Mb到90.7~92.2 Mb), 极大减小了携带不利基因的可能性, 为基因育种利用提供了新材料。本研究进一步证明, 通过染色体工程精细操作, 能够大幅度减小导入小麦的外源染色体片段大小, 为优异外源基因的高效利用奠定材料基础。
另一方面,基因的发现及在染色体工程中的应用, 已超过60年[26]。但是, 基于操控基因创制的新种质, 成功用于新品种选育的案例却很少。目前来看, 有两大因素限制了小麦-外源易位系的育种利用。首先, 非目标染色体易位, 特别是小麦自身的内源染色体易位。基因是保障小麦二倍化减数分裂的关键核心基因, 该基因的缺失(5B缺体、突变体、c突变体)或失活(Ph基因的抑制), 会导致普通小麦在减数分裂过程中发生部分同源配对重组[26]。伴随着自交, 这种小麦内源的部分同源易位会进一步导致复杂的结构变异[27]。本研究所用的2个初级易位系1-56和1-73均由CS作为亲本诱导而来[18]。CS突变体在本实验室已繁殖超过20年, 本研究在次级易位系中发现的内源小麦部分同源易位可能来自CS的繁殖保存过程, 也可能来自6VS/6AS初级易位系创制过程。但无论如何,基因利用过程中产生的小麦内源染色体易位, 不利于获得的小麦-外源易位系的稳定保存和育种利用。其次, 创制材料的综合农艺性状差。例如中国春广泛用作染色体工程工具材料, 但是中国春的综合农艺性状差。与推广品种相比, 外源易位系在一些特定性状上表现突出, 但通常综合农艺性状差、产量水平低。回交方法常用于改良综合农艺性状, 但从育种家实际应用看, 回交育种的效果不理想。
优化利用突变系进行染色体工程的操作程序, 可以减少小麦内源染色体易位、改良易位系的综合性状。第一,突变系以杂合形式保存。建议拿到纯合的突变系后, 尽量利用优良小麦品种进行杂交、回交, 在此过程中不断选择/杂合植株, 同时检测其染色体结构, 丢掉积累的内源易位, 利用杂合的基因抑制新的部分同源重组染色体形成, 同时改良突变系背景的农艺性状。目前, 一些实验室通过杂交、回交的方式将基因向当地品种背景进行了转移, 例如Pavon[28](Fan et al. 2021)、蜀麦126[29]、Mv9kr1[30]。第二, 利用Sears两步法创制小麦-外源易位过程中, 尽量减少纯合背景下的自交代数。例如, 在筛选得到基因纯合, 且目标外源染色体(或臂)和小麦部分同源染色体(或臂)均呈单存在的双单体后代, 与普通小麦(含野生型)测交, 来构建初级易位筛选群体。第三, 对综合农艺性状差的小麦-外源易位系, 例如利用中国春创制的易位系, 不是采用传统的回交、而是采用其它方式进行改良。例如, “双顶交-两段选择”育种技术体系, 在改良原始育种材料的综合农艺性状方面, 效率很高[31-32]。第四, 为了减少小麦内源易位, 需要利用具有正常染色体组成的小麦品种, 进行多次杂交, 替换内源易位。例如, 本研究创制的次级易位含有10多个小麦内源易位, 单次杂交很难同时消除这些内源易位, 需要多次杂交才能得到具有目标小麦-外源易位、但无小麦内源易位的材料。
4 结论
四川小麦品种(系)群体携带的6VS.6AL易位为单一来源的着丝点易位, 来源于南京农业大学创制的种质“92R178”。本研究通过染色体工程操作, 创制了一份携带基因、保留6VS大约36.9~39.1 Mb (以中国春6A染色体为参考, 53.1~53.8 Mb到90.7~92.2 Mb)的次级小片段易位, 大大减小了不利基因连锁导入的可能性, 可用于抗白粉病育种。为了提高突变体转移外源基因的效率, 建议突变体以杂合的形式进行长期保存, 以减少小麦内源易位, 影响后续的遗传研究和育种应用。同时, 在利用诱导小麦-外源部分同源重组的过程中, 减少纯合状态下的繁殖世代数。育种利用时, 应尽快消除小麦内源易位。
[1] Chen P, Qi L, Zhou B, Zhang Z, Liu D. Development and molecular cytogenetic analysis of wheat-6VS/6AL translocation lines specifying resistance to powdery mildew., 1995, 91: 1125–1128.
[2] Zhang R, Sun B, Chen J, Cao A, Xing L, Feng Y, Lan C, Chen P., a developmental-stage and tissue-specific powdery mildew resistance gene introgressed frominto common wheat., 2016, 129: 1975–1984.
[3] Zhang R, Fan Y, Kong L, Wang Z, Wu J, Xing L, Cao A, Feng Y., an adult-plant powdery mildew resistance gene introgressed fromchromosome arm 2VL into wheat., 2018, 131: 2613–2620.
[4] Zhang R, Xiong C, Mu H, Yao R, Meng X, Kong L, Xing L, Wu J, Feng Y, Cao A., a new powdery mildew resistance gene transferred fromchromosome 1V to common wheat (L.)., 2021, 9: 882–888.
[5] 江峥, 王琪琳, 吴建辉, 薛文波, 曾庆东, 黄丽丽, 康振生, 韩德俊. 基于基因特异性标记分析在中国冬小麦品种(系)中的分布. 中国农业科学, 2014, 47: 2078–2087. Jiang Z, Wang Q L, Wu J H, Xue W B, Zeng Q D, Huang L L, Kang Z S, Han D J. Distribution of powdery mildew resistance genein Chinese winter wheat cultivars and breeding lines based on gene-specific marker., 2014, 47: 2078–2087 (in Chinese with English abstract).
[6] 高煜, 程斌, 丁延庆, 曹宁, 高旭, 张立异. 西南地区小麦种质资源白粉病抗性的全基因组关联分析. 麦类作物学报, 2021, 41: 164–173. Gao Y, Cheng B, Ding Y Q, Cao N, Gao X, Zhang L Y. Genome- wide association study of powdery mildew resistance of wheat germplasm in Southwest China., 2021, 41: 164–173 (in Chinese with English abstract).
[7] Cao A, Xing L, Wang X, Yang X, Wang W, Sun Y, Qian C, Ni J, Chen Y, Liu D, Wang X, Chen P. Serine/threonine kinase gene, a key member of powdery mildew resistance gene, confers powdery mildew resistance in wheat., 2011, 108: 7727–7732.
[8] Huang X, Zhu M, Zhuang L, Zhang S, Wang J, Chen X, Wang D, Chen J, Bao Y, Guo J, Zhang J, Feng Y, Chu C, Du P, Qi Z, Wang H, Chen P. Structural chromosome rearrangements and polymorphisms identified in Chinese wheat cultivars by high-resolution multiplex oligonucleotide FISH., 2018, 131: 1967–1986.
[9] Wu N, Lei Y, Pei D, Wu H, Liu X, Fang J, Guo J, Wang C, Guo J, Zhang J, Liu A, Wen M, Qi Z, Yang X, Bie T, Chu C, Zhou B, Chen P. Predominant wheat-alien chromosome translocations in newly developed wheat of China., 2021, 41: 30.
[10] Hu Z, Luo J, Wan L, Luo J, Li Y, Fu S, Liu D, Hao M, Tang Z. Chromosomes polymorphisms of Sichuan wheat cultivars displayed by ND‑FISH landmarks., 2022, 50: 253–262.
[11] Zhao C, Lyu X, Li Y, Li F, Geng M, Mi Y, Ni Z, Wang X, Xie C, Sun Q.is linked with the powdery mildew resistance geneand contributes to increasing grain protein content in wheat., 2016, 17: 82.
[12] 李桂萍, 陈佩度, 张瑞奇, 王春梅, 曹爱忠, 张守忠. 小麦-簇毛麦6VS/6AL易位染色体在不同小麦背景中的遗传稳定性及其在配子中的传递. 麦类作物学报, 2007, 27: 183–187. Li G P, Chen P D, Zhang R Q, Wang C M, Cao A Z, Zhang S Z. Transmission of the 6VS/6AL chromosome through gametes and its genetic stability in different genetic background., 2007, 27: 183–187 (in Chinese with English abstract).
[13] 马秋香. 普通小麦-簇毛麦6VS·6AL易位系与辉县红的RIL群体及其部分农艺性状的遗传分析. 南京农业大学硕士学位论文, 江苏南京, 2007. pp 43–48. Ma Q X. Genetic Analysis of a New Wheat Recombinant Inbred Lines Population Derived from wheat-6VS·6AL Translocation and Huixian Hong and Some Agronomic Traits. MS Thesis of Nanjing Agricultural University, Nanjing, Jiangsu, China, 2007. pp 43–48 (in Chinese with English abstract).
[14] 李桂萍, 陈佩度, 张守忠, 赵和. 小麦-簇毛麦6VS/6AL易位染色体对小麦农艺性状的影响. 植物遗传资源学报, 2011, 12: 744–749. Li G P, Chen P D, Zhang S Z, Zhao H. Effects of the 6VS/6AL translocation chromosome on agronomic characteristics of wheat., 2011, 12: 744–749 (in Chinese with English abstract).
[15] Zhao R, Jiang Z, Chen T, Wang L, Ji Y, Hu Z, He H, Bie T. Comparative analysis of genetic effects of wheat-translocations T6V#2S·6AL and T6V#4S·6DL., 2019, 138: 503–512.
[16] Sears E R. Transfer of alien genetic material to wheat. In: Evans L, Peacock W J, eds. Wheat Science: Today and Tomorrow. Cambridge: Cambridge University Press, 1981. pp 75–89.
[17] Lukaszewski A J, Cowger C. Re-engineering oftransfer fromto bread wheat by induced homoeologous recombination., 2017, 57: 2590–2594.
[18] Zhang S, Fan C, Luo J, Huang L, Xie D, Li Y, Chen Z, Jiang B, Ning S, Yuan Z, Huang L, Zhang L, Liu D, Hao M. KASP markers to detect sub-chromosomal arm translocations between 6VS ofand 6AS of wheat., 2021, 217: 10.
[19] Gyawali Y, Zhang W, Chao S, Xu S, Cai X. Delimitation of wheatdeletion and development of-specific DNA markers., 2019, 132: 195-204.
[20] Xing L, Hu P, Liu J, Witek K, Zhou S, Xu J, Zhou W, Gao L, Huang Z, Zhang R, Wang X, Chen P, Wang H, Jones J D G, Karafiatova M, Vrana J, Bartos J, Dolezel J, Tian Y, Wu Y, Cao A.fromencodes a CC-NBS-LRR protein conferring powdery mildew resistance in wheat., 2018, 11: 874–878.
[21] Ye X, Li J, Cheng Y, Yao F, Long L, Wang Y, Wu Y, Li J, Wang J, Jiang Q, Kang H, Li W, Qi P, Lan X, Ma J, Liu Y, Jiang Y, Wei Y, Chen X, Liu C, Zheng Y, Chen G. Genome-wide association study reveals new loci for yield-related traits in Sichuan wheat germplasm under stripe rust stress., 2019, 20: 640.
[22] 范超兰. 小麦基因对部分同源染色体重组的影响. 四川农业大学博士学位论文, 四川成都, 2022. pp 29–33. Fan C L. The Effects of WheatGenes on Homoeologous Chromosome Recombination. PhD Dissertation of Sichuan Agricultural University, Chengdu, Sichuan, China, 2022. pp 29–33 (in Chinese with English abstract).
[23] Zhao L, Ning S, Yu J, Hao M, Zhang L, Yuan Z, Zheng Y, Liu D. Cytological identification of anchromosome carrying stripe rust resistance in wheat., 2016, 66: 522–529.
[24] International Wheat Genome Sequencing Consortium (IWGSC). Shifting the limits in wheat research and breeding using a fully annotated reference genome., 2018, 361: eaar7191.
[25] He H, Zhu S, Zhao R, Jiang Z, Ji Y, Ji J, Qiu D, Li H, Bie T., encoding a typical CC-NBS-LRR protein, confers broad- spectrum resistance to wheat powdery mildew disease., 2018, 11: 879–882.
[26] Riley R, Chapman V. Genetic control of the cytologically diploid behaviour of hexaploid wheat., 1958, 182: 713–715.
[27] Martín A C, Borrill P, Higgins J, Alabdullah A, Ramírez- González R H, Swarbreck D, Uauy C, Shaw P, Moore G. Genome- wide transcription during early wheat meiosis is independent of synapsis, ploidy level, and thelocus., 2018, 9: 1791.
[28] Fan C, Hao M, Jia Z, Neri C, Chen X, Chen W, Liu D, Lukaszewski A J. Some characteristics of crossing over in induced recombination between chromosomes of wheat and rye., 2021, 105: 1665–1676.
[29] Li Y, Li Q, Lan J, Tang H, Qi P, Ma J, Wang J, Chen G, Pu Z, Li W, Li Z, Harwood W, Lan X, Deng M, Wei Y, Zheng Y, Jiang Q. Transfer of thegene of ‘Chinese Spring’ into a common wheat cultivar with excellent traits., 2020, 48: 283–291.
[30] Türkösi E, Ivanizs L, Farkas A, Gaál E, Kruppa K, Kovács P, Szakács É, Szőke-Pázsi K, Said M, Cápal P, Griffiths S, Doležel J, Molnár I. Transfer of thedeletion chromosome 5B from Chinese Spring wheat into a winter wheat line and induction of chromosome rearrangements in wheat-hybrids., 2022 13: 875676.
[31] Hao M, Zhang L, Zhao L, Dai S, Li A, Yang W, Xie D, Li Q, Ning S, Yan Z, Wu B, Lan X, Yuan Z, Huang L, Wang J, Zheng K, Chen W, Yu M, Chen X, Chen M, Wei Y, Zhang H, Kishii M, Hawkesford M J, Mao L, Zheng Y, Liu D. A breeding strategy targeting the secondary gene pool of bread wheat: introgression from a synthetic hexaploid wheat., 2019, 132: 2285–2294.
[32] 李庆成, 黄磊, 李亚洲, 范超兰, 谢蝶, 赵来宾, 张舒洁, 陈雪姣, 甯顺腙, 袁中伟, 张连全, 刘登才, 郝明. 6RS/6AL易位染色体的遗传稳定性及其在配子中的传递. 作物学报, 2020, 46: 513–519. Li Q C, Huang L, Li Y Z, Fan C L, Xie D, Zhao L B, Zhang S J, Chen X J, Ning S Z, Yuan Z W, Zhang L Q, Liu D C, Hao M. Genetic stability of 6RS/6AL translocation chromosome and its transmission through gametes., 2020, 46: 513–519 (in Chinese with English abstract).
Creation and analysis of secondary translocation harbouring gene
ZHANG Lan-Yue1,**, LUO Jiang-Tao2,**, FAN Chao-Lan1, LI Ya-Zhou1, JIANG Bo1, CHEN Xue1, CHEN Xue-Jiao1, YUAN Zhong-Wei1, NING Shun-Zong1, ZHANG Lian-Quan3, LIU Deng-Cai3,*, and HAO Ming1,*
1Triticeae Research Institute, Sichuan Agricultural University, Wenjiang 611130, Sichuan, China;2Crop Research Institute, Sichuan Academy of Agricultural Science, Jinjiang 610066, Sichuan, China;3State Key Laboratory of Crop Gene Exploration and Utilization in Southwest China, Sichuan Agricultural University, Wenjiang 611130, Sichuan, China
Wheat-6VS.6AL translocation harbouring the genehas made a great contribution to powdery mildew resistance breeding in China.Based on the data of 55K SNP chip, 25 (15.4%) out of 162 Sichuan wheat varieties contained the translocation. In this study, recombination point and haplotype analysis on the 25 varieties showed that it was centric translocation. Combined with the pedigree information, 92R178 was the original donor of the 6VS.6AL translocation in these varieties. 6AS-6VS-6AS.6AL secondary recombinant containingwas generated by using primary recombinants 6VS-6AS.6AL and 6AS-6VS.6AL as the cross parents, which both formed by the induction of. The secondary recombinant had a much smaller 6VS chromatin than the primary recombinants. Based on the Chinese Spring reference genome, thecrossover points of the secondary recombinant were located within 53.1–53.8 Mb and 90.7–92.2 Mb of chromosome 6A, with a 6VS fragment sizeabout 36.9–39.1 Mb. Molecular cytological identification also detected the extensive recombinantsamong wheat endogenoushomoeologs induced by, which was not only disadvantagefor genetic stabilization of wheat-alien recombinants but also for wheat breeding. A proposed solution to reduce endogenous recombinants was to preservethemutant line in a heterozygouscondition and reduce the selfing times during the development of-mediated wheat-alien recombination. In breeding, it is necessary to eliminate endogenous recombinants as soon as possible.
wheat;; powdery mildew; 6VS.6AL translocation;gene; small fragment translocation line
10.3724/SP.J.1006.2023.21082
本研究由四川省科学技术项目(2022ZDZX0014, 2022NSFSC1696)和国家自然科学基金项目(31971884, 32172020)资助。
This study was supported by the Sichuan Science and Technology Program (2022ZDZX0014, 2022NSFSC1696) and the National Natural Science Foundation of China (31971884, 32172020).
郝明, E-mail: haomingluo@foxmail.com; 刘登才, E-mail: dcliu7@sicau.edu.cn
**同等贡献(Contributed equally to this study)
张蓝月, E-mail: 569395258@qq.com; 罗江陶, E-mail: jtluohao@163.com
2022-12-12;
2023-02-21;
2023-03-06.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20230306.0853.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

