幽门螺杆菌感染对慢性胃炎中医证素与肠道菌群的影响
胡莹莹 ,林雪娟 ,李星慧 ,黄琰钰 ,黄伟荣
1.福建中医药大学,福建中医药大学中医证研究基地,福建省2011中医健康管理协同创新中心,福建 福州 350122; 2.福建中医药大学附属晋江中医院,福建 晋江 362200
幽门螺杆菌(Helicobacter pylori,Hp)感染是慢性胃炎最常见的病因,Hp可长期定植于人体胃黏膜,并引起胃黏膜活动性炎症反应[1-2],进而出现消化不良症状。中医药在根除Hp、减轻临床症状及改善胃黏膜病理形态方面具有显著优势[3-5]。
胃肠道菌群被称为“微生物器官”,对平衡人体微环境具有重要意义,通过参与人体生理活动和病理过程调节人体健康,并对胃肠道疾病的产生有重要影响。研究发现,胃内菌群的种类和丰度与Hp感染密切相关,Hp感染可改变人体胃肠道菌群的正常结构,增加致病菌数量,降低肠道内有益菌的丰度[6-9]。因此,胃肠道菌群分析可为Hp阳性人群提供重要生物学指标,胃肠道菌群变化特征可作为慢性胃炎中医“证”的生物学基础。
本研究探讨Hp感染对慢性胃炎中医证素与肠道菌群的影响及中医证素与肠道菌群的相关性,为临床辨治提供参考。
1 资料与方法
1.1 研究对象
收集2021年3月-2022年1月就诊于福建中医药大学附属晋江中医院脾胃科门诊及体检中心的慢性胃炎患者180例,同时选取来自福建中医药大学附属晋江中医院体检中心的健康志愿者30名作为对照。
1.2 诊断标准
慢性胃炎的诊断标准参照《中国慢性胃炎共识意见(2017年,上海)》[10]。Hp感染的诊断标准参照《第五次全国幽门螺杆菌感染处理共识报告》[11]:13C/14C-尿素呼气试验(UBT)、组织学光镜检查、快速尿素酶试验任意1 项诊断为阳性,即可判定为Hp感染。
证素积分诊断标准:参照《证素辨证学》[12]。根据四诊信息在诊断中的权重,以加权阈值法确定病理要素和证素。每一症状的轻重以中等程度为准,该症状重时其定量诊断值乘1.5,该症状轻时乘0.7。各证素的诊断确定以100作为通用阈值,各症状对某证素贡献度之和达到或超过100时即可诊断为该证素。
1.3 纳入标准
Hp 阳性组:①符合上述慢性胃炎诊断标准;②符合Hp感染诊断标准;③年龄18~70岁;④1个月内未服用过抗生素和质子泵抑制剂者;⑤1个月内未服用过黄连素、二甲双胍或益生菌制剂者。
Hp阴性组:①符合慢性胃炎诊断标准;②Hp-;③年龄18~70岁;④1个月内未服用过抗生素和质子泵抑制剂者;⑤1个月内未服用过黄连素、二甲双胍或益生菌制剂者。
健康组:①年龄18~70岁;②心理健康,身体无明显不适症状;③Hp-;④证素积分均低于70分;⑤常见理化指标如血常规、尿常规、肝功能、肾功能、心肌酶、心电图或B 超等未见异常或无器质性改变;⑥1个月内未服用过抗生素、质子泵抑制剂或益生菌制剂者。
1.4 排除标准
①合并心脑血管、肝、肾、造血系统等严重疾病或影响其生存的严重疾病者,如肿瘤或艾滋病;②有严重认知障碍、精神病患者;③其他胃肠道疾病患者,如胃癌、肠癌等消化道肿瘤者,慢性肠炎者,合并胃溃疡或胃大部切除者;④妊娠或哺乳期妇女。
1.5 四诊信息采集
参照“600常见症状的辨证意义”[13],结合临床调研与专家意见,制订慢性胃炎四诊信息采集表,由2位经过培训的中医人员依据中医传统四诊方法进行四诊信息采集并记录。
1.6 样本采集
采用14C-UBT进行Hp检测,由福建中医药大学附属晋江中医院电子内镜室指派1名对胃镜检查有丰富操作和诊断经验的医师进行检查,得出胃镜检查报告。
粪便采集:用取样棉签蘸取中段、内部粪便样品,放入粪便采样管,并于采样当日移至-80℃冰箱保存。所有样本送至杭州谷禾健康生物科技有限公司进行肠道微生物高通量测序。
1.7 样本提取与检测
利用试剂盒提取样本DNA,保证DNA浓度、纯度满足二代测序要求。选择V4区为测序区域,使用高保真酶进行PCR扩增。用1%琼脂糖凝胶电泳检测PCR产物,利用磁珠对PCR产物进行纯化,用2%琼脂糖凝胶电泳回收PCR产物,获取文库。用Qubit对回收的文库进行定量,用qPCR进行接头效率检测,用Illumina NovaSeq测序。
1.8 数据分析流程与方法
测序所得原始数据经质控留下有效数据用于下一步分析。数据间通过overlap拼接成Tags,通过可操作分类单元(OTU)聚类方法获得扩增子序列变异(ASV)统计结果,并将原始序列比对回ASVs。使用97%的默认参数挑选OTU的代表序列,通过qiime2基于silva138数据库对代表序列进行物种注释,进一步生成OTU列表,在kingdom(界)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)、species(种)分类水平统计各样本的群落组成。基于物种注释结果及OTUs的丰度信息,进一步行Alpha多样性分析和Beta多样性分析,统计并评估菌群物种的丰富度和多样性。使用R stats 包Kruskal方法比较样本间或组间各分类水平的差异。LEfSe分析使用线性判别分析(LDA)与非参数的 Kruskal-Wallis及 Wilcoxon秩和检验相结合,检测各组间分类单位上的差异。
1.9 统计学方法
采用SPSS26.0统计软件进行分析。计量资料符合正态分布以±s表示,组间比较采用两独立样本t检验;不符合正态分布采用四分位数法进行描述统计,组间比较采用非参数检验。所有统计检验均采用双侧检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况
Hp阳性组50例,其中男性26例、女性24例;Hp阴性组130例,其中男性70例、女性60例;健康人30名,其中男性16例、女性14例。年龄最小者18岁,年龄最大者70岁。
2.2 证素分布情况
Hp阳性组常见病位证素依次为:胃、脾和肝。Hp阴性组常见病位证素依次为:胃、肝和脾。Hp阳性组常见病性证素依次为:气滞、湿、热、痰、阴虚、阳虚和气虚。Hp阴性组常见病性证素依次为:热、阴虚、气滞、湿、痰、气虚和阳虚。见表1。
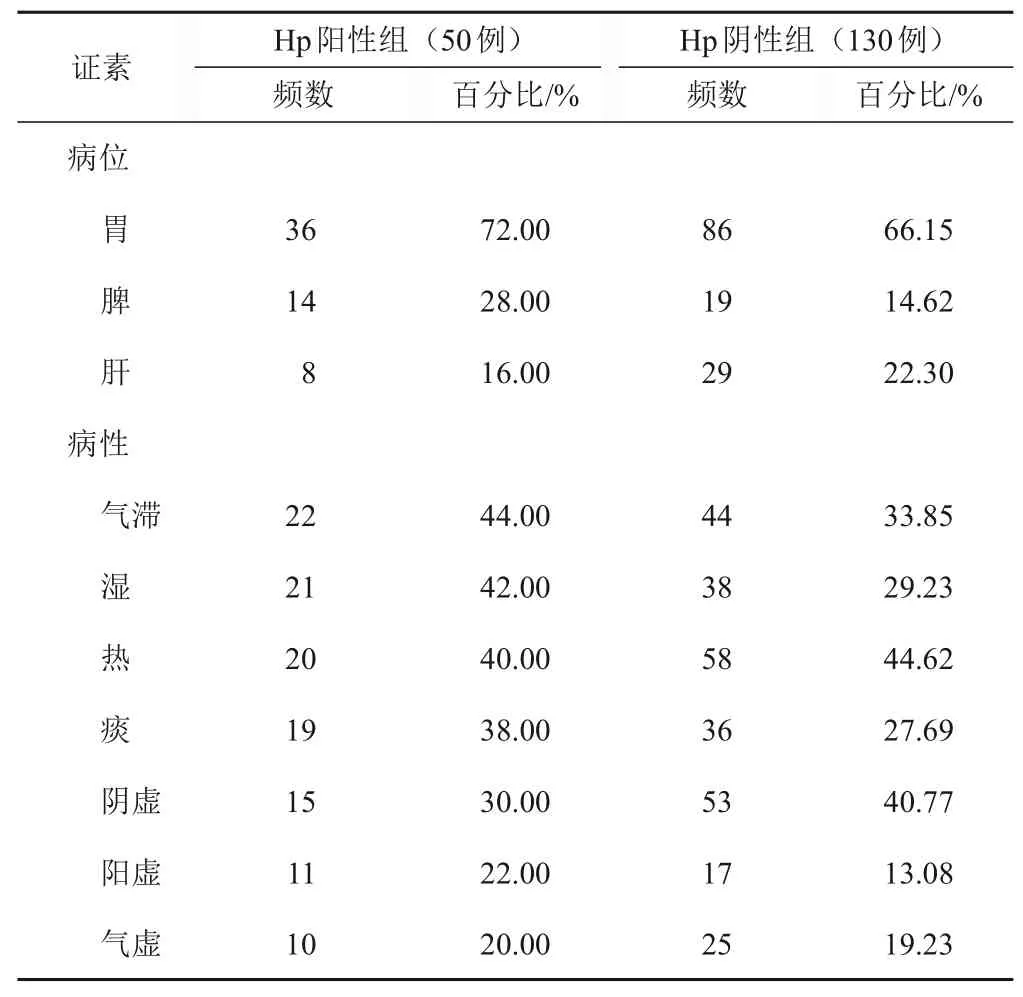
表1 Hp阳性组、Hp阴性组证素分布
2.3 测序数据分析
Hp阳性组、Hp阴性组及健康组测序样本共获得6 392个OTUs,其中,3组共有的OTUs 5 241个,Hp阳性组特有OTUs 35个,Hp阴性组特有OTUs 261个,健康组特有OTUs 131个,说明不同组间存在大部分重合的群落。见图1。
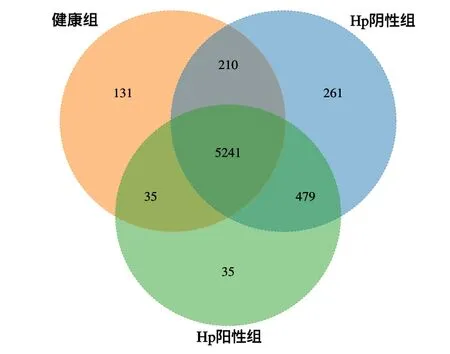
图1 3组受试者OTU韦恩图
2.4 多样性分析
2.4.1 Alpha多样性分析结果
Hp阳性组Simpson和Shannon指数均低于Hp阴性组和健康组,但差异无统计学意义(P>0.05),说明3组样本在群落丰富度和群落异质性上差异不显著。见图2。
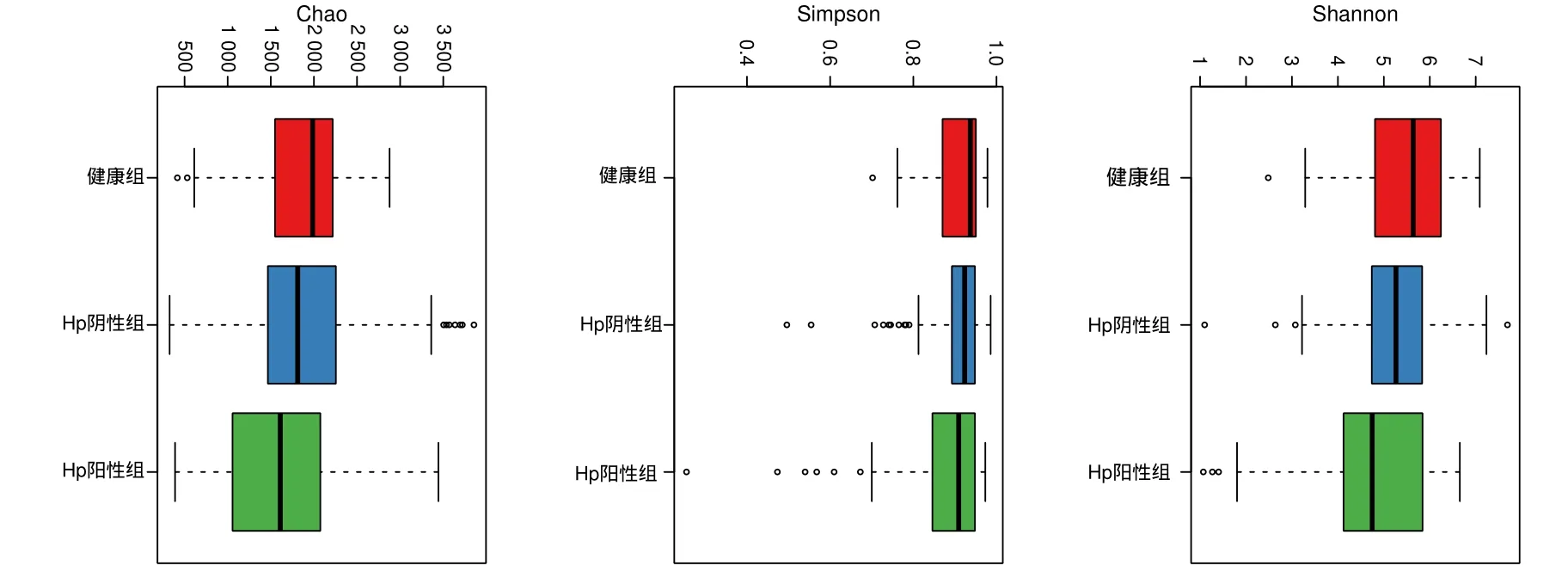
图2 3组受试者Alpha多样性组间比较
2.4.2 Beta多样性Anosim检验结果
考虑到物种差异,使用非加权距离的Anosim分析,结果R=0.053,R值介于(-1,1)之间,说明不同组间菌群结构存在差异,且组间差异大于组内差异;P=0.03,表示差异有统计学意义。见图3。
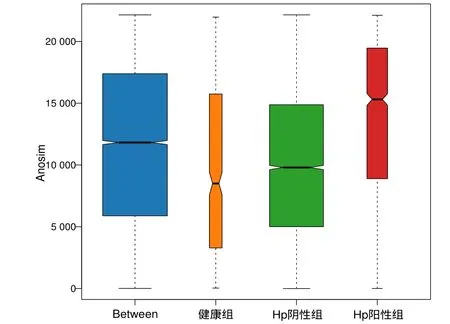
图3 3组受试者非加权距离Anosim分析
2.5 组间物种组成情况
2.5.1 门水平组成分析
门水平上,3组绝大部分OTU属于10个门,从高到低依次为:拟杆菌门Bacteroidota、厚壁菌门Firmicutes、 变形菌门Proteobacteria、 梭杆菌门Fusobacteria、放线菌门Actinobacteriota、脱硫杆菌门Desulfobacterota、疣微菌门Verrrucomicrobia、巴氏杆菌门Patescibacteria、弯曲杆菌门Campilobacterota、互养菌门Synergistota。另外还有一些未识别分类的物种统一归于一个门unidentified。见图4。
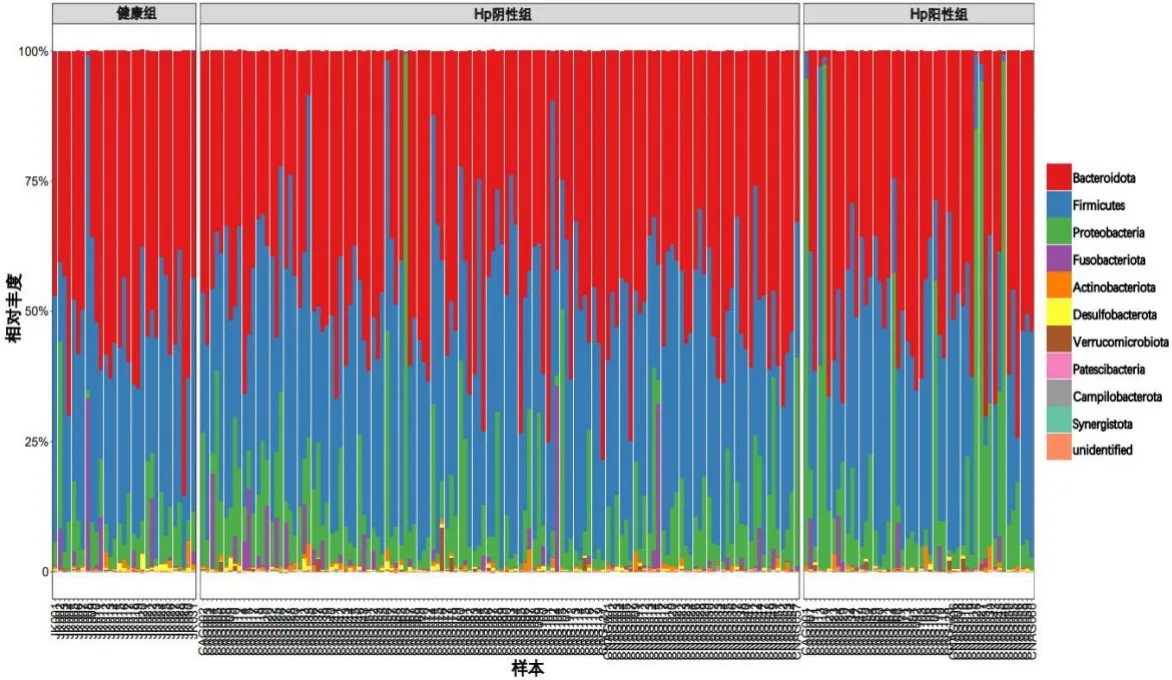
图4 3组受试者粪便样本菌群门水平相对丰度
3组优势菌门在构成上基本一致,但在丰度上存在差异:Hp 阳性组变形菌门Proteobacteria 的丰度高于Hp阴性组和健康组(P>0.05),梭杆菌门Fusobacteria的丰度低于Hp阴性组和健康组(P>0.05)。见图5。
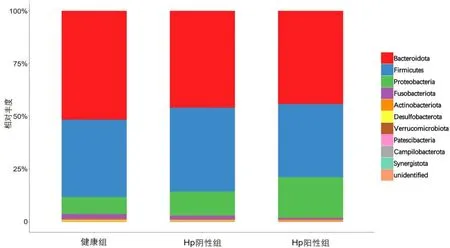
图5 3组受试者粪便样本菌群门水平组成
2.5.2 属水平组成分析
3组样本在优势菌属上的构成相似,排名前10位的优势菌属由高到低依次为:拟杆菌目未知菌属Bacteroidales|f、普雷沃氏菌属Prevotella、粪杆菌属Faecalibacterium、巨单胞菌属Megamonas、考拉杆菌属Phascolarctobacterium、 副 拟 杆 菌 属Parabacteroides、梭杆菌属Fusobacterium、罗氏菌属Roseburia、毛螺菌属Lachnospira、属于毛螺菌科的Eubacterium_eligens_group 菌群。组间群落比较,健康组考拉杆菌属Phascolarctobacterium和梭杆菌属Fusobacterium的丰度较Hp阳性组和Hp阴性组高,而巨单胞菌属Megamonas、副拟杆菌属Parabacteroides在Hp 阳性组表现更为富集。见图6、图7。
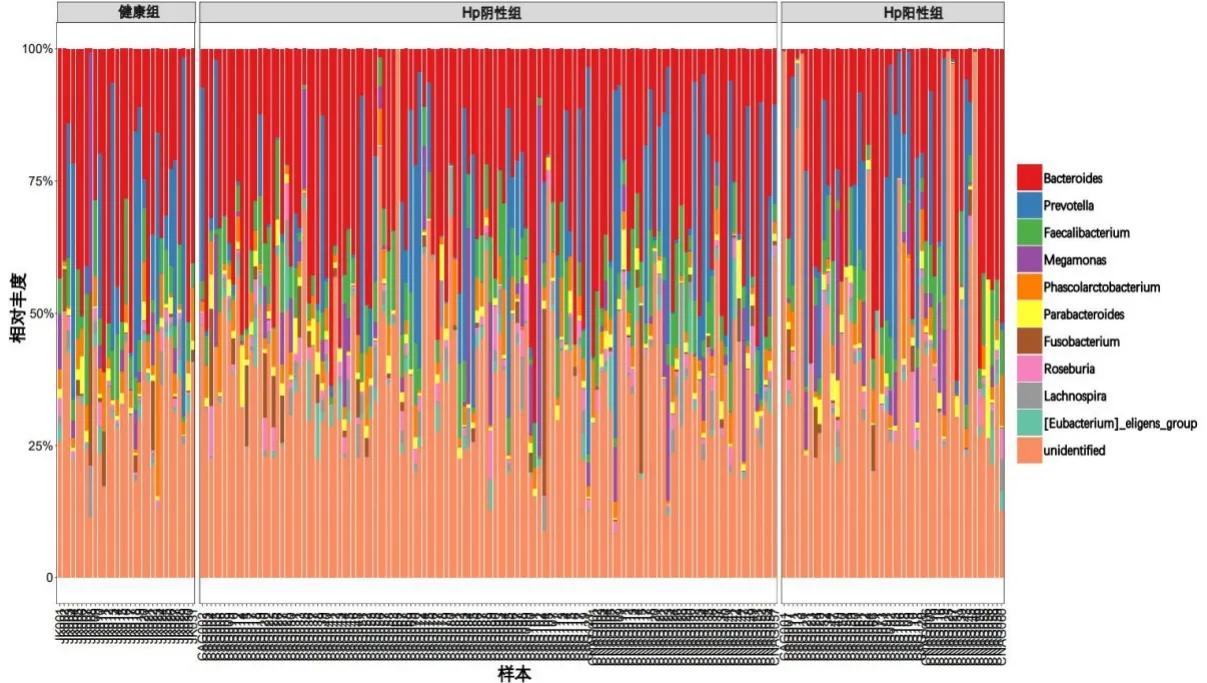
图6 3组受试者粪便样本菌群属水平相对丰度
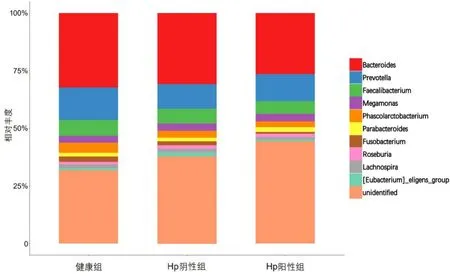
图7 3组受试者粪便样本菌群属水平组成
通过Kruskal-Wallis非参数检验对各菌属进行丰度比较,3组样本拟杆菌目未知菌属Bacteroidales|f(P<0.01)、嗜胆菌属Bilophila(P<0.05)、厚壁菌门未知菌属Firmicutes|c(P<0.05)、经黏液真杆菌属Blautia(P<0.05)、毛螺菌属Lachnospira(P<0.05)、毛旋螺菌科UCG-010 群Lachnospiraceae_UCG-010(P<0.01)、考拉杆菌属Phascolarctobacterium(P<0.05)、萨特氏菌属Sutterella(P<0.05)、巴斯德菌科未知菌属Pasteurellaceae|g(P<0.01)差异显著。与健康组比较,Hp阳性组巴斯德菌科未知菌属Pasteurellaceae|g丰度明显减少(P<0.01),拟杆菌目未知菌属Bacteroidales|f、厚壁菌门未知菌属Firmicutes|c、考拉杆菌属Phascolarctobacterium上丰度减少(P<0.05);Hp阴性组拟杆菌目未知菌属Bacteroidales|f丰度减少(P<0.01)。与Hp阴性组相比,Hp阳性组经黏液真杆菌属Blautia丰度明显减少(P<0.01), 毛螺菌属Lachnospira、萨特氏菌属Sutterella丰度减少(P<0.05)。 Hp 阳性组毛旋螺菌科UCG-010 群Lachnospiraceae_UCG-010 丰度低于Hp 阴性组(P<0.05)、健康组(P<0.01)。见表2。

表2 3组受试者肠道菌群属水平丰度比较[M(Q1,Q3),%]
通过LEfSe分析获得组间差异标记物。默认LDA>2、P<0.05,共获得39个显著差异标记物,其中,Hp阳性组特有12个重要微生物类群,Hp阴性组有27个重要微生物类群。Hp 阳性组差异类群在变形菌门Proteobacteria、γ-变形菌纲Gammaproteobacteria、肠杆菌科Enterobacteriaceae、巨球形菌属Megasphaera丰度较高;Hp 阴性组差异类群在毛螺菌目Lachnospirales、毛螺菌科Lachnospiraceae、乳杆菌科Lactobacillaceae 及乳杆菌属Lactobacillus丰度较高。见图8。
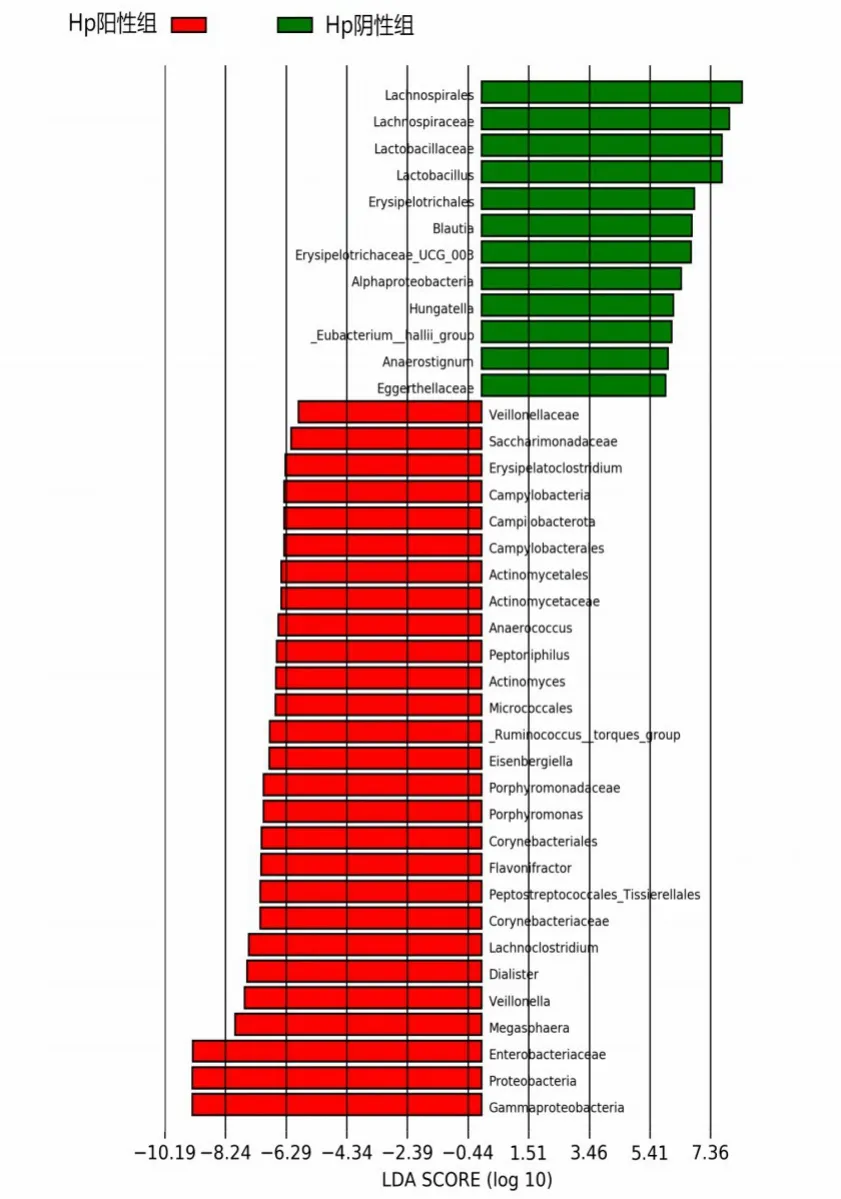
图8 Hp阳性组与Hp阴性组患者LEfSe物种标记物
2.6 Hp阳性、Hp阴性慢性胃炎证素与肠道菌群相关性比较
将Hp阳性与Hp阴性患者证素与肠道菌群的菌属丰度做相关性比较,发现同一菌属与不同证素之间相关性不同。Hp阳性组毛螺菌属Lachnospira与肝呈正相关,与痰呈负相关;萨特氏菌属Sutterella与阴虚呈正相关。Hp阴性组萨特氏菌属Sutterella与肝、气滞呈正相关,与热呈负相关。见表3。
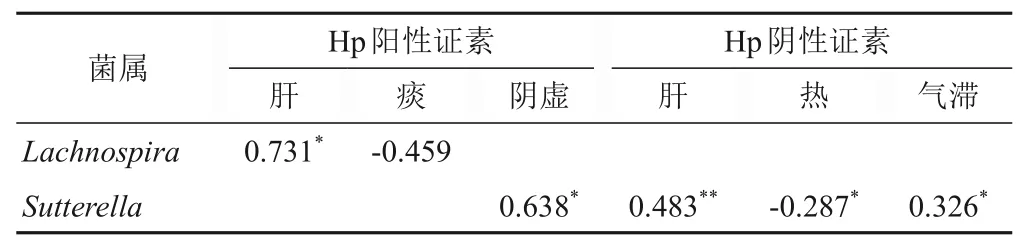
表3 Hp阳性、Hp阴性慢性胃炎证素与肠道菌群属水平丰度相关性(r)
3 讨论
3.1 幽门螺杆菌感染对病位、病性影响
本研究显示,在病位证素分布上,Hp阳性患者胃的频率最高,其次是脾、肝;Hp阴性患者频率最高的亦是胃,其次是肝、脾。可见,Hp感染对脾的影响较大,与相关研究结果一致[14-16]。一方面,脾胃共居中焦,为气血生化之源、气机升降之枢。生理上,二者纳运相得,升降相合,以助水谷运化,精微布散。病理上,二者互结相兼,胃腑受邪,水谷不化,胃失和降,亦伤脾脏,脾不升清,精微不散;Hp为外来邪气,Hp感染可伤胃腑,亦犯脾脏。另一方面,肝与脾胃密切联系。肝主疏泄,调畅脾胃气机,助脾胃升降相济,纳运相得,化生气血,涵养肝木。若肝气郁结,乘脾犯胃,纳运失和,饮食积滞,胃腑壅滞为病。故慢性胃炎患者病位在胃,亦伤肝木,克伐脾土。
在病性证素分布上,Hp阳性组以气滞、湿、热、痰等实性证素为主,而Hp阴性组热、阴虚等证素占比较高。脾胃为气机升降之枢,二者功能失常,升降失调则饮食内停,阻滞气机。气滞加重脾胃运化失司,水饮内停,邪壅成滞,痰湿内生,日久可郁而化热,导致气滞、湿邪、热邪、痰邪相兼为患。研究表明,Hp感染与慢性胃炎湿热证的发生存在相关性,感染Hp可出现胃腑湿、热的相关症状,湿热之邪内生,痰湿内盛,阻滞气机,郁而化热,进一步加重湿热之证[17-19]。Hp为外来之邪,外邪犯胃,正气未虚,病程较短,因此,阴虚等虚性证素占比较低。临床治疗中,Hp感染初期,应于辨证论治的基础上佐以行气、化湿、清热、祛痰类中药,防止Hp感染对胃腑的进一步损伤。而Hp阴性组多为胃腑功能失调,饮食积滞,久积则郁而化火,煎灼阴液,日久则阴虚,阴虚则热,二者相兼为病,故Hp阴性组可出现热等实性证素,又可见阴虚等虚性证素。临床治疗慢性胃炎应于辨证论治的基础上佐以滋阴清热之品,防止胃腑阴津耗伤,虚热内生。
3.2 幽门螺杆菌感染对肠道菌群影响
本研究发现,Hp阳性组、Hp阴性组与健康组的优势菌门相同,均为拟杆菌门Bacteroidota、厚壁菌门Firmicutes、 变形菌门Proteobacteria、 梭杆菌门Fusobacteria、放线菌门Actinobacteriota,与目前研究发现人胃内5大优势菌门相同[20]。虽然3组优势菌门在构成上基本一致,但在丰度上存在差异,Hp阳性组和Hp 阴性组变形菌门Proteobacteria 的丰度高于健康人群,结合组间差异标记物结果,推测变形菌门Proteobacteria可能是感染Hp的慢性胃炎患者的特征性菌门。
在属水平上,与健康人相比,Hp阳性患者考拉杆菌属Phascolarctobacterium、毛旋螺菌科UCG-010群Lachnospiraceae_UCG-010、巴斯德菌科未知菌属Pasteurellaceae|g、拟杆菌目未知菌属Bacteroidales|f上丰度较低。考拉杆菌属厚壁菌门,该菌属会增加Bacteroides、Odoribacter(被报道能有效降低肠道炎症、抑制结肠癌的发生[21])、Peptococcaceae等在胃肠道的丰度。毛旋螺菌科UCG-010群Lachnospiraceae_UCG-010的存在有助于改善胃肠黏膜屏障完整性,降低局部和全身炎症风险。拟杆菌属能产生抗炎介质,抑制中性粒细胞和巨噬细胞、释放促炎细胞因子,帮助维持胃肠道生物稳态。研究显示,拟杆菌属过低会导致炎症性胃肠道疾病的发生,如克罗恩病和溃疡性结肠炎等[22]。我们推测Hp感染引起胃肠道菌群失调的原因,可能由于Hp感染引起胃黏膜萎缩和壁细胞显著减少,导致胃酸分泌减少、pH值升高,胃内环境改变,显著抑制益生菌的生长,使胃内正常菌所占比例下降,对胃黏膜的保护作用降低,胃内的弱势菌厌氧菌数量显著增加,成为Hp感染患者胃内的优势菌,从而导致胃内微生态平衡破坏,慢性胃炎等疾病的发生。经黏液真杆菌属Blautia、毛螺菌属Lachnospira、萨特氏菌属Sutterella在Hp阴性患者胃肠道中丰度较高,而在Hp阳性患者胃肠道丰度降低,推测可能与Hp定植对其抑制作用有关,具体机制有待进一步研究。
3.3 慢性胃炎证素与肠道菌群相关性
对慢性胃炎主要证素与肠道菌群各菌属的丰度进行相关性分析,发现Hp阴性组萨特氏菌属Sutterella丰度与肝和气滞呈正相关,与热呈负相关。肝失疏泄可致气滞,可见肝气郁滞有利于萨特氏菌属Sutterella富集,而“热”对其富集具有抑制作用。Hp阳性组毛螺菌属Lachnospira丰度与肝呈正相关,与痰呈负相关。毛螺菌属Lachnospira为肠道有益菌,肝气疏泄助脾胃气机调畅,表明肝气调达有利于毛螺菌属Lachnospira生长。Hp致病特点与中医湿热之邪相似,湿邪内阻,久郁化火,炼津为痰,痰湿内扰,表明痰湿可能是导致毛螺菌属Lachnospira丰度降低的重要因素。
综上所述,Hp感染对脾影响较大,易出现气滞、湿、热、痰等实性证素。Hp感染影响肠道菌群的构成,降低中性菌及有益菌的丰度。本研究可为Hp感染患者临床诊治提供参考。

