动态光散射传感器在食品安全检测中的应用进展
冷远逵, 范思雨, 胡馨予, 熊勇华,3
(1. 南昌大学 食品学院,江西 南昌 330031; 2. 南昌大学 前湖学院,江西 南昌 330031; 3. 南昌大学 中德联合研究院,江西 南昌 330047)
动态光散射(dynamic light scattering,DLS)技术自1970 年商业化以来, 已成为粒度分析测量的常规实验室技术, 用于测量溶液或悬浮液中纳米、微米级别颗粒的尺寸分布情况[1]。 其基本原理是测量粒子散射光强度随时间的波动规律,分析得出粒子的布朗运动扩散速度, 从而通过Stokes-Einstein 方程得到粒子的流体力学直径(水化粒径)。 因具有操作简单、 成本低、 响应速度快和重现性好等优点,Cohen 等早在1975 年就提出以特异性识别分子修饰的聚合物微球作为探针,通过DLS 技术测量因目标物引起微球聚集而导致的粒径变化来定量分析目标物的方法[2]。 然而由于聚合物微球光散射能力较弱,该方法在实际应用时易受到样品基质中生物分子、胶体颗粒等物质的散射信号干扰,导致灵敏度偏低、稳定性不足。因此,构建DLS 传感器的关键在于选择具有较强光散射能力的信号探针。 金纳米颗粒(gold nanoparticles,AuNPs)具有较强的光散射能力, 比直径相近的聚合物微球强2~3 个数量级,可有效屏蔽复杂样品基质引起的背景信号干扰,显著提高DLS 传感器的检测灵敏度[3]。 同时AuNPs 具有易于制备、粒径可控、易于生物修饰等优点,且相比于同样具备强光散射能力的银纳米材料,其胶体稳定性和生物相容性更好。 近年来,以AuNPs 为信号探针构建AuNP-DLS 传感器受到广泛关注,成功用于食品危害物[4-6]、环境污染物[1]、药物[7]、临床标志物[8-9]等的高灵敏检测。
作者从传感器构建策略、探针设计原则等方面阐述了近年来AuNP-DLS 传感器的方法学研究进展,总结了其在真菌毒素[5]、有毒金属离子[6]、食源性致病菌[10]等食品危害因子检测中的应用情况,并探讨了该领域的发展趋势和面临的主要挑战。
1 DLS 传感器方法学研究进展
1.1 DLS 传感器构建策略
DLS 传感器可测量两种信号:水化粒径和散射光强度。因此,AuNP-DLS 传感器的核心在于目标物引起AuNPs 粒径或散射光强度的变化。 目前AuNP-DLS 传感器主要通过以下3 种方式来实现信号输出:1)基于目标物引起的AuNPs 聚集;2)基于目标物引起的AuNPs 有序组装或解组装;3)基于标记免疫分析技术建立目标物和AuNPs(与AuNPs 磁珠或酶标板载体结合的部分或游离的部分)浓度之间的剂量关系。
1.1.1 基于AuNPs 聚集的DLS 传感器 这类传感器最常见的构建方法是基于目标物与AuNPs 探针的特异性识别作用(免疫识别、核酸杂交、配位键等)直接介导探针聚集。 以特异性识别分子修饰的AuNPs 为探针构建的DLS 传感器已被用于蛋白质[11]、核酸[12]、小分子[13]和离子[1]等物质的均相免洗高灵敏检测。 Wang 等以单抗和多抗分别修饰的50 nm 和10 nm AuNPs 作为探针, 构建乙肝表面抗原的DLS均相免疫分析方法(见图1(a))[11]。 以目标物引起探针聚集导致的粒径增大为定量信号,该方法检测乙肝表面抗原的灵敏度较常规酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)提高了80 倍。 Miao 等以两种寡核苷酸修饰的AuNPs 为探针检测双链DNA[14]。 两种寡核苷酸链分别与目的DNA 不同区域杂交形成三链体结构, 引发AuNPs聚集, 进而通过检测粒径变化实现对DNA 的高灵敏分析,检测限(limit of detection,LOD)低至500 fmol/L。 一般地,颗粒的散射光强度与粒径呈正相关关系,因此探针聚集同时也会导致散射光强度的增加。 有研究者以对巯基苯胺修饰的AuNPs 为DLS探针,利用三硝基甲苯(trinitrotoluene,TNT)与对巯基苯胺之间的π-π 相互作用介导探针聚集的原理来检测TNT[13]。以散射光强度变化为定量信号,该方法检测TNT 的LOD 达100 pmol/L。
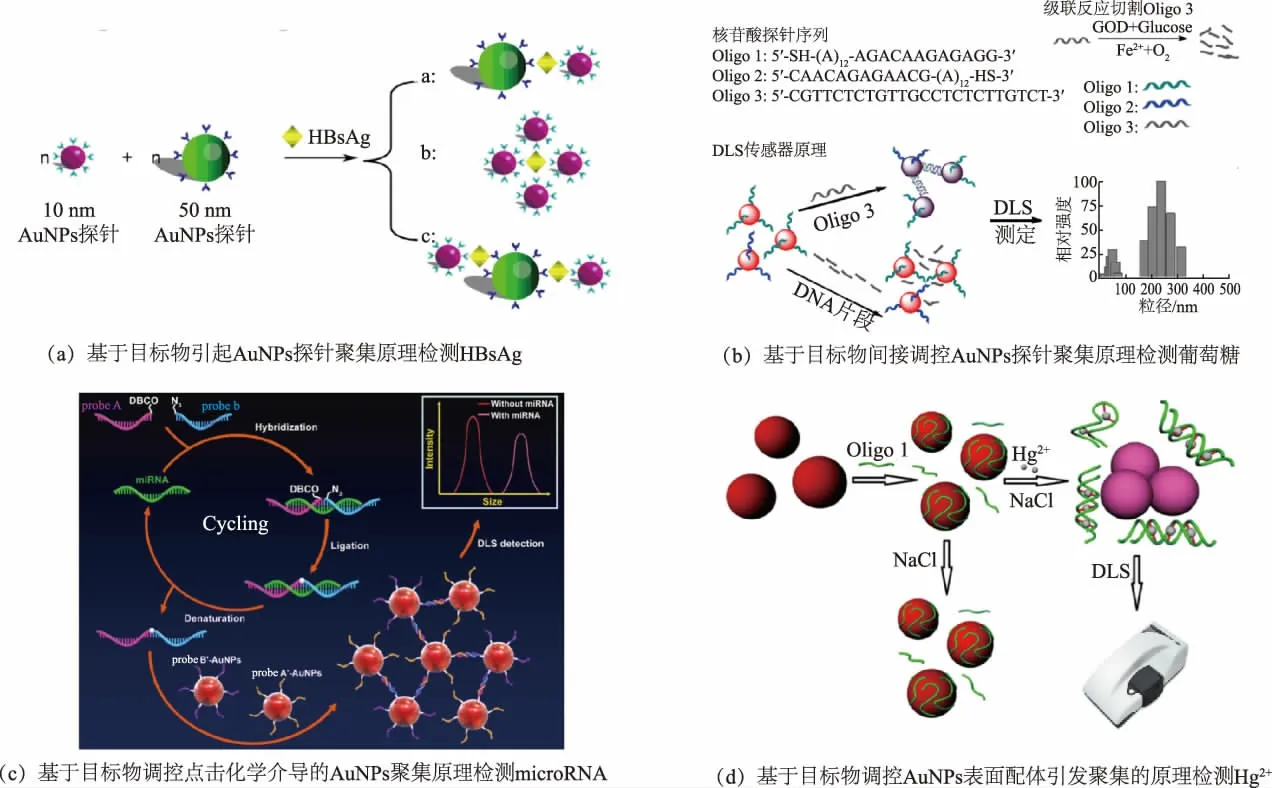
图1 基于AuNPs 聚集的DLS 传感器Fig. 1 DLS sensors based on AuNPs aggregation
第二种常见方法是基于目标物间接调控AuNPs 探针的交联反应。Miao 等以两种寡核苷酸链修饰的AuNPs (Oligo1-AuNP、Oligo2-AuNP) 为探针,以能同时与Oligo1、Oligo2 进行杂交的寡核苷酸链Oligo3 为交联探针构建葡萄糖传感器 (见图1(b))[15]。 葡萄糖在葡萄糖氧化酶 (glucose oxidase,GOx)、Fe2+级联催化下产生羟自由基(·OH),·OH 可降解Oligo3,从而调控AuNPs 探针的聚集反应。 该方法通过粒径变化检测葡萄糖, 线性范围为0.05~5.00 pmol/L,LOD 为38 pmol/L。 Lu 等报道的检测植物微小RNA(microRNA)的无酶催化均相DLS 传感器原理[16]见图1(c)。 microRNA 可与二苯基环辛炔(DBCO) 修饰的寡核苷酸探针probe A 和叠氮基(N3)修饰的寡核苷酸探针probe B 杂交形成夹心结构, 促使probe A 与probe B 发生点击化学反应并连接起来,所形成的probe A-probe B 链同时与probe A’修饰的AuNPs 和probe B’ 修饰的AuNPs 杂交,导致AuNPs 发生聚集。 由于目标microRNA 实现了循环利用,信号得到放大,该方法LOD 达78.6 fmol/L。
AuNPs 溶液胶体稳定性的基础是表面配体(如柠檬酸) 提供的表面电荷和亲水性。 因此, 调控AuNPs 的表面配体,可影响其胶体稳定性从而引发AuNPs 聚集。寡核苷酸链修饰的AuNPs 具有很好的胶体稳定性, 但当寡核苷酸链脱落或者裂解后,AuNPs 胶体稳定性变差,从而在高盐离子浓度下发生团聚。 基于此原理,Xiong 等以5′-TTTCTTCTTC GTTGTTT-3′修饰的AuNPs 为探针构建Hg2+传感器(见图1(d))[6]。 Hg2+与寡核苷酸链结合形成T-Hg2+-T,寡核苷酸链形成双链结构而脱离AuNPs 表面,加入高浓度NaCl,AuNPs 发生聚集,粒径变大,该方法LOD 达0.43 nmol/L。
1.1.2 基于AuNPs 组装结构的DLS 传感器 由于聚集的无序性以及容易受到样本基质影响等缺陷,导致基于AuNPs 聚集的DLS 传感器信号稳定性不足。 相比较而言,基于AuNPs 有序自组装结构形成的信号或组装体解组装过程的信号更加可控和稳定。 目前,基于AuNPs 组装结构的DLS 传感器中,AuNPs 组装体形成主要分为以下4 种方式:1)基于与目标物特异性结合作用形成AuNPs 低聚体;2)以DNA 为框架进行自组装;3)在微生物模板表面自组装;4)在纳米颗粒模板表面自组装。
在基于特异性识别作用直接介导AuNPs 聚集的体系中,当控制AuNPs 颗粒表面特异性识别分子的数量时,可使AuNPs 在目标物存在时组装成低聚体,甚至是二聚体结构[17-18]。 如Seow 等以寡核苷酸链修饰的AuNPs 为探针构建针对let7a(microRNA)的均相DLS 传感器[17]。通过对比平均每个AuNPs 上偶联的寡核苷酸分子数为2、5、10 个时AuNPs 的目标物介导组装行为,发现偶联寡核苷酸越多,AuNPs粒径变化越明显。 单个AuNPs 表面平均有10 个寡核苷酸分子时,其粒径变化最明显,但有趋近于无序聚集的趋势, 信号的稳定性变差。 而当平均有5个寡核苷酸分子时,AuNPs 在let7a 存在时会稳定组装成低聚体,LOD 达100 fmol/L。
Li 等开发了一种基于AuNPs 自组装的端粒酶传感器,通过对癌细胞或尿液中端粒酶的高灵敏检测可实现膀胱癌的诊断(见图2(a))[19]。 在端粒酶作用下,底物(telomerase substrate,TS)末端延伸n 次重复序列(TTAGGG),该重复序列可以作为启动子,触发两个发夹探针(H1 和H2)之间的杂交链式反应(hybridization chain reaction,HCR) 形成双链DNA。该HCR 产物DNA 旁边带有大量寡核苷酸支链可与互补序列修饰的AuNPs 探针杂交, 因此AuNPs在HCR 产物上形成有序组装体, 导致水化粒径的急剧增大。 该方法可检测仅从4 个MCF-7 细胞中提取的端粒酶含量。 Zou 等报道了一种基于AuNPs探针在目标DNA 的聚合酶链式反应(polymerase chain reaction,PCR)扩增产物核酸框架上自组装的DLS 均相传感器, 其检测艾滋病病毒(human immunodeficiency virus,HIV)DNA 的 LOD 达 1.8 amol/L[20]。 近期该课题组通过引入核酸适配子,利用上述原理设计了可检测肿瘤标志物CA-125 的PCR-DLS 传感器,LOD 低至1.1 fg/mL[21]。
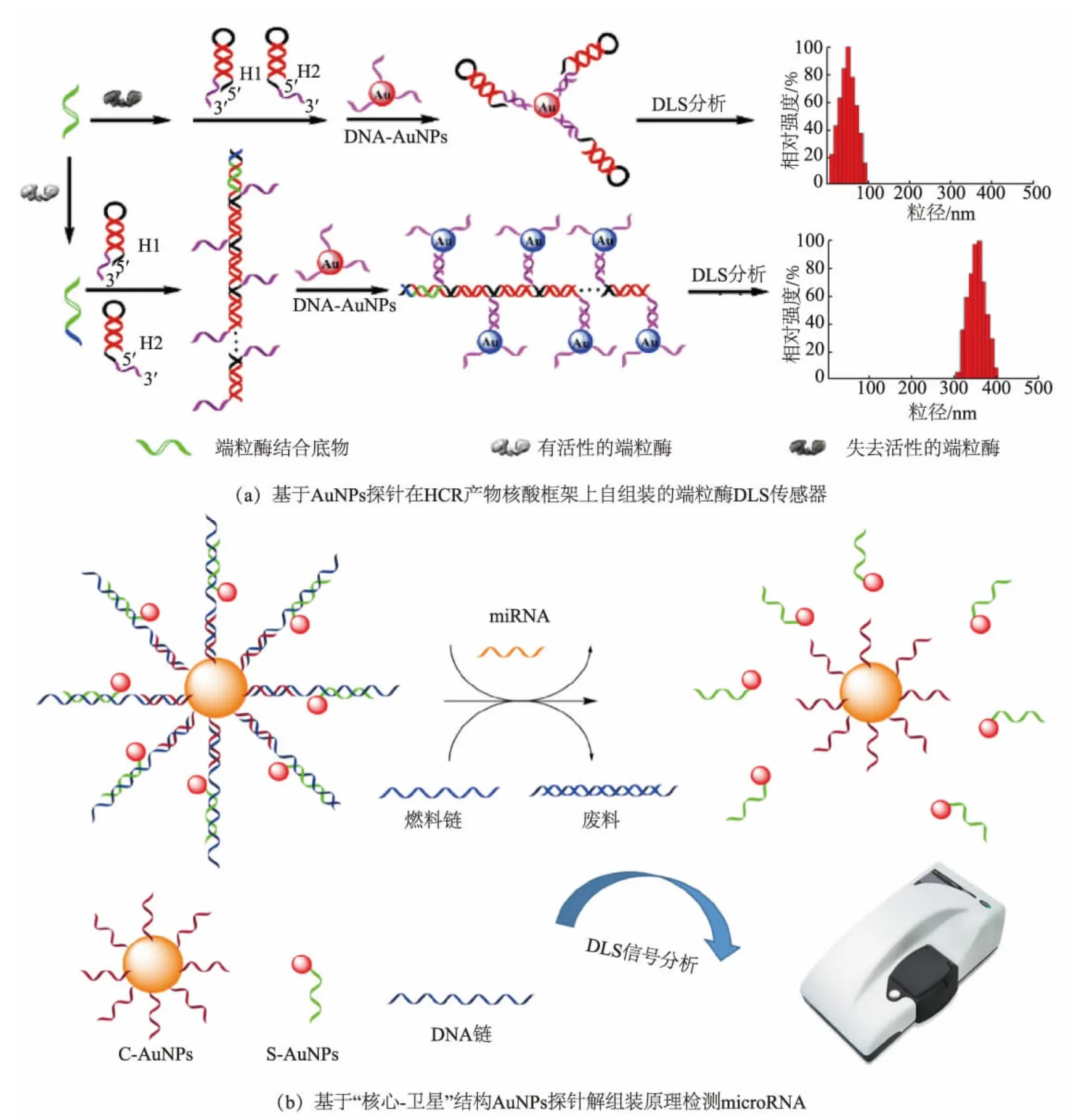
图2 基于AuNPs 组装体结构的DLS 传感器Fig. 2 DLS sensors based on AuNPs assemblies
对于病毒[22]、细菌[10]等微生物目标物,免疫AuNPs 探针会以目标物为模板在其表面形成组装体,从而导致粒径增大。 如Driskell 等以抗体修饰的AuNPs 为免疫探针来检测PR8 型流感病毒[22]。 在病毒颗粒浓度较低时,免疫AuNPs 探针会在病毒颗粒表面自组装形成“核心-卫星”组装结构,从而导致粒径增大。 该方法LOD 小于100 TCID50/mL,灵敏度较商业诊断试剂盒提高1~2 个数量级。
Wang 等开发了一种等离子体 “核心-卫星”结构纳米组装探针用于microRNA-21 的检测[23](见图2(b))。 其中,核心AuNPs 和卫星AuNPs 通过DNA链连接,目标物microRNA-21 通过链置换反应可使卫星AuNPs 脱落引发解组装。 而燃料DNA 链又通过链置换反应使microRNA-21 重新解离出来实现循环利用, 从而使信号得到放大。 该方法对microRNA-21 的定量检测范围为5~150 pmol/L,LOD 为0.24 pmol/L。
1.1.3 基于免疫标记技术的非均相DLS 传感器AuNPs 探针与目标物特异性结合后,无论是游离的还是结合的探针部分均会产生目标物引起的浓度差,从而表现出散射光强度的差异。 Chao 等以片状二氧化锰修饰的AuNPs(MnO2-pAuNP)作为免疫标记材料构建了检测前列腺特异性抗原 (prostatespecific antigen,PSA) 的超灵敏DLS 免疫分析方法(见图3(a))[24]。 样本中存在PSA 时,酶标板上会捕获一定量的MnO2-pAuNP 免疫探针,通过谷胱甘肽(glutathione,GSH) 消解MnO2壳层可释放大量的AuNPs 到溶液中,通过检测溶液中AuNPs 引起的散射光强度,可以对PSA 进行定量分析。 由于MnO2-pAuNP 是载有多个AuNPs 的组装体,且溶液中基本无背景干扰,因此该方法LOD 低至1 fmol/L。 在此模式的基础上,Yu 等根据金属有机框架 (metalorganic framework,MOF) 大 量 装 载 和 可 控 释 放AuNPs,以及AuNPs 释放后可控生长的原理设计了检测甲胎蛋白(alpha-fetoprotein,AFP)的DLS 免疫分析方法(见图3(b))[25]。 当存在AFP 时,一定量的MOF@AuNP 会结合在酶标板上,MOF 在碱性条件下消解释放出大量的小粒径AuNPs(4 nm)到溶液中,然后加入生长液(盐酸羟胺和氯金酸)使4 nm AuNPs 生长成大粒径AuNPs, 光散射能力得到放大。 通过测定散射光强度对AFP 定量分析,该方法LOD 为0.36 pg/mL。
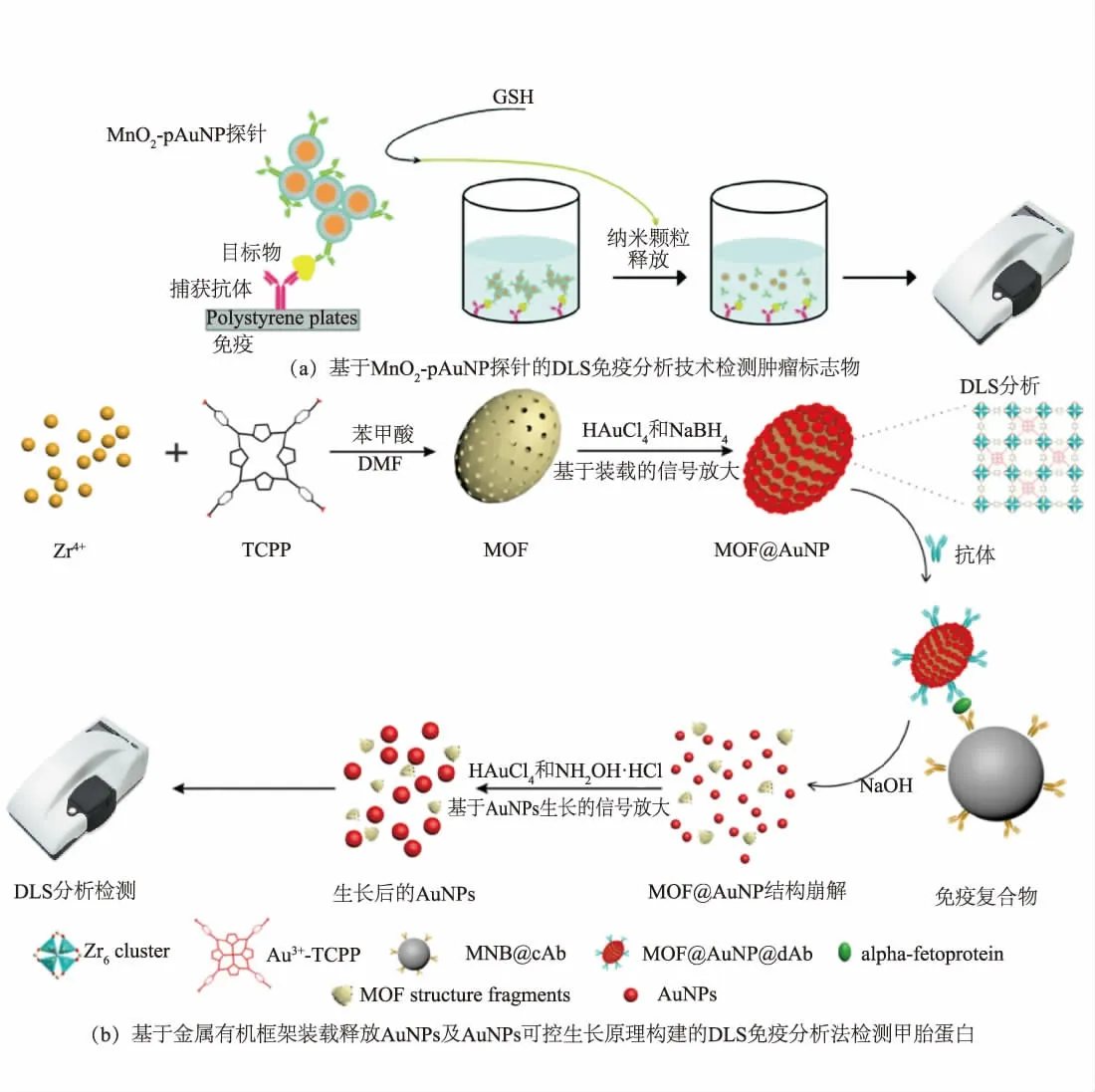
图3 基于免疫标记技术的DLS 传感器Fig. 3 DLS sensors based on immunolabelled technology
1.2 AuNPs 探针对传感器灵敏度的影响
构建AuNP-DLS 传感器的核心在于设计合适的AuNPs 探针, 其对检测灵敏度的影响至关重要。而AuNPs 的形貌、 粒径是影响其光散射能力的关键,AuNPs 探针的浓度是影响其对外界刺激敏感性的关键, 因此探针的形貌、 粒径及使用浓度对AuNP-DLS 传感器的检测性能影响很大。
理论上,AuNPs 探针粒径越大, 其光散射能力越强,检测灵敏度越高。 但是粒径过大的AuNPs 胶体稳定性不足,信号稳定性变差,同时大颗粒与目标物结合时可能会存在位阻效应反而降低其结合率[22]。 Kalluri 等构建了基于AuNPs 聚集的As3+传感器,探究了AuNPs 的粒径对检测灵敏度的影响。 结果表明,LOD 随着AuNPs 粒径的增大而逐渐降低,当粒径为110 nm 时,LOD 低至3 pg/mL[26]。Huang 等报道了基于AuNPs 免疫探针检测单增李斯特菌的均相免洗免疫分析技术[4]。 单增李斯特菌表面存在多个抗原表位,可结合多个AuNPs 探针形成组装结构,使纳米尺寸的AuNPs 探针表观水化粒径达到微米级别,从而使隐身的细菌“显形”。 他们探究了探针粒径对灵敏度的影响。 结果表明,30、70、100 nm的AuNPs 探针对应的最佳工作浓度分别为2.640、0.044、0.022 pmol/L。 大粒径探针光散射能力更强、所需工作浓度更低、检测灵敏度更高。 基于100 nm AuNPs 探针的DLS 传感器LOD 最低, 达0.35 CFU/mL,结合免疫磁分析方法,生菜样品中LOD 为0.22 CFU/g。 多枝状金纳米花 (gold nanoflowers,AuNFs)因有更大的比表面积,而具有更强的光散射能力,且能修饰更多的识别分子从而获得高亲和力的探针,另外其胶体稳定性也更高,所以理论上是更理想的DLS 传感器探针。 Zhan 等以AuNFs 为探针构建了相似的DLS 均相免洗免疫传感器,实现对大肠杆菌O157:H7 的高灵敏检测[10]。 同时也探讨了AuNFs 粒径对检测灵敏度的影响。 结果显示,基于120 nm AuNFs 的DLS 传感器灵敏度最高,其线性范围为6~60 000 CFU/mL,LOD 为2.7 CFU/mL,实现单菌水平检测。 金纳米棒 (gold nanorods,AuNRs)是应用最广的异形AuNPs,通过对其“顶端”或“长边”进行定点修饰,可实现“头对头”或“肩并肩” 的定向自组装。 Wang 等将抗体、 微囊藻毒素LR-卵清蛋白(MC-LR-OVA)修饰的AuNRs 作为自组装探针, 构建了针对微囊藻毒素LR(microcystin LR,MC-LR)的竞争免疫DLS 传感器。 通过将抗体、MC-LR-OVA 定点修饰在AuNRs 的“顶端”或“长边”,分别实现了AuNRs 探针的“头对头”或“肩并肩” 的定向自组装。 目标物MC-LR 的存在会破坏AuNRs 探针的自组装, 从而使AuNRs 组装体的尺寸发生变化。 通过分析组装体尺寸检测目标物,“头对头”或“肩并肩”组装模式的DLS 传感器LOD 分别为5.00、0.45 ng/mL[27]。
理论上,当探针浓度越低时,其对外界刺激(包括目标物)越敏感(受目标物影响而发生聚集等现象的探针占比更高)。 然而,当探针浓度过低时,基质内生物分子的散射信号会成为不可忽视的背景信号,信噪比反而下降。Driskell 等在PR8 型流感病毒A 的AuNP-DLS 免疫分析方法中,探讨了AuNPs浓度对检测灵敏度的影响。 结果表明,在能充分抑制背景信号的基础上,探针浓度越低,检测灵敏度越高[22]。
2 DLS 传感器的食品安全检测应用现状
近年来,农兽药残留、重金属污染、致病微生物污染、超剂量或超范围使用添加剂等食品安全问题严重威胁国人饮食安全和生命健康。 如何高效、便捷地对食品链中有毒有害物质进行检测是保障人民“舌尖上的安全”的关键。 AuNP-DLS 传感器因其简单、快速、成本低廉、高灵敏度、可实现均相免洗检测等优点, 成为优良的食品危害物检测技术平台。 DLS 传感器用于食品安全检测的研究见表1。
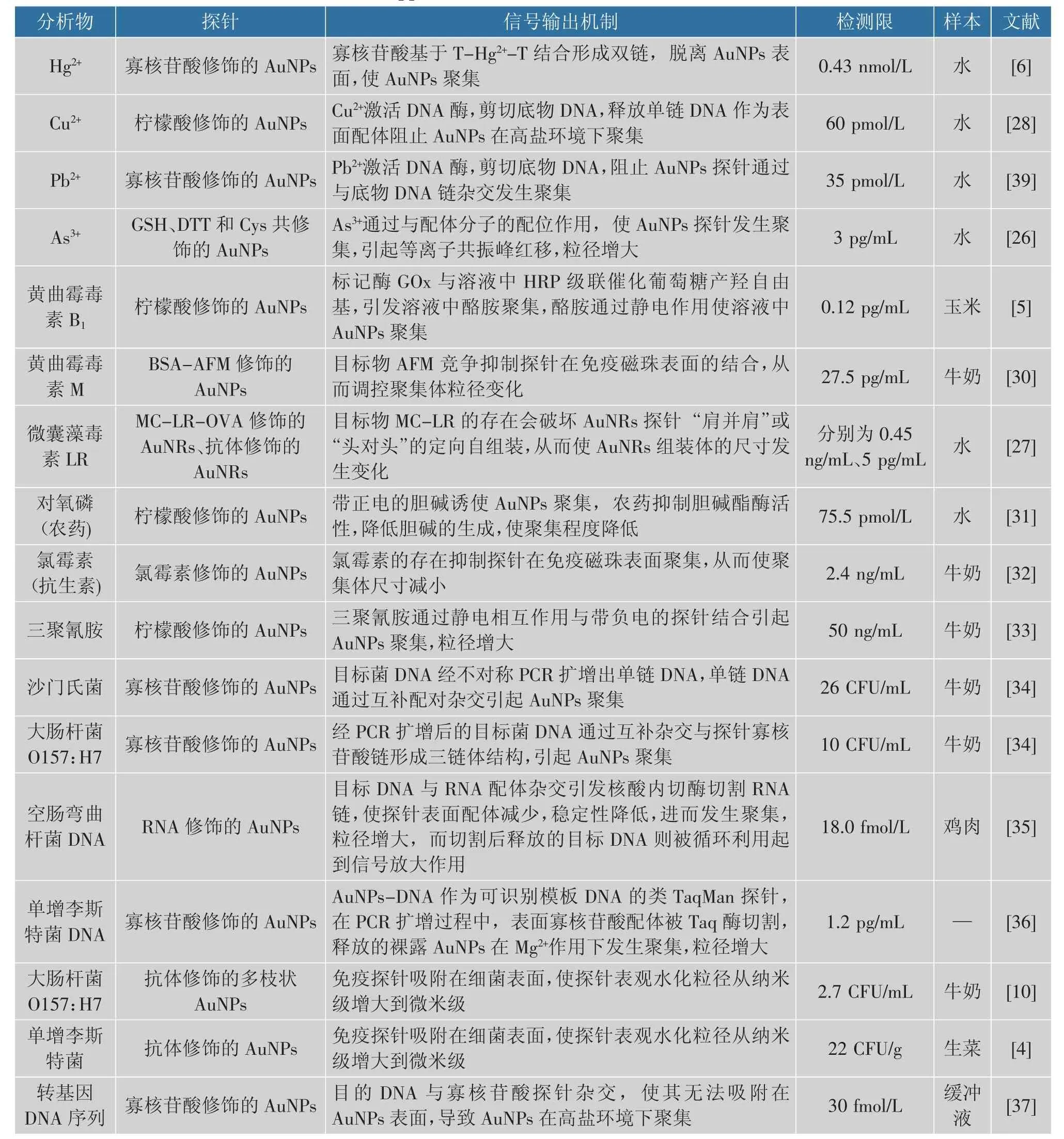
表1 AuNP-DLS 传感器在食品安全检测中的应用研究现状Table 1 Research status of the application of AuNP-DLS sensors for food contamination detection
2.1 检测重金属
重金属污染在我国食品安全问题上占据相当大的比重,其蓄积性、慢性毒性等特点导致其对人体健康影响巨大。 AuNP-DLS 传感器已应用于汞[6]、铜[28]、铅[29]、砷[26]等多种重金属的高灵敏检测。
Miao 等基于Cu2+依赖型DNA 酶和柠檬酸修饰的AuNPs 构建了均相Cu2+传感器[28]。DNA 酶与底物结合成双链结构, 无法吸附在AuNPs 表面, 加入NaCl 后AuNPs 会发生聚集;而加入Cu2+后,活化的DNA 酶切割底物DNA,释放出一段单链DNA 并吸附在AuNPs 表面,可阻止AuNPs 聚集。 根据水化粒径变化值可估算Cu2+浓度, 定量检测范围为0.1~20.0 nmol/L,LOD 为60 pmol/L。 此外,他们利用Pb2+依赖型DNA 酶和寡核苷酸修饰的AuNPs 构建了均相Pb2+传感器[29]。 AuNPs 探针可通过与底物DNA 互补杂交而发生聚集,然而Pb2+存在时,活化的酶催化切断底物DNA,从而阻止AuNPs 聚集。 最低可检测35 pmol/L 的Pb2+。 Kalluri 等以GSH、二硫苏糖醇和半胱氨酸共修饰的AuNPs 为探针构建了读取比色信号和DLS 信号的均相As3+传感器。 As3+与3 种配体均可通过配位作用结合引起AuNPs 聚集,从而导致等离子共振峰(比色信号)和粒径的急剧变化。 结果显示,DLS 检测As3+的灵敏度(3 pg/mL)远高于比色信号灵敏度(1 ng/mL)[26]。
2.2 检测生物毒素
生物毒素是广泛存在的食品污染物,尤其以真菌毒素对粮油及其制品的污染问题最受关注[38]。 以抗体为识别分子、以AuNPs 为信号输出探针的DLS免疫学分析方法可检测0.1~100.0 pg/mL 的毒素,灵敏度较常规ELISA 方法高约2 个数量级[5,27,30]。 如Zhang 等以免疫磁珠为载体,以抗原-牛血清白蛋白(bovine serum albumin,BSA) 复合物修饰的30 nm AuNPs 为信号输出探针,构建竞争DLS 免疫分析方法检测牛奶中的黄曲霉毒素M(aflatoxin M,AFM)。在形成免疫复合物后进行磁分离,通过检测溶液的散射光强度实现对AFM 的快速定量分析,LOD 达27.5 pg/mL[30]。 基于AuNPs 的等离子共振吸收为输出信号的等离子共振ELISA (plasmonic ELISA,pELISA)是近年来比较受欢迎的高灵敏比色分析技术。 Zhan 等以GOx 为酶标记物,构建针对黄曲霉毒素B1(aflatoxin B1,AFB1) 的竞争免疫分析方法[5]。GOx 可与体系中的辣根过氧化物酶(HRP)级联催化葡萄糖产生·OH,引发静电吸附在AuNPs 探针表面的酪胺发生交联反应, 进而导致AuNPs 聚集,通过DLS 分析粒径变化可检测低至0.12 pg/mL 的AFB1。 该方法比竞争pELISA 和常规ELISA 方法的灵敏度分别提高了153 倍和385 倍。
2.3 检测农兽药残留和非法添加物
近年来,我国农兽药残留和非法添加物引起的食品安全事件频发,社会影响极其恶劣[39]。乙酰胆碱酯酶催化乙酰胆碱水解可产生带正电的胆碱,其可使带负电的柠檬酸修饰的AuNPs 发生聚集。 Alami等基于这一原理设计了针对农药对氧磷的DLS 传感器。 对氧磷会抑制体系中乙酰胆碱酯酶活性,阻止乙酰胆碱水解生成胆碱,从而导致AuNPs 聚集程度下降。 该方法的LOD 为75.5 pmol/L,由于灵敏度极高,在检测实际样品时可进行大比例稀释,从而可降低农药残留中基质效应的影响,提高检测准确性[31]。Levin 等利用小分子目标物的竞争反应可抑制纳米颗粒(分别修饰抗体、BSA-抗原复合物)之间的聚集,构建了DLS 快速均相免疫分析方法来检测氯霉素。 并对比了AuNPs、磁珠、聚合物微球等探针的检测性能, 发现AuNPs 体系的检测灵敏度最高,LOD 达2.4 ng/mL, 定量检测范围为5~10 000 ng/mL[32]。Ma 等基于静电作用可诱导柠檬酸修饰的AuNPs 探针聚集, 实现牛奶中三聚氰胺的特异性快速检测,LOD 为50 ng/mL[33]。
2.4 检测致病菌
微生物污染是目前我国乃至全球面临的首要食品安全问题,其中以食源性致病菌最为常见[40]。目前平板培养法是检测食源性致病菌的金标准方法,但其存在耗时长(通常需要24~48 h)、操作烦琐等缺陷,无法实现对致病菌的高效监测。 据研究报道,AuNP-DLS 分析方法能实现致病菌或其DNA 的快速(2~4 h)、高灵敏检测,是潜在的优良筛查技术。
Huang 和Zhan 等分别以抗体修饰的球状AuNPs 和多枝状AuNFs 为免疫探针检测生菜中单增李斯特菌和牛奶中的大肠杆菌O157:H7,分别达到LOD 为10 CFU/g 和单菌检测水平[4,10]。 周宝青将PCR 扩增技术与以扩增DNA 为目标的AuNP-DLS技术结合,检测牛奶中沙门氏菌和大肠杆菌O157:H7,LOD 达10 CFU/mL[34]。 Mcvey 等 以RNA 修 饰 的AuNPs 为探针, 开发一种利用核酸内切酶控制AuNPs 聚集的方法检测致病菌DNA[35]。 AuNPs 表面的RNA 可与目标DNA 特异性杂交形成DNA-RNA异源双链结构, 该结构很容易被RNAse H 酶切,从而释放目标DNA 与另一个RNA 探针杂交,直至所有的RNA 探针被切割, 使暴露在高电解质中的AuNPs 聚集并产生粒径信号变化。 该传感器检测鸡肉中空肠弯曲菌DNA 的LOD 为18 fmol/L,总分析时间不到3 h。
3 展 望
由于AuNPs 易制备和便于修饰的特点,AuNPDLS 传感器构建过程非常简单, 可实现均相分析,也可与多种技术如ELISA[5]和核酸扩增[19-20]结合。 同时, 由于DLS 仪器的高灵敏性和AuNPs 超强的光散射能力,AuNP-DLS 传感器具备简单、快速和灵敏性高等优点,在食品安全、临床诊断和环境监测等生化分析领域具有很好的应用前景。 然而,这项技术在走向实际应用之前还有一些瓶颈问题有待突破。
第一,目前DLS 传感器在食品安全检测中的应用研究仍比较有限,缺乏系统性研究,且目前多是用于水、牛奶等少数几种食品样品基质中的危害物分析,该类技术抗复杂食品基质干扰的能力需得到更多实证。 AuNP-DLS 方法的高灵敏性利于通过样本稀释的方法来降低基质效应对探针的干扰,同时也可以通过结合免疫磁分离等技术减少基质干扰。另外,通过改善AuNPs 表面修饰技术,制备鲁棒性更好的探针至关重要。
第二,现有检测灵敏度仍无法满足一些极端痕量物质的检测需求, 因此检测灵敏度需进一步提高。 目前,DLS 传感器几乎都是以AuNPs (包括球形、多枝状和棒状AuNPs)为信号输出探针。 后续可探究采用光散射能力更强的探针(如银纳米颗粒或包覆银壳层的纳米材料)[41]来提高灵敏度。 同时,多功能探针,如金磁纳米粒子[42]可同时实现信号输出和磁富集功能, 从而构建抗基质干扰能力更强、灵敏度更高的DLS 传感器。
第三,DLS 分析技术目前仅限于实验室使用,无法满足一些现场检测或资源匮乏地区的需求。 因此,开发小型化、便携式DLS 设备非常关键。

