苦荞对发酵豆乳纳豆激酶活力、风味及抗氧化活性的影响
王淼霜, 仝艳军, 蒋雨桥, 杨瑞金*1,
(1. 江南大学 食品科学与资源挖掘全国重点实验室, 江苏 无锡 214122;2. 江南大学 食品学院, 江苏 无锡 214122)
心脑血管疾病(cardiovascular disease,CVD)是造成我国居民死亡的首要病因之一[1]。 从病理上来看, 形成CVD 的主要原因是纤维蛋白在循环系统的累积。 外源性纤维蛋白溶解酶可有效溶解纤维蛋白并改善血流情况,如尿激酶、链激酶、纳豆激酶(nattokinase,NK)等[2]。 其中,NK 是近几十年来的研究热点,与其他纤维蛋白溶解酶相比,NK 不仅具有成本低、疗效好、有效时间长、安全性高的特点,还具有多种CVD 的预防和缓解作用,如抗血栓、抗高血压、抗动脉粥样硬化、降脂和神经保护等[3]。
目前市场上纳豆激酶的主要来源是纳豆、纳豆激酶胶囊、纳豆激酶片剂,但这些产品存在成本高、有异味、吞咽困难等缺点。 关于纳豆的制作分为固态发酵和液态发酵两大类。 相比固态发酵,液态发酵更适用于纳豆激酶的大量工业化生产及提取纯化[4-5]。 发酵豆乳是在液态豆乳中接种纳豆芽孢杆菌,经发酵后获得的营养丰富的发酵豆制品, 但发酵豆乳产品刺鼻的“氨臭味”常常使消费者望而却步。
有研究表明“氨臭味”的主要来源为挥发性盐基氮和含硫化合物[6],纳豆产品的挥发性盐基氮未有国家标准规定,但存在相关文献报道。 郑丹妮利用多菌种复合发酵低“氨臭味”的纳豆,最终产品中挥发性盐基氮质量分数为198.66 mg/hg, 酶活力为341.25 U/g[7]。 为了改善纳豆的“氨臭味”,许多研究人员从发酵底物入手进行创新。 陈乐乐等在以高蛋白质大豆为原料制备纳豆过程中加入超甜玉米,结果发现随着超甜玉米质量分数的提高,纳豆激酶活力呈现先上升后下降的趋势,挥发性盐基氮呈现持续降低的趋势;高蛋白质大豆和超甜玉米质量比为8∶2 时,纳豆的挥发性盐基氮质量分数为32.87 mg/g,纳豆激酶活力达到1 134.76 U/g[8]。 张杰等通过糯米与小黄豆复合发酵获得品质较好的纳豆,结果表明“氨臭味” 显著降低, 挥发性盐基氮质量分数为15.41 mg/hg,纳豆激酶活力为382.32 U/g[9]。 赵谋明等在纳豆菌液态基础培养基中添加不同谷物(糙薏仁、玉米、荞麦、糙米)并采用不同的谷物处理方式探究对纳豆激酶活力的影响,结果表明采用浸泡蒸煮的方式处理谷物并添加糙米可显著促进纳豆菌产纳豆激酶[10]。此外,有文献报道以糙米作为发酵底物,采用纳豆芽孢杆菌发酵,总必需氨基酸和脂肪质量分数增加, 粗蛋白质质量分数减少,2,2-二苯基-1-苦基肼(DPPH)自由基清除能力显著增加[11]。由上述报道可见谷物对纳豆的纳豆激酶活力、挥发性盐基氮质量分数等方面存在积极影响,在纳豆制作方面具有应用价值。
谷物通常具有良好的生物活性[12-16],比如:苦荞具有降血脂、抗氧化、增强人体免疫力的作用;燕麦经枯草芽孢杆菌发酵后可提升其蛋白质含量。 作者以实验室前期研究中筛选出的一株高产纳豆激酶且产“氨臭味”少的纳豆芽孢杆菌JNFE0127 作为发酵菌株。 通过添加不同谷物(苦荞、糙米、薏米、藜麦、燕麦粉)探究纳豆芽孢杆菌JNFE 0127 产纳豆激酶的能力,确定使其产酶量高的谷物种类;然后研究该谷物不同添加量对纳豆芽孢杆菌JNFE 0127发酵豆乳的纳豆激酶活力、风味及抗氧化活性的影响。 该研究提高了液态发酵豆乳制品的酶活力并改善其风味,为产业发展提供理论依据。
1 材料与方法
1.1 材料与试剂
纳豆芽孢杆菌JNFE 0127 (Bacillus natto JNFE 0127,简称为JNFE 0127):作者所在实验室前期筛选并保存;大豆、苦荞、糙米、薏米、藜麦、燕麦:购自京东商城;牛凝血酶(1 000 U/g)、牛纤维蛋白原:沈阳拜英生物技术有限公司产品;2,4,6-三吡啶基三嗪(纯度98%)、2,2-二苯基-1-苦基肼(纯度98%)、5,6-二苯基-3-(2-吡啶基)-1,2,4-三嗪-4,4’-二磺酸单钠盐(纯度97%):北京沃凯生物科技有限公司产品;其余试剂均购自国药集团化学试剂有限公司。
1.2 仪器与设备
LE2002E 型分析天平、FE28 型pH 计:梅特勒-托利多仪器(上海)有限公司产品;LDZX-50KBS 型立式压力蒸汽灭菌器: 上海申安医疗器械厂产品;DRP-9082 型电热恒温培养箱: 上海森信实验仪器有限公司产品;MQD-S3R 型振荡培养箱:上海旻泉仪器有限公司产品;HH-4 型数显恒温水浴锅:常州国华电器有限公司产品;UV-1800PC 型紫外可见分光光度计: 上海美谱达仪器有限公司产品;Super Mini Dancer 桌面型迷你离心机:生工生物工程(上海)股份有限公司产品;高速冷冻离心机:赛默飞世尔科技(上海)有限公司产品;KQ52000DE 型数控超声波清洗机:昆山市超声仪器有限公司产品;破壁机: 九阳股份有限公司产品;4500A 型多功能粉碎机:永昌市展帆工贸有限公司产品;快速气相色谱电子鼻:法国Alpha MOS S.A.有限公司产品。
1.3 培养基的配制
LB 固体培养基:胰蛋白胨质量分数1.0%、酵母提取物质量分数0.5%、氯化钠质量分数1.0%、琼脂质量分数2.0%。
活化培养基:无水葡萄糖质量分数0.5%、大豆蛋白胨质量分数1.0%、氯化钠质量分数0.5%。
基础发酵培养基:酵母粉质量分数0.50%、葡萄糖质量分数1.50%、CaCl2质量分数0.02%、NaCl 质量分数0.20%、MgSO4质量分数0.05%,0.1 mol/L K2HPO4/KH2PO4缓冲液调pH 至7.2。
发酵豆乳培养基:大豆粉质量分数11.1%、水质量分数89.9%。
1.4 方法
1.4.1 种子发酵液的制备 将保藏于-80 ℃甘油管中的JNFE 0127 菌液划线接种到LB 固体培养基上,37 ℃恒温培养10 h; 分别挑取JNFE 0127 单菌落接种于活化培养基中,37 ℃、200 r/min 培养12 h,即为种子发酵液。
1.4.2 样品的制备
1)基础发酵液的制备 取活化的JNFE 0127种子发酵液按照体积分数2%接种于基础发酵培养基中,37 ℃、200 r/min 分别培养24、36、48、60、72、96 h。
2)不同谷物发酵乳的制备 在基础发酵培养基中分别添加苦荞粉、薏米粉、糙米粉、藜麦粉、燕麦粉,添加质量分数分别为1%、3%、6%,装液量50 mL,115 ℃灭菌30 min,冷却后按照体积分数2%接入活化的种子发酵液, 于39 ℃、200 r/min 培养24、36、48、60、72、96 h。
3)不同质量比的发酵豆乳制备 将大豆清洗并浸泡12 h,沥干后加入湿豆质量8 倍的水用破壁机打浆5 min, 再添加体积分数9%的42 型果葡糖浆, 使用高速剪切分散机以10 000 r/min 剪切15 min。采用相同方法处理谷物。将不同质量比的大豆浆和谷物浆(3∶1、2∶1、1∶1、1∶2、1∶3)以及纯豆乳和纯谷物浆装入250 mL 三角瓶中, 装液量100 mL,105 ℃灭菌25 min,冷却后接入体积分数2%的种子发酵液,39 ℃、200 r/min 摇瓶发酵12 h。
1.4.3 NK 活力的测定 参考Astrup 等的方法测定NK 活力[17]。 将灭菌生理盐水置于37 ℃水浴锅中保温, 取0.15 g 纤维蛋白原溶于15 mL 生理盐水,37 ℃水浴溶解10 min, 制成纤维蛋白原溶液。 将100 μL 凝血酶(10 U/mL)溶于400 μL 生理盐水中,制成2 U/mL 的凝血酶溶液。 将1.25 g 琼脂粉加入125 mL 去离子水中,加热至完全溶解。 待琼脂溶液温度降低至55 ℃左右时, 与配好的纤维蛋白原溶液和凝血酶溶液快速混匀并立即倒平板, 每个板25~27 mL。 待完全凝固后打孔。 在纤维蛋白原平板孔内加入10 μL 发酵液,37 ℃静置培养18 h, 用游标卡尺测量透明圈直径。1 min 转化1 μmoL 底物所需酶量为1 个酶活力单位(U)。
1.4.4 pH 及酸度的测定
1)pH 的测定 使用pH 计测定发酵液pH。
2)酸度的测定 配置0.1 mol/L 氢氧化钠溶液并用邻苯二甲酸氢钾(KHP)进行标定,取10 mL 发酵液加20 mL 灭菌水,混匀,用氢氧化钠标准溶液滴定直至终点(pH 8.3)[18]。 记录消耗氢氧化钠标准溶液的体积V1,按公式(1) 计算:
式中:X 为样品的酸度,°T;c 为氢氧化钠标准溶液的浓度,mol/L;V1为滴定所消耗氢氧化钠标准溶液的体积,mL;V2为空白组消耗氢氧化钠标准溶液的体积,mL;m 为样品的质量,g。
1.4.5 挥发性盐基氮的测定 参考GB 5009.228—2016《食品中挥发性盐基氮的测定》[19]。 取10 mL 样品于消化管中,加入75 mL 水,振荡均匀,浸渍30 min。待浸渍结束后,加入1 g 氧化镁,立刻连接到凯氏定氮仪上,设置加碱体积和加水体积均为0,蒸馏时间180 s。 将1 份甲基红乙醇溶液与5 份溴甲酚绿乙醇溶液混合作为指示剂,量取30 mL 硼酸接收液,滴加10 滴混合指示剂,以指示剂颜色的变化来判断终点。 挥发性盐基氮质量浓度的计算见公式(2):
式中:ρ 为样品挥发性盐基氮质量浓度,mg/dL;V1为消耗盐酸的体积,mL;V2为空白组消耗盐酸的体积,mL;c1为盐酸滴定液的浓度,mol/L;V 为样品的体积,mL。
1.4.6 抗氧化活性的测定
1)总抗氧化能力的测定 采用文献[20]的方法, 将0.3 mol/L 醋酸缓冲液 (pH 3.6)、10 mmol/L TPTZ 溶 液、20 mmol/L FeCl3溶液按体 积比10∶1∶1混合得到FRAP 工作液。 取发酵液1 mL,5 000 g 离心10 min,取离心后的上清液100 μL,加入2.4 mL FRAP 工作液, 空白组取去离子水100 μL, 加入2.4 mL FRAP 工作液, 分别混匀后37 ℃水浴10 min,在593 nm 下用分光光度计测吸光度。 依照FeSO4·7H2O 标准曲线计算总抗氧化能力。
2)DPPH 自由基清除能力的测定 参考Ai 等的方法[21]稍加改动。 在1 mL 发酵液中加入4 mL 去离子水混匀,5 000 g 离心10 min, 取上清液500 μL,加入500 μL 0.2 mmol/L DPPH 溶液(用体积分数95%乙醇定容),空白组取100 μL 体积分数95%乙醇,加入500 μL 0.2 mmol/L DPPH 溶液,分别混匀后25 ℃避光水浴30 min,设定检测波长为517 nm。DPPH 自由基清除能力按公式(3)计算:
式中:Y 为样品的DPPH 自由基清除能力,%;As为样品组的吸光度;Ac为空白组的吸光度。
3)亚铁离子螯合能力的测定 参照文献[22]的方法测定亚铁离子螯合能力。 量取10 mL 发酵液,5 000 g 离心10 min, 准确取3 mL 上清液加入50 μL 2 mmol/L FeCl3溶液、200 μL 5 mmol/L 菲洛嗪溶液和750 μL 去离子水,空白组取3.75 mL 去离子水 加 入50 μL 2 mmol/L FeCl3溶 液 和200 μL 5 mmol/L 菲洛嗪溶液,分别混匀后25 ℃孵育30 min,在562 nm 波长下测定吸光度。 亚铁离子螯合能力按公式(4)计算:
式中:Z 为样品的亚铁离子螯合能力,%;A1为样品组的吸光度;A0为空白组的吸光度。
1.4.7 电子鼻测定 取10 mL 发酵液于20 mL 气相样品瓶中,旋紧瓶盖,按大豆含量递减的顺序摆放,重复两次,首尾各放一个空瓶作为空白样,采用HeraclesII 系统进行自动测定,分析软件为该仪器配套软件。
1.4.8 数据处理 利用SPSS 20.0 进行方差分析及ANOVA 差异显著性分析(P<0.05 为差异显著)。 利用Origin 9.0 软件处理数据并绘图。
2 结果与讨论
2.1 谷物对JNFE 0127 发酵产NK 能力及pH 的影响
2.1.1 谷物对JNFE 0127 发酵产NK 能力的影响近年来液态发酵制备NK 产品已经成为趋势。 选择特色的发酵底物,并对发酵条件进行优化可以实现底物的高效利用。 赵谋明等以糙米为底物,通过优化纳豆芽孢杆菌液态发酵条件, 制备具有高NK 活力和富含谷物多酚的发酵产物[23]。 作者选择消费者普遍认可的苦荞、燕麦、藜麦等5 种富含膳食纤维、蛋白质、多酚、矿物质等成分[12-16]的健康谷物作为添加物展开研究。 如图1 所示,将JNFE 0127 在不添加谷物的基础发酵培养基中发酵,48 h 时产酶量最高,可达到6 000 U/mL 以上。 在基础发酵培养基中添加不同谷物后,产酶量显著提高。 值得注意的是,在发酵时间和谷物添加质量分数一致的条件下,不同谷物对JNFE 0127 发酵产NK 能力的影响不同。用同一种谷物进行发酵时,添加质量分数影响产酶量的大小, 添加质量分数为3%时, 产酶量普遍更高。 添加质量分数3%的苦荞粉发酵96 h 时,其产酶量为23 326.23 U/mL,与基础发酵培养基相比提高301.96%。 目前文献报道的纳豆芽孢杆菌产酶量为300~15 000 U/mL[24-27]。 比如,王艳平等利用纳豆芽孢杆菌固态发酵花生粕制备NK, 经正交优化后产酶量为3 162 U/mL[28]。 根据以上信息可以说明添加苦荞粉可以明显提升产酶能力。 此外,当谷物添加质量分数一定时,随着发酵时间的延长,产酶量显示出达到峰值后回落的变化规律。 因此发酵时间是产酶能力的重要影响因素。 在发酵过程中,应及时终止发酵预防酶回落现象,刘文涛等也发现了该现象[29]。
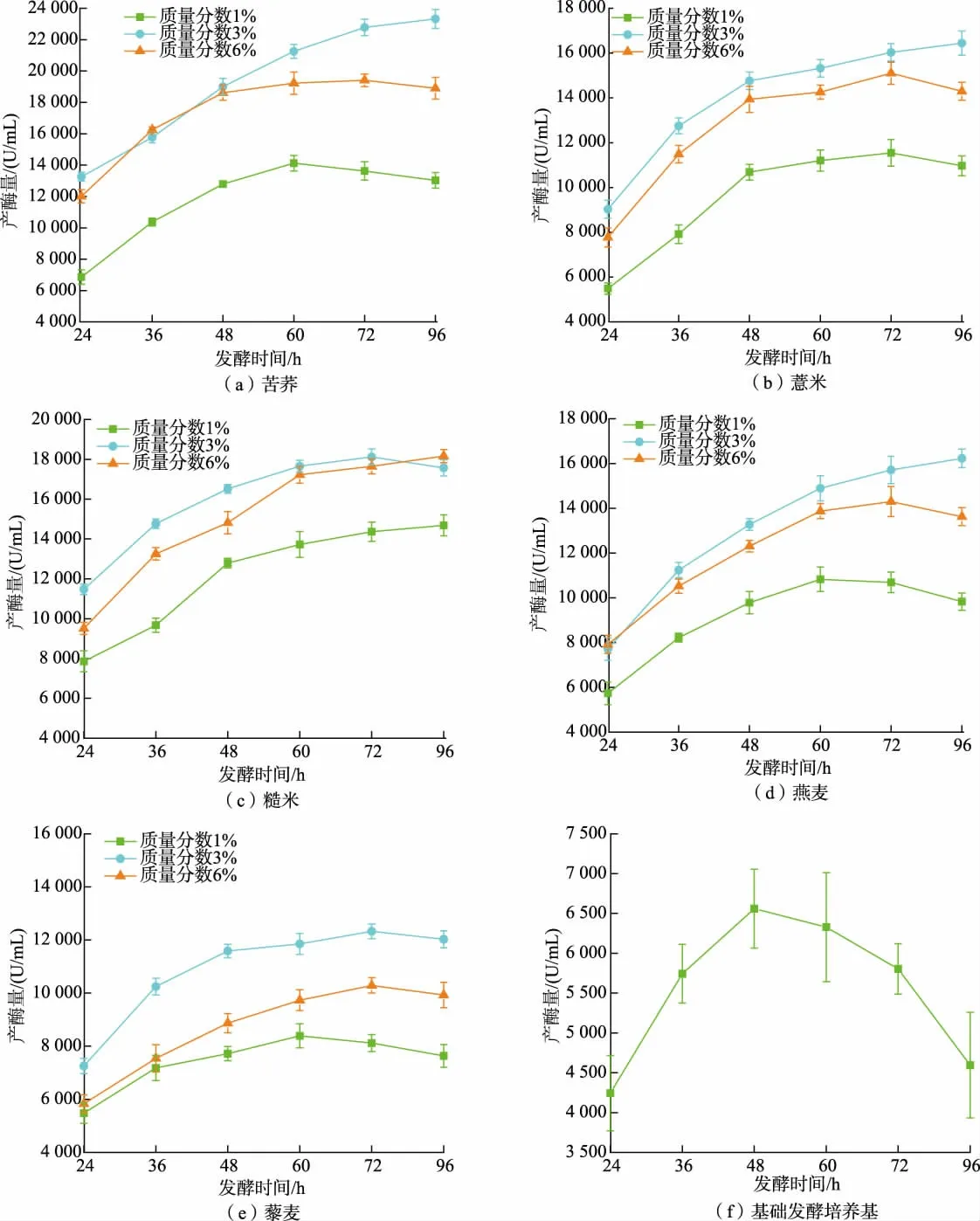
图1 谷物对JNFE 0127 发酵产NK 的影响Fig. 1 Effect of grains on NK production by fermentation of JNFE 0127
2.1.2 谷物对JNFE 0127 发酵过程pH 的影响pH是评价微生物生长过程的一项重要指标。 依据pH可以了解菌株的生长周期、对培养基的适应能力以及NK 的稳定性等情况。 由图2 可知, 在发酵过程中, 发酵体系的pH 呈现先减小后增加的趋势,在24~60 h 发酵阶段,pH 基本逐渐降低, 在发酵60 h时pH 为5.6 左右; 发酵60~96 h, 体系pH 逐渐升高, 在96 h 发酵结束后, 体系pH 基本均在6.0 以上。 当JNFE 0127 处于对数生长期时,快速消耗培养基中的碳源和氮源等营养物质,同时会分泌酸性代谢产物,如奎尼酸、琥珀酸等[30],使pH 逐渐降低;在进入稳定期后,培养基中可供直接利用的碳源被逐步消耗完毕,JNFE 0127 会将有机酸作为碳源,氮源中的碳元素也会被利用,并以氨的形式释放氮元素,导致培养基pH 升高;进入衰亡期后,由于菌体自溶的原因,培养基的pH 会进一步升高。此处培养基pH 的变化规律与上述JNFE 0127 的生长周期一致。

图2 谷物对JNFE 0127 发酵中pH 的影响Fig. 2 Effect of grains on pH in JNFE 0127 fermentation
2.2 大豆和苦荞质量比对发酵豆乳NK 活力的影响
大豆与苦荞按不同质量比复配后进行发酵,NK活力的结果见图3。随着苦荞添加量的增加,发酵液中的酶活力出现峰值。 当大豆与苦荞质量比为2∶1时,发酵液中NK 活力最高,可达到4 460.28 U/mL;与纯大豆发酵液相比,酶活力提高了61.42%。 由此得出,复配谷物有利于提高发酵豆乳酶活力,与其他研究者的结论一致[16]。 然而随着苦荞添加量继续增加,发酵体系中酶活力逐渐降低,在纯苦荞发酵体系中NK 活力只有2 018.10 U/mL。根据前人的研究可知,苦荞本身含有单宁和芦丁成分[31],单宁和芦丁具有一定的抗菌性, 可抑制纳豆芽孢杆菌的生长,进而使产酶量降低[32]。 此外,酸性环境以及缺乏某些生长补充剂也会限制其生长速度[33]。
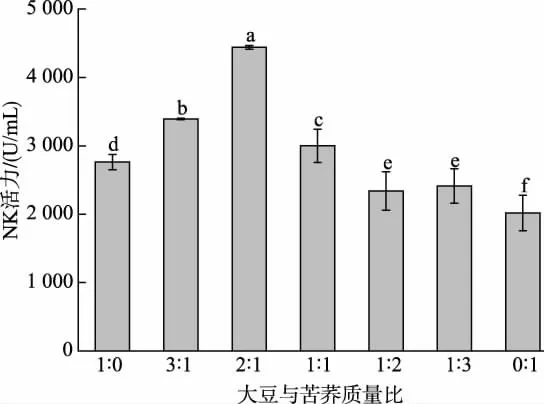
图3 谷物质量比对发酵豆乳酶活力的影响Fig. 3 Effects of grain mass ratios on enzyme activity of fermented soybean milk
2.3 大豆和苦荞质量比对发酵豆乳pH 及酸度的影响
由于发酵体系中氮源含量的不同以及JNFE 0127 生长状态的差异,发酵前后的pH 和酸度也会有所差异。如图4(a)所示,发酵前各体系的pH 无差异, 均为6.5~6.6, 发酵后各体系的pH 降至5.6 左右,并且随着苦荞添加量的增加,发酵后体系的pH呈现下降的趋势, 纯大豆和纯苦荞体系发酵后pH分别为5.74 和5.52。 另外,由图4(b)可知,纯苦荞发酵液的酸度最大(25.3 °T),与纯大豆的酸度相比较,提高了27.78%。 一方面,苦荞含有较多氨基酸类、多酚类等酸性物质,会使酸度升高[34];另一方面,在发酵过程中微生物产生的酶(纤维素酶、蛋白酶等)能打破多酚和其他取代基之间的联系以释放可溶性及游离性酚类化合物,也会使发酵液酸度升高[35]。
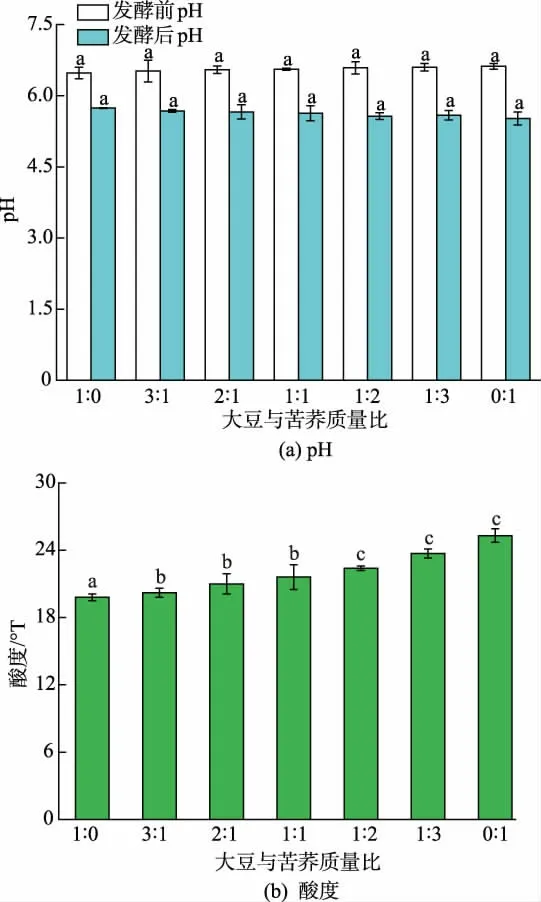
图4 谷物质量比对发酵豆乳pH 及酸度的影响Fig. 4 Effects of grain mass ratios on pH and acidity of fermented soybean milk
2.4 大豆和苦荞质量比对发酵豆乳风味物质的影响
2.4.1 大豆和苦荞质量比对发酵豆乳挥发性盐基氮质量浓度的影响 挥发性盐基氮包含氨类、甲胺、二甲胺、三甲胺等化合物,通常是判断纳豆芽孢杆菌发酵豆乳不良风味的一项重要指标。 在JNFE 0127 发酵过程中,产生的蛋白酶或微生物分解体系含有的蛋白质及发酵过程中产生的游离氨基酸,会释放挥发性氨类物质,产生不良气味[36-37]。 结果如图5 所示, 发酵液中挥发性盐基氮质量浓度随苦荞添加量增加先降低后稳定。 在大豆与苦荞质量比为1∶3 时,发酵体系中挥发性盐基氮质量浓度最低,为2.63 mg/dL, 与纯大豆发酵体系相比, 降低了39.12%;另外,大豆与苦荞质量比为2∶1 的复配体系中,挥发性盐基氮质量浓度为3.45 mg/dL,相比纯大豆发酵降低了20.14%。 这与董岳峰的研究结果类似[12],其研究表明苦荞中淀粉糖含量较高,在纳豆芽孢杆菌发酵过程中添加苦荞,可以提高复配发酵体系中的碳氮比,从而减少游离氨形成,改善风味[12]。
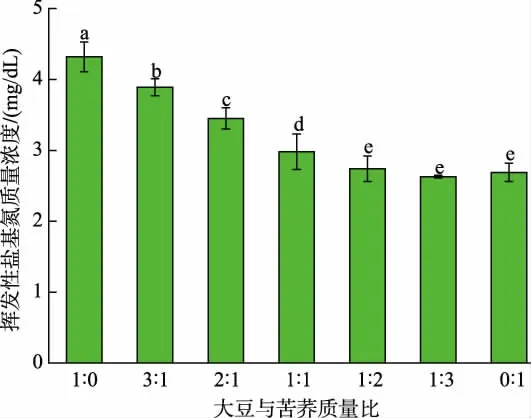
图5 谷物质量比对发酵豆乳挥发性盐基氮质量浓度的影响Fig. 5 Effects of grain mass ratios on volatile base nitrogen mass concentration in fermented soybean milk
2.4.2 发酵豆乳的电子鼻分析结果 纳豆芽孢杆菌发酵的不良风味主要来自大豆本身的豆腥味和其发酵过程中产生的挥发性盐基氮、生物胺等不良风味物质,电子鼻可以快捷地测定其不良风味的主要来源,有助于进行针对性改良。 结果如图6 所示,大豆与苦荞不同复配发酵体系的电子鼻测定数据主要有4 个峰位, 保留时间-色谱柱号分别为16.54-1、50.67-1、19.99-2、61.02-2。 经过Alphasoft软件分析,16.54-1、19.99-2 对应氨氮类化合物,是发酵豆乳中不良风味的主要来源;50.67-1、61.02-2对应己醛等豆腥味的主要来源物质。 随着苦荞添加量的增加,4 种主要物质的峰面积逐渐降低,即含量逐渐降低。 该结果表明大豆与苦荞复配可以有效改善发酵豆乳的不良风味,与上述测定的挥发性盐基氮结果一致。
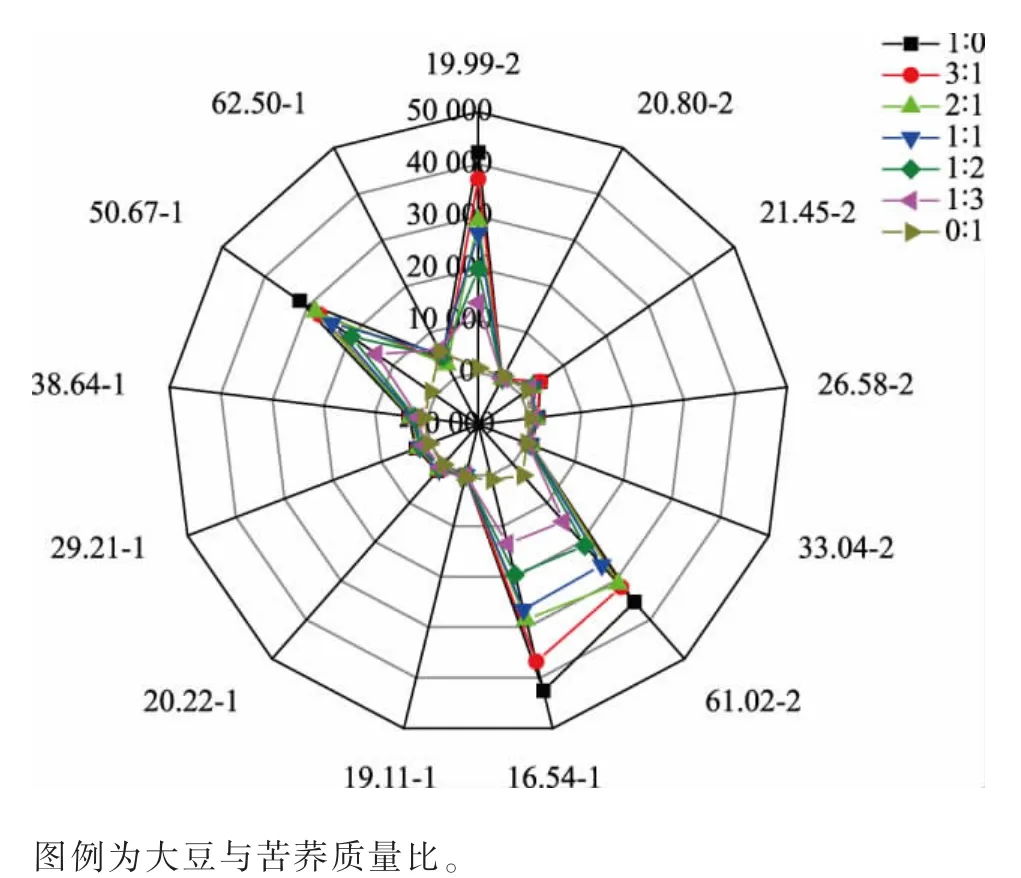
图6 不同复配发酵体系所产豆乳的电子鼻分析Fig. 6 Electronic nose analysis of fermented soybean milk with different compound fermentation system
2.4.3 发酵豆乳的主成分分析结果 由图7 可知,主成分1 和主成分2 累积贡献率高达99.690%。 另外,如果两样品之间的距离越近,表示其整体的气味信息越接近,差异越小,反之则越大。 各组在PCA分布图中空间相对独立,可以很好地区分不同复配发酵体系,也进一步说明不同发酵体系中风味特征存在差异。 其中,纯大豆发酵体系和大豆与苦荞质量比1∶3 的复配发酵体系风味信息较为相近, 大豆与苦荞质量比为2∶1 和3∶1 的复配发酵体系风味信息较为相近,纯苦荞发酵体系与其他发酵体系整体风味信息差异较大。 此外,沿PC1 轴自左向右分布的样品中,苦荞添加量依次增加。 结合电子鼻及挥发性盐基氮测定结果可知,第一主成分为可接受的风味,第二主成分为异味。
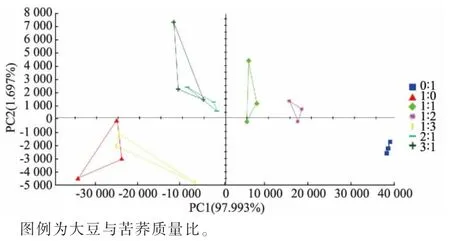
图7 不同组别发酵豆乳的信号强度主成分分析Fig. 7 Principal component analysis of signal strength of fermented soybean milk in different groups
2.5 大豆和苦荞质量比对发酵豆乳抗氧化活性的影响
通过测定发酵液总抗氧化能力、DPPH 自由基清除能力以及亚铁离子螯合能力来评价不同组的抗氧化水平。 结果如表1 所示,大豆与苦荞质量比为2∶1 时,发酵豆乳的总抗氧化能力(16.34 mmol/L)、DPPH 自由基清除能力(93.02%)以及亚铁离子螯合能力(56.43%)均显著高于纯大豆及纯苦荞发酵体系, 与纯大豆发酵体系相比分别提高96.39%、14.51%、34.17%。苦荞中含有大量的酚类物质,随着发酵体系中苦荞的增加,酚类物质含量增加[38]。 Liu等发现结合酚不能被人体内的酶系统直接消化,经过微生物发酵后可发挥更高的生物活性[39]。 Caizhi等进一步研究表明酚类物质是植物性食品中的主要抗氧化剂,主要以与纤维素、胺和脂质部分结合的共轭形式存在[40];发酵过程能够将共轭酚类化合物转化为游离形式,从而增强抗氧化活性[29]。
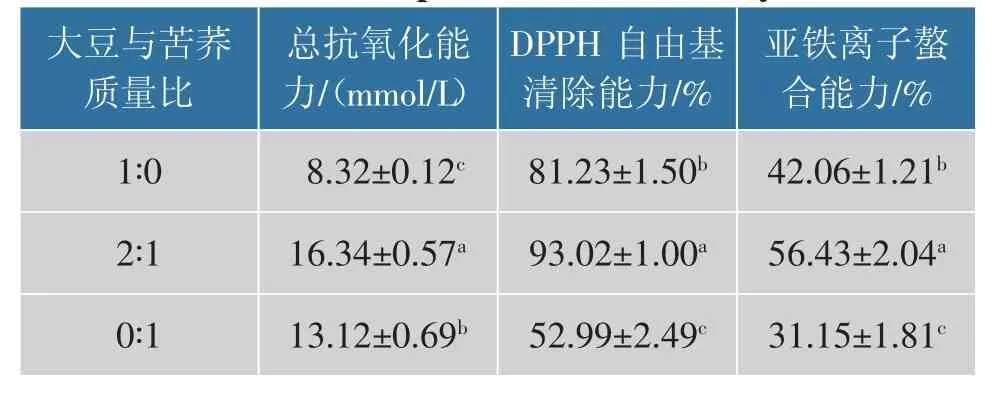
表1 不同复配发酵体系所得豆乳的抗氧化活性Table 1 Antioxidant properties of soybean milk with different compound fermentation system
3 结 语
通过添加苦荞、糙米、薏米、藜麦、燕麦粉可明显提高JNFE 0127 液体发酵的产酶能力,其中苦荞效果最好,当添加质量分数为3%时,产酶量由原来的5 803.12 U/mL 提高到23 326.23 U/mL。 在发酵豆乳制备中,随着苦荞添加量的增加,酶活力出现峰值,挥发性盐基氮质量浓度呈现先降低后维持稳定的趋势, 抗氧化活性呈现先升高再降低的趋势。当大豆与苦荞质量比为2∶1 时, 挥发性盐基氮质量浓度可降低到3.45 mg/dL, 比纯大豆发酵得到的发酵豆乳降低20.14%; 总抗氧化能力、DPPH 自由基清除能力以及亚铁离子螯合能力分别提高到16.34 mmol/L、93.02%和56.43%, 也均高于纯大豆发酵得到的发酵豆乳。 该研究在确保NK 活力足够的条件下,为开发产品风味更易被消费者接受、食用更方便的纳豆食品提供借鉴。

