ART调节PI3K/AKT通路对肝癌细胞增殖及迁移的影响
张雄,周江,李涛,郝琪伟,李胜,杨刚,李腾,李建雄,乔培宇,张鑫
榆林市第二医院普通外科二病区,陕西 榆林 719000
肝癌是临床常见的消化道恶性肿瘤,起病较为隐匿,发病初期无明显症状,多数患者在确诊时已达到中、晚期或发生远端转移,预后较差[1-2]。寻找高效低毒的抗肝癌药物对于肝癌患者的临床治疗及预后具有重要意义。青蒿琥酯(artesunate,ART)是青蒿素的衍生物,具有特异的抗疟效果,在治疗重症以及耐药性疟疾上效果显著[3]。相关研究发现,ART除了具有特异的抗疟作用以外,还具有调节免疫力、抗肿瘤等其他生物学特性[4]。目前,有较多文献报道,ART对于多种肿瘤细胞具有生长抑制作用,其作用机制与诱导细胞凋亡、阻滞细胞周期有关[5]。磷脂酞肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路在肝癌、乳腺癌等多种恶性肿瘤进展中发挥关键作用,主要参与了肿瘤细胞的增殖、分化和凋亡等过程[6]。本研究探讨了ART对PI3K/AKT信号通路以及对肝癌细胞增殖及迁移的影响,现报道如下:
1 材料与方法
1.1 主要试剂及仪器 本研究的主要试剂和仪器见表1。
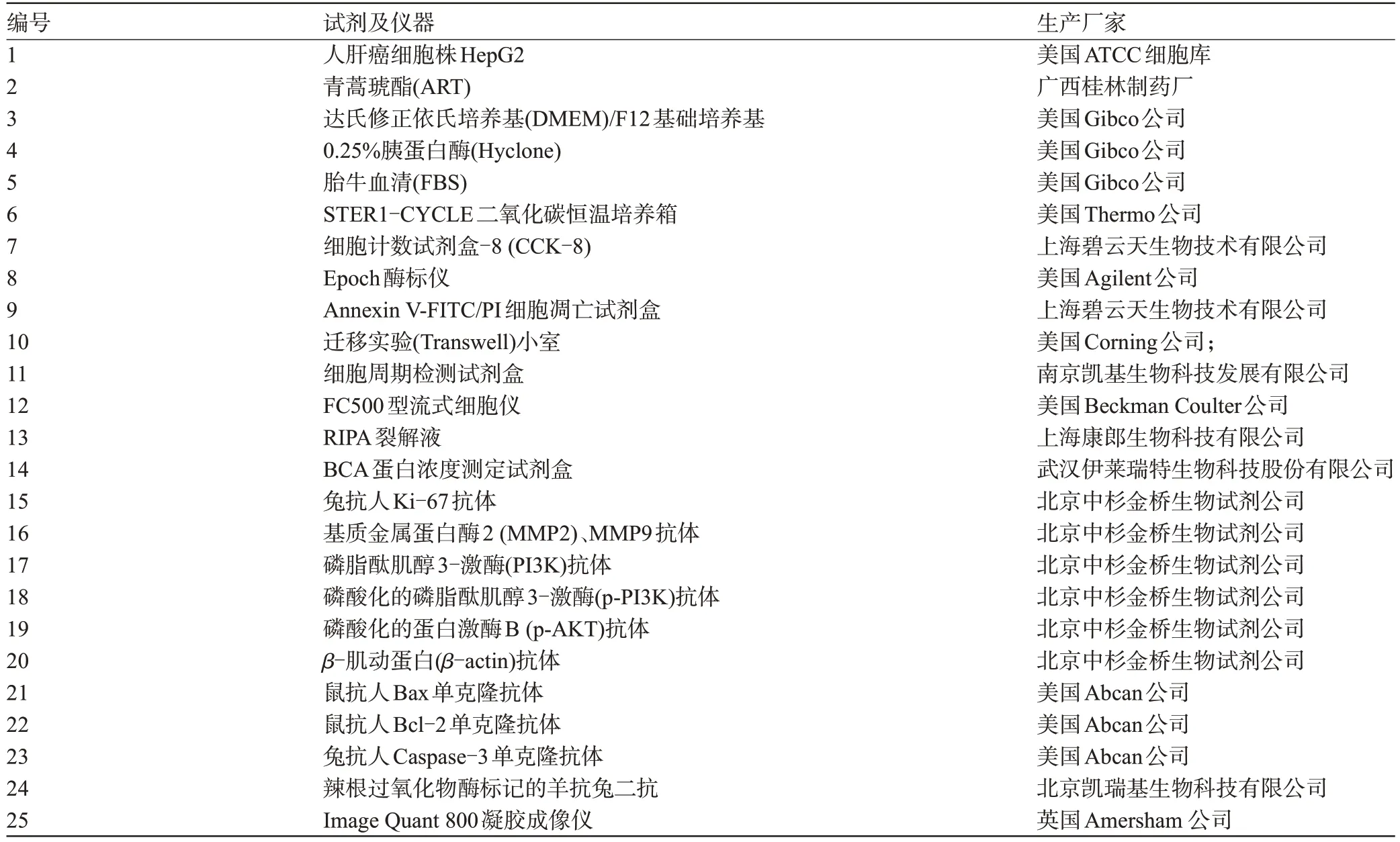
表1 主要试剂及仪器明细Table 1 Details of main reagents and instruments
1.2 方法
1.2.1 HepG2 细胞培养 在10%胎牛血清(FBS)的DMEM/F12 培养基中接种HepG2 细胞后放置在二氧化碳恒温培养箱中(二氧化碳含量为5%,温度37℃,湿度97%)培养。随后每隔1 d 更换液体,当细胞生长融合时,按照1∶2 传代培养。采用含0.05%乙二胺四乙酸(EDTA)的0.25%胰蛋白酶消化,收集对数生长期细胞进行后续实验。青蒿琥酯采用二甲基亚砜(DMSO)溶解,加水稀释到10 mg/mL 作为储存液,避光储存到-20℃的冰箱中,实验时采用DMEM/F12 培养基稀释到目标浓度。
1.2.2 分组方法 将HepG2 细胞培养至对数生长期,采用0.25%胰蛋白酶消化后,离心去上清液。采用10%FBS的DMEM/F12培养基配置细胞悬液,细胞浓度调整至2.5×104个/mL,每孔加入200 μL 接种至96 孔板中放置在培养箱中过夜培养(二氧化碳含量为5%,温度37℃,湿度97%),分别加入200 μL 含有30 μg/mL、60 μg/mL和120 μg/mL的ART,每种浓度各加20孔,分别作为30 μg/mL组、60 μg/mL组、120 μg/mL组,另取20孔加入等量的培养液作为对照组。
1.2.3 CCK-8检测细胞增殖 将四组细胞放入培养箱中,培养24 h后弃去培养基,加入90 μL细胞培养液和10 μL CCK-8试剂,放置在恒温培养箱中孵育2 h后,采用酶标仪450 nm 处的光密度(OD)值,计算各组的HepG2细胞增殖率,增殖率=(处理组OD值/对照组OD值)×100%。实验重复三次,取平均值作为最终结果。
1.2.4 流式细胞仪检测细胞凋亡 选取对数生长期的肝癌HepG2 细胞,采用10%FBS 的DMEM/F12培养基配置细胞悬液,细胞浓度调整至2.5×104个/mL,每孔1.0 mL 接种于96 孔板中,培养24 h 后吸去培养液,加入200 μL 含有30 μg/mL、60 μg/mL 和120 μg/mL 的ART,每种浓度各加20 孔,另取20 孔加入等量的培养液作为对照组,将四组细胞放入培养箱中培养48 h后,采用0.25%胰蛋白酶消化后,离心收集细胞,采用PBS清洗两次,300目尼龙网滤除细胞团块后,调整细胞浓度≥1×106个/mL,按照Annexin V-FITC/PI 试剂盒说明书,加入10 μL Annexin V-FITC,避光孵育10 min后再加入5 μL PI,避光孵育10 min 后,采用流式细胞仪检测各组HepG2细胞的凋亡率。实验重复三次,取平均值作为最终结果。
1.2.5 Transwell 法检测细胞迁移和侵袭 选取对数生长期的肝癌HepG2 细胞,采用10%FBS 的DMEM/F12 培养基配置细胞悬液,细胞浓度调整至2.5×104个/mL。迁移实验:上、下室分别加入100 μL细胞悬液、500 μL含FBS的培养基。细胞悬液分别加入200 μL 含有30 μg/mL、60 μg/mL 和120 μg/mL 的ART以及等量的培养液进行培养,培养24 h 后弃去培养基。取出小室后采用4%多聚甲醛固定30 min,0.4%结晶紫染色15 min,倒置显微镜进行观察,随机选取20 个视野,拍照并计数。侵袭实验:Transwell 上室铺Matrigel基质胶,自然晾干后加入100 μL细胞悬液,其余步骤同迁移实验。
1.2.6 Western blot 法检测细胞中相关蛋白的表达 各组细胞培养72 h后弃去培养基,收集细胞,PBS洗涤2 次后去除液体,加入RIPA 裂解液后4℃环境下裂解细胞30 min;提取各组细胞蛋白,BCA 法测得领蛋白含量后进行定量,之后将蛋白质溶液与等量上样缓冲液混合,10%SDS-PAGE电泳后转移至NC膜上,在脱脂奶粉溶液中(稀释比例为5%,温度37℃)封闭放置3 h;分别加入一抗后放置在4℃下孵育过夜,TBS漂洗后加入辣根过氧化物酶标记的羊抗兔二抗,37℃下孵育1 h,TBS 漂洗3 次;滴加化学放光液后在室温环境下孵育3 min,去除化学放光液后将NC膜放入凝胶成像系统进行成像,检测各蛋白条带的积分光密度(IOD)值,重复三次取平均值作为最终结果。
1.3 统计学方法 应用SPSS18.0 统计软件对本研究中各项数据资料进行统计学分析。计量资料符合正态分布,以均数±标准差()表示,两组间数据比较采用独立样本t检验,多组间数据比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度ART对肝癌HepG2细胞增殖的影响 与对照组比较,不同浓度ART作用于HepG2细胞后,细胞增殖率和Ki-67蛋白表达均明显降低,ART浓度越高,细胞增殖率和Ki-67蛋白表达越低,差异均有统计学意义(P<0.05),见表2和图1。
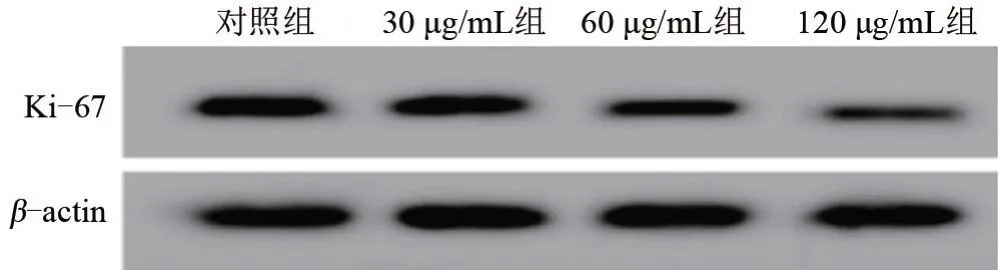
图1 Western Blot 检测不同浓度ART对Ki-67蛋白表达Figure 1 Expression of Ki-67 protein in the four groups by western blot
表2 各组肝癌HepG2细胞的增殖率及Ki-67蛋白表达水平比较()Table 2 Comparison of proliferation rate and Ki-67 protein expression of HepG2 cells among the four groups()
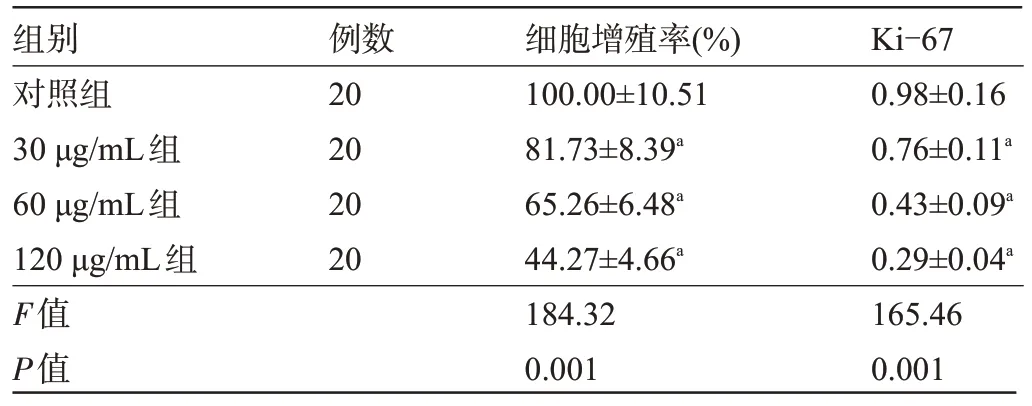
表2 各组肝癌HepG2细胞的增殖率及Ki-67蛋白表达水平比较()Table 2 Comparison of proliferation rate and Ki-67 protein expression of HepG2 cells among the four groups()
注:与对照组比较,aP<0.05。Note:Compared with that in the control group,aP<0.05.
组别对照组30 μg/mL组60 μg/mL组120 μg/mL组F值P值Ki-67 0.98±0.16 0.76±0.11a 0.43±0.09a 0.29±0.04a 165.46 0.001例数20 20 20 20细胞增殖率(%)100.00±10.51 81.73±8.39a 65.26±6.48a 44.27±4.66a 184.32 0.001
2.2 不同浓度ART对肝癌HepG2细胞凋亡的影响 与对照组比较,不同浓度ART作用于HepG2细胞后,细胞凋亡率、Bax和Caspase-3蛋白表达明显升高,Bcl-2表达明显降低;ART浓度越高,细胞凋亡率、Bax和Caspase-3 蛋白表达越高,Bcl-2 表达越低,差异均有统计学意义(P<0.05),见表3和图2。
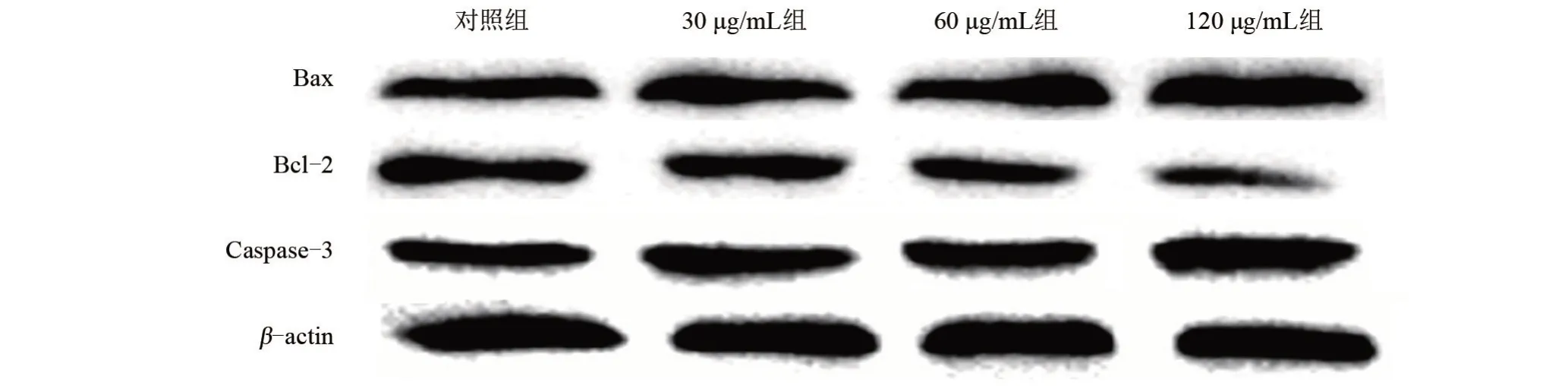
图2 Western Blot 检测不同浓度ART对Bax、Bcl-2、Caspase-3蛋白表达Figure 2 Expression of Bax,Bcl-2,and Caspase-3 proteins in the four groups by western blot
表3 各组肝癌HepG2细胞的凋亡率及Bax、Bcl-2、Caspase-3蛋白表达比较()Table 3 Comparison of apoptosis rate and expression of Bax, Bcl-2,and Caspase-3 proteins in HepG2 cells among the four groups()
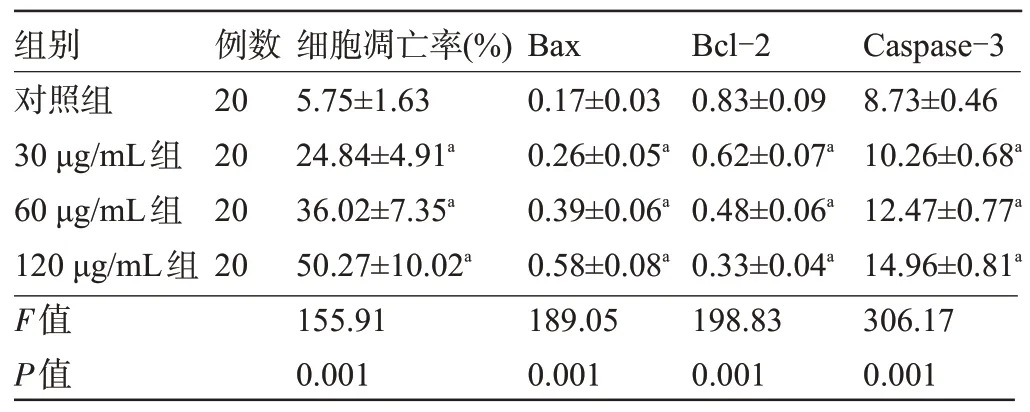
表3 各组肝癌HepG2细胞的凋亡率及Bax、Bcl-2、Caspase-3蛋白表达比较()Table 3 Comparison of apoptosis rate and expression of Bax, Bcl-2,and Caspase-3 proteins in HepG2 cells among the four groups()
注:与对照组比较,aP<0.05。Note:Compared with that in the control group,aP<0.05.
组别对照组30 μg/mL组60 μg/mL组120 μg/mL组F值P值Caspase-3 8.73±0.46 10.26±0.68a 12.47±0.77a 14.96±0.81a 306.17 0.001例数20 20 20 20细胞凋亡率(%)5.75±1.63 24.84±4.91a 36.02±7.35a 50.27±10.02a 155.91 0.001 Bax 0.17±0.03 0.26±0.05a 0.39±0.06a 0.58±0.08a 189.05 0.001 Bcl-2 0.83±0.09 0.62±0.07a 0.48±0.06a 0.33±0.04a 198.83 0.001
2.3 不同浓度ART 对肝癌HepG2 细胞迁移、侵袭的影响 与对照组比较,不同浓度ART 作用于HepG2 细胞后,细胞迁移数量、侵袭数量和MMP2、MMP9 蛋白表达明显降低;ART 浓度越高,细胞迁移数量、侵袭数量和MMP2、MMP9 蛋白表达越低,差异均有统计学意义(P<0.05),见表4和图3。
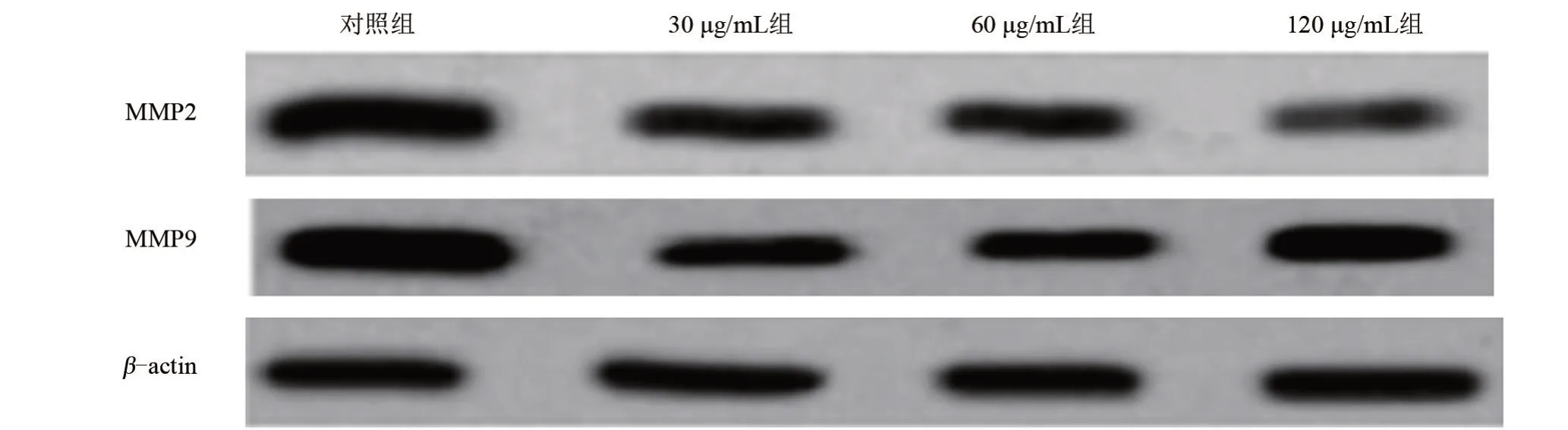
图3 Western Blot 检测不同浓度ART对MMP2、MMP9蛋白表达Figure 3 Expression of MMP2 and MMP9 protein in the four groups by western blot
表4 各组肝癌HepG2细胞的细胞迁移、侵袭数量以及MMP2、MMP9 蛋白表达()Table 4 Cell migration,invasion number,and MMP2,MMP9 protein expression of HepG2 cells in the four groups()
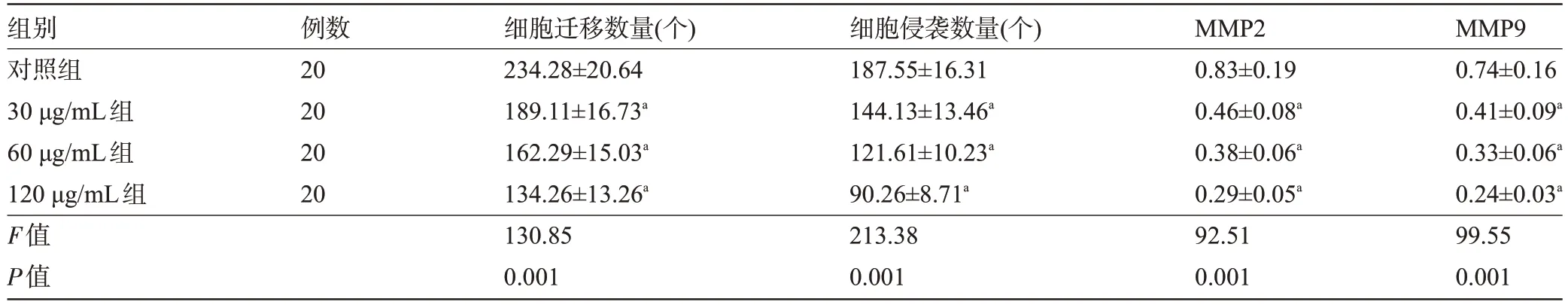
表4 各组肝癌HepG2细胞的细胞迁移、侵袭数量以及MMP2、MMP9 蛋白表达()Table 4 Cell migration,invasion number,and MMP2,MMP9 protein expression of HepG2 cells in the four groups()
注:与对照组比较,aP<0.05。Note:Compared with that in the control group,aP<0.05.
组别对照组30 μg/mL组60 μg/mL组120 μg/mL组F值P值例数20 20 20 20细胞迁移数量(个)234.28±20.64 189.11±16.73a 162.29±15.03a 134.26±13.26a 130.85 0.001细胞侵袭数量(个)187.55±16.31 144.13±13.46a 121.61±10.23a 90.26±8.71a 213.38 0.001 MMP2 0.83±0.19 0.46±0.08a 0.38±0.06a 0.29±0.05a 92.51 0.001 MMP9 0.74±0.16 0.41±0.09a 0.33±0.06a 0.24±0.03a 99.55 0.001
2.4 各组细胞中PI3K/AKT通路相关蛋白的表达水平比较 与对照组比较,不同浓度ART 作用于HepG2 细胞后,PI3K、p-P13K 和p-AKT 蛋白表达明显降低;ART 浓度越高,PI3K、p-P13K 和p-AKT 蛋白表达越低,差异均有统计学意义(P<0.05),见表5 和图4。

图4 Western Blot 检测不同浓度ART对PI3K、p-P13K、p-AKT蛋白表达Figure 4 Expression of PI3K,p-P13K,and p-AKT proteins in the four groups by western blot
表5 各组细胞中PI3K/AKT通路相关蛋白的表达水平比较()Table 5 Comparison of expression levels of PI3K/AKT pathway-related proteins in cells among the four groups()
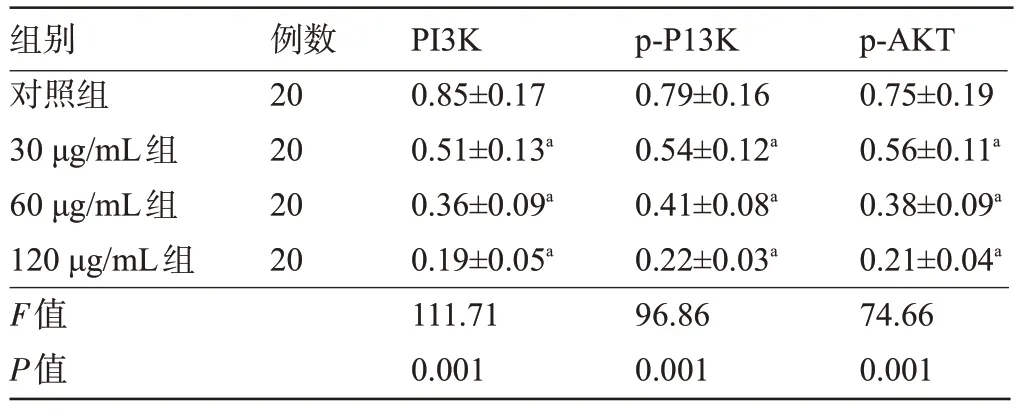
表5 各组细胞中PI3K/AKT通路相关蛋白的表达水平比较()Table 5 Comparison of expression levels of PI3K/AKT pathway-related proteins in cells among the four groups()
注:与对照组比较,aP<0.05。Note:Compared with that in the control group,aP<0.05.
组别对照组30 μg/mL组60 μg/mL组120 μg/mL组F值P值p-AKT 0.75±0.19 0.56±0.11a 0.38±0.09a 0.21±0.04a 74.66 0.001例数20 20 20 20 PI3K 0.85±0.17 0.51±0.13a 0.36±0.09a 0.19±0.05a 111.71 0.001 p-P13K 0.79±0.16 0.54±0.12a 0.41±0.08a 0.22±0.03a 96.86 0.001
3 讨论
手术切除和肝移植是目前治疗肝癌的最佳方案,但介于多数患者在确诊时已处于中晚期,手术切除和肝移植并不适用;而介入治疗操作难度较大,极易造成误栓、分流、微转移等情况发生;放疗、化疗对正常肝脏细胞损伤较大,且化疗常因肿瘤耐药性而导致疗效效果欠佳[7]。因此,寻求安全有效的肝癌治疗方法对于其临床治疗及预后具有重要意义。
中草药在治疗肿瘤上具有低毒副作用、价格低廉等特点。大量研究结果发现,多种中草药对于肿瘤生长具有抑制作用[8-9]。ART是治疗疟疾的经典药物,在治疗重症疟疾以及耐药性疟疾上具有较好的治疗效果。进一步研究结果显示,ART除了具有较好的抗疟作用以外,还具有较好的抗肿瘤活性[10-11],对多种肿瘤的生长具有明显抑制作用。尤杨等[12]研究表明,ART具有抑制肺腺癌A549 细胞生长的作用,其机制与诱导肿瘤细胞凋亡、调控肿瘤细胞周期有关。
肿瘤细胞的异常增殖和凋亡受阻是肿瘤发生的最重要机制,其中细胞凋亡在维持机体正常生命活动中发挥关键作用,而肿瘤细胞的凋亡受阻是肿瘤的发生、发展的重要因素之一[13]。通过药物诱导肿瘤细胞凋亡是控制肿瘤发展的关键,也是临床治疗肿瘤的新的途径。Ki-67 在细胞有丝分裂中发挥重要作用,是细胞增殖的标志性蛋白,能够较好反映细胞的增殖活性[14]。Bcl-2蛋白存在于线粒体膜,可通过调控细胞线粒体膜电位而抑制细胞凋亡[15]。Bax 能够与Bcl-2 蛋白与形成二聚体:Bax 相对量高于Bcl-2 时,Bax 同二聚体的数量增多,从而促进细胞凋亡;Bcl-2相对量高于Bax时,Bcl-2同二聚体增加而抑制细胞凋亡[16]。
Caspase-3 蛋白在细胞凋亡的启动和执行过程中发挥作用,是细胞凋亡最重要的调控蛋白,其表达反映了Caspases家族蛋白对细胞凋亡的调控作用[17]。本研究结果显示,ART 能够显著降低HepG2 细胞中Ki-67蛋白、Bcl-2蛋白表达以及细胞增殖率,同时能够有效促进Bax、Caspase-3 蛋白表达及HepG2 细胞凋亡。ART 能够在一定程度上抑制HepG2 细胞增殖并诱导其凋亡,且呈剂量依赖性。肿瘤细胞迁移和侵袭对于降低肿瘤复发和转移具有重要意义。本研究结果表明,ART 能够有效降低HepG2 细胞的迁移、侵袭以及细胞中MMP2、MMP9 蛋白表达,ART 可抑制肿瘤细胞迁移和侵袭。
PI3K/AKT信号通路是恶性肿瘤增殖和转移的重要分子机制之一[18]。PI3K 是一种胞内磷脂酰肌醇激酶,可通过特异性催化使磷酸肌醇-3-位羟基发生磷酸化,产生肌醇脂物质而进一步激活或募集通路下游靶蛋白产生一系列信号级联反应[19]。AKT 是PI3K 的下游效应基因,被激活后能够促进磷酸化发生,进而激活或抑制PI3K/AKT 信号通路的下游靶蛋白,从而对肿瘤细胞的增殖或凋亡进行调控[20]。本研究结果显示,不同浓度的ART 作用于HepG2 细胞后,PI3K、p-P13K 和p-AKT 蛋白表达明显降低。ART 浓度越高,PI3K、p-P13K 和p-AKT 蛋白表达越低。ART 可通过下调PI3K/AKT信号通路活性而抑制细胞生长。
本研究存在一定局限性,首先只是从细胞水平上验证了ART对肝癌HepG2细胞具有生长抑制作用,缺乏临床样本验证其临床实用性;其次,本研究对于ART抑制肝癌HepG2细胞的具体机制缺乏深入研究,值得后续进行进一步研究。
综上所述,ART对肝癌HepG2细胞具有生长抑制作用,且呈剂量依赖性,其作用机制与调控细胞周期和诱导细胞凋亡有关。ART能够通过调控细胞内Ki-67、Bax、Bcl-2、Caspase-3、MMP2、MMP9 等多种蛋白的表达以及PI3K/AKT 信号通路活性,抑制肝癌HepG2细胞的增殖、迁移和侵袭,并诱导细胞凋亡。

