冠状动脉旁路移植术后Hct、LP(a)、MPV动态变化及其与血管内皮功能的相关性
龙美静,孙静静,张慧慧,王雪玢
郑州大学第一附属医院检验科,河南 郑州 450000
我国冠心病发病率、病死率逐年上升,临床常采用冠状动脉旁路移植术(CABG)治疗,但手术操作过程会不同程度地损伤冠状动脉[1]。CABG 可激活血管内皮细胞,诱发血管挛缩、凝血紊乱、炎性反应,引起血管内皮细胞功能障碍[2]。因而寻找CABG后血管内皮功能障碍的预测指标具有重要意义。红细胞比容(Hct)与血液黏度有关,可调控血管壁剪切应力,促进血管内皮损伤,进而参与心血管疾病发生发展过程[3]。脂蛋白(a)[LP(a)]与血栓形成、纤溶受损有关,其水平升高可增加动脉粥样硬化斑块不稳定性[4]。平均血小板体积(MPV)属于血小板活化标志物,其水平升高可促进多种生物活性物质释放,引起炎性反应,诱发动脉硬化[5]。目前Hct、LP(a)、MPV 与血管内皮功能障碍相关性研究较少。本研究通过检测行CABG 的冠心病患者的Hct、LP(a)、MPV水平,探究其与血管内皮功能指标的相关性,并分析其对血管内皮功能障碍的预测价值。
1 资料与方法
1.1 一般资料 选取2020 年1 月至2022 年8 月于郑州大学第一附属医院行CABG的115例冠心病患者为研究对象。纳入标准:符合冠心病诊断标准[6],且经心电图、超声心动图检查确诊;符合CABG 治疗指征;左室射血分数(LVEF)>40%;未合并严重心脏瓣膜疾病;初次发病者;近1个月内无激素类或免疫抑制剂用药史;所有患者均签署知情同意书。排除标准:血管畸形病变;颅内器质性病变;入院前已接受静脉溶栓治疗;肝肾等脏器功能严重障碍;近1个月内有输血史;合并免疫缺陷、传染性疾病;合并血液系统疾病;合并恶性肿瘤。115 例患者中男性75 例,女性40 例;年龄56~70岁,平均(63.18±2.15)岁;体质量指数(BMI)17~30 kg/m2,平均(23.48±2.06) kg/m2;ASA 分级:Ⅱ级67例、Ⅲ级48例;美国纽约心脏病协会心功能(NYHA)分级:Ⅱ级74例、Ⅲ级41例;合并症:高血压54例、糖尿病31 例;冠脉病变情况:单支病变38 例、双支病变42例、左主干或三支病变35例。本研究经我院医学伦理委员会批准。
1.2 CABG 手术方法 前胸正中切口获取内乳动脉、大隐静脉,予以肝素1~2 mg/kg,切开心包后探查狭窄、闭塞冠状动脉,完成血管重建,以大隐静脉、乳内动脉、挠动脉为血管移植物,采用双头针(7-0)无创伤Prolene 线连续外翻吻合,完成后使用0.9%氯化钠检测吻合口是否通畅。
1.3 分组方法 术后3 个月依据其是否发生血管内皮功能障碍分为发生者65 例(设为研究组)、未发生者50 例(设为对照组),采用Vivd7 型超声诊断仪(美国GE公司)检测血流依赖性舒张功能(FMD),以FMD评估血管内皮功能,其中FMD≤7%视为血管内皮功能障碍[7]。
1.4 检测方法 (1)血管内皮功能指标检测:术前采集所有患者5 mL晨起空腹静脉血,3 000 r/min离心5 min(离心半径10 cm),取上清液,采用ELISA法检测血清内皮素-1 (ET-1)、血小板内皮细胞黏附分子(PECAM-1)、血管内皮细胞钙粘连蛋白(VE-cadherin)、神经型钙黏连蛋白(N-cadherin)水平,美国R&D公司提供ET-1、PECAM-1检测试剂盒,厦门仑昌硕生物科技有限公司提供VE-cadherin、N-cadherin 检测试剂盒。(2) Hct、LP(a)、MPV 检测:于术前、术后2 d、术后7 d 采集所有患者晨起空腹静脉血5 mL,以10 min 半径离心5 min(3 000 r/min),留取上清液待测,采用Mindray BS-220型全自动生化分析仪(南京贝登医疗股份有限公司)检测Hct。采用免疫比浊法检测LP(a)、MPV水平,武汉明德生物科技股份有限公司提供检测试剂盒。
1.5 观察指标 (1)比较两组患者术前、术后2 d、7 d 的Hct、LP(a)、MPV 水平,并分析其与血管内皮功能指标相关性;(2)计算Hct、LP(a)、MPV差值(△2 d、△7 d),△2 d为术后2 d与术前差值的绝对值,△7 d为术后7 d 与术前差值的绝对值;(3)分析Hct、LP(a)、MPV差值(△2 d、△7 d)对血管内皮功能障碍的预测价值。
1.6 统计学方法 应用SPSS24.0软件进行数据统计学分析。计量资料经K-S 检验符合正态分布,以均数±标准差()表示,两组间比较采用t检验,术前术后组内比较采用配对t检验;计数资料组间比较采用χ2检验;采用Pearson 法分析不同指标间的相关性;采用多因素Logistic回归分析各指标差值对血管内皮功能障碍的影响;利用受试者工作特征曲线(ROC)及ROC 下面积(AUC)评价各指标差值对血管内皮功能障碍的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床资料比较 研究组患者的ET-1、PECAM-1 水平明显高于对照组,VE-cadherin、N-cadherin 水平明显低于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者的临床资料比较[,例(%)]Table 1 Comparison of clinical data between the two groups[,n(%)]
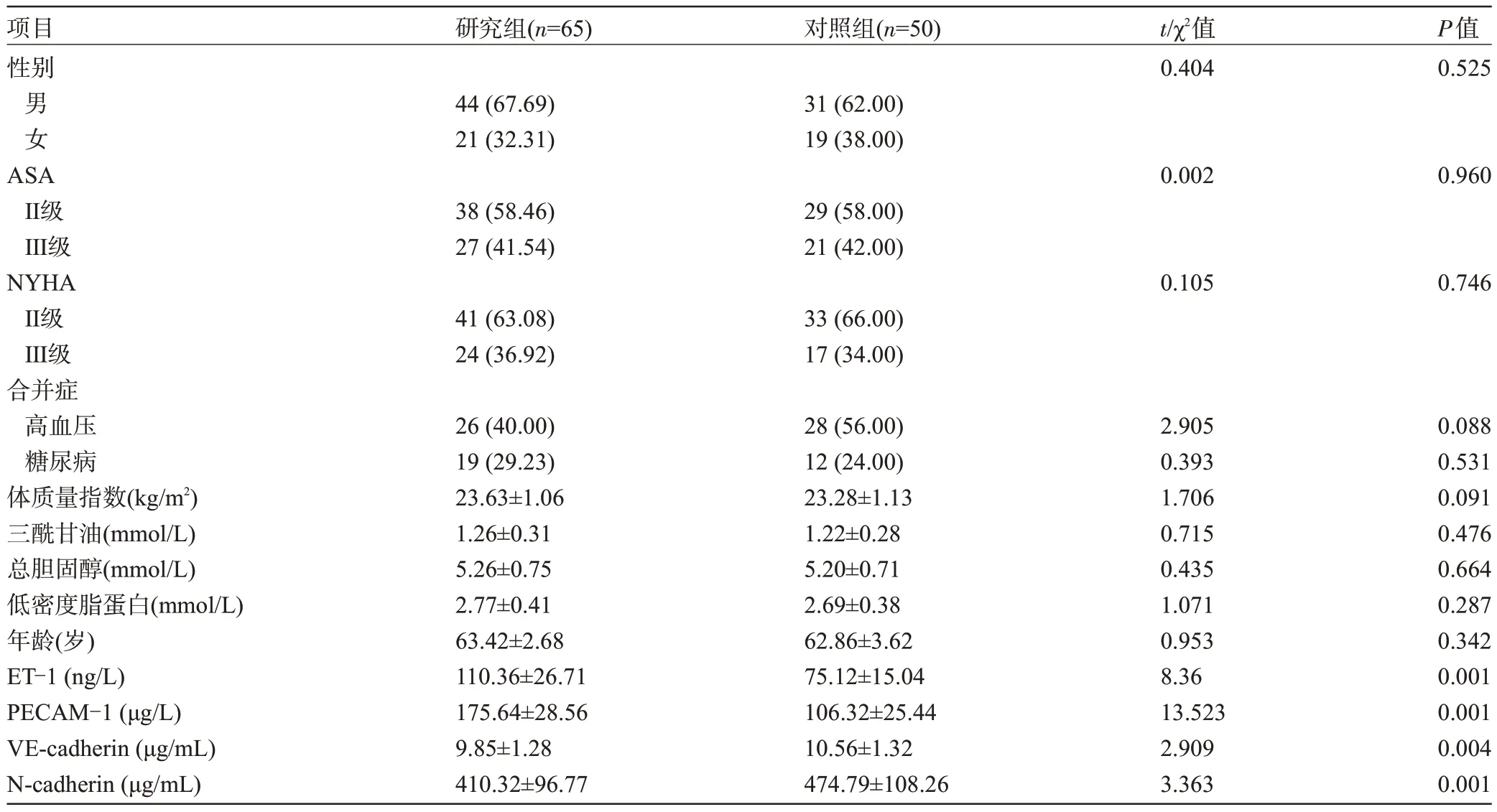
表1 两组患者的临床资料比较[,例(%)]Table 1 Comparison of clinical data between the two groups[,n(%)]
项目性别研究组(n=65)对照组(n=50)t/χ2值0.404 P值0.525男女44(67.69)21(32.31)31(62.00)19(38.00)ASAⅡ级Ⅲ级NYHAⅡ级Ⅲ级合并症高血压糖尿病体质量指数(kg/m2)三酰甘油(mmol/L)总胆固醇(mmol/L)低密度脂蛋白(mmol/L)年龄(岁)ET-1(ng/L)PECAM-1(μg/L)VE-cadherin(μg/mL)N-cadherin(μg/mL)0.0020.960 38(58.46)27(41.54)29(58.00)21(42.00)0.1050.746 41(63.08)24(36.92)33(66.00)17(34.00)26(40.00)19(29.23)23.63±1.06 1.26±0.31 5.26±0.75 2.77±0.41 63.42±2.68 110.36±26.71 175.64±28.56 9.85±1.28 410.32±96.77 28(56.00)12(24.00)23.28±1.13 1.22±0.28 5.20±0.71 2.69±0.38 62.86±3.62 75.12±15.04 106.32±25.44 10.56±1.32 474.79±108.26 2.905 0.393 1.706 0.715 0.435 1.071 0.953 8.36 13.523 2.909 3.363 0.088 0.531 0.091 0.476 0.664 0.287 0.342 0.001 0.001 0.004 0.001
2.2 两组患者手术前后的Hct、LP(a)、MPV 比较 术前,两组患者的Hct、LP(a)、MPV比较差异均无统计学意义(P>0.05);术后2 d、7 d,两组患者的Hct明显高于术前,LP(a)、MPV明显低于术前,且术后2 d、7 d,研究组患者的Hct 明显低于对照组,LP(a)、MPV 明显高于对照组,差异均有统计学意义(P<0.05);研究组患者的Hct、LP(a)、MPV 差值(△2 d、△7 d)明显低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者手术前后的Hct、LP(a)、MPV比较()Table 2 Comparison of Hct,LP(a),and MPV before and after surgery between the two groups()
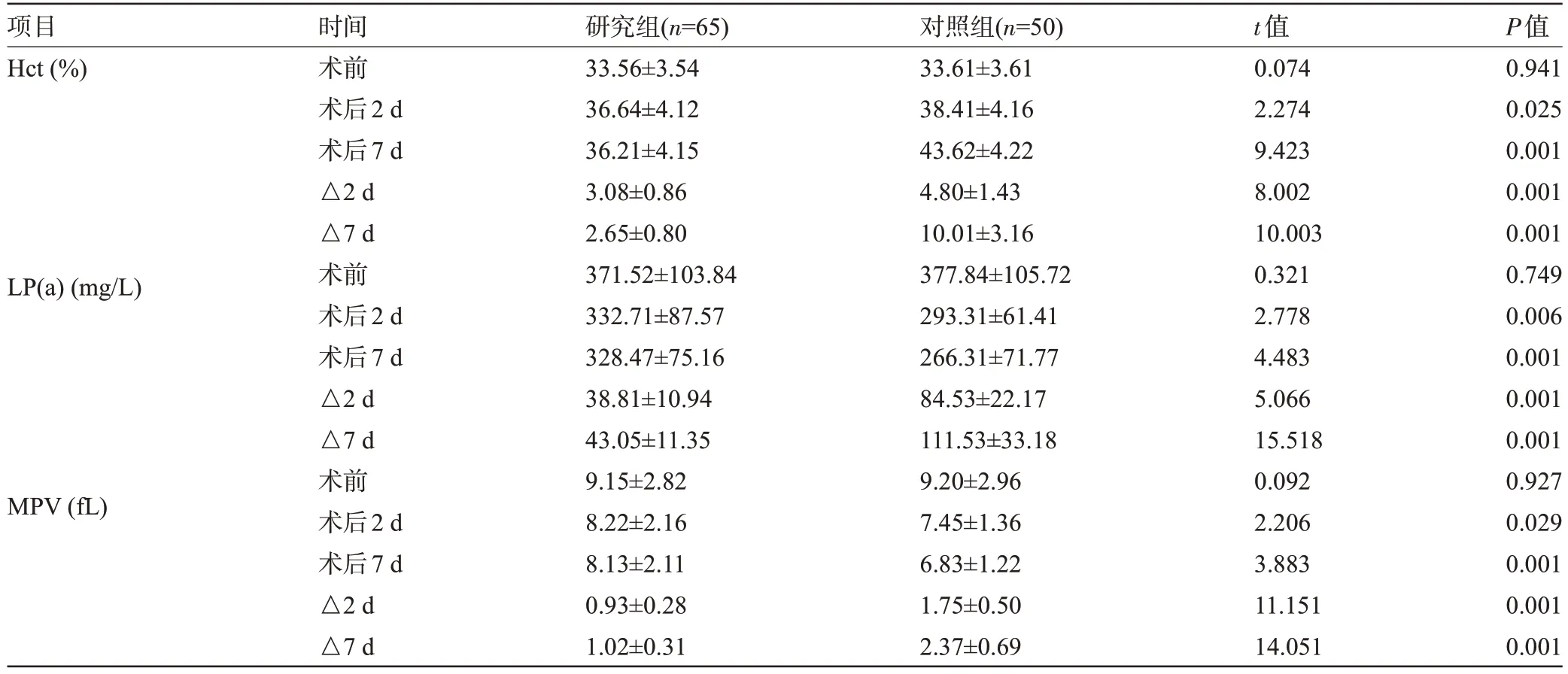
表2 两组患者手术前后的Hct、LP(a)、MPV比较()Table 2 Comparison of Hct,LP(a),and MPV before and after surgery between the two groups()
项目Hct(%)LP(a)(mg/L)MPV(fL)时间术前术后2 d术后7 d△2 d△7 d术前术后2 d术后7 d△2 d△7 d术前术后2 d术后7 d△2 d△7 d研究组(n=65)33.56±3.54 36.64±4.12 36.21±4.15 3.08±0.86 2.65±0.80 371.52±103.84 332.71±87.57 328.47±75.16 38.81±10.94 43.05±11.35 9.15±2.82 8.22±2.16 8.13±2.11 0.93±0.28 1.02±0.31对照组(n=50)33.61±3.61 38.41±4.16 43.62±4.22 4.80±1.43 10.01±3.16 377.84±105.72 293.31±61.41 266.31±71.77 84.53±22.17 111.53±33.18 9.20±2.96 7.45±1.36 6.83±1.22 1.75±0.50 2.37±0.69 t值0.074 2.274 9.423 8.002 10.003 0.321 2.778 4.483 5.066 15.518 0.092 2.206 3.883 11.151 14.051 P值0.941 0.025 0.001 0.001 0.001 0.749 0.006 0.001 0.001 0.001 0.927 0.029 0.001 0.001 0.001
2.3 各指标与血管内皮功能指标的相关性 经Pearson法分析结果显示,Hct与ET-1、PECAM-1水平呈负相关(P<0.05),且与VE-cadherin、N-cadherin 水平呈正相关(P<0.05);LP(a)、MPV 与ET-1、PECAM-1 水平呈正相关(P<0.05),且与VE-cadherin、N-cadherin 水平呈负相关(P<0.05),见表3。
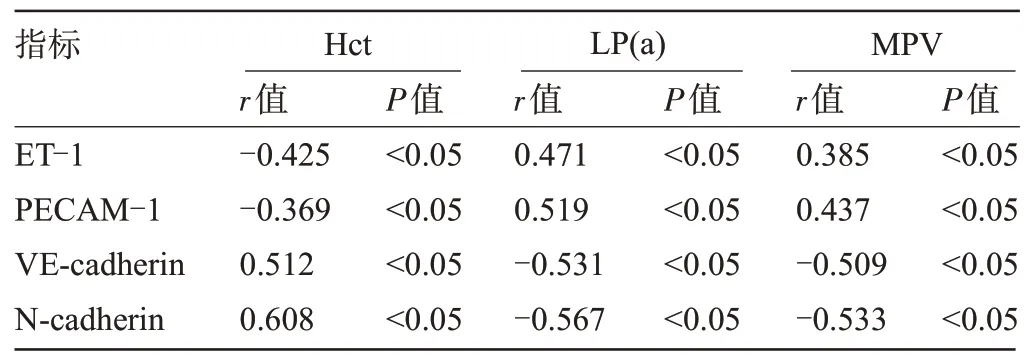
表3 各指标与血管内皮功能指标的相关性Table 3 Correlation between Hct, LP(a), and MPV and vascular endothelial function indicators
2.4 各指标差值对血管内皮功能障碍的影响 经Logistic回归分析结果显示,校正ET-1、PECAM-1、VE-cadherin、N-cadherin 等其他因素前后,Hct、LP(a)、MPV 差值(△2 d、△7 d)与血管内皮功能障碍独立相关(P<0.05),见表4。
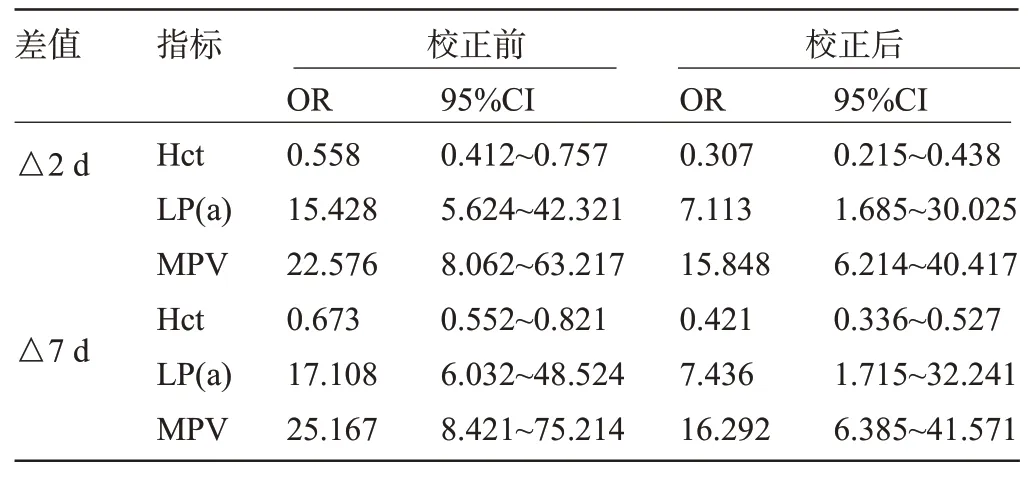
表4 各指标差值对血管内皮功能障碍的影响Table 4 Effect of Hct, LP(a), and MPV differences on vascular endothelial dysfunction
2.5 各指标差值对血管内皮功能障碍的预测价值 以研究组65例为阳性样本,以对照组50例为阴性样本,绘制ROC曲线,结果显示,Hct△2 d、LP(a)△2 d、MPV△2 d联合预测血管内皮功能障碍的AUC大于单项指标预测,差异有统计学意义(P<0.05),Hct△7 d、LP(a)△7 d、MPV△7 d 联合预测血管内皮功能障碍的AUC 大于单项指标预测,差异具有统计学意义(P<0.05),且Hct△7 d、LP(a)△7 d、MPV△7 d 预测血管内皮功能障碍的AUC 大于Hct△2 d、LP(a)△2 d、MPV△2 d 联合预测,差异有统计学意义(P<0.05),见表5、图1。
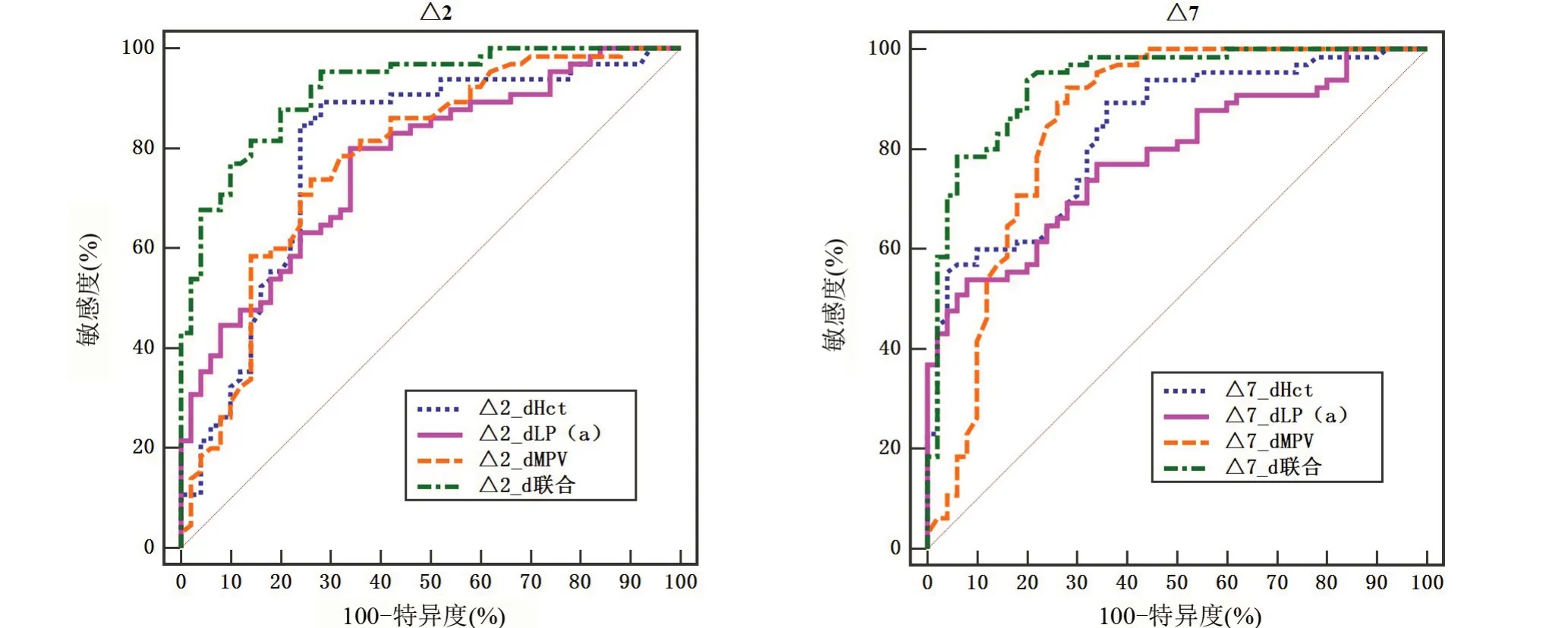
图1 各指标差值预测血管内皮功能障碍的ROC图Figure 1 ROC Chart of predicting vascular endothelial dysfunction by Hct,LP(a),and MPV
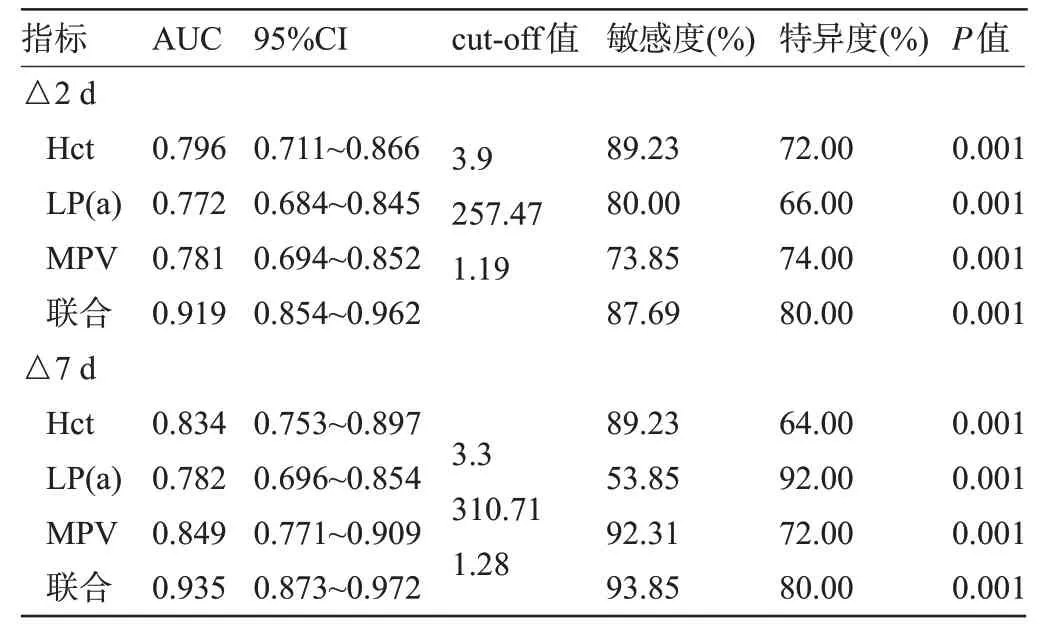
表5 ROC分析各指标差值对血管内皮功能障碍的预测价值Table 5 Predictive value of Hct, LP(a), and MPV difference for vascular endothelial dysfunction by ROC analysis
3 讨论
冠心病发生发展与炎性反应、血管内皮功能障碍有关,CABG 后短期内补体系统、中性粒细胞、纤溶系统激活,可促进炎性细胞因子生成,引起血管内皮细胞损伤,而血管内皮细胞功能障碍可引起脂质过氧化反应、凝血功能障碍,诱发靶器官损伤[8]。因而早期及时治疗血管内皮功能障碍有助于改善患者预后。
Hct 可反映心功能障碍程度,其水平降低预示左室舒张末期容量增加,心室壁张力升高[9-10]。本研究结果显示,术后2 d、7 d两组Hct高于术前,且研究组Hct低于对照组,提示Hct 水平变化可能反映血管内皮功能受损程度。Hct 水平降低可减小血液黏度,引起收缩/扩张调节因子水平紊乱,诱发血管内皮损伤。血管内皮功能障碍与血管收缩、血栓形成、异常血管增生、心血管不良事件密切相关,ET-1、PECAM-1水平升高可刺激血管收缩,促进血栓形成,致使血管内皮功能失衡,促进冠心病病情发展;VE-cadherin、N-cadherin可维持血管完整性,其水平降低可引起内皮功能障碍[11-12]。本研究结果显示,研究组ET-1、PECAM-1水平高于对照组,VE-cadherin、N-cadherin 水平低于对照组,进一步研究发现Hct与ET-1、PECAM-1水平呈负相关,而与VE-cadherin、N-cadherin 水平呈正相关,提示Hct 水平与血管内皮功能指标密切相关,并可能反映内皮功能障碍程度。分析其原因可能为血管内皮功能障碍发生后机体内炎性反应加剧,可促进动脉内膜增生、血小板黏附凝聚,并可降低Hct水平,破坏血管内皮完整性,促进冠脉血流再灌注。
LP(a)具有促氧化应激作用,其水平升高可干扰纤溶系统、脂代谢功能,致使纤溶酶水平降低,减弱血栓溶解能力,影响动脉粥样斑块稳定性[13]。LP(a)可通过结合巨噬细胞,促进泡沫细胞、脂肪斑块生成,引起平滑肌细胞、内皮细胞氧化损伤,进而参与动脉粥样硬化发生过程[14]。本研究结果显示,研究组术后LP(a)水平高于对照组,且与ET-1、PECAM-1水平呈正相关,而与VE-cadherin、N-cadherin 水平呈负相关,提示LP(a)水平升高与血管内皮功能障碍密切相关。由此可知LP(a)可能引起血管内皮细胞氧化损伤,增加不稳定斑块数量、冠脉钙化程度,进而参与血管内皮功能障碍发生过程。MPV水平升高可释放炎性介质,加重血管内皮功能障碍,致使心脏功能恶化[15]。心血管疾病发生过程中,血小板可激活循环系统中单核细胞,增加炎性细胞因子释放量,促使血小板体积增大[16]。本研究结果显示,研究组术后MPV 水平高于对照组,且与血管内皮功能指标密切相关,提示MPV水平升高预示血小板活性增强、淋巴细胞数量减少,可加剧炎性反应,引起血管内皮功障碍。原因可能为MPV可通过增加炎性因子释放量,引起血管内皮功能紊乱,增加冠状动脉斑块不稳定性。MPV 水平升高可影响经皮冠状动脉介入术(PCI)后再灌注情况,并可用于预测PCI后无复流发生[17]。但Hct、LP(a)、MPV 对CABG 后血管内皮功能障碍的预测价值尚未可知。本研究结果显示,Hct△7 d、LP(a)△7 d、MPV△7 d预测血管内皮功能障碍的AUC大于Hct△2 d、LP(a)△2 d、MPV△2 d联合预测,提示联合检测Hct、LP(a)、MPV 水平对CABG后血管内皮功能障碍具有一定预测价值。
综上所述,Hct、LP(a)、MPV 水平变化与CABG 后血管内皮功能障碍有关,联合检测对CABG后血管内皮功能障碍具有一定预测效能,有助于临床医师调整治疗方案,以减少血管内皮功能障碍的发生。

