miRNA-23a-3p和TLR4在急性脑出血患者血清中的表达及临床意义
贺琦,王燕
西安宝石花长庆医院神经内科,陕西 西安 710201
急性脑出血(acute cerebral hemorrhage,ACH)是一种颅内出血性疾病,其发病率高,预后差[1-2]。因此,寻找与ACH 发病及预后转归相关的指标,对及时干预,改善ACH 患者预后有积极意义。有研究认为,ACH发病与炎症反应、微小RNA(microRNA,miRNA)表达失调、信号传导异常等相关[3-4]。研究发现,微小RNA-23a-3p(microRNA-23a-3p,miR-23a-3p)在ACH患者中呈高表达,与血肿体积、ACH 患者预后相关,可能参与并影响ACH 患者预后[5]。此外,研究发现脑出血患者Toll 样受体4(Toll-like receptor 4,TLR4)水平较高,是影响脑出血预后的危险因素,且具有评估ACH 患者预后的潜在价值[6]。但miR-23a-3p、TLR4在ACH患者中的相关性,及两者联合预测ACH患者预后的价值尚未明确。基于此,本文通过测定miR-23a-3p、TLR4 在ACH 患者血清中的水平,旨在分析miR-23a-3p与TLR4的相关性以及miR-23a-3p、TLR4联合检测对ACH患者预后的预测价值。
1 资料与方法
1.1 一般资料 选取2020 年1 月至2022 年3 月西安宝石花长庆医院诊治的ACH 患者110 例作为ACH 组。纳入标准:(1)符合《中国脑出血诊治指南(2019)》[7]中有关ACH 的诊断标准;(2)首次发病,入院就诊<4 h;(3)检查资料齐全。排除标准:(1)凝血功能障碍者;(2)伴有感染、糖尿病、传染病者;(3)近1 个月服用抗血小板药物者;(4)合并肝肾功能不全、自身免疫系统疾病者;(5)因蛛网膜下腔出血、外伤等引发的继发性脑出血者;(6)脑血管畸形导致的颅内出血者。ACH 组患者中男性56 例,女性54 例;年龄61~73 岁,平均(69.98±7.24)岁。另纳入同期健康体检者110例作为对照组,其中男性61 例,女性49 例;年龄61~73 岁,平均(68.73±7.11)岁。两组受检者的性别和年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经本院医学伦理委员会批准,所有受试者及其亲属对本研究知情同意。
1.2 检测方法
1.2.1 样本收集 收集ACH患者入院治疗前,及健康者体检当日3~5 mL空腹外周血,自然凝集,分离出血清(4 000 r/min离心10 min),分装,存于-70℃冰箱。
1.2.2 血清miR-23a-3p 表达水平测定 采用实时荧光定量逆转录-聚合酶链反应(real-time quantitative reverse transcription- polymerase chain reaction,qRT-PCR)法测定血清miR-23a-3p 表达水平。首先,按miRNeasy Serum/Plasma Kit (217184,北京索莱宝科技有限公司)说明书提取血清样本总RNA,且在提取RNA 时加内参cel-miR-39。其次,利用miScript Reverse Transcription Kit(218061,杭州开泰生物技术有限公司)获得cDNA。最终,应用miScript SYBR Green PCR Kit(218075,北京欣华绿源科技有限公司)配制反应体系,qRT-PCR 仪(StepOne TM,美国ABI 公司)将cDNA 扩增、检测。qRT-PCR 扩增参数:96.5℃8 min;94℃30 s,64.5℃40 s,70℃20 s,40 个循环。miR-23a-3p 上游引物序列为5'-ACACTCCAGCTGGGATCA-3',下游引物序列为5'-CTCAACTGGTGT CGT-3',cel-miR-39 上游引物序列为5'-CAGAGTCACCGGGTGTAAAT-3',下游引物序列为5'-CCAGTGCGTGTCGTGGAGTC-3'。血清miR-23a-3p相对表达量以2-△△CT法计算。
1.2.3 血清肿瘤坏死因子-α(TNF-α)、TLR4、核因子κB(NF-κB)水平测定 采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定血清TNF-α、TLR4 和NF-κB 水平。采用人TNF-αELISA试剂盒(70-EK182HS-96,杭州联科生物技术股份有限公司)、人TLR4 ELISA 试剂盒(CSB-E12954h-1,上海恒斐生物科技有限公司)、人NF-κB ELISA 试剂盒(XFH11333,上海信帆生物科技有限公司)配制TNF-α、TLR4、NF-κB的标准样品溶液,解冻血清,酶标仪(美国Awareness公司,Chromate 4300)测定TNF-α、TLR4、NF-κB标准品溶液及血清样本在450 nm处的吸光度,绘制TNF-α、TLR4、NF-κB 的标准回归曲线,结合TNF-α、TLR4、NF-κB 的标准回归方程,计算血清TNF-α、TLR4、NF-κB水平。
1.3 治疗与随访 ACH 患者均依据《中国脑出血诊治指南(2019)》[7]给予ACH患者降颅内压、吸氧、脑保护剂等对症治疗。对110例ACH患者随访6个月,对患者进行改良Rankin量表(modified Rankin scale,mRS)评估,并依据mRS评分将其分为预后良好组(58例,mRS评分<3分)、预后不良组(52例,mRS评分≥3分)。此外,收集整理两组ACH 患者美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)、年龄、高脂血症、性别、高血压、血小板分布宽度、身体质量指数(body mass index,BMI)、糖尿病等资料。
1.4 统计学方法 应用SPSS25.0 软件进行数据统计学分析。计量资料均符合正态分布,以均数±标准差()表示,组间比较采用t检验;计数资料比较采用χ2检验,理论频数<5 时,采用Fisher 精确概率法分析;ACH患者血清miR-23a-3p、TLR4水平与TNF-α、NF-κB 的相关性采用Pearson 法分析;采用受试者工作特征曲线(receiver operating characteristic curve,ROC)评估血清mmiR-23a-3p、TLR4预测ACH患者预后的价值。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组受检者的血清miR-23a-3p、TLR4、TNF-α、NF-κB 水平比较 与对照组相比,ACH 组患者血清miR-23a-3p、TLR4、TNF-α、NF-κB 水平均升高,差异有统计学意义(P<0.05),见表1。
表1 两组受检者的血清miR-23a-3p、TLR4、TNF-α、NF-κB 水平比较()Table 1 Comparison of serum levels of miR-23a-3p,TLR4,TNF-α and NF-κB between the two groups()

表1 两组受检者的血清miR-23a-3p、TLR4、TNF-α、NF-κB 水平比较()Table 1 Comparison of serum levels of miR-23a-3p,TLR4,TNF-α and NF-κB between the two groups()
组别对照组ACH组t值P值例数110 110 miR-23a-3p 1.01±0.30 2.29±0.67 18.287 0.001 TLR4(μg/L)17.46±5.82 32.94±10.98 13.065 0.001 TNF-α(pg/mL)20.31±8.47 51.28±21.37 14.130 0.001 NF-κB(ng/mL)8.50±3.04 17.34±6.19 13.444 0.001
2.2 ACH 患者血清miR-23a-3p、TLR4 水平与TNF-α、NF-κB的关系 经Pearson法分析结果显示,ACH患者血清miR-23a-3p、TLR4水平与TNF-α、NF-κB 均呈正相关(r=0.377、0.538、0.403、0.572,P<0.05),见表2;ACH 患者血清miR-23a-3p 表达水平与TLR4呈正相关(r=0.581,P<0.05),见图1。
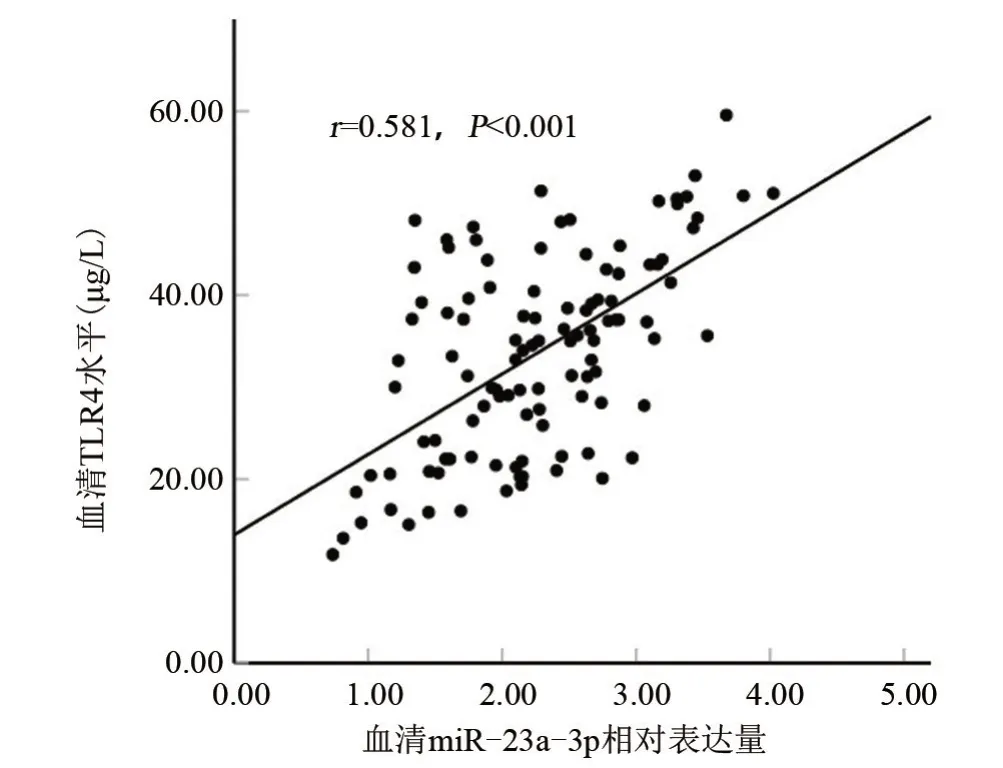
图1 ACH患者血清miR-23a-3p表达水平与TLR4的相关性Figure 1 Correlation between serum miR-23a-3p expression level and TLR4 in patients with ACH

表2 ACH 患者血清miR-23a-3p、TLR4 水平与TNF-α、NF-κB 的相关性Table 2 Correlation of serum miR-23a-3p and TLR4 levels with TNF-α and NF-κB in ACH patients
2.3 不同预后ACH 患者的一般资料及血清miR-23a-3p、TLR4、TNF-α、NF-κB 水平比较 与预后良好组相比,预后不良组ACH患者NIHSS评分、脑出血体积、血清miR-23a-3p、TLR4、TNF-α、NF-κB水平均升高,差异有统计学意义(P<0.05),年龄、高脂血症、男/女比、高血压、血小板分布宽度、BMI、糖尿病比较差异无统计学意义(P>0.05),见表3。
表3 不同预后ACH患者的一般资料及血清miR-23a-3p、TLR4、TNF-α、NF-κB水平比较[,例(%)]Table 3 Comparison of general data and serum levels of miR-23a-3p,TLR4,TNF-α and NF-κB in ACH patients with different prognosis[,n(%)]
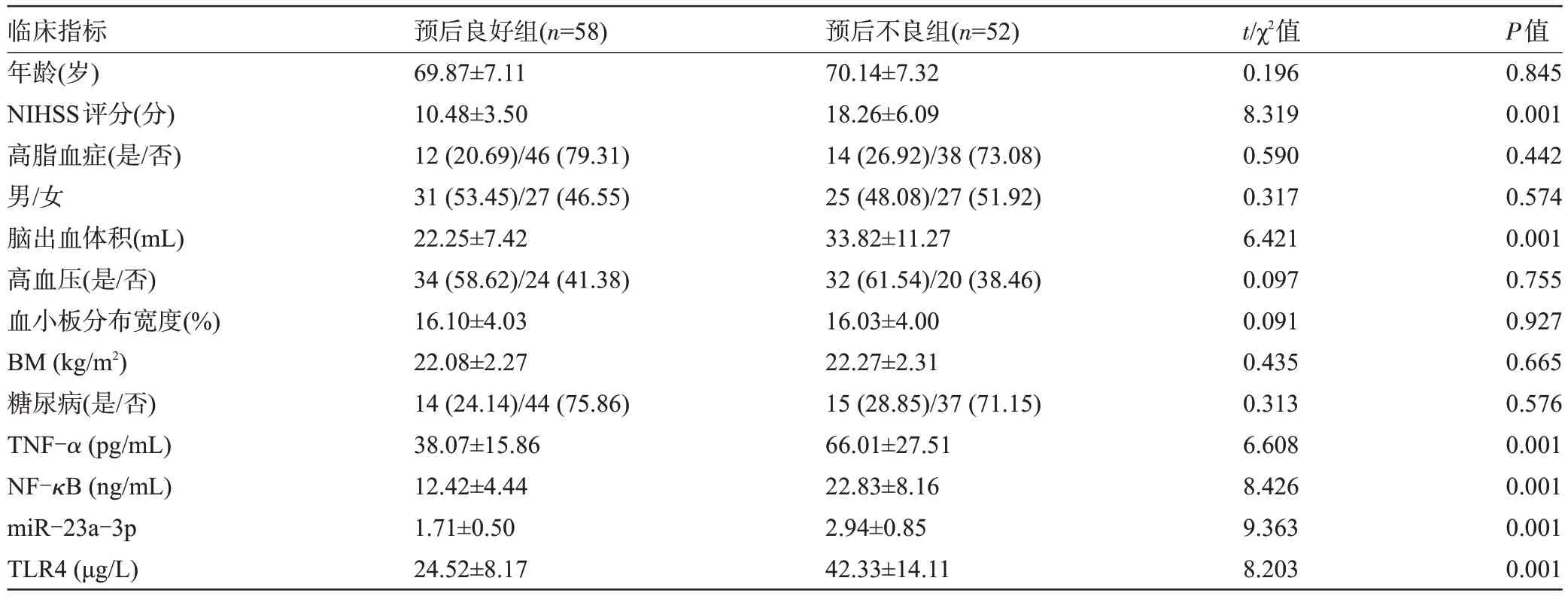
表3 不同预后ACH患者的一般资料及血清miR-23a-3p、TLR4、TNF-α、NF-κB水平比较[,例(%)]Table 3 Comparison of general data and serum levels of miR-23a-3p,TLR4,TNF-α and NF-κB in ACH patients with different prognosis[,n(%)]
临床指标年龄(岁)NIHSS评分(分)高脂血症(是/否)男/女脑出血体积(mL)高血压(是/否)血小板分布宽度(%)BM(kg/m2)糖尿病(是/否)TNF-α(pg/mL)NF-κB(ng/mL)miR-23a-3p TLR4(μg/L)预后良好组(n=58)69.87±7.11 10.48±3.50 12(20.69)/46(79.31)31(53.45)/27(46.55)22.25±7.42 34(58.62)/24(41.38)16.10±4.03 22.08±2.27 14(24.14)/44(75.86)38.07±15.86 12.42±4.44 1.71±0.50 24.52±8.17预后不良组(n=52)70.14±7.32 18.26±6.09 14(26.92)/38(73.08)25(48.08)/27(51.92)33.82±11.27 32(61.54)/20(38.46)16.03±4.00 22.27±2.31 15(28.85)/37(71.15)66.01±27.51 22.83±8.16 2.94±0.85 42.33±14.11 t/χ2值0.196 8.319 0.590 0.317 6.421 0.097 0.091 0.435 0.313 6.608 8.426 9.363 8.203 P值0.845 0.001 0.442 0.574 0.001 0.755 0.927 0.665 0.576 0.001 0.001 0.001 0.001
2.4 血清miR-23a-3p、TLR4 水平对ACH 患者预后的评估价值 经ROC 分析结果显示,血清miR-23a-3p 预测ACH 患者预后的曲线下面积(area under curve,AUC)为0.857 (95%CI:0.781~0.933),截断值为2.37,约登指数为0.648,其敏感度、特异性分别为76.9%、87.9%;TLR4 预测ACH 患者预后的AUC 为0.868 (95%CI:0.800~0.937),截断值为34.52 μg/L,约登指数为0.621,其敏感度、特异性分别为78.8%、86.2%;miR-23a-3p、TLR4联合预测ACH患者预后的AUC为0.941(95%CI:0.893~0.990),约登指数为0.801,其敏感度、特异性分别为90.4%、89.7%,见图2。
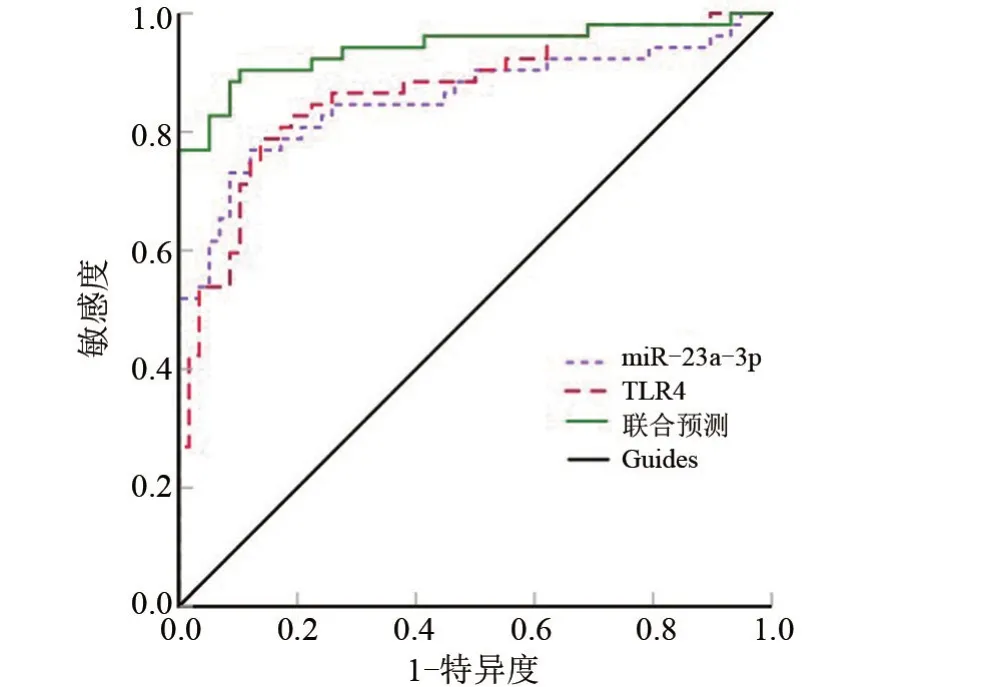
图2 血清miR-23a-3p、TLR4预测ACH患者预后的ROC曲线Figure 2 ROC curve of serum miR-23a-3p and TLR4 in predicting prognosis of patients with ACH
3 讨论
ACH 是因非外伤性脑血管破裂引发的一种脑内出血病变,起病急,经治疗后,部分患者可能伴有神经功能缺损,发生不同程度残疾,甚至死亡[8-9]。因此,寻找与ACH 病理变化相关,且可有效预测ACH 患者预后的方法十分重要。
miRNA是一类不编码蛋白的RNA小分子,其可调控信号转导、参与炎症反应、介导自噬,并可调节细胞凋亡,与蛛网膜下腔出血、ACH等关系密切[10-11]。研究发现,miR-23a-3p 在心肌梗死中表达失调,可能是评估心肌梗死患者预后的标志物[12];另外,miR-23a-3p在脑出血患者中过表达,经针灸治疗后,miR-23a-3p 表达水平降低,miR-23a-3p 可能通过影响炎症反应、神经元细胞凋亡过程进而在脑出血中发挥调节作用[13]。本研究中ACH 患者血清miR-23a-3p 表达水平较高,提示miR-23a-3p 可能与ACH 的病变过程相关,推测miR-23a-3p 可能通过调节信号转导、影响炎症反应,调控细胞凋亡进而参与ACH 病理发展,但其机制仍需深入探讨。本研究又分析血清miR-23a-3p 表达水平与ACH 患者预后的关系,结果发现,预后不良的ACH患者血清miR-23a-3p高表达。为进一步探究血清miR-23a-3p的临床意义,进行了ROC曲线分析,结果显示,血清miR-23a-3p 预测ACH 患者预后的AUC为0.857,且当血清miR-23a-3p 相对表达量>2.37 时,ACH 患者发生不良预后概率较高,提示miR-23a-3p不仅与ACH 患者预后有关,还可能作为ACH 患者预后预测的辅助指标。
TLR4 是Toll 样受体家族的一员,是一种膜蛋白,其主要分布于神经小胶质细胞,可诱导炎症反应,与脑出血的神经损伤密切相关[14-15]。研究发现,TLR4在脑出血中呈高水平,经麦角甾苷治疗后,TLR4水平下降,TLR4 可能通过促进炎症反应进而影响脑出血病理过程[16];另外,周喜燕等[17]也研究发现脑出血大鼠脑组织中TLR4表达水平升高,TLR4可能促进脑组织损伤,增加血脑屏障通透性,其与神经功能显著相关。本研究中ACH患者血清TLR4水平高于健康者,与既往研究[16-17]类似,提示TLR4可能参与ACH发病进程,推测TLR4可能通过影响炎症反应,进而影响ACH发生发展,其具体机制有待深入探讨。进一步研究发现,预后不良的ACH 患者血清TLR4 高于预后良好者,提示TLR4 可能与ACH 患者预后相关,推测高水平TLR4 通过促进炎症反应进而影响ACH患者预后。随后的ROC曲线分析显示,血清TLR4预测ACH患者预后的AUC 为0.868,当血清TLR4 水平>34.52 μg/L 时,ACH患者发生不良预后风险较大,提示TLR4对ACH患者预后有一定预测价值,测定血清TLR4 水平有助于临床预测ACH患者的预后情况。
近年来,关于miRNA 与下游靶基因的3'-非翻译区结合,抑制翻译或降解mRNA,进而调控疾病进展方面的研究越来越多。miR-23a-3p 靶向TLR4 调控疾病进程的研究目前已有报道,如Gao 等[18]研究发现,miR-23a-3p 可以通过调节TLR4 表达,进而影响脓毒症的炎症反应过程,Chen 等[19]发现结核患者中miR-23a-3p的下调通过靶向IRF1/SP1的TLR4/TNF-α/TGF-β1/IL-10信号传导抑制单核细胞的功能和吞噬作用,目前关于miR-23a-3p/TLR4在ACH中的作用报道较少,故本研究分析了ACH 患者血清miR-23a-3p表达水平与TLR4的关系,结果显示,血清miR-23a-3p表达水平与TLR4呈正相关,提示miR-23a-3p可能与TLR4 相互作用进而影响ACH 发生发展,但其机制需结合基础实验加以证实。进一步研究显示,血清miR-23a-3p、TLR4 联合预测ACH 患者预后的AUC 为0.941,敏感度为90.4%,特异性为89.7%,提示miR-23a-3p、TLR4 联合可提高对ACH 患者预后的预测价值,为临床判定ACH患者预后提供新思路。
综上所述,ACH患者血清miR-23a-3p、TLR4水平较高,miR-23a-3p与TLR4呈正相关,且miR-23a-3p、TLR4 均与ACH 患者预后相关,两者联合检测可提高预测ACH 患者预后的价值,为临床预测ACH 患者预后提供新思路。但后期仍需深入探讨miR-23a-3p、TLR4 在ACH 中的机制,为诊治ACH、评估ACH 患者预后增加说服力。

