儿童重症肺炎的免疫功能变化及预后危险因素
孙星星,林 海
(1.福建医科大学附属泉州第一医院 儿科,福建 泉州 362000;2.福建省妇幼保健院 PICU,福建 福州 350001)
儿童重症肺炎发病率高,起病较急,是发展中国家儿童死亡的重要原因。发展中国家的重症肺炎患儿50%~80%需住院治疗[1]。婴幼儿是重症肺炎发病的主要年龄段,并发症多,相关实验指标变化大。重症患者在治疗中可能会出现一系列并发症,如脓毒症、胸腔积液等,对患者的预后效果具有较大的影响[2]。儿童重症肺炎在临床中的主要表现在于通气与换气发生障碍及肺内、肺外并发症。在病情的发展中,可能会出现呼吸衰竭、心力衰竭、休克等。对有基础疾病患儿的治疗难度更大,甚至有更高的死亡率。儿童重症肺炎对患儿的身心健康及生长发育有较大影响[2]。研究表明,儿童重症肺炎的发病机制可能与细菌、病毒或其他病原体对呼吸道上皮细胞直接损伤及其分泌的毒素损伤、免疫功能失调及全身炎症反应有关,但其具体发病机制尚未阐明[3]。为进一步探究儿童重症肺炎的免疫水平变化及其对预后的影响,本研究探讨分析儿童重症肺炎患者免疫功能变化及其临床意义,为临床预测患者预后提供参考依据,现报道如下。
1 资料与方法
1.1病例选择 选取2019年12月-2021年12月福建医科大学附属泉州市第一院PICU儿童重症肺炎患儿152例,根据治疗后转归情况分为完全缓解组与未完全缓解组(部分缓解或死亡)。完全缓解组104例,未完全缓解组48例。纳入标准:满足中华医学会儿科分会对儿童重症肺炎的相关诊断标准,并经影像学等手段确诊,临床资料完整者。排除标准:合并其他严重感染性疾病;研究前接受过免疫抑制治疗;合并严重免疫功能缺陷或其它严重基础疾病;未取得家属知情同意者。
1.2研究方法
1.2.1资料收集 包括性别、年龄、发病季节、血常规、C反应蛋白(C-reactive protein,CRP)、住院天数、儿童危重病例评分量表(pediatric critical illness score,PCIS)(入院后24小时内评分)等临床资料,实验室检查结果、转归等。
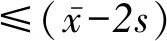
1.2.3PCIS 主要包括心率、血压、呼吸、血氧分压、pH值、血钠、血钾、肌酐或血尿素氮、血红蛋白、胃肠系统症状。在患儿入院后第1天用其评价患儿病情严重程度,选择1天内最异常检测值进行评分,血尿素氮或肌酐评分时计1项。>90分为非危重;70~90分为危重;<70分为极危重[5]。
2 结 果
2.1两组临床资料 完全缓解组104例,男性56例,女性48例;未完全缓解组48例,男性24例,女性24例。两组性别差异无统计学意义(P>0.05)。两组年龄、发病季节差异有统计学意义(P<0.05)。完全缓解组住院天数显著低于未完全缓解组,差异有统计学意义(P<0.05)。完全缓解组血常规白细胞计数及CRP数值明显低于未缓解组,差异有统计学意义(P<0.05)。见表1。
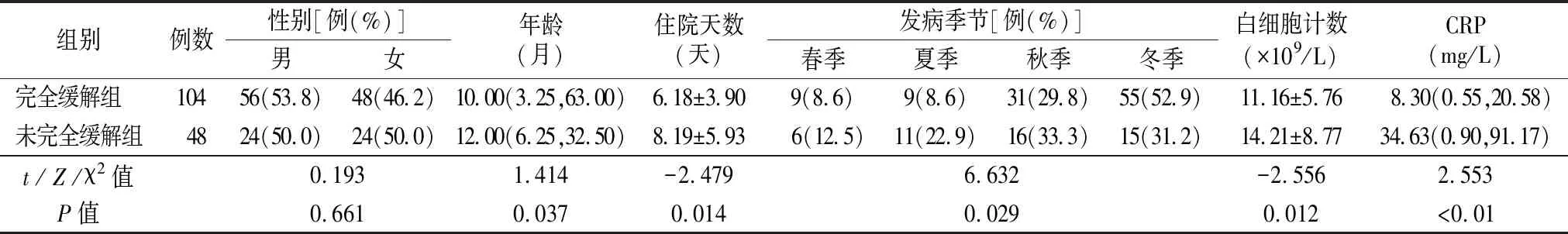
表1 两组一般资料比较
2.2两组入院后24小时内PCIS评分 未完全缓解组PCIS评分水平低于完全缓解组,差异具有统计学意义(P<0.05),见表2。
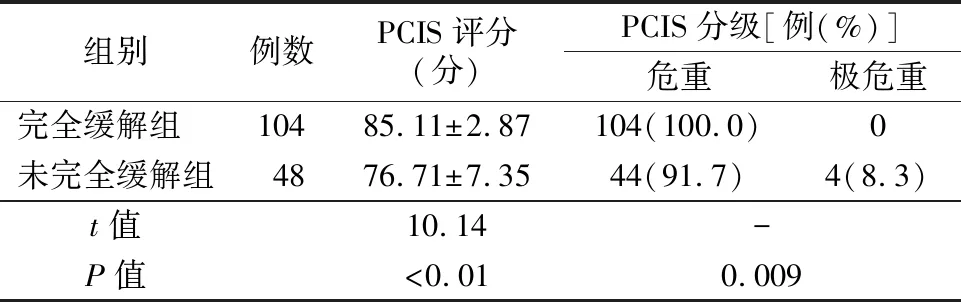
表2 两组PCIS评分比较
2.3两组淋巴细胞及免疫球蛋白水平 两组在CD3+、CD4+、 CD8+与B淋巴细胞水平及IgG、IgM与IgA水平上差异均有统计学意义(P<0.05)。与完全缓解组相比,未完全缓解组免疫指标处于低水平者占更大比例。见表3。
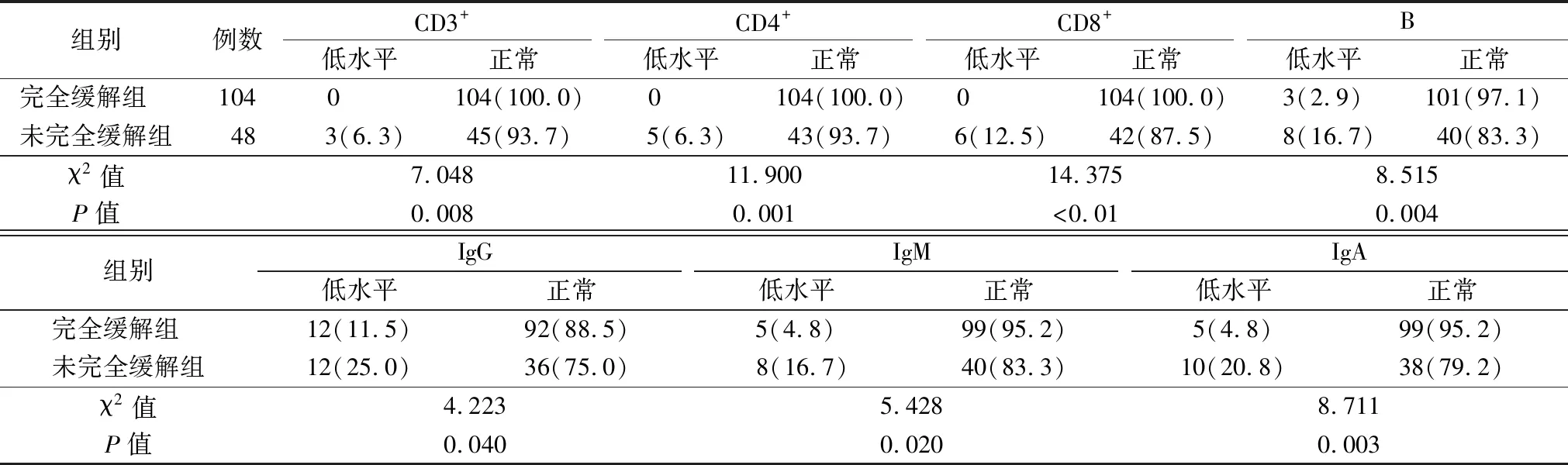
表3 两组淋巴细胞及免疫球蛋白水平比较[例(%)]
2.4预后相关危险因素Logistic回归分析 将年龄、住院天数、发病季节、白细胞计数、CRP、PCIS评分、体液免疫、细胞免疫数值纳入Logistic回归分析。经分析后显示年龄、发病季节、PCIS评分、CD4+及IgG水平均为影响预后的独立危险因素(P<0.05),见表4。
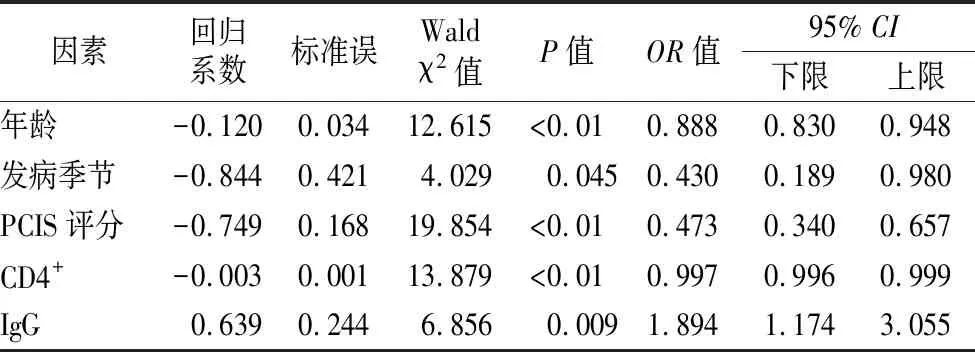
表4 预后相关危险因素分析
3 讨 论
儿童重症肺炎起病急、来势猛、并发症多、常累及全身、典型表现常被掩盖,往往因诊治不当或抢救不及时,导致病情进展恶化,甚至死亡[6]。本组资料显示,秋冬季是儿童重症肺炎的好发季节,且是独立危险因素。根据杨小青等[7]的研究,秋冬季节的儿童重症肺炎发病率相比春夏季明显增高,提示季节、天气是儿童重症肺炎的高危因素。本研究病例所在地区的冬季呼吸道病毒感染发生率上升,寒冷导致人们外出减少,可能会增加环境拥挤和室内空气污染从而使患者接触潜在感染的危险性增加,总发病率高。肺炎按照病原体分类有细菌性肺炎、病毒性肺炎、支原体肺炎等[8], 随着抗生素的广泛应用,耐药菌在肺炎发病中扮演着越来越重要的角色[9]。由于各器官尚在发育,免疫功能尚不完善,对疾病的防御意识较差,儿童易受环境中病原体侵害而成为肺炎的好发人群[10]。肺炎的早期临床表现为发热、咳嗽、气促等, 部分患儿伴发食欲不振、烦躁不安等全身症状。若炎症控制仅局限在肺部较小范围,则病情较轻,恢复顺利,若患儿存在重症肺炎高危因素,则感染可能难以控制,肺部受累面积扩大,可致肺通气功能及肺换气功能障碍,出现低氧血症及高碳酸血症,严重者可出现呼吸衰竭、心力衰竭、中毒性脑病、微循环障碍、休克、弥散性血管内凝血、多脏器功能衰竭等严重并发症甚至导致患儿死亡[11]。儿童患者由于身体器官发育不成熟,自身免疫力比较弱,在患病后症状较为明显,且进展快,治疗也具有一定难度,容易出现反复,如果不能早期识别儿童重症肺炎,可能耽误最佳治疗时机,对其他脏器造成累及,损伤身体机能,引发其他病症,例如急性肾炎、心肌炎、脑膜炎等,影响预后。练文灿[12]研究提示观察组细胞免疫与体液免疫检测结果与对照组存在明显差异,同时观察组内比较,重症肺炎患儿的细胞免疫与体液免疫检测结果与轻症患儿也有明显差异,说明细胞免疫与体液免疫检测结果作为儿童肺炎的诊断与预后指标有现实意义。
早期发现并干预儿童肺炎,预防肺炎的进一步进展并控制并发症的发生显得尤为重要。虽然儿童重症肺炎的发病机制目前尚不明确,但有研究指出,细胞免疫在儿童重症肺炎的发生及发展中发挥着重要作用[13]。病原体侵入肺部,产生炎症介质与患儿的支气管上皮细胞直接相互作用,激活细胞免疫,引起细胞损伤,白细胞介素-1β在其中发挥了重要作用,是炎症的主要调节因子[14-15]。同时,部分病原体表面的抗原成分与人体组织细胞成分类似,因而可发生交叉反应,激活补体系统产生自身免疫反应,大量白细胞通过炎症介质的引导抵达病变部位,释放的水解酶可导致周围组织器官损伤。
目前有假说认为,初次感染时肺部免疫水平不足,导致肺部感染持续时间较长,继而引发过度的免疫反应,抑或是肺炎感染时激发的过度活跃的固有免疫反应,是儿童肺炎发展为重症肺炎的重要免疫学机制[16]。重症肺炎患儿的lgM 与肺部感染之间存在着密切联系,其是初次体液免疫中最先出现的抗体;lgA 具有抗菌作用,参与黏膜局部免疫,当机体出现感染后, 其值会降低;lgG是血清与体液中含量最高的抗体,在免疫应答中发挥着中和多种毒素、激活补体的作用;以上指标是临床常用免疫指标, 可以反映患者免疫功能。随着免疫系统的逐渐发育,正常儿童在1~6岁期间体液免疫功能不断提高,IgG、IgM、IgA水平不断升高。感染肺炎的患儿处于炎症反应状态下,细胞免疫及体液免疫激活[17]。介导体液免疫的主要抗体为免疫球蛋白。感染肺炎可导致血清IgA和血清IgG水平的升高。T淋巴细胞亚群测定反映患儿的细胞免疫水平,CD4+T淋巴细胞又称辅助性T淋巴细胞,CD4+是辅助T淋巴细胞的标志, 具有很强的敏感性, 在机体细胞免疫应答中发挥着调节、制约作用[18]。CD8+T淋巴细胞又称细胞毒性T淋巴细胞,分别在启动免疫反应与杀伤靶抗原过程中发挥作用,重症肺炎患儿细胞免疫功能下降,可导致肺炎进展与器官损伤[19]。在干预前,往往可检测到患儿的CD4+/CD8+比值失衡,IgA、IgG、IgM等免疫球蛋白水平降低[20]。
本研究结果显示,重症肺炎完全缓解患儿与未完全缓解患儿在CD3+、CD4+、CD8+与B淋巴细胞水平及IgG、IgM与IgA水平上差异均有统计学意义(P<0.05),这提示重症肺炎早期淋巴细胞亚型检测及免疫球蛋白检测指标较低的患儿发生不良预后的可能性较大,也证实细胞免疫及体液免疫与重症肺炎的发生及发展关系密切[21]。因此,监测细胞免疫、体液免疫指标可能对早期识别儿童重症肺炎有一定帮助,为早期干预儿童重症肺炎提供新的思路[22]。同时,本研究对比了不同预后的两组患儿的年龄情况及PCIS评分,结果提示,预后较差的患儿年龄小于预后较好的患儿,这可能与患儿免疫功能发育规律相关。预后较差的患儿PCIS评分显著低于预后较好患儿,未完全治愈组PCIS评分较完全治愈组低,多评为极危重。因而早期结合年龄及PCIS评分进行评估,可为判断患儿预后、选择合适的治疗方案提供参考。
综上所述,重症肺炎患儿若年龄小、PCIS评分低、秋冬季节发病、且伴有较低水平的CD4+、IgG,往往提示预后较差,需采取更为积极的治疗措施。

