酪蛋白-汉麻籽蛋白复合物制备工艺优化及其消化性和致敏性研究
王丹凤,薛舒苑,周学府,钟 宇,郑远荣,邓 云*
(1 上海交通大学农业与生物学院 上海 201100 2 内蒙古农业大学 呼和浩特 010018 3 乳业生物技术国家重点实验室 上海乳业生物工程技术研究中心光明乳业股份有限公司乳业研究院 上海 200436)
酪蛋白(Casein)占牛奶蛋白的80%左右,是牛奶中最主要的蛋白质,由αs1-、αs2-、β-和κ-casein 组成,分子质量在19~24 ku 之间,具有独特的结构和功能特性。酪蛋白是牛奶的主要过敏原,其中αs1-casein 致敏性最强,牛奶过敏人群中约有65%对αs1-casein 过敏[1]。对αs1-casein 的致敏性及降低其致敏性研究至今仍是热点[2-5]。
汉麻籽蛋白(Hemp protein isolate,HPI)由70%左右的麻仁球蛋白和30%左右的白蛋白组成,是一种新兴的植物蛋白源。研究显示,白蛋白比麻仁球蛋白的二级结构更有序[6]。HPI 包含所有必需氨基酸(EAA)[7],必需氨基酸指数(>80)显著高于其它植物蛋白,如板栗蛋白(76~79)、藜麦种子蛋白(79)[8]。此外,HPI 几乎没有致敏性且抗营养因子含量极低,有助于其在食品工业中的广泛应用[9]。
食品配方中植物蛋白替代动物蛋白已成为重要趋势[10]。HPI 因独特的营养特性和低致敏性而被认为是酪蛋白优良的替代品[11]。然而,HPI 较差的溶解性和加工特性使其简单地替换酪蛋白会对食品品质产生不利影响。如何降低HPI 对其替代后的动植物蛋白复合体系的影响鲜有报道。谷氨酰胺转氨酶(TG 酶)能诱导蛋白质分子间或分子内的共价交联,进而修饰蛋白特性[12]。通过TG 酶强化酪蛋白与HPI 间的相互作用,以实现HPI 对酪蛋白的部分替代,具有降低HPI 对食品体系不利影响的潜力。本团队前期研究已证实Casein-HPI复合物具有更强的乳化性、凝胶性,而交联降低了复合物的抗氧化性。本文采用响应面法优化Casein-HPI 复合物的制备工艺,目的是制备具有最优乳化活性、凝胶持水率和抗氧化性保留率的复合蛋白。考察最优工艺下制备的复合物的体外消化率、致敏性、微观结构,旨在为实现HPI 替代或部分替代酪蛋白提供理论依据。
1 材料与方法
1.1 主要材料与试剂
汉麻籽,巴马十琅生态农业有限公司。
酪蛋白(C3400-500 g),上海Sigma 公司。胃蛋白酶、胰蛋白酶,国药集团化学试剂有限公司;谷氨酰胺转氨酶,江苏一鸣生物股份有限公司。
1.2 主要仪器与设备
D-1903 扫描电子显微镜,德国WITec 公司;UV-1800 紫外分光光度计,岛津国际贸易(上海)有限公司;PT 10-35GT 均质机,瑞士Kinematica公司;Z326K 低温离心机,德国哈默股份公司;Triad 冷冻干燥机,美国Labconoco 公司。
1.3 试验方法
1.3.1 HPI 提取 参照Alavi 等[13]的方法,粉碎后的汉麻籽粉中添加正己烷(0.33 g/mL)搅拌2 h 脱脂,该过程重复3 次。将脱脂后的汉麻籽粉置于通风橱中,室温(20 ℃)下风干24 h,后将汉麻籽粉分散在去离子水中(0.1 g/mL),用6 mol/L NaOH 调节pH 值至11,并在25 ℃下连续搅拌2 h。将混合物在6 000×g 下离心10 min,取上清液,用6 mol/L HCl 调节pH 值至4.5,并在4 ℃下过夜以沉淀蛋白质。沉淀通过6 000×g 离心10 min 分离,然后分散于蒸馏水中并调节pH 值至7.0,最后将混合物冻干,并在4 ℃下储存备用。
1.3.2 Casein-HPI 复合物的制备 Casein-HPI 的制备参考Yang 等[14]的方法。将酪蛋白溶液(6%)和HPI 溶液(6%)以一定比例混合,加入TG 酶并充分搅拌后,在40 ℃条件下水浴交联一段时间。交联结束后在80 ℃下水浴10 min,使TG 酶失活以终止反应。蛋白溶液经真空冷冻干燥,并于4 ℃保存备用。
1.3.3 Casein-HPI 复合物制备条件的响应面设计
1)因素及水平 通过单因素实验,根据Box-Behnken 设计原理,采用三因素三水平的响应面分析法,研究其对Casein-HPI 复合物乳化活性、抗氧化性保留率和凝胶持水率的影响。因素及水平见表1。
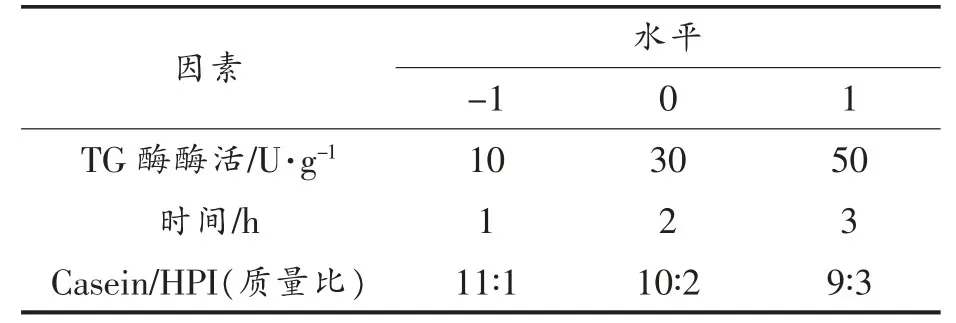
表1 响应面的因素及水平Table 1 Response surface factors and levels
2)响应面试验方案 试验方案由Design-Expert 8.0 软件随机生成,如表2 所示。
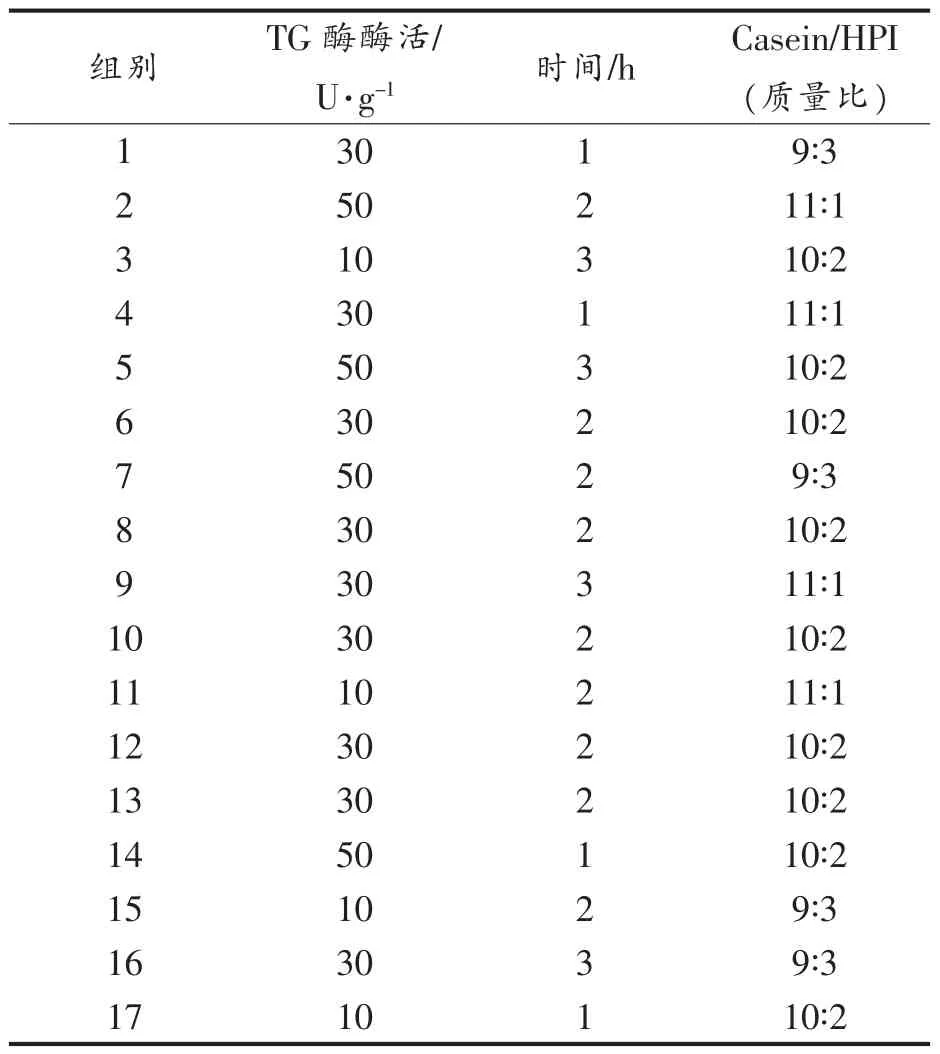
表2 响应面试验方案设计Table 2 Response surface design
3)最优工艺选择 在Design-Expert 软件中选择乳化活性、抗氧化性保留率和凝胶持水率均最高的值(各指标的权重为1∶1∶1),由软件进行最优工艺选择,使用RSM 法预测最优工艺和处理效果,从而得到Casein-HPI 复合物最优的制备工艺。
4)最优工艺验证 按照最优工艺制备Casein-HPI 复合物,测定其乳化活性、抗氧化性保留率和凝胶持水率,并与软件计算出的理论值对比,验证试验结果与实际检测结果的一致性与可靠性。
1.3.4 乳化活性测定 蛋白质的乳化活性指数(EAI)测定参照Jiang 等[15]的方法并稍作修改。将6 mL 质量浓度为2.5 mg/mL 蛋白质样品与3 mL大豆油混合以制备水包油乳液,并使用均质器以10 000 r/min 均质1 min。然后吸取30 μL 乳液加入至3 mL SDS(1 g/L)溶液中,于波长500 nm 处测量吸光度。根据式(1)计算EAI:
式中,T——log 与ln 的换算常数,ln10≈2.303;A0——稀释的乳液吸光度;D——稀释倍数(100);C——蛋白溶液质量浓度(2.5 mg/mL);Φ——油相体积分数(1/3)。
1.3.5 凝胶持水率测定 将葡萄糖酸内酯(GDL)粉末以0.2 g/g 蛋白质的比例添加到Casein-HPI溶液(60 mg/mL)中,40 ℃孵育3 h,将凝胶样品转移到4 ℃下稳定24 h。凝胶持水率测定参照Tang等[16]的方法并稍作修改。凝胶样品以2 000×g 离心15 min。根据式(2)通过凝胶中的水损失计算持水率(WHC):
式中,M1——离心前的凝胶质量(g);M2——离心后去除水分的凝胶质量(g)。
1.3.6 抗氧化保留率测定 复合物抗氧化性通过ABTS 法测定,具体参照Jiang 等[17]的方法,其保留率为交联后与交联前复合物抗氧化能力的比值。将7.4 mmol/L ABTS 溶液加到2.6 mmol/L 过硫酸钾中,使用前室温下暗处静置至少12 h。然后将ABTS 溶液用5 mmol/L pH 7.0 的磷酸钠缓冲盐水溶液稀释,直至在波长734 nm 下的吸光度达到0.7±0.02。测定时,将1 mL 蛋白样品加到2 mL 稀释的ABTS 溶液中。室温下反应6 min 后,用酶标仪在波长734 nm 处测定样品的吸光值AS。以蒸馏水为空白对照测定的吸光值为AC。抗氧化性保留率计算公式如下:
式中,AS0——未经TG 酶交联的蛋白样品吸光值;AS——经TG 酶交联的蛋白样品吸光值;AC——空白对照的吸光值。
1.3.7 体外消化率测定 参照He 等[18]的方法,通过体外消化过程中的氮释放分析,评估蛋白样品的体外消化率。为模仿人体内消化环境,整个过程在37 ℃水浴中进行。首先配制质量浓度为10 g/L的蛋白悬浮液,并用2 mol/L 盐酸调节pH 值至2.0。随后向悬浮液中加入胃蛋白酶(20 mg/g pro),振荡孵育1 h。用1 mol/L NaOH 调节悬浮液pH 值至7.5,以终止胃消化阶段,后加入胰蛋白酶(20 mg/g pro),振荡孵育2 h。在体外消化1,2,3 h时,分别收集样品溶液,并用同体积的15%的三氯乙酸洗涤,随后在8 000×g 下离心15 min,收集上清液。通过凯氏定氮测定上清液的氮含量,根据公式(4)计算样品的体外消化率:
式中,N0——上清液N 含量(mg);N总——样品总氮含量(mg)。
1.3.8 致敏性测定 参照Hu 等[19]的方法,用ELISA 测定蛋白样品消化前、后的致敏性。将样品稀释适当倍数,将100 μL 稀释液加入到包被有特异性抗体的微孔板中,室温下(20~25 ℃)孵育10 min,倒出孔中液体,倒置微孔板并在吸水纸上拍打3 次,加入250 μL 洗涤缓冲液洗涤,重复洗涤3 次。加入酶标记的抗体,小心混匀,室温下孵育10 min,倒出孔中的液体,并重复上述洗涤动作,后加入100 μL 底物,室温下暗处孵育10 min,使底物与酶连接物结合。最后加入100 μL 反应终止液并充分混合,于波长450 nm 处测量吸光值。根据标准曲线,计算样品的抗原性。
1.3.9 微观结构观察 将蛋白样品喷金处理,随后用扫描电子显微镜在5 kV 电压条件下观察其微观结构。
1.4 数据处理
采用SPSS 26.0 进行统计分析,使用Duncan多范围检验(P<0.05)进行单向方差分析。结果以“平均值±标准差()”表示,使用OriginPro 2018进行绘图。
2 结果与分析
根据单因素实验结果,选择酶活(10,30,50 U/g)、交联时间(1,2,3 h)、Casein/HPI 的质量比(11∶1,10∶2,9∶3)进行响应面试验。
2.1 响应面优化Casein-HPI 复合物制备
2.1.1 Box-Behnken 试验结果 根据上述试验方案,在不同酶活、交联时间及Casein/HPI 质量比条件下制备Casein-HPI 复合物,并测定其乳化活性、凝胶持水率及抗氧化性保留率。结果如表3 所示。
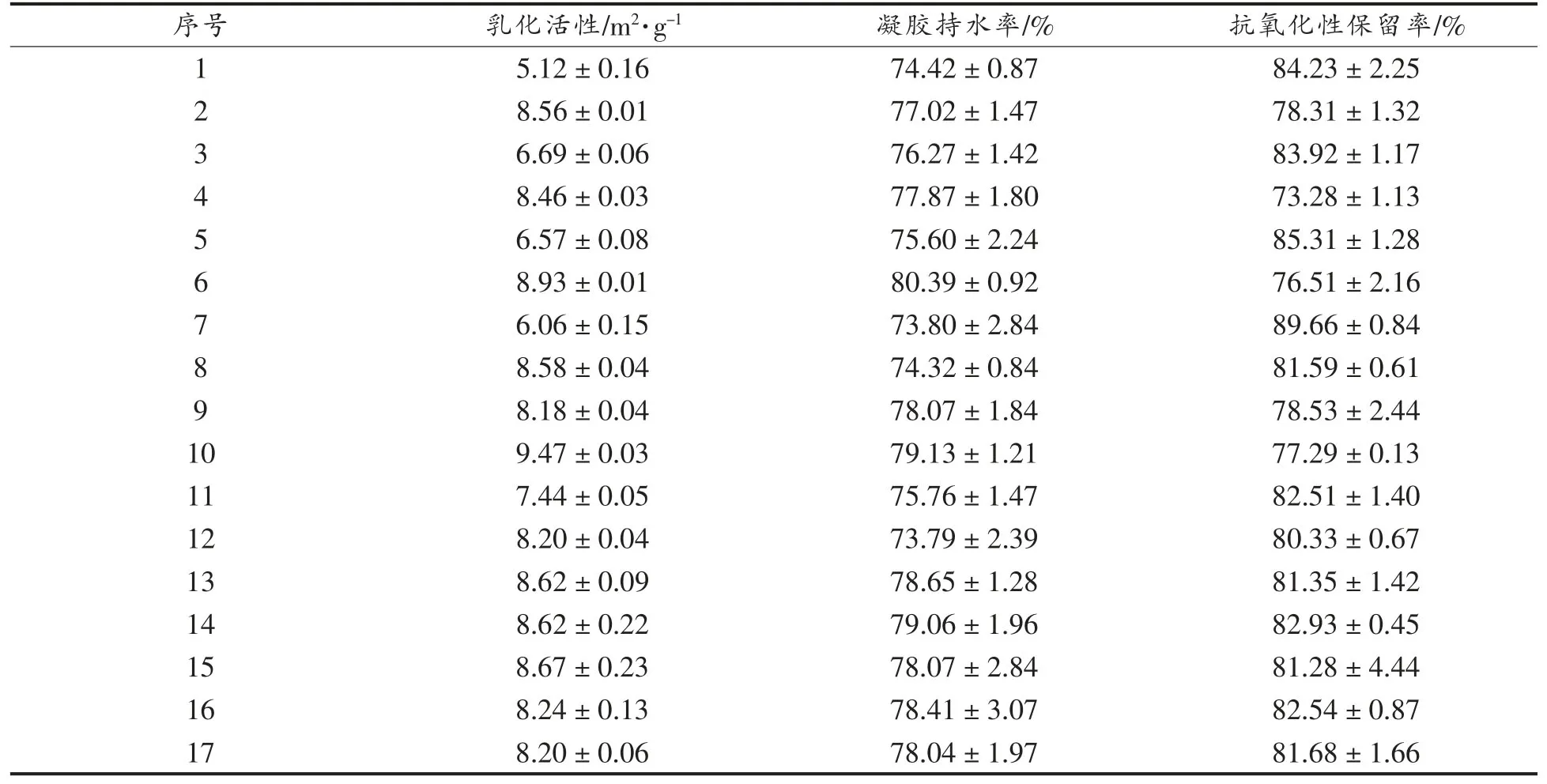
表3 响应面试验结果Table 3 Results of the response surface experiment
2.1.2 自变量对Casein-HPI 复合物乳化活性的影响 用Design-Expert 软件对回归模型进行方差分析(ANOVA),结果表明了各个变量的重要性以及变量之间的相互作用,如表4 所示。模型的F=58.31,P=0.0001<0.05,差异显著,表明方程可能由于噪音干扰导致0.01%的概率与实际结果有差异。函数模型R2=0.964,说明模型预测值和试验值拟合度高,预测Casein-HPI 乳化活性最大值是可信的。回归方程的方差分析结果显示,一次项X1,X2,X3,交互项X1X2和二次项X12对乳化活性的影响显著。回归分析得到的回归方程为:
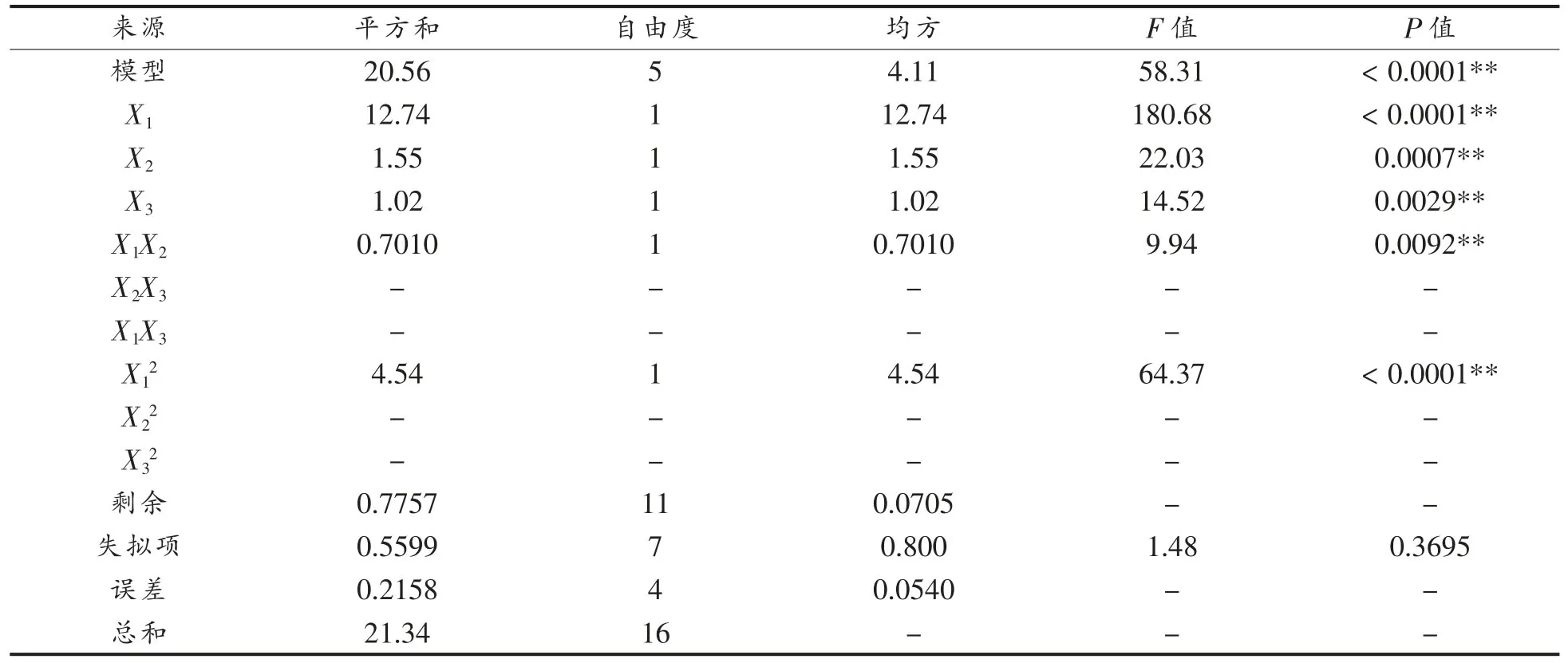
表4 乳化活性的响应面模型拟合结果Table 4 Model fitting for EAI
如图1 所示,随TG 酶酶活增大,Casein-HPI复合物乳化活性先增大后减小,TG 酶交联暴露出Casein-HPI 的疏水性基团,并在低酶活条件下达到亲水性和疏水性平衡。蛋白乳化活性在酶活较低的条件下呈增大趋势,然而随酶活继续增大,过度交联导致其亲水和疏水相互作用被打破,而使其乳化活性降低[20]。然而此趋势在交联时间缩短时发生改变,尤其在1 h 时,随TG 酶酶活增大乳化活性呈持续增大的趋势,说明短时间交联条件下,达到亲水性和疏水性平衡需要更大的TG 酶酶活。另外,随交联时间的延长,Casein-HPI 复合物乳化活性呈增大趋势,而该趋势随着酶活增大变得不显著。尤其当TG 酶酶活为50 U/g 时,Casein-HPI 复合物的乳化活性随处理时间延长基本无显著变化。可能是因为在高酶活条件下,交联反应达到饱和所需的时间更短。此外,由图1 可知,增大HPI 在复合物中的配比会降低Casein-HPI的乳化活性。
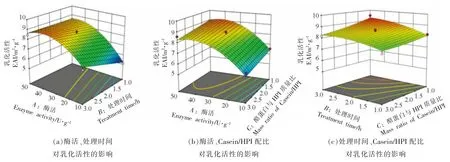
图1 不同自变量对Casein-HPI 复合物乳化活性影响的响应面等高线图Fig.1 The response surface and contour for the effect of emulsifying activity index(EAI)of casein-HPI complex between different independent variables
2.1.3 自变量对Casein-HPI 复合物抗氧化性保留率的影响 如表5 所示,模型的F=76.13,P=0.0001<0.05,差异显著,表明方程可能由于噪音干扰导致0.01%的概率与实际结果有差异。函数模型R2=0.9786,说明模型的预测值和试验值拟合度高,预测Casein-HPI 复合物抗氧化性保留率最大值可信。由回归方程的方差分析结果可以看出,一次项X1,X2,X3,交互项X1X2和二次项X12,X22对抗氧化性保留率的影响显著。回归分析得到的回归方程为:
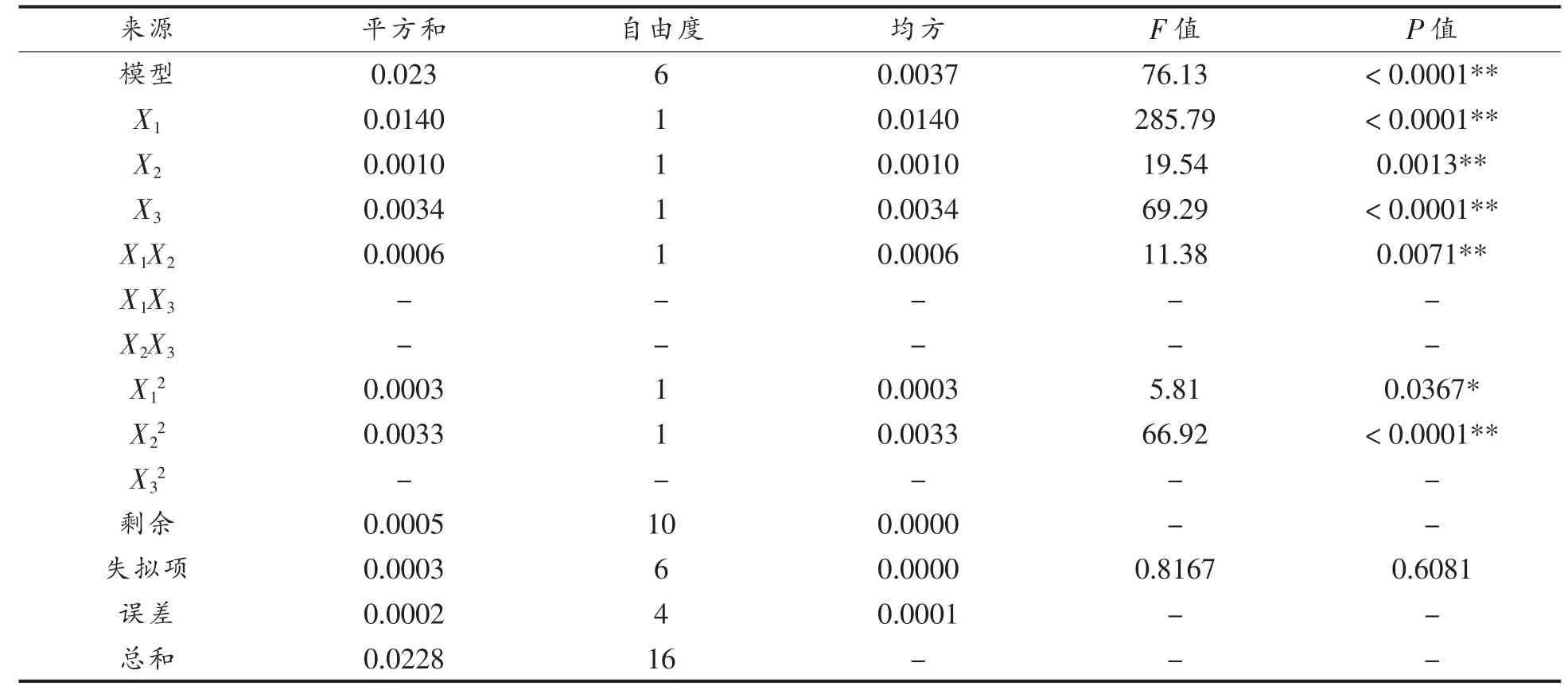
表5 抗氧化性保留率的响应面模型拟合结果Table 5 Model fitting for antioxidant retention rate
如图2 所示,随酶活增大,Casein-HPI 复合物的抗氧化性保留率呈下降趋势,表明交联处理对Casein-HPI 复合物的抗氧化性有抑制作用。根据预试验结果,酶活增大使得Casein-HPI 交联度增大,蛋白质的共价交联导致更多自由基清除活性位点被掩埋。然而,增大HPI 在复合蛋白中的配比能有效提高Casein-HPI 的抗氧化性保留率,如图2b 所示。结合预试验结果,添加HPI 导致复合蛋白交联度降低,复合物聚集程度降低,有效抑制了抗氧化基团的掩埋,从而使得蛋白质抗氧化性保留率提高。
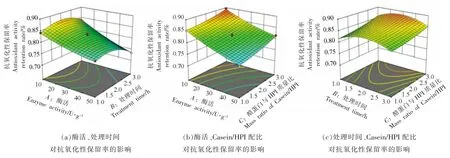
图2 不同自变量对Casein-HPI 复合物抗氧化性保留率影响的响应面等高线图Fig.2 The response surface and contour for the effect of antioxidant retention rate of casein-HPI complex between different independent variables
2.1.4 自变量对Casein-HPI 复合物凝胶持水率的影响 如表6 所示,回归模型方差分析(ANOVA)F=23.47,P=0.0001<0.05,差异显著,表明方程可能由于噪音干扰导致0.01%的概率与实际结果有差异。函数模型R2=0.9591,说明模型的预测值和试验值拟合度高,预测Casein-HPI 凝胶持水率最大值可信。由回归方程的方差分析结果可以看出,一次项X1,X3,交互项X1X2、X2X3和二次项X12,X22,X32对凝胶持水率的影响显著。回归分析得到的回归方程为:
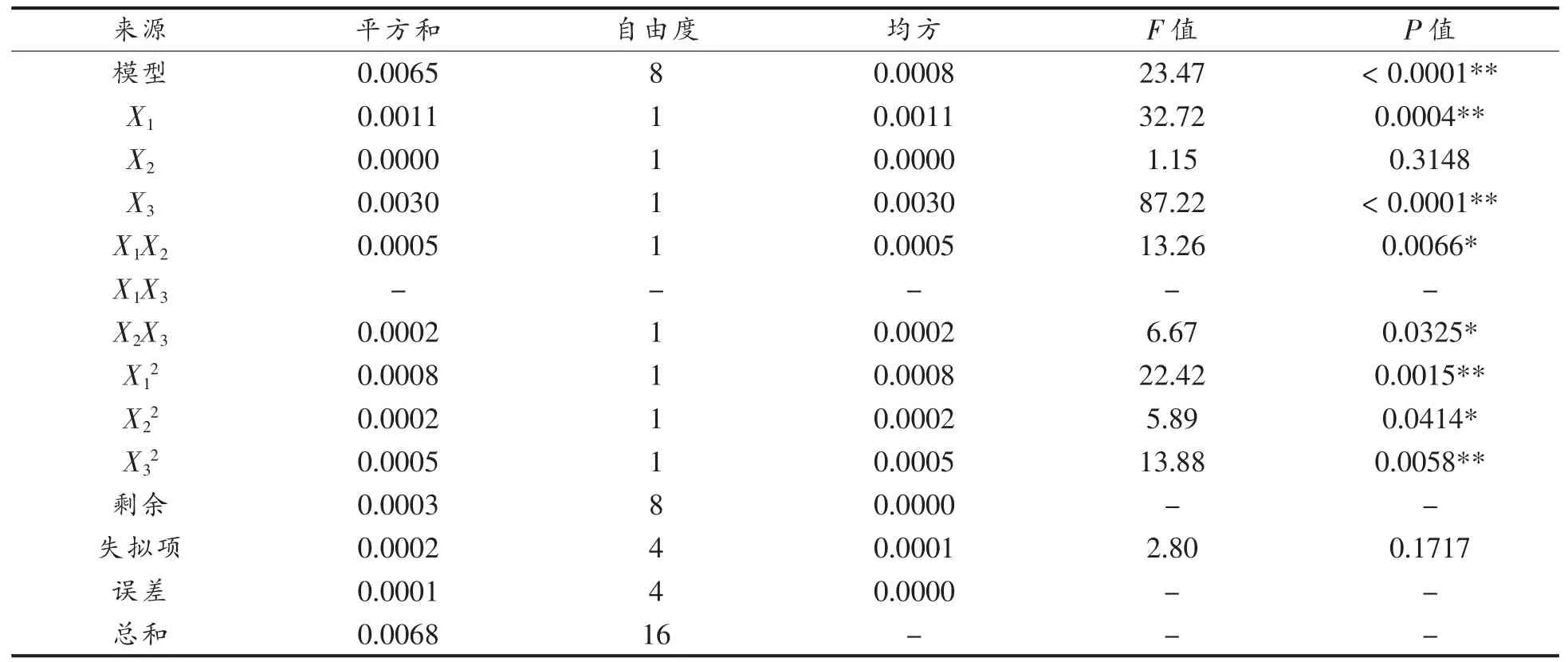
表6 凝胶持水率的响应面模型拟合结果Table 6 Model fitting for WHC of gel
如图3 所示,Casein-HPI 凝胶持水率随TG酶酶活的升高和交联时间的延长呈先上升后下降的趋势。TG 酶交联能诱导蛋白凝胶形成致密的蛋白网络结构,有利于凝胶中保留更多水分。这使得在酶活和交联时间增大的初始阶段Casein-HPI复合物凝胶的持水率提升。而继续增大酶活或延长交联时间,过度交联导致Casein-HPI 与水分子的结合位点减少,凝胶持水率下降[21]。如图3c 所示,随着复合物中HPI 配比增大,Casein-HPI 复合物凝胶的持水率显著降低,是由于HPI 导致复合蛋白的交联度降低,形成更为疏松的网络结构,进而使得持水能力降低。HPI 含量增大导致凝胶持水率下降的趋势在高酶活条件下尤为明显,证实HPI 在高酶活条件下对复合物的交联存在更强的抑制能力。
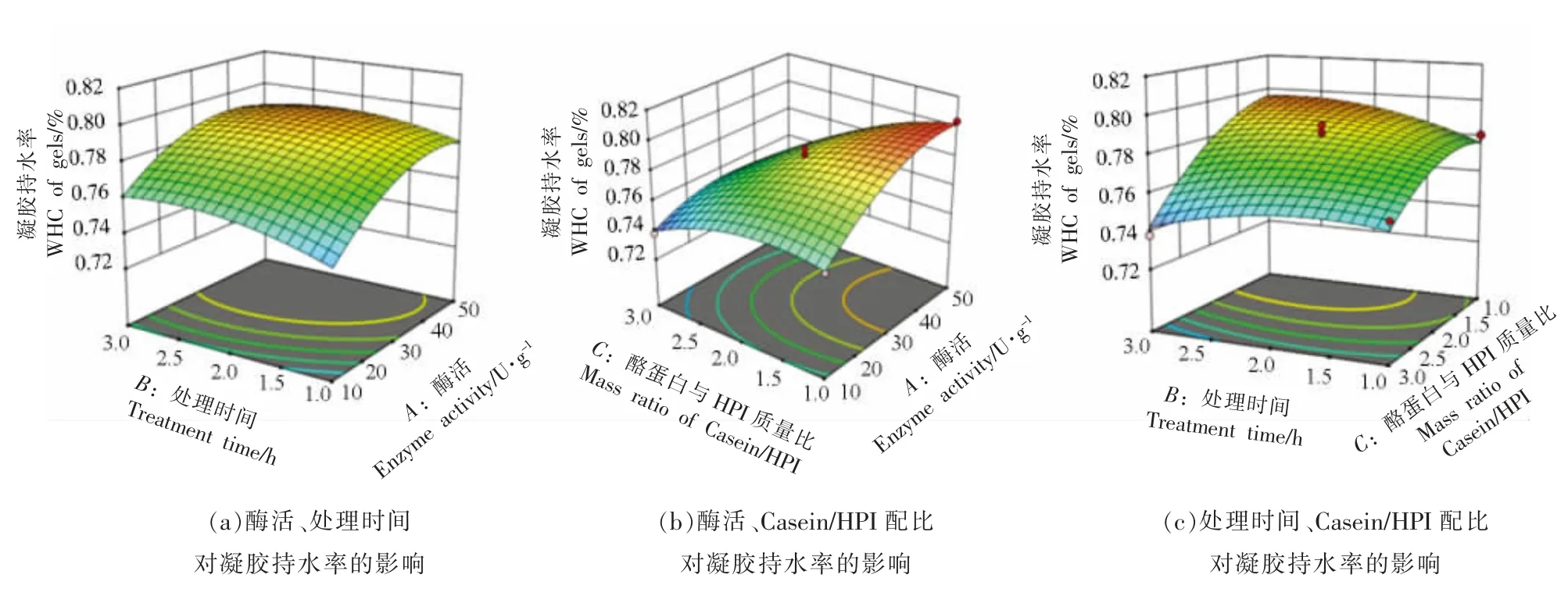
图3 不同自变量对Casein-HPI 复合凝胶持水率影响的响应面等高线图Fig.3 The response surface and contour for the effect of WHC of casein-HPI complex between different independent variables
2.1.5 最优交联工艺验证 将乳化活性、抗氧化性保留率、凝胶持水率的权重设为1∶1∶1,经RSM预测,Casein-HPI 最优交联条件为TG 酶酶活为31.90,交联时间为2.06 h,Casein/HPI 质量比为10.51∶1.49。按最优工艺制备Casein-HPI 复合物,对比实际值与预测值,结果如表7 所示,各预测值的相对偏差均小于5%,可见响应面法优化得到的最优工艺结果可靠。

表7 最优工艺条件制备的Casein-HPI 复合物实际值与预测值对比Table 7 Comparison of optimal processing Casein-HPI response value and prediction value
2.2 体外消化率
蛋白质体外消化率揭示了蛋白质被消化酶水解的能力,直接影响消化后氨基酸和肽的吸收,因此可体现出待测物的营养价值及在食品领域是否具有广泛应用的潜力[22]。图4 显示了酪蛋白、HPI、Casein-HPI 混合物(不添加TG 酶)以及最优工艺下制备的Casein-HPI 复合物体外消化过程中的氮释放曲线。4 种蛋白样品显示出相似的氮释放特性,其消化过程主要集中于胃消化阶段(0~1 h)和肠道消化前半阶段(1~2 h)。而在消化的2~3 h内,所有蛋白样品的氮释放曲线逐渐趋于平稳。He等[18]也报道了相似的结论,其发现大米谷蛋白的体外消化过程中肠道消化的后半阶段氮释放变得缓慢。在胃消化阶段中,酪蛋白、HPI 及Casein-HPI 混合物显示出较相似的消化特性。胃消化阶段结束后,上述3 种蛋白的消化率呈酪蛋白>Casein-HPI 混合物>HPI 的规律。而交联后的Casein-HPI 复合物在胃消化1 h 后消化率显著降低。赖氨酸作为胃蛋白酶酶切位点之一,在TG 酶诱导下与谷氨酰胺残基共价交联形成异肽键,从而抑制胃蛋白酶的水解作用[23]。Romano 等[24]研究了TG 酶对豆粉蛋白体外消化率的影响,发现TG酶诱导豆粉蛋白形成致密的网络结构而降低了其在胃消化阶段的消化率。
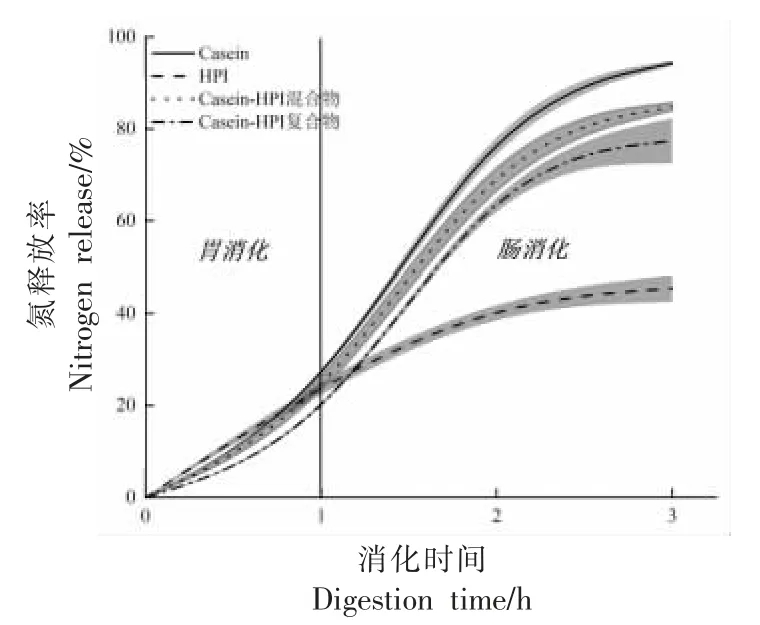
图4 酪蛋白、HPI、Casein-HPI 混合物、Casein-HPI 复合物的体外消化氮释放曲线Fig.4 Protein digestion curves of casein,HPI,Casein-HPI mixture,Casein-HPI complex in vitro
进入肠道消化阶段后,4 种蛋白氮释放量持续增加证实了胰蛋白酶的水解作用。在肠道消化阶段,酪蛋白、Casein-HPI 混合物以及Casein-HPI复合物的氮释放增加了3~4 倍,而HPI 显示出最平缓的释放曲线,其氮释放量仅增大1 倍左右,最终消化率仅有50%左右,表明HPI 含有较少的胰蛋白酶酶切位点。据报道[22,25],HPI 的体外消化率可达70%~80%,显著高于本文HPI 的消化率。一方面是因为体外消化阶段的时长不同,另一方面可能是因为本文的HPI 是由未脱壳的汉麻籽制备,壳中的酚类物质与蛋白形成多酚-蛋白质复合体从而导致消化率降低[25]。体外消化中,酪蛋白消化率最高,Casein-HPI 混合物介于酪蛋白和HPI之间。与上述胃消化阶段相似,TG 酶交联显著降低了Casein-HPI 复合物的体外消化率,归因于TG 酶诱导更大分子质量的抗消化共聚物的形成。然而,Casein-HPI 复合物消化率的降低有利于增强饱腹感,并且在胃肠道特异性药物递送方面具有应用潜力[18]。
2.3 致敏性测试
检测了蛋白质消化前、后的抗原含量以表征蛋白质的致敏性。如图5 所示,酪蛋白、Casein-HPI 混合物在体外消化前致敏性没有明显差异。TG 酶交联显著降低了混合物体外消化前的致敏性。这是因为TG 酶能催化赖氨酸残基和谷氨酰胺残基生成异肽共价键,最终形成多分支结构的共聚物。当有足够多的交联位点参与交联时,TG酶诱导的多分支结构可能会掩盖潜在的IgE 结合位点,进而降低蛋白质的致敏性[26]。Li 等[26]也曾证明TG 酶交联具有降低蛋白致敏性的潜力,其发现酪蛋白、乳清蛋白、大豆蛋白通过TG 酶交联能有效降低其致敏性。
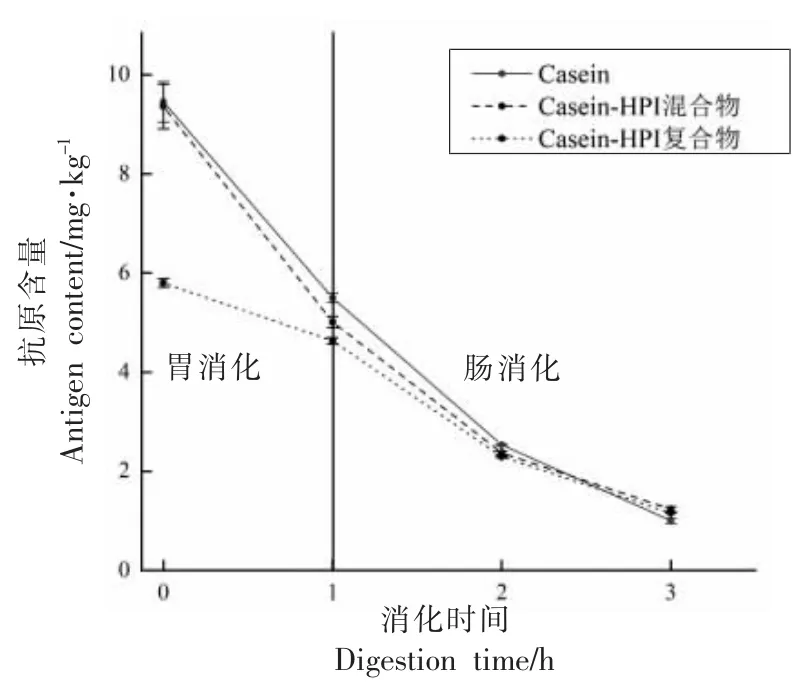
图5 酪蛋白、HPI、Casein-HPI 混合物、Casein-HPI 复合物致敏性Fig.5 Allergenicity of casein,HPI,Casein-HPI mixture,Casein-HPI complex
消化作用显著降低了蛋白的致敏性,归因于消化酶的水解作用破坏了IgE 结合位点[27]。消化结束后,酪蛋白、Casein-HPI 混合物,Casein-HPI 复合物显示出相似的致敏性。表明仍有未被消化酶水解的过敏原表位,这也证实了TG 酶交联只能降低消化前或轻度水解时的致敏性,其交联作用并未破坏蛋白的IgE 结合位点,而是通过聚合作用掩埋其过敏原表位。因此随着消化时间的延长,尤其是后期阶段,Casein-HPI 致敏性的降低主要是由于蛋白酶对过敏原表位的破坏作用而与TG酶无关。
2.4 微观结构
通过扫描电子显微镜观察进一步表征蛋白质交联前、后的微观结构。如图6 所示,酪蛋白呈现表面光滑的片状微观结构。而HPI 的表面相对粗糙,可能是碱溶酸沉法提取HPI 过程中蛋白质有轻微变性。交联后的Casein-HPI 显示出不同于其它3 种蛋白的微观结构,表面出现明显的颗粒状突起。证明TG 酶交联显著改变了复合蛋白的微观形貌,主要是因为TG 酶对复合蛋白的结构修饰。Yang 等[14]也发现卵黄高磷蛋白与面筋蛋白通过TG 酶交联后,其微观结构从蜂窝状空腔结构逐渐向致密、光滑的结构转化。

图6 酪蛋白、HPI、Casein-HPI 混合物、Casein-HPI 复合物微观形貌Fig.6 Morphology of casein,HPI,Casein-HPI mixture,Casein-HPI complex
3 结论
1)以乳化活性、凝胶持水率和抗氧化性保留率作为响应指标,TG 酶酶活、处理时间和酪蛋白/HPI 质量比为自变量,采用响应面法优化了Casein-HPI 制备条件。3 个响应值模型拟合方程的R2值均超过0.9,P 值均小于0.05,失拟项均不显著,证实了模型的有效性。通过响应面法拟合后得出的最优工艺条件为:TG 酶酶活31.90 U/g,交联时间2.06 h,酪蛋白/HPI 质量比10.51∶1.49。
2)在最优工艺下制备的Casein-HPI 复合物与未交联蛋白相比具有更强的抗酶解能力。酪蛋白通过TG 酶与HPI 交联在消化前或轻度水解阶段致敏性显著降低,而在消化末期复合物致敏性和未交联蛋白没有显著区别。同时,交联改变了混合蛋白的微观形貌,源于TG 酶对蛋白质结构的修饰。
3)本文通过TG 酶强化酪蛋白和HPI 的相互作用以实现HPI 部分替代酪蛋白的同时,能有效缓解HPI 对复合蛋白的不利影响,进而促进HPI 在食品工业中的广泛应用。

