地参结合酚提取物体外保肝作用
高春燕,杨文艺,洪 玥,张天阳,李 望,李媛丽,卢跃红*
(1 北方民族大学生物科学与工程学院 银川 750021 2 大理大学公共卫生学院 云南大理 671000)
肝脏疾病是最常见的慢性疾病,包括肝炎、肝硬化、纤维化和肝细胞癌,已成为死亡和疾病的首要原因之一[1]。许多因素,如营养不足、病毒感染、酒精和药物依赖、异生物暴露和代谢性疾病,都参与了肝脏疾病的产生和进一步发展[2]。根据全球疾病负担(GBD)相关数据,近年来因肝脏疾病而死亡的人数有二百多万,约占全球总死亡人数的百分之四[3]。肝脏疾病正成为一个相当大的公共卫生负担。CCl4是一种常用于肝损伤模型的化学制剂,经代谢产生活性氧自由基,进一步与细胞分子结合,诱导氧化应激反应的发生,从而导致细胞损伤、炎症和凋亡[4]。据报道,植物酚类化合物可以改善氧化应激和炎症引起的肝损伤,并预防肝脏疾病的发生[5-8]。
地参(Lycopus lucidusTurcz.),系唇形科(Labiatae)地笋属多年生草本植物,属云南高原特色食品资源,以大理剑川沙溪镇分布最为广泛,且品质最优。民间传统以炒食、做汤、油炸、腌渍食用为主。地参富含矿物质、有机酸、维生素、粗脂肪、氨基酸和酚类化合物等营养成分[9-12],具有降血糖[13-14],降血脂[13],抑制体外肿瘤细胞生长[15],抗D-半乳糖所致小鼠衰老[16],提高免疫功能[17],抑制消化酶[18-19],抗氧化[11-12,20-21],保肝[7,22]等多方面生理功能。
植物多酚以游离和结合两种形式存在于植物体内,与游离酚相比,结合酚是与其它物质结合而存在的酚类化合物。前期研究显示[11-12,20-21],地参结合酚含量丰富,主要含有的单体酚类化合物为咖啡酸,且具有显著的抗氧化活性,而肝损伤通常伴随着氧化损伤。本研究采用体外CCl4损伤肝细胞模型,通过细胞存活率和肝功能指标(ALT、AST 和LDH)评价地参结合酚的体外保肝作用。同时,检测脂质过氧化产物、抗氧化指标(SOD 和GSH)、炎症反应因子(TNF-α、IL-6 和IL-8)、Caspase-3 活化程度、细胞凋亡及线粒体膜电位的变化,从抗氧化,抑制炎症反应和细胞凋亡,保护线粒体的角度揭示地参结合酚对CCl4损伤肝细胞的保护作用机制,以期为地参功能食品的开发提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
地参,采于云南省剑川县沙溪镇;BRL 大鼠肝细胞,中国科学院细胞库;Annexin V-FITC 细胞凋亡试剂盒、Caspase-3 活性测试盒、细胞MDA 测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、还原型谷胱甘肽(GSH)测定试剂盒,南京建成生物工程研究所;TNF-α、IL-8、IL-6 检测试剂盒,上海酶联生物科技有限公司;线粒体膜电位检测试剂盒(JC-1),上海碧云天生物技术有限公司。
ELx800 全自动酶标仪,美国Bio-Tek 基因有限公司;FACSCalibur 流式细胞仪,美国Becton Dickinson 公司;日立-7180 生化分析仪,日本日立公司;TCS SP8 激光共聚焦显微镜,德国Leica 公司。
1.2 试验方法
1.2.1 地参结合酚的提取及纯化 按照文献[18]的方法提取地参结合酚并纯化。具体流程:地参粉末5.0 g→80%的甲醇超声波辅助提取3 次→抽滤→残渣以4 mol/L NaOH 水解4 h→调pH 值至1~2→抽滤→滤液用乙酸乙酯萃取→合并乙酸乙酯相→旋转蒸发→浓缩液蒸馏水并定容15 mL→加入X-5 大孔树脂吸附24 h→抽滤→大孔树脂以70%的乙醇解析24 h→抽滤→滤液旋蒸→浓缩液真空冷冻干燥→地参结合酚纯化物。
1.2.2 细胞毒性的测定 BRL 大鼠肝细胞悬液(2.5×104/mL)→100 μL/孔接种于96 孔板(空白对照组加培养液)→培养12 h→干预组加入100 μL 0.2~1.6 mg/mL 的地参结合酚溶液(先用PBS 配制成质量浓度为5 mg/mL,再用培养液稀释至各浓度),正常组和空白对照组加入100 μL 培养液→培养4 h→加入20 μL MTT 溶液(5 mg/mL)→培养4 h→吸走上清液→加入150 μL DMSO→避光低速振荡15 min→测定吸光度值(490 nm)→计算细胞存活率。
1.2.3 细胞存活率的测定 按照1.2.2 节方法种板→培养12 h→干预组加入100 μL 0.4~1.6 mg/mL 的地参结合酚溶液,正常组、损伤组和空白对照组加入100 μL 培养液→培养4 h→干预组和损伤组加入40 μL CCl4(100 mmol/L),正常组和空白对照组加入40 μL 培养液→培养3 h→测定细胞存活率。
1.2.4 ALT、AST 和LDH 的测定 BRL 大鼠肝细胞悬液(5×104/mL)→500 μL/孔接种于24 孔板→培养24 h→干预组加入500 μL 0.4~1.6 mg/mL 的地参结合酚溶液,正常组、损伤组和空白对照组加入500 μL 培养液→培养4 h→干预组和损伤组加入200 μL CCl4(100 mmol/L),正常组和空白对照组加入200 μL 培养液→培养3 h→离心→收集上清→测定。
1.2.5 MDA、SOD 和GSH 的测定 根据试剂盒说明书操作,具体流程:按照1.2.4 节方法培养各组细胞→离心→收集上清→测定。MDA、SOD 和GSH 的测定结果分别以nmol/mL、U/mL 和μmol/L表示。
1.2.6 TNF-α、IL-6 和IL-8 的测定 根据试剂盒说明书操作,具体流程:按照1.2.4 节方法培养各组细胞→裂解细胞→离心→收集上清→测定。结果均表示为pg/mL。以浓度(C)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得TNF-α、IL-6 和IL-8 的标准曲线方程分别为A=0.0042C +0.0439(R=0.9912,线性范围为0~320 pg/mL),A=0.0101C-0.0101(R=0.9995,线性范围为0~160 pg/mL)和A=0.0069C +0.0014(R=0.9992,线性范围为0~240 pg/mL)。
1.2.7 细胞凋亡的检测 根据Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书操作,具体流程:按照1.2.4 节方法培养各组细胞→收集各孔细胞培养液→D-PBS 洗涤细胞→胰酶消化细胞1~2 min→加入对应各孔收集的细胞培养液→混匀→离心→弃上清→收集细胞→D-PBS 重悬细胞→取5×105/mL 的细胞悬液→离心→弃上清→加500 μL 结合液轻轻重悬细胞→加入5 μL Annexin V-FITC→5 μL 碘化丙啶→混匀→25 ℃暗室放置10 min→流式细胞仪检测。
1.2.8 Caspase-3 活化程度的测定 按Caspase-3活性测试盒说明书操作,具体流程:按照1.2.4 节方法培养各组细胞→裂解细胞→收集培养液→离心→取上清液→测定。Caspase-3 活化程度以OD样品/OD空白对照值来表示。
1.2.9 细胞膜电位的测定 根据试剂盒说明书操作,具体流程:按照1.2.4 节方法培养各组细胞→吸除培养液→PBS 洗涤细胞→加入1 mL 细胞培养液→加入1 mL JC-1 染色工作液→混匀→37 ℃孵育20 min→吸弃上清→JC-1 染色缓冲液洗涤2次→加入2 mL 细胞培养液→激光共聚焦显微镜拍照。
1.3 数据处理
各试验组分别设置5 个复孔,数据以“x¯ ±s“表示,采用SPSS 17.0 软件ANOVA 进行差异统计学检验,采用Pearson 对各检测指标的相关性进行分析。
2 结果与分析
2.1 细胞毒性
地参结合酚细胞毒性测定结果见表1。在0.2~1.6 mg/mL 干预范围,细胞存活率在90.51%~92.27%,与正常组之间无统计学差异(P>0.05),表明在该浓度范围,地参结合酚无细胞毒性,可以开展地参结合酚对肝细胞损伤保护作用的后续试验。
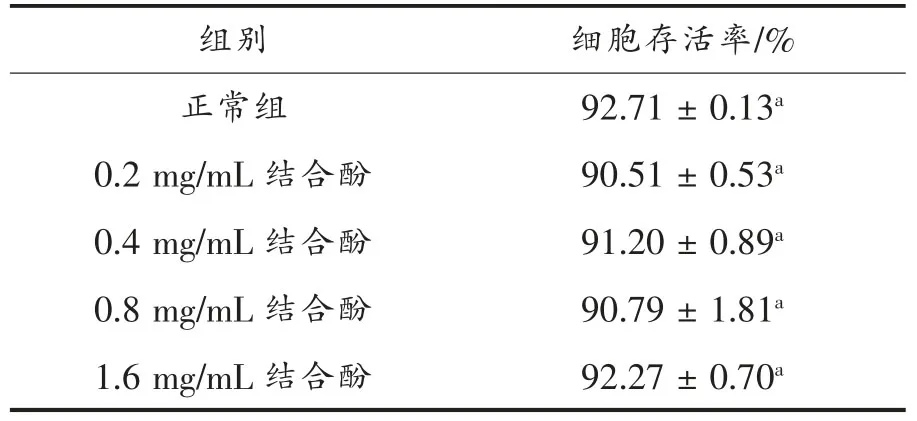
表1 细胞毒性测定结果Table 1 Results of cytotoxicity assays
2.2 地参结合酚对CCl4 损伤肝细胞细胞存活率、ALT、AST 和LDH 的影响
地参结合酚对CCl4损伤肝细胞细胞存活率、ALT、AST 和LDH 的影响见表2。就细胞存活率而言,CCl4损伤组比正常组下降了74.48%;0.4,0.8,1.6 mg/mL 地参结合酚干预组比CCl4损伤组分别增加了1.25,1.71 倍和2.08 倍。就ALT、AST 和LDH 而言,CCl4损伤组比正常组分别增加了0.96,2.57 倍和1.13 倍;地参结合酚干预组与CCl4损伤组相比,均有不同程度的下降,且呈剂量效应关系。当干预剂量为1.6 mg/mL 时,ALT、AST 和LDH的水平分别下降41.13%,21.57%和15.94%。
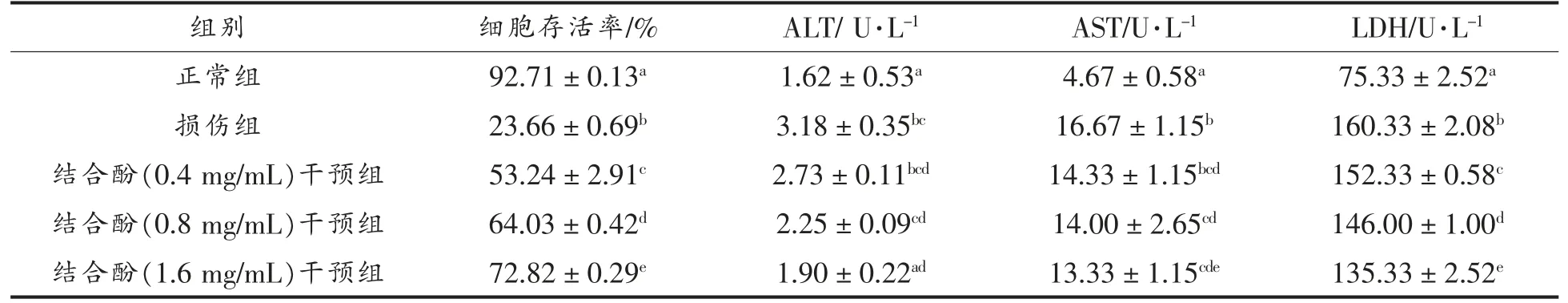
表2 地参结合酚对CCl4 损伤肝细胞细胞存活率、ALT、AST 和LDH 的影响Table 2 Effects of bound phenolics from Lycopus lucidus Turcz.on cell viability,ALT,AST and LDH in CCl4-injured hepatocytes
LDH 从细胞中的释放是对凋亡信号的回应,LDH 的水平是细胞凋亡的有效指标[23]。同样,ALT和AST 是肝细胞功能受损的重要指标。ALT、AST和LDH 大量释放,进入细胞培养液,表明CCl4对肝细胞的损伤造成细胞膜功能的严重受损,使其通透性增加。地参结合酚预处理显著降低了ALT、AST 和LDH 的水平,表明其对体外CCl4损伤肝细胞具有显著的保护作用。
2.3 地参结合酚对CCl4 损伤肝细胞MDA、GSH和SOD 水平的影响
地参结合酚对CCl4损伤肝细胞MDA、GSH和SOD 水平的影响见图1。就MDA 含量而言,CCl4损伤组比正常组增加了1.61 倍;0.4,0.8,1.6 mg/mL 地参结合酚干预组比CCl4损伤组分别减少了47.76%,50.31%和52.83%。就GSH 和SOD 含量而言,CCl4损伤组比正常组分别下降了45.12%和67.18%;地参结合酚干预组与CCl4损伤组相比,均有不同程度的上升,且呈现剂量效应关系。当干预剂量为1.6 mg/mL 时,GSH 和SOD 的水平分别增加了55.56%和172.01%。
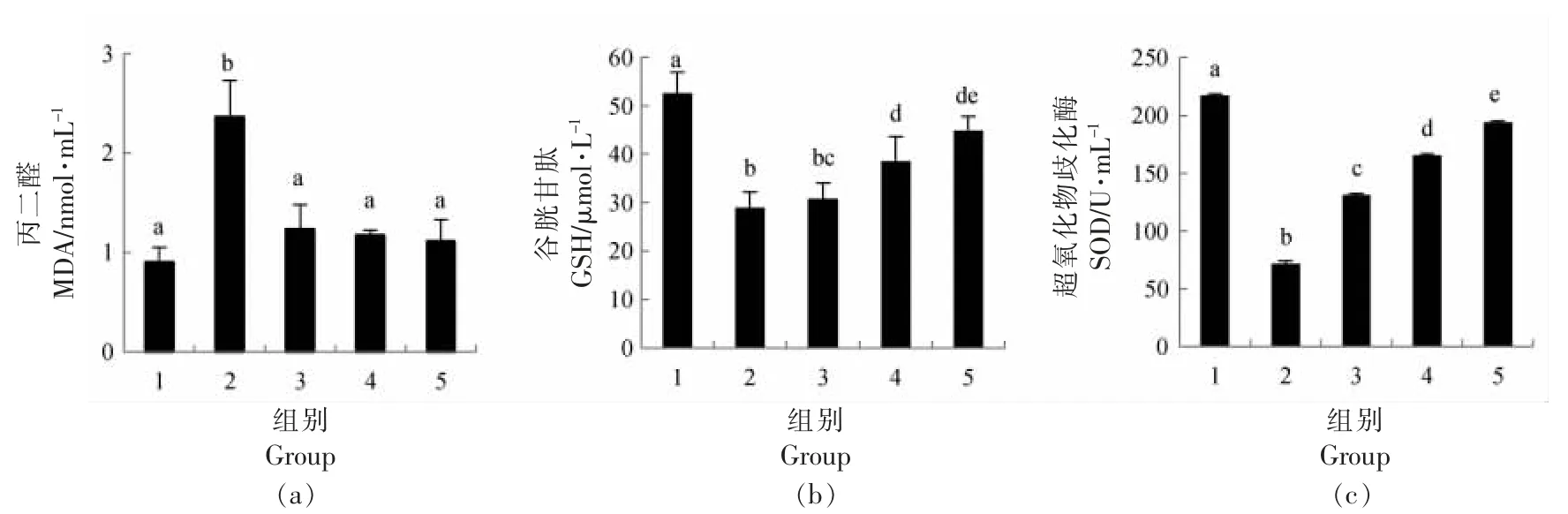
图1 地参结合酚对CCl4 损伤肝细胞MDA、SOD 和GSH 水平的影响Fig.1 Effects of bound phenolics from Lycopus lucidus Turcz.on the levels of MDA,SOD and GSH in CCl4-injured hepatocytes
CCl4通过自由基和过氧化作用引起肝细胞的损伤,其产生的反应代谢性自由基攻击并破坏多不饱和脂肪酸,尤其是那些与磷脂相关的脂肪酸,进而导致肝细胞中的脂质过氧化[24],可对其终产物MDA 的含量进行表征。SOD 通过催化ROO·与质子结合,进一步形成过氧化氢和氧,从而促进ROO·的分解[25]。GSH 对CCl4毒性衍生物的解毒有很大贡献,当GSH 存储明显耗尽时,肝细胞坏死开始[26]。CCl4损伤组MDA 含量显著增加,GSH 和SOD 含量显著下降,表明肝细胞脂质过氧化程度严重,细胞处于氧化损伤状态。地参结合酚抑制了CCl4损伤引起的肝细胞MDA 的增加和GSH 和SOD 的下降,表明其抑制了肝细胞的脂质过氧化,提高了抗氧化酶的活性,从而发挥对肝细胞损伤的保护作用。
2.4 地参结合酚对CCl4 损伤肝细胞TNF-α、IL-6 和IL-8 水平的影响
地参结合酚对CCl4损伤肝细胞TNF-α、IL-6和IL-8 水平的影响见图2。CCl4损伤组与正常组相比,TNF-α、IL-6 和IL-8 的水平分别增加了95.61%,75.87%和41.89%。地参结合酚干预组与CCl4损伤组相比,TNF-α、IL-6 和IL-8 水平均显著下降,且呈现剂量效应关系。当地参结合酚干预剂量为1.6 mg/mL 时,TNF-α、IL-6 和IL-8 水平分别下降了41.72%,21.49%和21.59%。
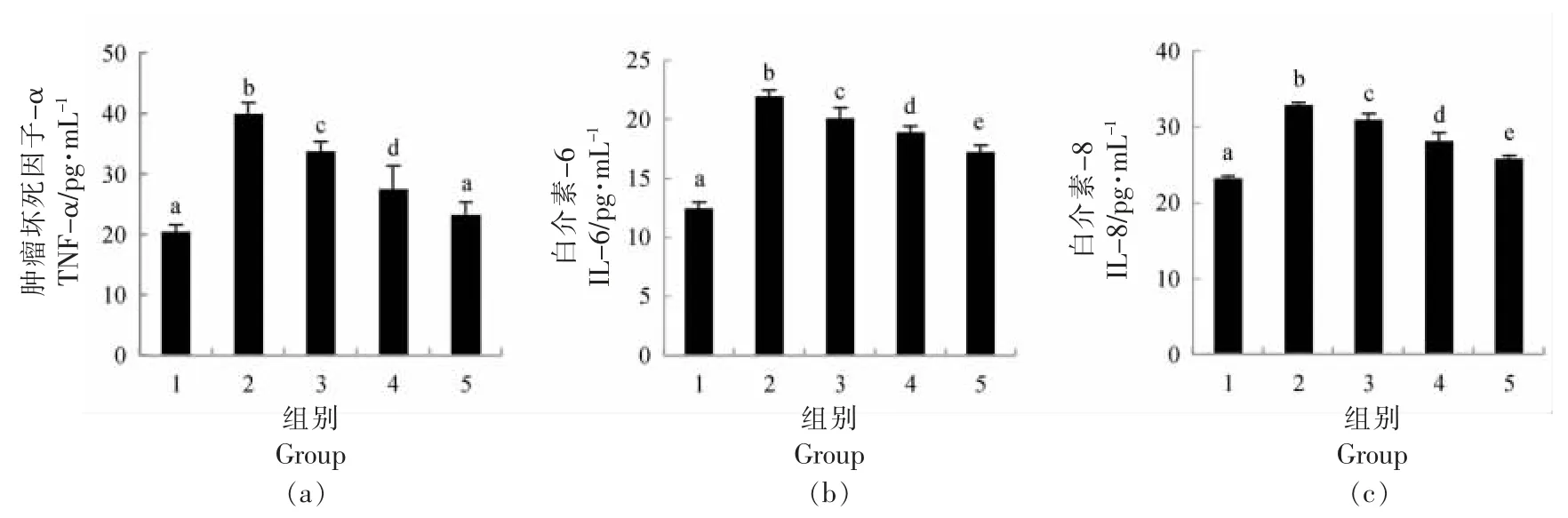
图2 地参结合酚对CCl4 损伤肝细胞TNF-α、IL-6 和IL-8 水平的影响Fig.2 Effects of bound phenolics from Lycopus lucidus Turcz.on TNF-α,IL-6 and IL-8 levels in CCL4-injured hepatocytes
CCl4产生的活性氧(ROS)激活了肝细胞内在免疫系统和Kupff 细胞,通过产生更多的ROS 和前炎症细胞因子加剧了肝细胞的炎症损伤[27]。肿瘤坏死因子(TNF-α)作为CCl4介导的肝损伤炎症介质,刺激细胞因子从巨噬细胞中释放出来,并诱发吞噬细胞的氧化代谢和NO 的产生[28]。NO 是反应活性更高的氧化物,它由iNOS 产生,通过与ROS 反应和形成过氧亚硝基增强了氧化应激[29]。TNF-α 还可引起许多与肝细胞损伤有关的第二介质,如IL-1β、IL-6、IL-8 及蛋白酶等的出现。CCl4损伤组TNF-α、IL-6 和IL-8 水平的显著提升,表明肝细胞发生严重的炎症反应,地参结合酚干预组TNF-α、IL-6 和IL-8 水平的显著下降,表明地参结合酚抑制炎症反应,从而发挥对肝细胞损伤的保护作用。
2.5 地参结合酚对CCl4 损伤肝细胞凋亡的影响
地参结合酚对CCl4损伤肝细胞凋亡的影响见图3。图中左下象限为正常细胞,左上象限为坏死细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞。CCl4损伤组(图3b)与正常组(图3a)相比,正常细胞显著减少,凋亡细胞显著增加;地参结合酚干预组(图3c、3d 和3e)与CCl4损伤组相比,随着干预剂量的增加,正常细胞逐渐增多,凋亡细胞逐渐减少。定量分析结果(图4)表明,CCl4损伤组与正常组相比,正常细胞减少了38.48%,坏死细胞、早期凋亡细胞和晚期凋亡细胞分别增加了22.99%,234.54%和140.39%,表明CCl4导致肝细胞的坏死和凋亡。地参结合酚干预组与CCl4损伤组相比,干预剂量为0.4,0.8 mg/mL和1.6 mg/mL 时,正常细胞分别增加了29.07%,41.37%和49.83%,坏死细胞分别减少了34.34%,9.66%和3.62%,早期凋亡细胞分别减少了29.87%,52.22%和56.87%,晚期凋亡细胞分别减少了25.81%,45.55%和53.06%,这表明地参结合酚在一定程度上可以降低细胞凋亡率,抑制肝细胞坏死,从而发挥对肝细胞损伤的保护作用。
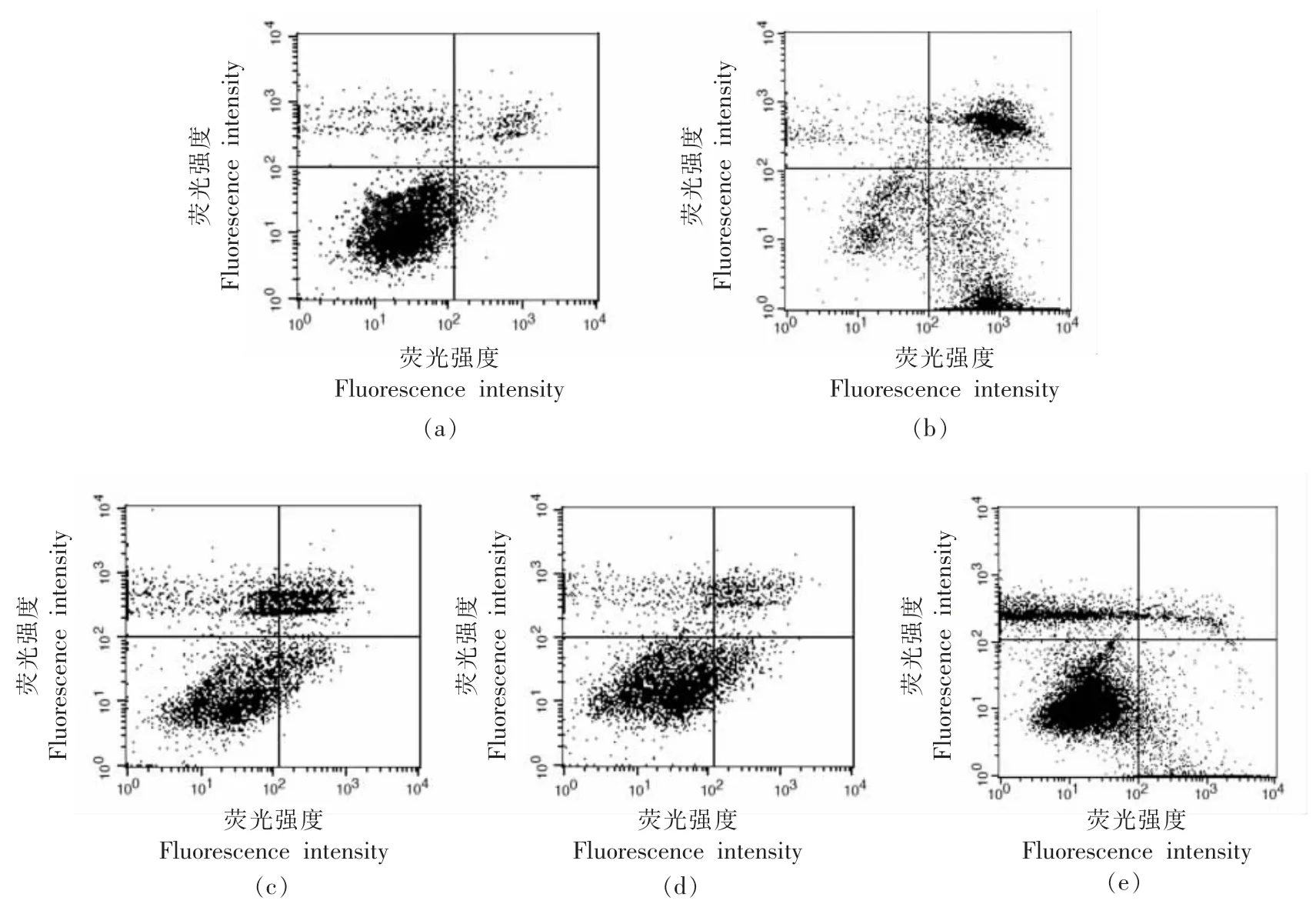
图3 地参结合酚对CCl4 损伤肝细胞凋亡的影响Fig.3 Effects of bound phenolics from Lycopus lucidus Turcz.on CC14-injured hepatocyte apoptosis
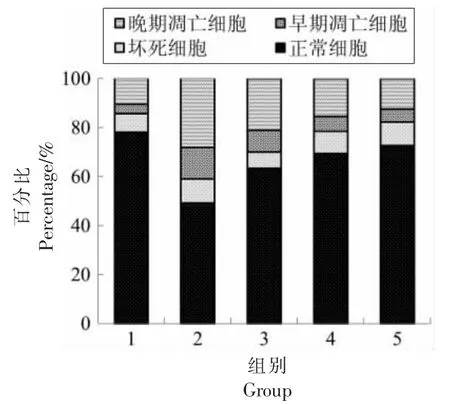
图4 肝细胞凋亡的定量分析Fig.4 Quantitative analysis of the hepatocyte apoptosis
2.6 地参结合酚对CCl4 损伤肝细胞Caspase-3活化程度的影响
地参结合酚对CCl4损伤肝细胞Caspase-3 活化程度的影响见图5。CCl4损伤组与正常组相比,Caspase-3 活化程度增加了44.87%。地参结合酚干预组与CCl4损伤组相比,干预剂量为0.4,0.8 mg/mL 和1.6 mg/mL 时,Caspase-3 活化程度分别减少了14.16%,15.49%和18.58%。
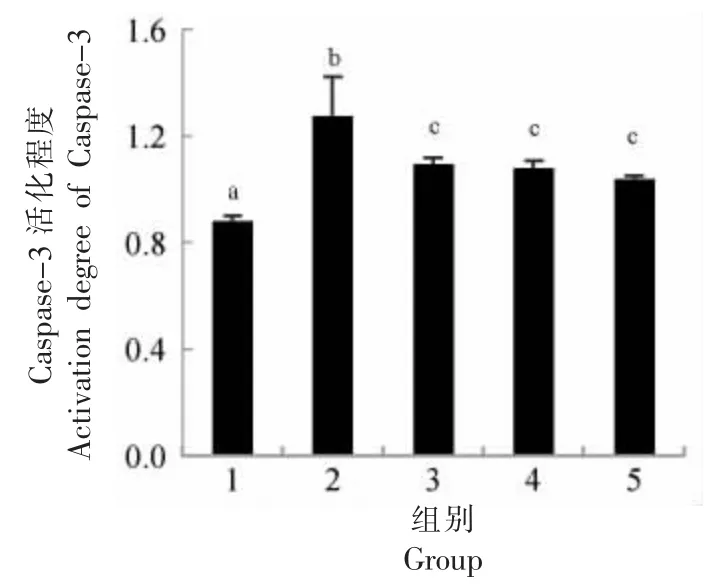
图5 地参结合酚对CCl4 损伤肝细胞Caspase-3活化程度的影响Fig.5 Effects of bound phenolics from Lycopus lucidus Turcz.on the activation of Caspase-3 in CCl4-injured hepatocytes
Caspase-3,又称为胱氨酸蛋白酶3,参与细胞凋亡的执行,是细胞凋亡的效应者。异源活化后的Caspase-3 酶解切割胞内重要的蛋白质,使DFF-45(DNA fragmentation factor-45)、DNA 依赖的蛋白激酶(DNA-PK)、多聚(ADP-核糖)聚合酶(PARP,poly(ADP-ribose)polymerase)降解[30],从而阻止DNA 的修复,并导致DNA 的降解,致细胞凋亡。Caspase-3 的活化程度可以反映细胞凋亡的情况。试验结果显示,CCl4使细胞发生明显的的凋亡,而地参结合酚可通过阻滞Caspase-3 的活化,抑制细胞凋亡。
2.7 相关性分析
为了进一步研究所检测各指标间的关联,进行相关性分析,结果见图6。ALT、Caspase-3、TNFα、IL-6 和IL-8 之间具有显著的正相关性,这与崔健娇等[31]研究结果一致,表明CCl4损伤肝细胞使转氨酶释放并伴随着炎症反应和细胞的凋亡。相反,GSH 和SOD 与ALT、Caspase-3、TNF-α、IL-6、IL-8 间具有显著的负相关性,表明地参结合酚通过抗氧化作用抑制CCl4引起的肝细胞的炎症反应和凋亡,从而发挥保护肝细胞损伤的作用。
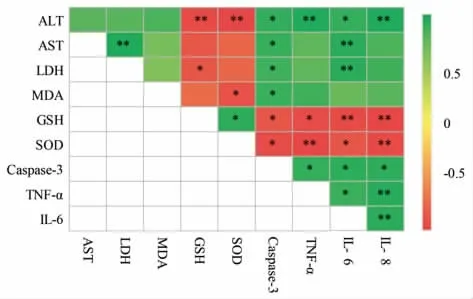
图6 相关性分析热图Fig.6 Heatmap of correlation analysis
2.8 地参结合酚对CCl4 损伤肝细胞线粒体膜电位(ΔΨm)的影响
地参结合酚对CCl4损伤肝细胞ΔΨm的影响见图7。正常细胞ΔΨm较高,JC-1 以聚合物的形式存在于线粒体中,可以显示红色荧光(图7A);CCl4产生的自由基和脂质过氧化导致线粒体DNA 的消耗和损伤以及超微结构的改变[32],进而导致ΔΨm的降低,此时JC-1 以单体(Monomer)的形式存在,可以显示绿色荧光(图7B)。线粒体膜电位的显著降低意味着膜通透性和完整性受到严重损害[32]。线粒体通透和功能障碍,使线粒体上的膜透过性转换孔开放,释放出大量的促凋亡蛋白和细胞色素C[33],进一步诱发细胞的凋亡[34]。试验结果表明,地参结合酚随着干预浓度的升高,红色荧光逐渐加强(图7C~7E),提示地参结合酚干预可显著抑制CC14诱导的ΔΨm的降低,稳定线粒体的功能,同时具有抑制肝细胞凋亡的作用,这与Caspase-3 活化程度的测定结果一致。
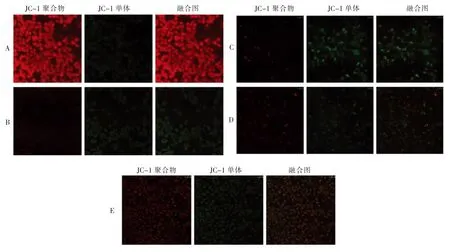
图7 地参结合酚对CCl4 损伤肝细胞线粒体膜电位的影响Fig.7 Effects of bound phenolics from Lycopus lucidus Turcz.on mitochondrial membrane potential in CCl4-injured hepatocytes
细胞凋亡受到两条基本途径的调控:死亡受体介导的(外源性)途径和线粒体(内源性)途径[35]。在外源性途径中,配体与死亡受体(DR)之间的相互作用始于质膜,然后激活Caspase-8,从而直接激活Caspase-3 的下游作用[36]。在内源性途径中,细胞凋亡使线粒体外膜的通透性增加,从而将溶解的蛋白从线粒体内部释放到细胞质中,进一步激活Caspase 破坏细胞[37]。试验结果显示,地参结合酚通过抑制Caspase-3 的活化和保护线粒体抑制CC14引起的肝细胞的凋亡。
3 结论
地参结合酚在干预剂量范围无细胞毒性,能抑制CCl4导致的细胞存活率、MDA、SOD 和GSH的降低,以及ALT、AST、LDH、TNF-α、IL-6、IL-8和Caspase-3 活化程度的升高;同时,能显著降低CCl4引起的细胞凋亡和线粒体膜电位的降低。相关性分析结果显示,ALT、Caspase-3、TNF-α、IL-6和IL-8 之间具有显著正相关,GSH 和SOD 与ALT、Caspase-3、TNF-α、IL-6、IL-8 之间具有显著负相关。研究结果表明,CCl4损伤肝细胞产生了氧化损伤,并伴随着炎症反应、细胞凋亡和线粒体膜电位的改变。地参结合酚通过抗氧化、抑制炎症反应和细胞凋亡及保护线粒体的功能,发挥对CCl4损伤肝细胞的保护作用。今后可从信号转导通路揭示其抗氧化、抑制炎症反应和细胞凋亡的分子机制,为开发地参保肝功能性食品提供理论参考。

