连接肽对β-木糖苷酶HJ14GH43 热适应性的影响
曹丽娟,李 娜,刘 钰,张 蕊,2,3,4,黄遵锡,2,3,4,周峻沛,2,3,4*
(1 云南师范大学生命科学学院 昆明 650500 2 云南师范大学生物能源持续开发利用教育部工程研究中心 昆明 650500 3 云南省生物质能与环境生物技术重点实验室 昆明 650500 4 云南师范大学云南省高校高原特色食品酶重点实验室 昆明 650500)
木聚糖是陆地植物细胞壁中半纤维素的主要成分,同时也广泛存在于海藻的细胞壁中[1]。木聚糖分子由β-1,4-连接(或β-1,3-连接)的木糖主链和包括L-阿拉伯呋喃糖、葡萄糖醛酸,O-乙酰基和阿魏酸等在内的不同的取代基组成[2]。由于木聚糖的复杂性和异质性,因此其完全水解需要一系列协同作用的水解酶[2]。其中,β-木糖苷酶(βxylosidase)是木聚糖水解过程中的关键酶之一,其主要作用是协同内切木聚糖酶水解木聚糖生成木糖[3-4]。木糖为自然界中第二丰富的糖,可被应用于食品、饲料、生物燃料以及化学品生产等领域,具有良好的应用价值[5-8]。此外,木糖在降低血脂、改善肠道菌群以及调节血糖等方面均具有重要意义[9-11]。广义上,将包含β-木糖苷酶在内的能水解木聚糖的一类酶称为木聚糖酶,近年来不少关于木聚糖酶的研究聚焦于获得具有低温、耐热、耐盐、耐酸、耐碱、耐乙醇、耐木糖等独特性质的酶[2,12-14]。
通常,连接肽被定义为连接模块化蛋白质中两个相邻结构域的柔性区域[15]。天然多域蛋白质由通过连接肽区域连接的两个或多个结构域组成[16]。连接肽不仅是灵活的连接器,而且已被广泛证明影响蛋白质的表达水平、溶解性和生化特征等性质[17-23]。例如,Li 等[20]研究表明连接肽的删除使木聚糖酶XynAS27 的pH 值稳定性以及对不溶性底物的活性降低;Srisodsuk 等[21]研究表明连接肽的缩短和删除降低了外切纤维素酶I(1,4-β-D-glucan cellobiohydrolase I,CBHI)的催化活性;Sonan 等[22]研究表明连接肽的顺序缩短导致纤维素酶Cel5G 对大分子底物的比活性有规律地降低;Tsutsumi 等[23]研究表明用长度相等或更长的不带电荷的连接肽替换分子伴侣热休克蛋白90(Heat shock protein 90,Hsp90)中的带负电荷的连接肽,导致其结构破坏,从而降低三磷酸腺苷酶(ATPase)的活性。
目前,有研究报道了连接肽对内切木聚糖酶热适应性的影响(表1),其中,连接肽的删除可使酶的最适温度和/或热稳定性降低:Liu 等[24]研究表明连接肽的删除使酶在50 ℃下处理180 min 后的剩余活性降低约10%;Miao 等[25]研究表明连接肽的删除使酶的最适温度降低5 ℃,并使酶在60 ℃下处理360 min 后的剩余活性降低20%;Li 等[20]研究表明连接肽的删除使酶的最适温度降低5℃,并使酶在65 ℃下完全失活的时间由50 min 减至5 min(表1)。此外,Meng 等[26]研究表明将连接肽替换后同样导致内切木聚糖酶的最适温度和热稳定性降低。这些研究表明连接肽对于内切木聚糖酶热适应性的重要性,然而,其对β-木糖苷酶热适应性的影响机制还不清楚。

表1 连接肽对内切木聚糖酶热适应性的影响Table 1 Effects of linkers on thermal adaptability of endo-xylanases
本实验室研究人员在前期研究中从芽孢杆菌属菌株HJ14 中克隆和表达了一个糖苷水解酶(Glycoside Hydrolase,GH)第43 家族的冷活性β-木糖苷酶HJ14GH43,并解析其晶体结构[28]。通过基因和蛋白质序列分析,发现该蛋白属于GH43家族中的第11 亚家族[29],拥有该亚家族序列的典型结构域特征,即HJ14GH43 由两个结构域组成,包括GH43 结构域(K2 到A315;Pfam 蛋白家族:PF04616)与一个功能未知的DUF1349 结构域(V330 到E535;PF07081),它们之间通过一个连接肽(P316 到T329;PKIEEKVFAPTYHT)相连(图1),且Ontanon 等[30]和本实验室前期的研究均表明,该亚家族序列是双结构域必需酶,突变失去DUF1349 域,突变酶不能正常折叠及催化。目前,连接肽对于β-木糖苷酶HJ14GH43 的作用尚不清楚。本研究通过对β-木糖苷酶HJ14GH43 的连接肽序列进行替换获得突变子MutLK10,并对突变体MutLK10 进行诱导表达、纯化、酶学性质测定和蛋白质结构分析,旨在揭示连接肽对β-木糖苷酶热适应性的影响机制,从而为该酶及其它类型酶的热适应性改性研究提供理论参考。

图1 野生酶HJ14GH43 的三维结构Fig.1 3-D structure of wild-type enzyme HJ14GH43
1 试验材料和方法
1.1 材料
1.1.1 菌株、载体和试剂 重组菌株BL21(DE3)/hJ14GH43 由实验室保存。大肠杆菌BL21(DE3)和表达载体pEasy-E1 均购自北京全式金生物技术有限公司。
1.1.2 酶类及其它生化试剂 对硝基苯酚pNP 和对硝基苯基-β-D-木糖苷pNPX 均购自Sigma 公司,其它都为国产分析纯试剂(均可从普通生化试剂公司购买得到)。
1.1.3 培养基 LB 培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,加蒸馏水至1 000 mL,pH 自然(约为7)。固体培养基在此基础上加20 g/L 琼脂。
1.2 方法
1.2.1 野生型HJ14GH43 连接肽替换序列的分析 通过NCBI(https://www.ncbi.nlm.nih.gov/)对 已表征过的GH43 家族第11 亚家族的β-木糖苷酶进行搜索。搜获后获得的β-木糖苷酶与野生型HJ14GH43 的多序列比对通过DNAMAN(V6,中文版)分析获得。
1.2.2 突变酶表达菌株的构建 替换序列由苏州泓迅生物科技股份有限公司进行合成,然后经限制性内切酶KpnI 和EcoRI 酶切后连接到pEasy-E1 载体上。将突变体基因和酶分别命名为mutlk10 和MutLK10。将突变完成后返回的pEasy-E1-mutlk10 冻干质粒在12 000 r/min 下离心2 min 后加入适量无菌水。通过热激法将pEasy-E1-mutlk10 转化到大肠杆菌BL21(DE3)感受态细胞中,经PCR 验证后,挑取阳性克隆子送至上海生工公司进行核酸测序验证。
1.2.3 突变酶的表达和纯化 将30 μL(0.1%接种量)含mutlk10 的表达菌株接种于含有30 μL氨苄青霉素(质量浓度为100 μg/mL)的30 mL LB液体培养基中,在37 ℃下过夜培养(12~16 h)。然后,将活化后的菌液以1%的接种量分别接种于含有100 μg/mL 氨苄青霉素的新鲜LB 液体培养基中,于37 ℃振荡培养约2~3 h(OD600达到0.6~1.0)后,加入终浓度0.1 mmol/L 的IPTG 进行诱导,于20 ℃继续振荡培养约20 h。诱导培养结束后,在4 ℃下以6 500 r/min 离心8 min 收集菌体,然后以适量的pH 7.0 柠檬酸-磷酸氢二钠缓冲液悬浮菌体,最后在冰浴环境下超声波破碎菌体。在4 ℃下12 000 r/min 离心10 min 后获得上清粗酶液。将上清液上样到预先平衡好的Ni2+-NTA 树脂凝胶柱中,用含不同浓度咪唑(0~500 mmol/L)的试剂梯度纯化重组酶。纯化后的重组蛋白经SDSPAGE 分析确定纯度和分子质量。
1.2.4 酶的特性分析 采用pNP 法测定纯化的突变酶MutLK10 的活性,具体如下:将pNPX 溶于缓冲液(pH 7.0)中,使其终浓度为2 mmol/L;反应体系含50 μL 适量酶液,450 μL 的2 mmol/L 底物;底物在反应温度下预热5 min 后,加入酶液反应10 min,然后迅速加入2 mL 1 mol/L Na2CO3终止反应;待反应溶液冷却至室温后在405 nm 波长下测定释放出的pNP。1 个单位的β-木糖苷酶活性(U)被定义为每分钟分解底物产生1 μmol pNP所需的酶量。
pH 6.0~8.5 缓冲液采用柠檬酸/磷酸氢二钠缓冲液,pH 9.0 缓冲液采用甘氨酸/氢氧化钠缓冲液。
最适反应pH 值测定:在20 ℃条件下,将酶液置于pH 6.0~9.0 的缓冲液中进行酶促反应,以终浓度为2 mmol/L 的pNPX 为底物,反应10 min 后测定酶活力。
pH 稳定性测定:将MutLK10 酶液置于pH 6.0~9.0 的缓冲液中处理1 h,然后在pH 7.0 及20℃下进行酶促反应,以未处理的酶液作为对照,以终浓度为2 mmol/L 的pNPX 为底物,反应10 min后测定酶活力。
最适反应温度测定:在pH 7.0 的缓冲液中,于0~40 ℃下进行酶促反应,以终浓度为2 mmol/L的pNPX 为底物,反应10 min 后测定酶活力。
温度稳定性测定:将酶液分别置于10 ℃和20℃处理0~60 min 后,在pH 7.0 及20 ℃下进行酶促反应,以未处理的酶液作为对照,以终浓度为2 mmol/L 的pNPX 为底物,反应10 min 测定酶活力。
1.2.5 蛋白质结构的比较分析 本实验室研究表明HJ14GH43 的晶体结构在自然状态下是二聚体[28],因此,以β-木糖苷酶HJ14GH43 的晶体结构(PDB IDS:6IFE)为模板,采用软件HOMCOS(HOmology Modeling of Complex Structure;http://homcos.pdbj.org)建立突变体MutLK10 的三维(3-D)结构模型[31-32]。已有研究表明该软件生成的复杂结构模型更适合多聚体蛋白的结构建模。所建立的模型质量进一步利用SAVES v6.0(https://saves.mbi.ucla.edu/)中的ERRAT、拉曼图和VERIFY 3D 进行评估;使用PyMOL 查看蛋白质结构,观察蛋白质表面电势;使用UCSF Chimera 观察蛋白质的表面亲疏水性[33]。
2 试验结果
2.1 野生型HJ14GH43 连接肽序列的替换
通过NCBI 搜索共找到10 个已表征酶学性质的GH43 家族第11 亚家族β-木糖苷酶(表2)。野生酶HJ14GH43 与各β-木糖苷酶的多序列比对结果如图2 所示。从图中可以看出来自于嗜热脂肪地芽胞杆菌T-6 的XynB3 连接肽序列中酸性氨基酸高达42.9%,是已统计GH43 家族第11亚家族β-木糖苷酶中酸性氨基酸含量最高的连接肽。同时,与统计的其它10 个β-木糖苷酶相比,XynB3 具有最高的最适温度,且报导了在最高温度(60 ℃)下的热稳定性(表2)。此外,由图2 可见XynB3 与HJ14GH43 连接肽序列的氨基酸数目相同。

图2 野生酶HJ14GH43 与GH43 家族第11 亚家族β-木糖苷酶的部分氨基酸序列比对Fig.2 Partial amino acid sequences alignment of wild-type enzyme HJ14GH43 and other subfamily 11 of GH43 β-xylosidases
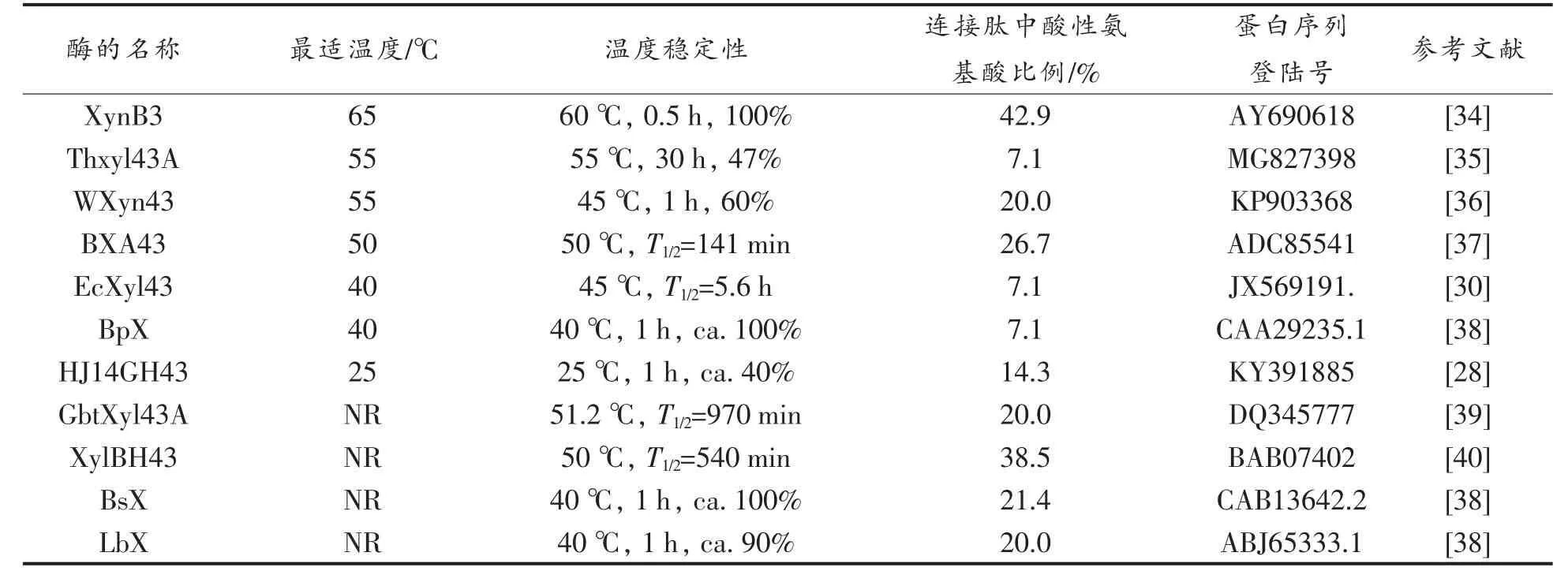
表2 野生酶HJ14GH43 与其它GH43 家族第11 亚家族β-木糖苷酶的特征Table 2 Characteristics of wide-type enzyme HJ14GH43 and other subfamily 11 of GH43 β-xylosidases
2.2 突变酶的表达和纯化
mutlk10 成功转化,并成功在大肠杆菌BL21(DE3)中得到了诱导表达。亲和层析纯化后,根据SDS-PAGE 结果,突变酶MutLK10 的蛋白质纯度达到电泳纯,产物为大小约为61.5 ku 的单一条带,与其535 个氨基酸计算得到的理论分子质量相符,并和野生酶的分子质量大小相似(图3)。

图3 纯化的野生酶HJ14GH43 和突变酶MutLK10 的SDS-PAGE 分析结果Fig.3 SDS-PAGE analysis of purified wild-type enzyme HJ14GH43 and its mutant MutLK10
2.3 重组酶的生化特性测定
以pNPX 为底物,野生酶HJ14GH43 和突变酶MutLK10 在pH 6.0~9.0 之间具有活性,且均在pH 7.0 下具有最佳活性(图4a)。但在偏碱性条件下(pH 7.5~9.0),MutLK10 的相对活性小于HJ14GH43。pH 对野生酶HJ14GH43 和突变酶MutLK10 的稳定性影响试验的结果表明,二者在pH 7.0~8.0 的缓冲液中保持稳定,即在pH 7.0~8.0 缓冲液中处理1 h 后均保持80%以上的相对酶活(图4b)。
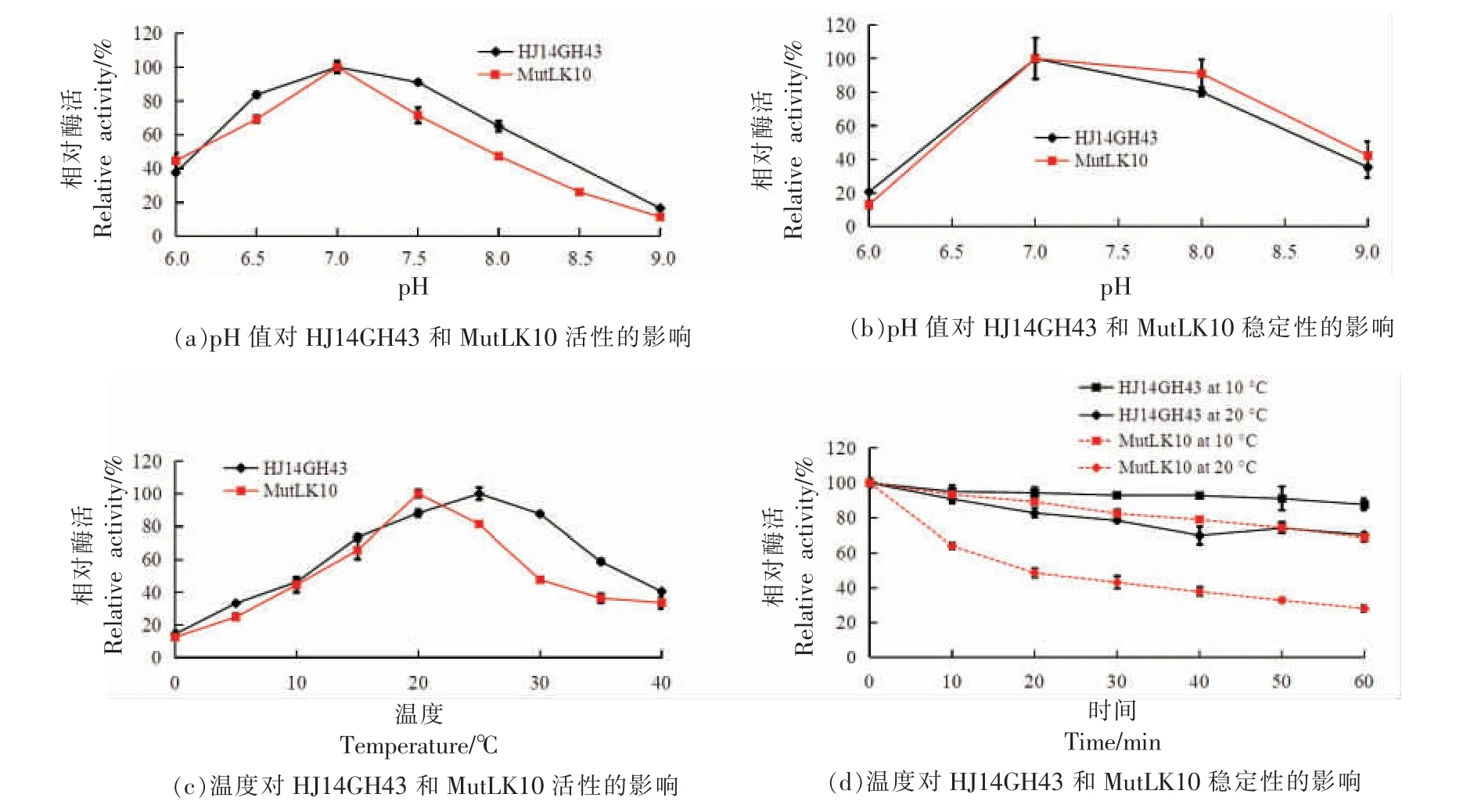
图4 野生酶HJ14GH43 及其突变体MutLK10 的酶学性质Fig.4 Enzymatic properties of wild-type enzyme HJ14GH43 and its mutant MutLK10
在0~40 ℃间测定温度对野生酶HJ14GH43和突变酶MutLK10 活性的影响。由图4c 可知,二者在0~40 ℃间都具有活性,其中野生酶HJ14GH43 的最适温度为25 ℃,突变酶MutLK10的最适温度为20 ℃。在25~40 ℃间MutLK10 的相对活性小于HJ14GH43。酶的热稳定性试验表明野生酶HJ14GH43 在20 ℃和10 ℃下处理60 min后分别保持约70%和88%的相对酶活;突变酶MutLK10 在20 ℃和10 ℃下处理60 min 后分别保持约28%和69%的相对酶活(图4d)。由此可见,突变酶MutLK10 的最适温度和热稳定性与野生酶HJ14GH43 相比均降低。同时表明MutLK10 是一个典型的低温活性酶。
2.4 蛋白质结构的比较分析
以β-木糖苷酶HJ14GH43 的晶体结构(PDB IDS:6IFE)为模板构建了MutLK10 的同源模型。对MutLK10 同源模型的质量评估显示该模型的ERRAT 得分为93.238,拉氏图显示99.2%的残基在允许区内,且98.13%的残基拥有大于0.2 的3D/1D 值。综上判断该模型的可信度高。蛋白质突变前后的表面电势分析表明,MutLK10 的表面负电势面积大于野生酶HJ14GH43(图5)。蛋白质突变前后的表面亲疏水性分析表明,MutLK10 的表面亲水性面积大于野生酶(图6)。
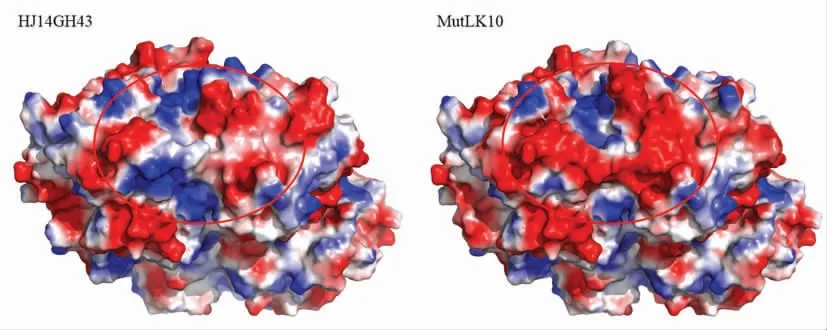
图5 野生酶HJ14GH43 及其突变体MutLK10 的表面电势分布Fig.5 Charge distribution on the structural surfaces of wild-type enzyme HJ14GH43 and its mutant MutLK10

图6 野生酶HJ14GH43 及其突变体MutLK10 的表面亲疏水性Fig.6 Surface hydrophilicity and hydrophobicity of wild-type enzyme HJ14GH43 and its mutant MutLK10
3 讨论
连接肽对于多结构域酶的组装、表达以及在各种环境下的适应性起重要作用[26]。目前,连接肽影响木聚糖酶热适应性的机制尚未确定。此外,尚无报导研究β-木糖苷酶中连接肽对酶热适应性的影响。通过分析11 个GH43 家族β-木糖苷酶的连接肽(包含HJ14GH43),发现连接肽中酸性氨基酸比例最高的XynB3 具有最高的最适温度且报导了在最高温度下的热稳定性。Ding 等[41]的研究发现来自于海洋噬糖菌属模式菌株2-40T的淀粉酶SdG5A 在连接肽区域同样具有高比例的酸性氨基酸,然而,该酶是冷适应性淀粉酶;SdG5A 连接肽区域中高比例的酸性氨基酸所带来的静电排斥作用和稳定的水化层驱使SdG5A 适应低温环境。由此可见,连接肽区域中酸性氨基酸比例对酶热稳定性的影响具有不确定性。本研究通过将HJ14GH43 的连接肽序列替换成XynB3的连接肽序列,揭示了连接肽中的酸性氨基酸比例对β-木糖苷酶HJ14GH43 热适应性的影响,即高比例的酸性氨基酸连接肽序列使突变酶Mut-LK10 的最适温度和热稳定性均低于野生酶。
先前的研究表明,典型的低温活性酶在低于30 ℃的温度下显示出最大活性,且在高于40 ℃的温度下稳定性差[42]。由此可见,MutLK10 是一个典型的GH43 家族低温活性β-木糖苷酶。酶的低温适应性引起了人们极大的关注和兴趣,例如,张明慧等[43]获得了GH43 家族低温木糖苷/阿拉伯呋喃糖苷酶AX543,与MutLK10 不同的是,AX543 是单结构域的GH43 家族酶。低温酶在食品、精细化工品、医药等工业中具有重要的应用潜力,对节约能源,降低生产成本,防止微生物污染和防止产品营养价值及风味降低具有重要作用[44-45],原因在于一方面,低温环境覆盖了80%以上的地球生物圈(例如,90%的海水≤5 ℃),包括永久寒冷的深海、阿尔卑斯山等山脉、极地等[46],适应低温(低于25℃)的酶具有加热成本低和反应环境方便的优点[47];另一方面,低温活性越高的酶往往具有更高的热敏性,该特性使酶的催化反应更容易得到控制并使酶的使用更具安全性[44-45,48]。
低温会严重影响酶和周围水的性质和结构,因为随着环境中温度的降低,蛋白质表面周围的水分子变得更有序,从而与蛋白质的结合更少,最终将系统平衡推向展开或变性状态[49-50]。因此,冷活性酶需要通过一些结构适应性来增加蛋白质表面与溶剂的相互作用,例如增加蛋白质表面的负电势[51]。不少研究论证了蛋白质表面静电相互作用与酶热适应性之间的关系。例如,Karan 等[51]表明极端酶可通过增大表面负电势来竞争水合作用,从而增加酶与溶剂的相互作用并使酶在低温下也能保持活性。Sriprang 等[52]、Turunen 等[53]的研究表明通过在木聚糖酶的Ser/Thr 平面引入带正电的精氨酸后,由于精氨酸的胍基促进了电荷间交互作用的进行,因而该酶的热稳定性提高。此外,一个来自于杀鲑异弧菌的冷活性铁超氧化物歧化酶的晶体结构展现了蛋白质表面净负电荷的增加[54]。在本研究中,用酸性氨基酸含量高的连接肽替换野生酶HJ14GH43 的连接肽,导致突变体MutLK10 的连接肽区域负电势面积增加,亲水性面积增加。酸性氨基酸带来的负电势能与盐离子竞争水而发生水合作用,同时,由于酸性氨基酸中的羧基比其它基团更亲水,因而酸性氨基酸具有较强的水结合能力[55]。蛋白质表面亲水性的增加促进了酶与溶剂的相互作用并帮助蛋白质形成稳定的水化层[51],最终使酶能适应低温环境。
4 结论
本研究通过对β-木糖苷酶HJ14GH43 中的连接肽进行替换,并对序列替换后所得突变体进行了诱导表达、纯化、酶学性质测定和蛋白质结构分析,从而研究连接肽对HJ14GH43 热适应性的影响。连接肽序列替换后的突变体MutLK10 的最适温度和热稳定性与野生酶HJ14GH43 相比均降低;同时,与野生酶HJ14GH43 相比,突变酶Mut-LK10 连接肽区域的负电势面积增大,亲水性面积增加,其机理为增大连接肽中的酸性氨基酸比例能使β-木糖苷酶通过增大表面负电势来竞争水合作用,从而增加酶在低温下与溶剂的相互作用,使酶在低温下仍然能形成稳定的水化层,维持酶的活性结构,并最终使酶能适应低温环境。本研究可为理解酶的温度适应性机理和为酶的改性研究提供理论基础,为研究连接肽的作用提供参考。

