氨溴索对α-突触核蛋白寡聚体诱导鼠多巴胺能神经元细胞株MES23.5损伤的预防作用观察
郑淑荣,杨巍巍,高华,杜婷婷
1 北京市神经外科研究所中心实验室,北京 100070;2 首都医科大学宣武医院神经生物学研究室;3 北京市神经外科研究所细胞生物室;4 北京市神经外科研究所功能神经外科研究室
帕金森病(Parkinson's disease, PD)是最常见的神经退行性疾病之一,伴有僵直、运动迟缓及震颤等主要症状,全球患者超过600万人,迄今为止尚无可改善疾病的药物治疗方案[1]。当前针对PD进展的主要治疗策略之一是靶向α-突触核蛋白(α-synuclein,α-syn),防止其寡聚体形成、释放以及在神经系统扩散[2]。研究[3-5]显示,α-syn寡聚体水平升高会损伤神经元轴突的完整性,导致神经元变性,抑制α-syn寡聚体可以改善脂多糖引起的老年小鼠线粒体损伤和神经元的凋亡情况。自噬-溶酶体途径是降解长寿命蛋白质α-syn和亨廷顿蛋白的主要途径,也是清除受损细胞器的唯一途径[6]。编码溶酶体酶β-葡萄糖脑苷脂酶(Glucocerebrosidase,GCase)的GBA1基因突变是PD的最常见危险因素[7]。氨溴索(Ambroxol, AMB)是一种抑制性分子伴侣药物,自1970年开始作为止咳药应用,不良反应小。高通量化合物评估表明,AMB呈pH依赖性增加GCase活性,体内外实验[8-9]显示AMB可增加GCase活性,并降低α-syn蛋白水平。2022年1—10月,我们观察了AMB对α-syn寡聚体诱导鼠多巴胺能神经元细胞株MES23.5(帕金森病模型细胞)损伤的预防作用,以期为GCase活性降低的家族性和散发性PD提供潜在的治疗策略。
1 材料与方法
1.1 细胞分组及药物给与 PD模型细胞MES23.5多巴胺能细胞株由拜尔医学部的Le Weidong教授赠送,使用F12培养基 + 5%胎牛血清在37 ℃条件下、5%CO2培养箱中培养。将处于对数生长期的MES23.5细胞分为A、B、C、D组4组,A组细胞加入二甲基亚砜,B组细胞加入终浓度为5 µmol/L的α-syn寡聚体,C组细胞加入终浓度为100 µmol/L的AMB,D组细胞先加入终浓度为100 µmol/L的AMB预处理12 h后再加入终浓度为5 µmol/L的α-syn寡聚体。各组细胞继续培养24 h用于后续实验。
1.2 各组细胞GCase活性测算 采用ELISA法。取各组细胞,以2×106个/孔种入6孔板,吸弃培养基,预冷的磷酸盐缓冲液洗细胞3遍后,胰酶消化细胞,离心收集细胞沉淀。在细胞沉淀内加入200 µL裂解液,匀浆后在4 ℃条件下1200×g离心15 min后取上清,继续1200×g离心15 min后弃上清,基质(0.1 mol/L Na2HPO4·12H2O,0.1 mol/L NaH2PO4·2H2O,pH 7.0)重悬沉淀,即为富含溶酶体溶液。按照GCase活性检测试剂盒要求的方法操作。准备一个96孔板,根据GCase活性检测试剂盒需要准备相应体积的工作液:200 µL检测缓冲液 + 8 µL底物液/孔。在96孔板中分别加入超纯水、校准液、样品和准备好的工作液,使用酶标仪测定405 nm处反应前(0 min)的光密度值(OD值),50 ℃水浴30 min后再次测定405 nm处OD值,计算GCase活性。GCase活性=[(OD30min-OD0min)/(OD标准液-OD水)]×250(U/L)。
1.3 各组细胞α-syn寡聚体水平检测 采用ELISA法。取各组细胞,以2×106个/孔种入6孔板,吸弃培养基,预冷的磷酸盐缓冲液洗细胞3遍后,胰酶消化细胞,离心收集细胞沉淀。放入含有200 µL裂解液的1.5 mL离心管中,冰上匀浆30 s,4 ℃条件下12000×g离心30 min,留取上清。用3D5小鼠抗人α-syn单克隆抗体(1 µg/mL)包被酶标板,4 ℃过夜,然后用2%牛血清白蛋白封闭,37 ℃孵育2 h,加入事先准备好的不同质量浓度α-syn寡聚体及待检测样品,100 µL/孔,于37 ℃孵育2 h。加入碱性磷酸酶标记的亲和素抗体(1/20000),37 ℃孵育1 h。以上每次反应结束后用PBST洗4次,每次5 min。最后加入对硝基酚磷酸显色液(pNpp),37 ℃孵育30 min。使用酶标仪测定405 nm处OD值,以吸光度值表示α-syn寡聚体水平。
1.4 各组细胞增殖能力检测 采用MTT法。取各组细胞,以1×104个/孔种入96孔板,继续培养24、48、72 h,分别加入20 µL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(噻唑蓝,5 mg/mL),继续培养4 h,吸弃孔内培养基,每孔加入二甲基亚砜100 µL,震荡10 min后,使用酶标仪在450 nm波长处检测OD450值,实验重复3次,取平均值。以OD450值表示细胞增殖能力。
1.5 各组细胞线粒体膜电位检测 取各组细胞,以1×106个/孔种入6孔板,胰酶消化细胞,1000 r/min离心收集细胞;加入0.5 mL JC-1工作液,培养箱孵育20 min,结合缓冲液洗细胞2次,加入200 µL结合缓冲液重悬细胞,使用流式细胞仪检测荧光强度,以红绿荧光强度比值表示线粒体膜电位。
1.6 各组细胞酪氨酸羟化酶(TH)磷酸化水平检测 采用Western Blotting法。取各组细胞,以PBS冲洗3次,加入非变性裂解液冰上孵育2 h,4 ℃条件下12000×g离心15 min,吸取上清液,采用BCA法检测蛋白浓度。蛋白电泳后,以湿转法将蛋白转移至PVDF膜,采用5%脱脂牛奶封闭1 h,分别加入p-TH一抗(1∶1000),TH一抗(1∶8000),4 ℃过夜。用TBST洗膜3次,加入相应的二抗孵育1 h,洗膜3次。加入ECL化学发光液,检测条带,分析灰度值,以磷酸化TH的灰度值/TH的灰度值的比值表示TH磷酸化水平。
1.7 统计学方法 采用SPSS22.0统计软件。计量资料呈正态分布时以±s表示,多组间比较用单因素方差分析,两两比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞GCase活性比较 A、B、C、D组细胞GCase活性分别为19.570 ± 0.536、7.767 ± 0.090、29.970 ± 1.770、16.730 ± 1.114,其中B组细胞GCase活性均低于其余三组(P均<0.05),C组细胞GCase活性均高于其余三组(P均<0.05)。
2.2 各组细胞α-syn寡聚体水平比较 A、B、C、D组细胞中α-syn寡聚体水平分别为0.920 ± 0.029、1.663 ± 0.085、0.752 ± 0.047、1.007 ± 0.088,其中B组细胞中α-syn寡聚体水平均高于其余三组(P均<0.05),C组细胞中α-syn寡聚体水平均低于其余三组(P均<0.05)。
2.3 各组细胞增殖能力比较 各组细胞增殖能力比较见表1。由表1可知,与A组相比,B组细胞培养24、48、72 h的OD450值均降低(P均<0.05),D组细胞培养72 h的OD450值降低(P<0.05);与B组相比,C、D组细胞培养24、48、72 h的OD450值均升高(P均<0.05);与C组相比,D组细胞培养24、72 h的OD450值均降低(P均<0.05)。
表1 各组细胞增殖能力比较(±s)
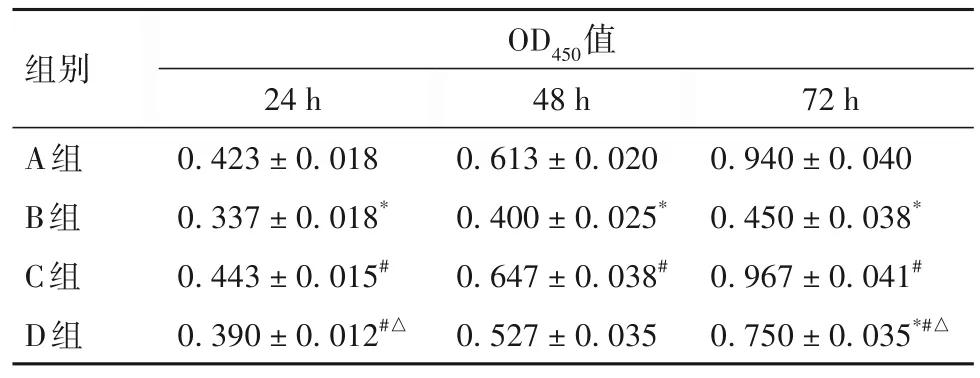
表1 各组细胞增殖能力比较(±s)
注:与A组相比,*P<0.05;与B组相比,#P<0.05;与C组相比,△P<0.05。
组别A组B组C组D组OD450值24 h 0.423 ± 0.0180.337 ± 0.018*0.443 ± 0.015#0.390 ± 0.012#△48 h 0.613 ± 0.0200.400 ± 0.025*0.647 ± 0.038#0.527 ± 0.03572 h 0.940 ± 0.0400.450 ± 0.038*0.967 ± 0.041#0.750 ± 0.035*#△
2.4 各组细胞线粒体膜电位比较 A、B、C、D组细胞线粒体膜电位分别为3.033 ± 0.262、0.690 ± 0.081、3.523 ± 0.238、2.237 ± 0.086,其中B组细胞线粒体膜电位均低于其余三组(P均<0.05),D组细胞线粒体膜电位均低于A、C组(P均<0.05)。
2.5 各组细胞TH磷酸化水平比较 A、B、C、D组细胞TH磷酸化水平分别为0.697 ± 0.024、0.237 ± 0.023、0.940 ± 0.064、0.573 ± 0.069,其中B组细胞TH磷酸化水平均低于其余三组(P均<0.05),C组细胞TH磷酸化水平均高于其余三组(P均<0.05)。
3 讨论
PD是全球第二大最常见的神经退行性疾病,主要发病人群是老年人,该疾病呈进行性加重,表现为运动障碍和多种非运动障碍。迄今为止,PD的确切发病机理尚不清楚,但是遗传学研究已经揭示了在疾病发病机理中涉及线粒体功能、α-syn聚集和溶酶体系统失常[10]。最近的遗传研究[11]表明,几个溶酶体基因中的变体之间存在明显的关联。动物和细胞模型[4]表明,增加GCase活性可以降低α-syn水平。本研究发现,应用GCase激动剂AMB能减轻外源性寡聚体对MES23.5细胞的损伤,恢复线粒体膜电位,具有潜在的临床应用价值。
PD的最常见危险因素是GBA1基因突变,该基因编码GCase蛋白。GCase是一种溶酶体水解酶,可催化葡萄糖基神经酰胺水解为葡萄糖和神经酰胺。GBA1的纯合突变导致功能丧失,引起溶酶体贮积病,称为高雪氏病。一项包括5691例PD患者和4898例对照的多中心研究表明,PD患者与对照组之间GBA1突变(L444P和N370S)的比值比在整个中心为5.43,与未携带GBA1突变的患者相比,携带GBA1突变的患者发病年龄更早,家族性概率更高[12]。尸检证实携带GBA1突变的PD患者脑组织中异常线粒体含量增加,线粒体氧化应激和自噬受损[13]。GCase活性受LRRK2活性负调节,抑制LRRK2激酶活性能够恢复携带LRRK2或GBA1突变的神经元的GCase活性,从而挽救与PD相关的疾病表型[14]。因此,增加GCase活性可能是逆转GBA1突变引起的PD症状的有效治疗方法。
溶酶体是α-syn降解的主要部位,溶酶体质量增加可能导致基础α-syn降解速率增加[15]。AMB是一种祛痰剂,被发现可以保护GCase免于热变性。AMB处理后,成纤维细胞基因表达谱较未处理组溶酶体和自噬相关基因水平明显上调[16]。本研究结果显示,AMB处理MES23.5细胞后,GCase活性明显上调,细胞内寡聚体水平均显著下降,同时受损的线粒体膜电位回升,体现多巴胺能细胞功能的TH磷酸化水平基本恢复。考虑到AMB可以穿越血脑屏障,我们认为它可以通过改善葡糖神经酰胺酶缺乏细胞的溶酶体功能,通过充当抗氧化剂和增加其清除率来靶向多巴胺能神经退行性病变的多个过程[17]。
总之,AMB可通过升高GCase活性、降低α-syn寡聚体水平,恢复MES23.5细胞增殖能力、线粒体膜电位、TH磷酸化水平,对α-syn寡聚体诱导的细胞损伤起预防作用,这一结果证实调控GCase活性和寡聚体水平可能对PD的治疗具有潜在的应用价值。

