大豆蛋白部分替代牛乳蛋白对酸奶理化性质及结构的影响
惠丹阳,华舒雨,唐裕芳,刘忠义,刘文星
(湘潭大学 化工学院,湖南 湘潭,411105)
我国是世界上的大豆生产大国,大豆蛋白是我国食用蛋白质的重要来源之一,如果能用大豆蛋白替代牛乳蛋白制备双蛋白酸奶,既可以增加大豆的消费途径,也可以提供高营养价值的酸奶供消费者选择。
近年来,国内外植物基酸奶[1-2]发展迅速,我国大豆酸奶市场初具雏形,大豆酸奶仍是小众饮品,且当前只有少数的大豆酸奶品牌供消费者选择,常温大豆酸奶产品非常稀少,大豆酸奶功能性质及其凝乳形成机制还需深入研究,大豆酸奶主要存在豆腥味和凝乳贮藏稳定性比较差等问题。降低豆腥味的方法包括添加化学试剂法、热处理法、微生物发酵法、酶分解法、气味掩盖法等[3-5],贮藏稳定性可以通过调节储藏温度、添加食品增稠剂、高压均质处理、选择合适的发酵剂[6-8]等方法得以改善。尽管有这么多方法可供选用,依然没有很好解决豆基酸奶的豆腥味及贮藏稳定性的问题。
本文试采用大豆蛋白与牛乳混合发酵制作酸奶的方法,期望改善豆基酸奶的品质和贮藏稳定性,同时缓解我国牛奶供应不足的问题,并探讨大豆蛋白和奶酪蛋白是否可以形成稳定的混合凝乳结构,在研究方法上,同时将理化性质和微观结构等结合起来,较为全面地研究用大豆蛋白部分替代牛乳蛋白对酸奶品质的影响及酸奶结构变化,期望为双蛋白酸奶的研究开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
原料:安佳全脂奶粉、安佳脱脂奶粉,恒天然集团;白砂糖,华坊城食品有限公司;混合发酵剂(保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌、植物乳杆菌、干酪乳杆菌),北京川秀国际贸易有限公司;大豆分离蛋白(soybean protein isolate,SPI),临沂山松生物制品有限公司;原料均为食品级。
试剂:考马斯亮蓝G250,天津市光复精细化工研究所;ANS荧光探针、NaOH,上海麦克林生化科技有限公司;其他化学试剂均为分析纯或者生化试剂。
1.2 仪器与设备
MYP11-2磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;SPX-250B-D振荡培养箱,上海博远实业有限公司;BAS224S电子天平,赛多利斯科技有限公司;CLT-1A电热套,韩西仪器科技有限公司;ZD-2自动电位滴定仪,上海康仪仪器有限公司;UV-VIS紫外分光光度计,美国安捷伦科技有限公司;DL-6M冷冻离心机,湖南湘仪实验室仪器开发有限公司;Universal TA质构仪,上海腾拔仪器科技有限公司;MIRA3 TESCAN电子扫描显微镜,北京亚科晨旭科技有限公司;Zetasizer nano ZS90电位粒度仪,英国马尔文仪器公司;F97 pro荧光分光光度计,上海棱光技术有限公司;NICOLET 380傅里叶红外光谱仪,美国尼高力公司。
1.3 实验方法
1.3.1 大豆蛋白酸奶样品的制备
1.3.1.1 工艺流程
工艺流程如图1所示。
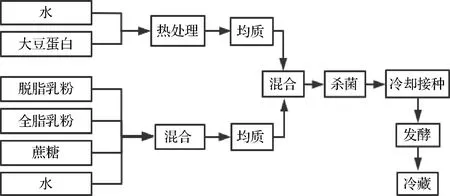
图1 大豆蛋白酸奶发酵工艺流程
1.3.1.2 样品的制备
普通酸奶制备:参考吴小艳[9]的酸奶配方制备酸奶,准确称取6.25 g全脂奶粉、5 g脱脂奶粉、8 g蔗糖溶解于88.75 mL去离子水中,磁力搅拌1 min,95 ℃杀菌5 min,冷却后接种0.1 g菌粉,43 ℃培养10 h,冷却后磁力搅拌1 min,4 ℃冰箱后熟24 h,制得没有大豆蛋白的酸奶,作为实验对照组记SPI0。
SPI酸奶的制备:保持蛋白质含量3.15%不变,用SPI替代牛乳中不同量(分别为10%、20%、30%、40%、50%,质量分数)的脱脂奶粉,被替代的奶粉的其他成分统一用乳糖代替,SPI加水混合均质后100 ℃热处理15 min,其他物料加水混合均质后与SPI溶液混合,95 ℃杀菌5 min,冷却后接种0.1 g菌粉,43 ℃培养10 h,冷却后磁力搅拌1 min,4 ℃冰箱后熟24 h后制得SPI酸奶,记不同替代量的酸奶分别为SPI1、SPI2、SPI3、SPI4、SPI5。
1.3.2 pH和滴定酸度值的测定
酸奶样品经发酵后熟取出恢复至室温,取10 g样品搅拌均匀,直接用ZD-2自动电位滴定仪测定样品pH值。
酸奶样品的滴定酸度值的测定参考GB 5009.239—2016《食品安全国家标准 食品酸度的测定》中发酵乳酸度的测定方法。测定与pH同时进行。
1.3.3 持水力的测定
参考文献[10],称取m1为空离心管的质量,加入10 g左右酸奶称取总质量记为m2,在4 ℃下,在5 000 r/min的转速下离心30 min,弃上清液后的质量记为m3,持水力计算如公式(1)所示:
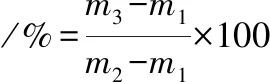
(1)
1.3.4 色度的测定
使用Ultrascan pro型色差计进行测定[11],直接读取L*、a*、b*。其中,L*表示亮度,L*=0 表示黑色,L*=100表示白色;+a*表示色度偏红,a*值越大,越接近红,-a*表示色度偏绿,a*值越小,越接近绿;b*值越大,越接近黄,b*值越小越接近蓝。
(2)
1.3.5 酸奶质构特性的测定
参考吴小艳等[12]的方法,取适量酸奶,使用Universal TA质构仪,选取P/BE中直径为35 mm的压力盘。设置测定参数为:下降速度和测试速度均为1.0 mm/s,提升速度10.0 mm/s,测试深度15.0 mm,测定硬度、黏性、弹性、咀嚼性、胶着性、黏聚性、回复性。
1.3.6 微观结构的测定
参考吴小艳等[12]的方法,将在4 ℃下贮藏的酸奶样品均匀薄涂在培养皿内壁上,在液氮中冷冻后迅速放入真空冷冻干燥机中进行干燥处理,然后采用离子溅射方法镀金,而后进行扫描电镜(scanning electron microscope,SEM)制片,最后在10 kV电压和放大2 000×的倍率下进行观察并采集图像。
1.3.7 Zeta电位与粒径的测定
Zeta电位测定:采用Zeta电位仪来测定酸奶样品的Zeta电位[13]。将提前制备好并冷藏12 h的酸奶样品取出,充分搅拌均匀后,用去离子水稀释100倍制备混合液样品待测。取适量样品于样品池中,运行Zeta电位测定系统,温度设定为25 ℃,分散剂设定为水(粒径测试条件同上)。
粒径测定:取出稀释100倍的样品混合液倒进石英比色皿中,样品约占石英比色皿的1/3,擦净外表面后放进电位仪中,运行粒径测试程序。
1.3.8 表面疏水性的测定
酸奶表面疏水性的测定参考刘鹏等[13]采用的ANS荧光探针法测定蛋白质表面疏水性。称取酸奶样品1 g溶于磷酸盐缓冲液中,均质后于7 000 r/min离心20 min,取上清液用pH 7.0的0.01 mol/L 磷酸盐溶液分别稀释蛋白质量浓度0.1~0.5 mg/mL,取2 mL不同浓度的样品溶液,分别加入20 μL 8 mmol/L ANS溶液,摇匀静置2 min,用荧光分光光度计测定样品荧光强度,设置激发波长为396 nm,检验发射波长为483 nm时的荧光强度。用荧光强度对蛋白质溶液浓度做图并进行线性回归,初始斜率即蛋白质的表面疏水性。
1.3.9 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
取适量酸奶样品放入超低温冰箱冷冻后冻干12 h,用研钵磨成粉,将处理后的酸奶粉末样品用KBr压片,用FTIR仪进行扫描。设置条件如下[14]:25 ℃测定波长扫描范围为4 000~400 cm-1的吸收光谱,分辨率4 cm-1,扫描次数8次。将扫描得到的图谱用Omnic软件校正后,用PeakFit Version4.12软件对酰胺Ⅰ带1 600~1 700 cm-1波段的图谱进行分析,基线矫正后进行高斯去卷积处理,再求二阶导数曲线拟合,直至拟合相关系数R2≥0.996不变为止,使得叠加的各子峰得以分辨,得出各个二级结构分布图,根据峰面积计算各二级结构组分的比例。
1.4 数据统计分析
所有实验重复3次,取平均值,用Origin 8.6和SPSS 17.0软件进行统计和方差分析(analysis of variance,ANOVA),用Duncan法进行差异显著性分析,P<0.05表示差异显著,本文所有表格中的数据呈现形式:平均值±标准偏差。
2 结果与分析
2.1 SPI替代牛乳蛋白对酸奶pH和滴定酸度的影响
SPI替代牛乳蛋白的酸奶pH和滴定酸度变化如图2、图3所示。酸奶的滴定酸度呈下降趋势(P<0.05)。当达到发酵终点时,对照组SPI0的酸度值为82.62 °T,此时酸味适中,符合大众口味。随SPI替代量从10%增加到50%时,酸奶的滴定酸度值呈先增加后下降的趋势,SPI5发酵终点时的酸度值为64.96 °T,显著低于SPI0(P<0.05)。
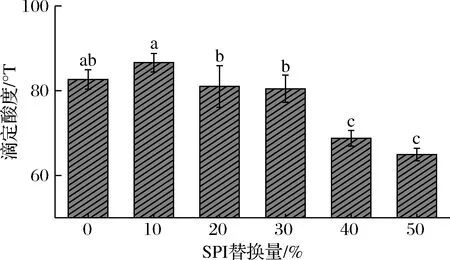
图2 SPI替代牛乳蛋白对酸奶滴定酸度的影响
图3 SPI替代牛乳蛋白对酸奶pH的影响
由图3可知,SPI替代牛乳蛋白对酸奶的pH无明显影响。普通酸奶与SPI4、SPI5的pH相同均为4.48,略低于SPI1的pH值,略高于SPI2与SPI3的pH值,整体来看,无显著性差异(P>0.05)。用SPI 替代牛乳蛋白对酸奶酸度的影响主要是由于外源蛋白(SPI)的添加使酸奶体系缓冲能力减小[15],因而酸度值也减小。
2.2 SPI替代牛乳蛋白对酸奶持水力的影响
图4显示了对照组酸奶与SPI替代不同牛乳蛋白量的酸奶在后熟24 h后的持水力呈持续增加态势(P<0.05)。SPI0的持水力为48%,而随着SPI替代量的增加,酸奶的持水力一直增加。当SPI替代量增加到50%时,SPI5持水力为59.17%,显著高于与对照组(P<0.05),因此用SPI替代部分牛乳蛋白可以有效提高酸奶的持水力。

图4 SPI替代牛乳蛋白对酸奶持水力的影响
推测酸奶持水率提高的原因,一是可能与体系中存在的蛋白质本身的结构和性质之间的差异有关;二是SPI经过热处理后,其中的蛋白质(主要是7 s和11 s组分)发生变性,伴随着分子结构的重排,蛋白质分子之间形成可溶性的复合体;随着乳酸菌发酵产酸,变性的蛋白质分子表面的负电荷被中和,导致蛋白质复合体之间的静电排斥作用降低,而后这些复合体通过疏水作用相互聚集形成凝胶。YANG等[16]提出,添加SPI的酸奶其空间结构是一种紧密、刚性的结构,因为添加SPI可能会导致酸奶凝胶结构更加紧密,蛋白胶束间连接作用增强,从而导致持水率升高;也有研究者认为在大豆酸奶中发挥重要作用的凝胶网络结构主要是通过氢键、疏水作用和离子桥连接而成,而二硫键并没有发生大的变化[17]。
2.3 SPI替代牛乳蛋白对酸奶色泽的影响
酸奶的色泽主要受使用原料的颜色与形成的凝胶结构这2个因素的影响。用不同量的SPI替代牛乳蛋白制备酸奶的色泽如表1所示。从SPI0到SPI5,反映酸奶白度的L*呈下降趋势,说明用SPI替代使酸奶颜色不断变暗;反映酸奶红度的a*值均为负值且不断增大,说明用SPI替代使得酸奶的红色消褪;反映酸奶蓝度的b*值都是正值且不断降低,说明用SPI替代会使酸奶的蓝色减弱。随着SPI替代量的逐渐增大,酸奶之间的颜色差异逐渐增大,ΔE值不断增大(P<0.05)。

表1 为用SPI替代牛乳蛋白制备的酸奶样品的色差值
ΔE值反映样品的总色差,当SPI替代10%~20%,SPI酸奶颜色亮度略微高于普通酸奶,这可能是因为大豆蛋白的添加使酸奶的凝胶结构发生变化,酪蛋白微粒和大豆球蛋白经过发酵聚集形成的凝胶具有较强的光散射特性。SPI3的颜色几乎与SPI0相近,这是由于大豆蛋白本身颜色为暗黄色使酸奶亮度变低,而SPI酸奶凝胶结构变化使酸奶亮度提高,2种因素作用相抵。当SPI替代40%~50%时,SPI酸奶凝胶结构对其亮度的提升有限,而SPI替代量增大,其本身颜色对酸奶色泽影响也逐渐增大,因此酸奶颜色不断变暗。
2.4 SPI替代牛乳蛋白对酸奶质构特性的影响
表2为SPI替代牛乳蛋白的酸奶质构指标测定结果。与对照组相比,用SPI替代牛乳蛋白的酸奶的硬度、黏性、弹性、黏聚性、咀嚼性等均有所变化。其中,酸奶硬度、黏性、咀嚼性和胶着性均随着SPI替代量的增大呈现递增规律,而弹性、黏聚性均略高于对照组,回复性无明显规律。当SPI替代量在10%~50%时,SPI酸奶的硬度、黏性、咀嚼性和胶着性呈现递增趋势,40%~50%的SPI酸奶硬度高于对照组(P<0.05),30%~50%的SPI酸奶黏性、胶着性高于对照组(P<0.05),10%~50%的SPI酸奶咀嚼性均高于对照组(P<0.05)。这可能是由于发酵过程中,大豆蛋白与酪蛋白发生相互作用,促进了氢键、疏水作用和离子桥的连接,形成了比只有酪蛋白更加紧密的复合网络结构。有研究表明酸奶凝乳[18]主要是由蛋白质互相连接形成复杂的三维凝胶网络结构。在发酵过程中,2种蛋白质相互交联形成了一种致密的凝胶网络,使酸奶凝乳结构更加稳定,改善并提高了酸奶的质构特性。
表2 SPI替代牛乳蛋白对酸奶质构特性的影响
2.5 SPI替代牛乳蛋白对酸奶微观结构的影响
图5为在2 000倍电镜视野中酸奶的微观结构图。普通酸奶微观结构是一种三维网状体结构,这种网状结构中间有无数有规则的孔隙,而与普通酸奶一样,SPI替代的酸奶样品也呈现清晰的三维网络结构。随着SPI替代量的增加,酸奶的结构更加紧密,相比普通酸奶孔隙明显变少。SPI1和SPI2酸奶与对照组SPI0一样表现出相对均匀细腻且开放疏松的凝胶网络结构,SPI3明显均一性变差,结构变的略微紧密。而SPI4和SPI5的酸奶微观结构则明显更加紧密和坚硬,但结构均一性较差且出现较大的蛋白聚集,更趋向于豆腐凝胶的质地。这与质构特性的结果一致。

a-SPI0;b-SPI1;c-SPI2;d-SPI3;e-SPI4;f-SPI5
究其原因,一方面可能是因为大豆蛋白亚基分子质量大,若大豆蛋白参与凝胶的量多到一定程度时,就会形成更坚硬的胶体;另一方面可能是因为在酸奶的凝胶体系中,大豆蛋白过多可能取代了酪蛋白在凝胶网络中的主导作用,此时大豆蛋白是起主要作用的基质,而含更多物理化学键或更高级结构的大豆蛋白凝胶可以更好地将水分包裹在网络结构中。总体而言,可以看出添加适量的大豆蛋白可以改善大豆酸奶的微观结构,形成紧密且均一性也特别好的多孔凝胶网络结构。
2.6 SPI替代牛乳蛋白对酸奶粒径与电位的影响
图6反映了用SPI替代牛乳蛋白的酸奶粒径变化。随着SPI替代量的增加,酸奶粒径也不断增大(P<0.05),SPI1的酸奶粒径比对照组SPI0增加了近一倍,继续增加替代量,酸奶的粒径也继续增大。这可能是由于大豆蛋白的分子质量大于酪蛋白的分子质量[19],大豆蛋白更易形成更大的聚集体,因此导致酸奶粒径不断增大且使得酸奶质地较硬[20],这与所测得的质构变化及微观结构的观察结果也是一致的。
图6 SPI替代牛乳蛋白对粒径的影响
图7为用SPI替代牛乳蛋白的酸奶的Zeta电位变化图。Zeta电位绝对值的大小反映着所测体系稳定性的强弱。当用SPI替代牛奶蛋白质时,酸奶的Zeta电位是随SPI替代量的增加而增大。对照组的Zeta电位值为7.14 mV,此时酸奶体系中的酪蛋白胶束带正电,这是因为牛奶在乳酸菌作用下发酵成酸奶后,体系环境会由中性逐渐变成酸性,体系中氢离子逐渐增多,导致酪蛋白表面带正电荷。而随着SPI替代量的增加,Zeta电位绝对值也增大,酸奶体系稳定性增强。这可能是因为大豆蛋白与酪蛋白产生复合,而复合物之间可能同时存在着静电引力和静电斥力以及范德华力,这几种力的相互作用,使酸奶保持较为稳定的平衡状态。GRYGORCZYK等[21]发现如酪蛋白先变性聚集,酪蛋白凝胶网络就包裹作为填充颗粒的大豆蛋白从而形成聚集体,若两者同时变性聚集就可与整体的凝胶网络中均匀分布,这也证实了大豆蛋白与酪蛋白确实产生了相互作用。
图7 SPI替代牛乳蛋白对电位的影响
2.7 SPI替代牛乳蛋白对酸奶表面疏水性的影响
蛋白质表面疏水性指标是表征蛋白质表面非共价作用的一个重要定量指标,反映酸奶内分子表面疏水性基团的相对含量,当蛋白质变性、结构或构象发生改变时,蛋白质的表面疏水性会相应产生某种程度的变化[22-23]。由图8可知,酸奶表面疏水性随SPI替代量的增加呈波动下降趋势,SPI5的表面疏水性与对照组有明显差异。一是由于酪蛋白本身疏水性高于大豆蛋白,用SPI替代牛乳蛋白使得整个酸奶体系疏水性下降;二是SPI含量的增多使酸奶体系中的SPI基团中的亚基之间形成了更多的蛋白质聚集体,因此疏水基团隐藏在蛋白聚集体内部使表面疏水性发生了一定程度的下降。
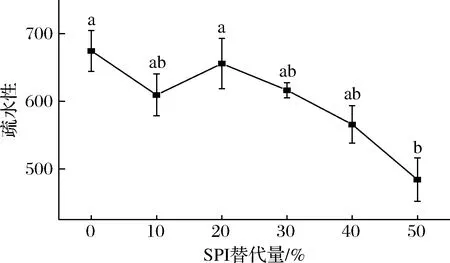
图8 SPI替代牛乳蛋白对酸奶表面疏水性的影响
2.8 SPI替代牛乳蛋白对酸奶二级结构的影响
依据红外谱图(图略),随着SPI替代量的增大,与对照组相比,红外光谱的特征峰吸收略微增强,这表明酸奶中的蛋白结构发生了改变或转化。
参考LONG等[24]的研究方法将酰胺I带进行各峰归属:1 600~1 625 cm- 1为分子间β-折叠,1 626~1 640 cm-1为分子内β-折叠,1 641~1 650 cm-1为无规则卷曲,1 651~1 660 cm-1为α-螺旋,1 661~1 685 cm- 1为β-转角,1 686~1 700 cm-1为反向平行β-折叠。根据拟合图确定各子峰与不同二级结构的对应关系,由其积分面积计算各二级结构的相对含量结果见表3。

表3 SPI替代0~50%牛乳蛋白酸奶二级结构的含量变化
蛋白二级结构主要分为α-螺旋、β-折叠、β-转角、无规卷曲4种结构,其中α-螺旋、β-折叠中含有较多的氢键,故是较有序、规则的结构。由表3可知,随SPI替代量的增加,酸奶中蛋白质二级结构确实发生明显变化。所有酸奶样品中的二级结构主要以β-折叠为主,占总含量40%以上,α-螺旋、β-转角次之,占总含量的20%以上。随着SPI替代量的增加,β-折叠的含量有下降的趋势,相应的α-螺旋、β-转角、无规卷曲不同程度的有所增加,而β-折叠与α-螺旋依旧占比很大,酸奶中二级结构依然是规则有序的。SPI替代10%~50%牛乳蛋白酸奶的总β-折叠含量下降,而α-螺旋、β-转角增加,说明有序的β-折叠转化成了有序的α-螺旋与无序的β-转角,而当替代量增加到50%时,β-折叠、α-螺旋、β-转角均有一部分转化成了无序的无规卷曲,这可能是由于加入过多的大豆蛋白造成的,但有序的β-折叠、α-螺旋占比依然最大,因此对酸奶结构体系的影响较小。
3 结论
通过保持原材料中蛋白质总含量不变,用大豆蛋白部分替代牛乳蛋白制备酸奶,酸奶的性质与结构发生了显著变化。在一定范围内用SPI替代牛乳蛋白较空白组都能显著提升酸奶制品持水性及质构特性;滴定酸度降低;pH无明显变化;色度呈现先变亮后变暗的趋势;总体而言,SPI的替代对酸奶各方面性质均有积极的影响。扫描电镜可以观察到,随SPI替代量的增大,酸奶中2种蛋白相互交联形成了坚硬且致密的网络凝胶;电位与粒径均增大,表面疏水性呈波动下降趋势,这可能是发酵过程中大豆蛋白形成大的聚集体,与质构及电镜观察的结果也是一致的。在二级结构上,随着SPI替代量的增加,β-折叠的含量有下降的趋势,相对的α-螺旋、β-转角、无规卷曲不同程度的有所增加,这说明酸奶中蛋白质二级结构发生了改变与转化。