基于原位培养和传统培养分析比较不同储存期酱香大曲的细菌群落
邹云曼,邱树毅,郑佳,戴怡凤,韦朝阳,闫岩,曾祥勇*
1(贵州大学 酿酒与食品工程学院,贵州 贵阳,550025)2(贵州省发酵与生物制药重点实验室,贵州 贵阳,550025)3(中国轻工业浓香型白酒固态发酵重点实验室,四川 宜宾,644000)
酱香白酒是中国三大香型白酒之一,具有独特的酿造工艺。其中高温大曲是酱香白酒最鲜明的特点之一。高温大曲可为白酒生产提供丰富的前体物质、微生物及酶类,对白酒品质和风味产生重大影响[1]。酱香大曲的生产工艺包括制作、发酵和储存3个阶段。即将曲料混合后制成曲块,入仓发酵40~50 d,再经过数月的储存才能投入生产[2]。在储存过程中,大曲微生物会进一步优化,形成稳定的利于生产的微生物群落结构[3]。其中,细菌在酱香大曲中的主要功能是“生香”,是形成酱香型白酒典型香气特征的主要菌群[4]。因此,对酱香大曲可培养细菌进行筛选鉴定及功能性研究具有重要意义。
近几十年来,对可培养白酒发酵细菌的分离、筛选和分子生物学特性研究绝大多数基于传统培养法[4-5]。但由于自然界大多都是未培养微生物(占99%),通过传统培养方法无法分离得到的[6],从发酵过程中分离活性显著、结构新颖的微生物越来越困难。尽管越来越多的酿酒微生物通过克隆文库技术[7]、变性梯度凝胶电泳(denatured gradient gel electrophoresis, DGGE)[8]、高通量测序[9]、多组学技术[10]等免培养技术被发现、评估和鉴定,但分子生物学技术提出的各种功能假说以及微生物的生物学特性只有在纯培养物中才能得到真正的验证[11]。因此,在发展分子生物学的基础上,除了利用培养基优化手段提高微生物的可培养性以外[12-13],一些新型培养技术,包括原位培养、共培养、微流控培养技术和细胞分选技术等,逐渐被开发用于培养和捕获微生物[14-15]。其中原位培养就是在人工培养条件下,将样品置于模拟自然环境的条件下进行分离。原位培养装置中的微生物细胞无法向外扩散,在原生态环境中获得天然的营养物质、信号分子或其他生长因子,将“未培养微生物”转变为可培养的菌种而加以研究,从而实现对微生物生长的控制[16]。原位培养解决了传统培养法因培养基富营养化[17]、生长因子缺乏[18]等原因而无法分离培养部分功能微生物的问题,在增加微生物的可培养率、理解微生物功能以及实现资源利用方面具有重要意义。
原位培养中分离芯片法(isolation chip,Ichip)[19]具备装置简单,可高通量操作,工作原理清晰明了等特点。Ichip原位培养法已经被广泛应用于土壤、海洋、口腔等环境中微生物的分离筛选[20],但迄今为止,还未见食品中特别是白酒发酵领域中利用原位培养法筛选酿酒微生物的相关报道。本课题组率先利用Ichip原位培养技术来筛选酿酒微生物,以不同储存期的酱香大曲为筛选源,对比分析原位培养和传统培养中大曲细菌菌群结构组成的差异,同时探究储存过程中群落结构特点和动态变化规律。这项研究有助于难培养酿酒细菌的分离筛选,使它们能够从酿造环境中被提取并在实验室中得到有效地驯化和培养,以期为酱香型白酒大曲中细菌的研究提供参考。
1 材料与方法
1.1 细菌原位培养装置
本研究用于细菌分离的原位培养装置由两部分构成,200 μL枪头板和孔径为0.03 μm的聚碳酸酯径迹蚀刻滤膜(polycarbonate track etched,PCTE)[20]。此板本质上是一个有96个通孔的塑料板,能高通量并行操作,且孔与孔之间互不干扰。任何带有这种通孔的塑料板都可以替代它。
1.2 样品采集
本试验高温大曲样品取自贵州省茅台镇某酒厂。从块状大曲不同层次中取样并研细成粉,等量混合后分装于无菌取样袋,于4 ℃保存备用。3个月、4个月、5个月、6个月、8个月高温大曲用于原位培养的编号为Y1、Y2、Y3、Y4、Y5;用于传统培养的编号分别为CY1、CY2、CY3、CY4、CY5。
1.3 培养基
营养琼脂(nutrient agar,NA)培养基(g/L):牛肉膏5,蛋白胨10,NaCl 5,琼脂20,pH 7.0~7.2,121 ℃灭菌20 min。
LB肉汤培养基(g/L):牛肉膏5,蛋白胨 10,NaCl 5,pH 7.0~7.2,121 ℃灭菌20 min。
改良R2A琼脂培养基[21]:琼脂15~20 g、NH4Cl 0.8 g、KNO30.5 g、酪蛋白水解物0.5 g、葡萄糖0.5 g、蛋白胨0.5 g、丙酮酸钠0.5 g、可溶性淀粉0.5 g、酵母浸出粉0.5 g、K2HPO40.4 g、KH2PO40.25 g、MgCl2·6H2O 20.0 mg、CaCl2·2H2O 15.0 mg、FeSO4·7H2O 7.0 mg、MnCl2·4H2O 5.0 mg、Na2SO45.0 mg、CoCl2·6H2O 0.5 mg、H3BO30.5 mg、NiSO4·6H2O 0.5 mg、ZnCl20.5 mg、CuCl2·2H2O 0.3 mg和Na2MoO4·2H2O 10.0 μg、用蒸馏水定容至1.0 L,pH 7.0±0.2,121 ℃灭菌15 min。
大曲浸出液(Daquextract,DE):曲样1.00 g,加入99 mL无菌水,加玻璃珠摇床振荡4~5 h后用0.2 μm膜过滤除菌。
R2A-DE培养基:90%体积的改良R2A培养基和10%体积的DE浸出液混匀,即为R2A-DE培养基。
1.4 样品分离及培养
1.4.1 传统培养法分离纯化细菌
在无菌环境下,各储存期大曲样品分别称取1.00 g,用无菌水进行浓度梯度稀释(10-2、10-3、10-4)。各浓度梯度菌悬液分别取100 μL涂布于R2A-DE培养基平板上,37 ℃倒置培养24 h,每个浓度梯度各做3个平行。挑取平板上不同形态的菌株,将获得的单菌落进行平板划线处理,多次纯化。观察纯化后的细菌菌落形态,去掉重复的细菌。转移至25%甘油管中,于-80 ℃保藏,用于后续鉴定。
1.4.2 原位培养法分离纯化细菌
原位培养法分离纯化细菌的操作流程见图2。在超净工作台中将PCTE膜覆盖在200 μL枪头板底侧,并用有机硅胶密封,放置2 h以上使胶完全凝固。
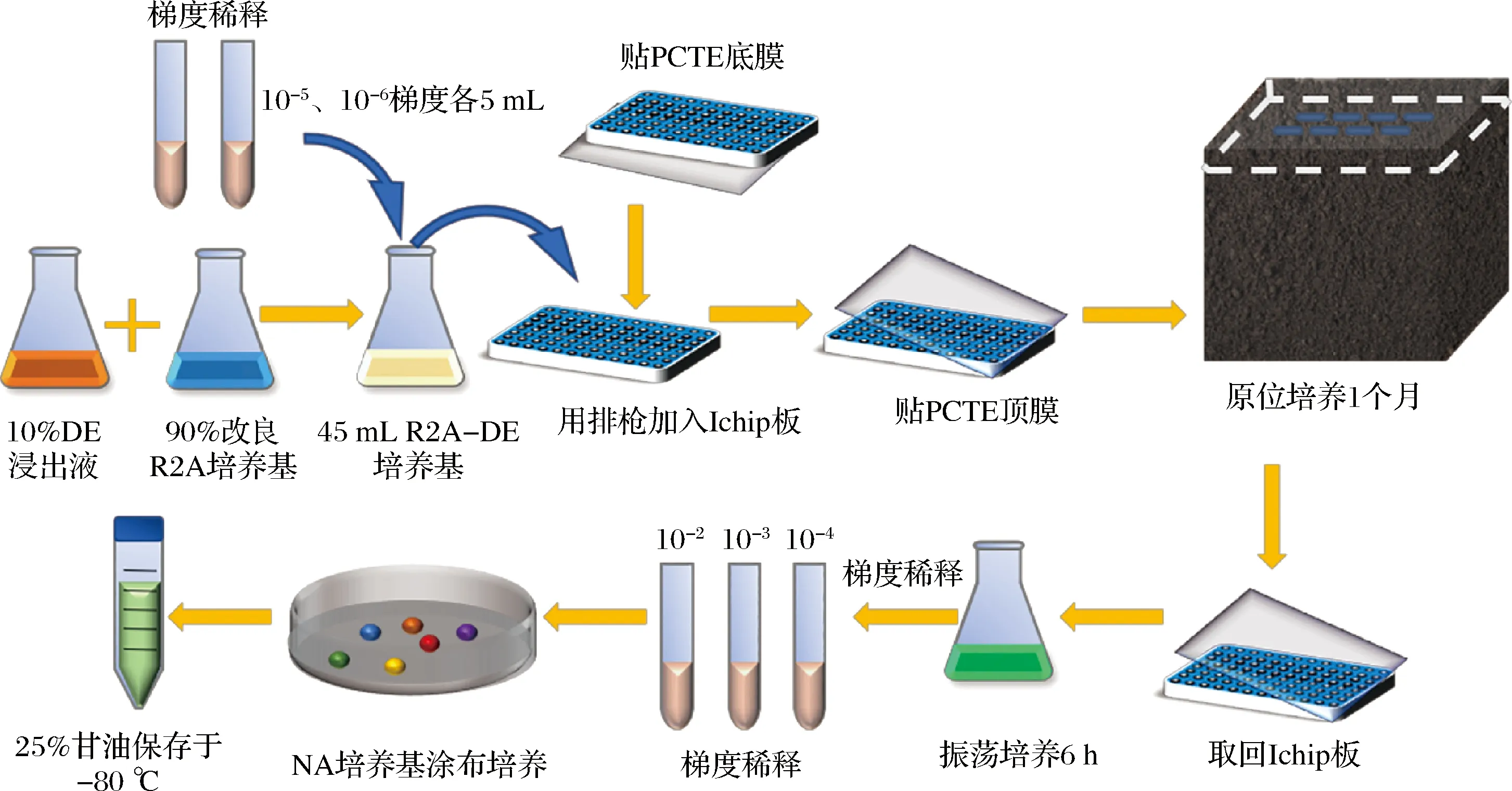
图2 原位培养法分离纯化细菌流程图
在无菌环境下,各储存期大曲样品分别称取1.00 g,用无菌水进行浓度梯度稀释。为了保证每孔均有合适数量的细胞,本研究选取10-5和10-6梯度菌悬液各5 mL加入45 mL熔融的R2A-DE培养基中混匀后,用排枪吸取250 μL分别加入Ichip板96孔中,待琼脂凝固后,将PCTE膜覆盖在200 μL枪头板顶部并用防水有机硅胶密封,于超净工作台放置2 h以上使胶完全凝固。将Ichip放回发酵糟醅中原位培养,在窖池内的放置位置见图3。

图3 Ichip板在窖池中原位培养时放置情况示意图
原位培养1个月后取回实验室驯化。在无菌条件下,擦拭Ichip板表面杂物后用镊子轻轻剥下顶膜,取出富集物。用灭菌牙签取出 Ichip 板中富集物,LB培养基摇床培养6 h。之后进行梯度稀释(10-2、10-3、10-4),各浓度梯度菌悬液分别取100 μL涂布于NA培养基平板上,37 ℃倒置培养24 h,每个浓度梯度各做3个平行。挑取平板上不同形态的菌株,将获得的单菌落进行平板划线处理,多次纯化。观察纯化后的细菌菌落形态,去掉重复的细菌。转移至25%甘油管中,于-80 ℃保藏,用于后续鉴定。
1.5 分子生物学鉴定
将纯化菌种接入LB肉汤培养基中活化,37 ℃、200 r/min培养24 h。取1 mL菌液12 000 r/min离心1 min,弃清液,按照细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取DNA。扩增细菌16S rDNA序列,扩增引物为27f (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r (5′-GGT-TACCTTGTTACGAC TT-3′)。PCR扩增条件:94 ℃预变性10 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共33个循环;72 ℃再延伸10 min,4 ℃下保存。PCR扩增体系(50.0 μL)为:2×TaqPCR MasterMix Ⅱ 25.0 μL,上下游引物(1.0 μmol/L)各1.0 μL,DNA 模板2.0 μL,双蒸水(ddH2O)21.0 μL。
PCR产物经1%琼脂糖凝胶电泳检测合格后,送至上海生物工程有限公司测序。将测序所得的特定细菌菌株序列结果,在NCBI上经BLAST进行同源性比较,对菌株进行菌种鉴定。
1.6 数据处理
采用分离频率(isolation frequency, IF)比较判断优势菌群[22]。IF:分离到的某一指定类型微生物的菌株数占该样品分离总微生物菌株数的百分比。
2 结果与分析
2.1 细菌的分离纯化和菌落形态观察
从5个储存期的酱香型高温大曲样品中共分离纯化出679株细菌,其中原位培养法471株,传统培养法208株,部分细菌菌落形态如图4所示。从菌落特征来看,相同培养条件下,不同细菌菌落形态、颜色、质地、边缘等特征略有不同。菌落形状多为圆形;颜色多为白色,兼有米色和黄色;质地有的湿润、黏稠、有光泽,有的干燥、有褶皱,边缘大多不规则。根据菌落形态特征进行感官性初筛,原位培养和传统培养分别选择296株和96株进行后续分子生物学鉴定。
2.2 菌株分子生物学鉴定
细菌16S rRNA序列扩增,部分菌株琼脂糖凝胶结果见图5,都得到1 400 bp大小片段,与预期产物大小一致。根据所得的基因序列,在NCBI上通过BLAST程序进行同源序列比较与分析。每种细菌的参考菌株编号及具体分离情况见表1和表2。结果表明这些菌株与各自的参考菌株的相似度都是100%,说明是同一种。

表1 高温大曲细菌基于原位培养法的分离情况
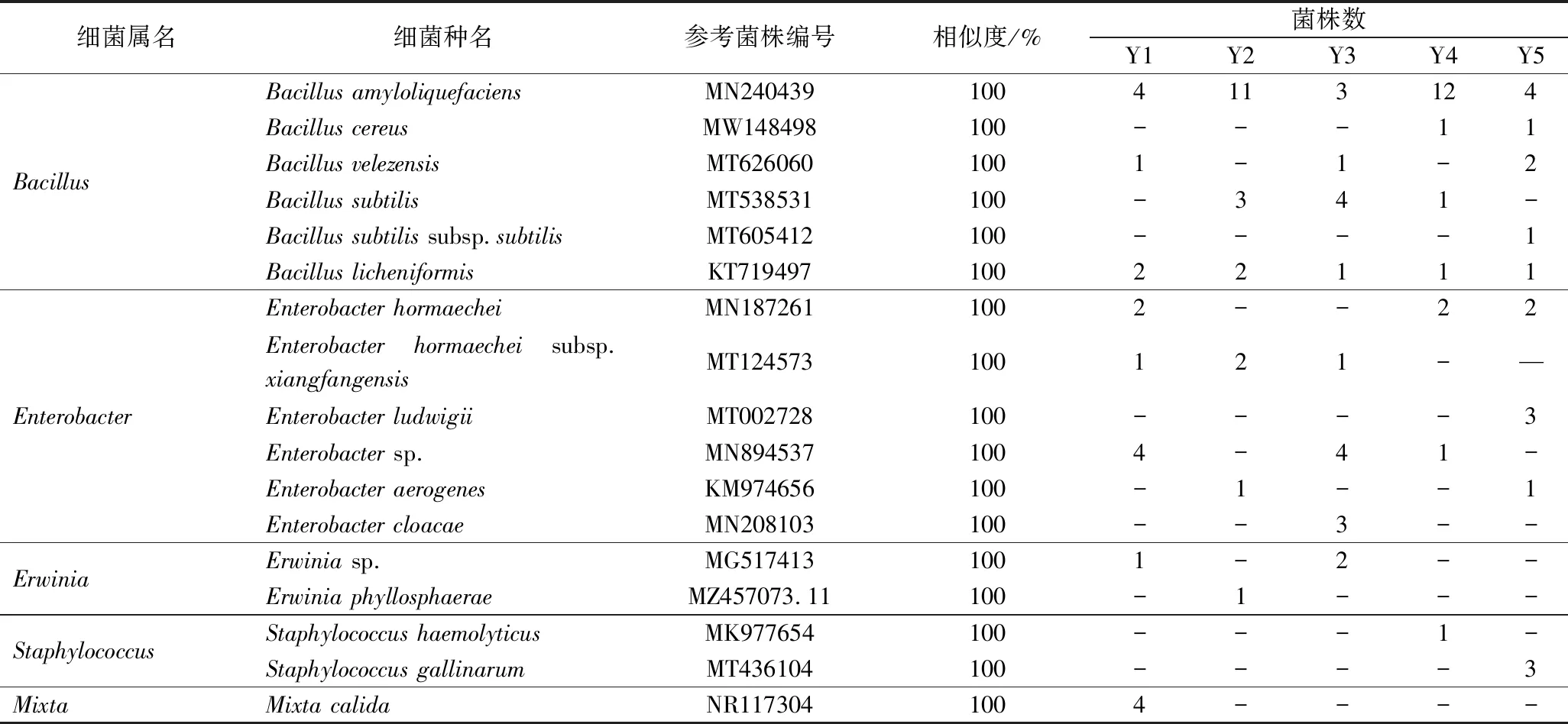
表2 高温大曲细菌基于传统培养法的分离情况
图5 部分细菌琼脂糖凝胶电泳图
2.3 传统培养和原位培养法细菌多样性分析
如图6所示,原位培养在3、4、5、6个月储存期大曲中获得的细菌属都比传统培养多。在种水平上,原位培养在5个储藏期大曲中获得的细菌物种数分别为13、15、14、16、12;传统培养获得的细菌物种数分别为8、6、8、7、10。统计分析表明,原位培养和传统培养在种水平上获得的菌种数量存在极显著差异(P<0.01;Fcalculated=22.09>Fcritical;df=1)。因此,本研究的原位培养装置适用于细菌培养,这种Ichip原位培养方法在酱香大曲细菌分离培养中是有效的。另外,随着储存时间的增加,传统培养细菌属和种数量呈现先降低后增加的整体趋势;原位培养呈现先增加后降低的整体趋势,这与2种培养法整合后的趋势基本吻合,同时与本课题组对同批次酱香大曲的高通量测序结果相符。这可能是因为原位培养装置被置于窖池糟醅中,糟醅中的信号分子和关键营养因子等被细菌利用,因此原位培养细菌变化趋势更接近于实际酱香大曲的细菌多样性,在实验室研究中具有较高的参考价值。
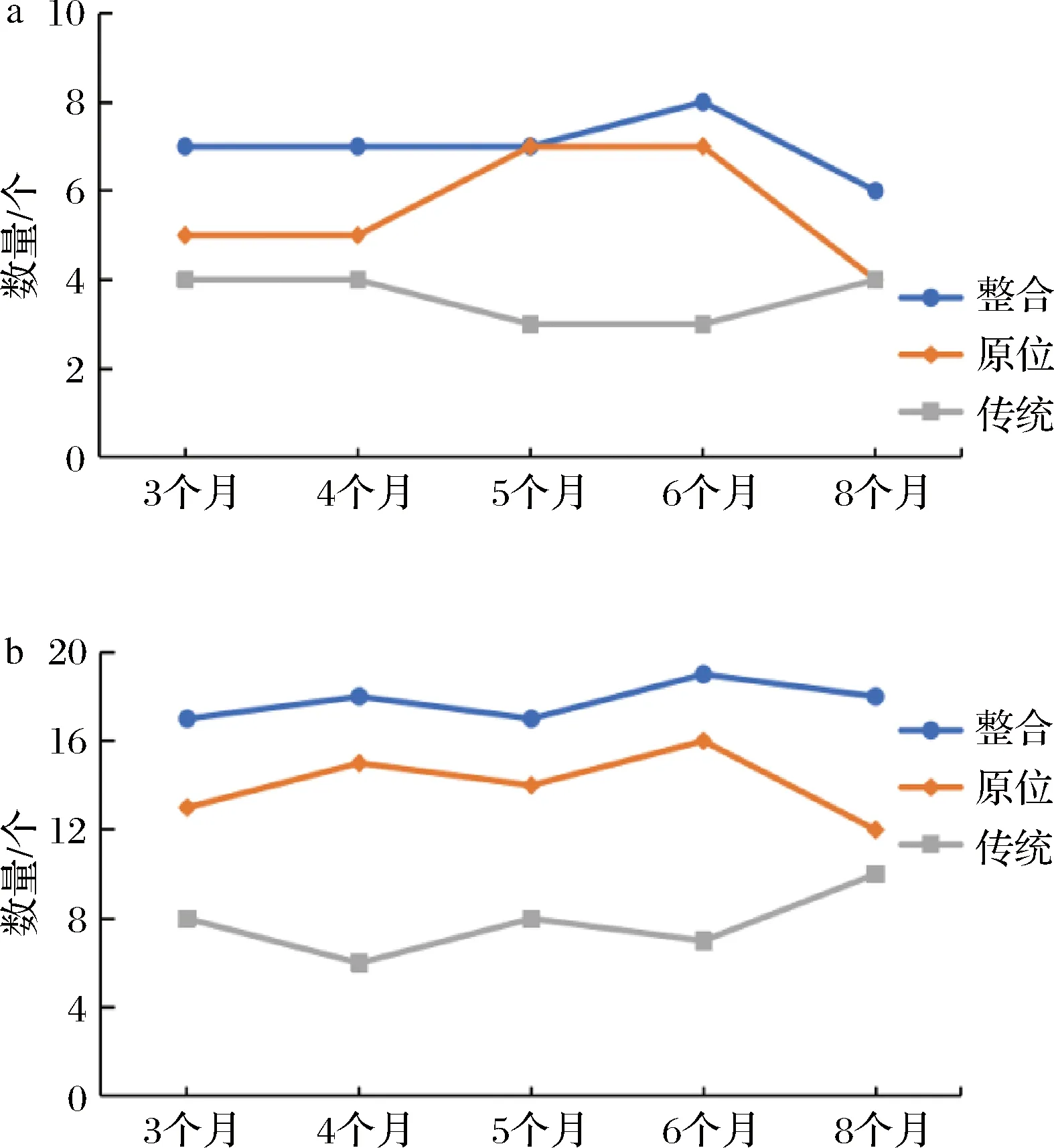
a-属水平;b-种水平
2种培养法从不同储存期大曲中共分离获得17个细菌属,其中原位培养获得15个属;传统培养获得5个属(图7)。比较2种培养法的属级细菌多样性,原位培养获得特有属10个,传统培养获得特有属1个。原位培养获得的10个特有属中,大多都只基于高通量测序等分子生物学技术检测到丰度及功能预测,但未见从白酒发酵环境中分离出它们相关物种的报道。SUN等[23]通过高通量测序揭示了浓香型白酒糟醅中之前未发现的Alcaligenes。基于高通量测序技术,Citrobacter和Paenibacillus被证明是酱香白酒主要优势菌属[24-25]。Citrobacter分泌的水解酶可降解酒中氨基甲酸乙酯,保障食品安全性[26]。Paenibacillus对酱香型糟醅的香气成分影响较为显著[27]。Paenibacillussp.中克隆出的β-1,3-1,4-葡聚糖酶基因能有效降解酿酒谷物中β-葡聚糖,降低啤酒糟黏度和浊度,促进优质啤酒生产[28]。母应春等[29]利用高通量测序技术发现Acinetobacter和Ralstonia与贵州酒曲酸度变化呈正相关。因此,在基于免培养技术和认识微生物的基础上,利用原位培养分离得到发酵功能菌以研究其生理生化以及发酵特性,为提高白酒品质做出重要贡献。

a-属水平;b-种水平
2种培养法从不同储存期大曲中共分离获得46个细菌种,其中原位培养获得36个种;传统培养获得17个种(图7)。比较2种培养法的种级细菌多样性。原位培养获得特有种28个,传统培养获得特有种9个。原位培养的28个特有细菌种中,Bacillusparamycoides、Bacillusvallismortis、Staphylococcusxylosus、Brevibacillusborstelensis等在白酒发酵环境中鲜有报道,这些微生物大多在酱香白酒中首次报道或者分离。其中,B.paramycoides分泌耐碱耐热的木聚糖酶证明了其在酒精饮料和发酵工业的应用潜力[30]。B.vallismortis已经被报道对提高芝麻香型白酒中含硫风味成分的重要性[31]。S.xylosus是常见的食品发酵物种[32],但在白酒领域深入研究较少。高亦豹等[33]利用DGGE检测到了传统方法未能分离鉴定的S.xylosus。B.borstelensis被报道能产生一种类似细菌素的抗菌物质,对Listeriamonocytogenes、Staphylococcusaureus等常见食品腐败致病菌具有抑制作用[34]。原位培养法提高了对酱香型白酒中潜在功能菌种的认识。
原位培养和传统培养共有优势属中,Bacillus是2种培养法的绝对优势属。原位培养中Bacillus在5个储存期总的IF为86.15%,共分离出Bacillus属下的15个种;传统培养中Bacillus在5个储存期总的IF为58.95%,只分离出Bacillus属下6个种(表1和表2)。除了5个共有种,原位培养获得Bacillus独有种10个。结果表明,原位培养分离出的Bacillus属不仅优势度大且种类多,体现了原位培养相较于传统培养的分离优势。Bacillus是酱香白酒的核心物种,具有产蛋白酶、淀粉酶、吡嗪和有机酸的功能,对白酒的生产和风味有重要影响[35-37]。基于原位培养法,人们将进一步加强对酱香型白酒绝对优势功能属Bacillus的认识,为改善白酒品质和风味提供参考。
本课题组研究发现同批次酱香大曲的高通量测序显示绝对优势菌属并不是Bacillus,而是Kroppenstedtia。然而,本试验原位培养法中却未分离出Kroppenstedtia,这可能是由于Kroppenstedtia是一种高温放线菌,而原位培养膜PCTE的孔径只有0.03 μm,高温放线菌的菌丝不能探出膜孔吸收外界营养物质。未来可将孔径为0.22 μm的无菌生物滤膜应用到丝状真菌及高温放线菌的原位培养中[38]。
为全面探究3~8个月储藏期大曲可培养细菌的菌群结构多样性,分析了2种培养法整合后的大曲菌群数量变化(图6),结果显示6个月储存期大曲中分离到的物种在种属水平上均最丰富,但是整体上菌种数量波动较小。同时,5个储藏期的大曲主要优势菌群相似且稳定(表1和表2),可以投入生产使用。梁晨等[39]利用高通量测序发现贮存4~6个月大曲微生物群落结构及风味成分更有利于白酒的酿造。XI等[2]基于高通量测序发现春季酱香大曲的有效储存期为6个月,夏季为2个月,秋季为6个月以上。本研究结果与上述研究基本吻合,因此,可选用3~8个月储存期的陈曲酿酒。值得注意的是,有些菌属在储存后期的IF较高。原位培养和传统培养法中Bacillus分别在8个月和6个月储存期达到最大IF,分别为89.9%和78.9%(表1和表2)。Staphylococcus属所有的种都在6~8个月储存期才筛选到(表1和表2)。Bacillus是酱香白酒生产的核心物种[37]。WANG等[40]证明Staphylococcus是3种不同类型(白大曲、黑大曲和黄大曲)高温大曲的主要细菌属。这种高IF现象可能是因为储存到后期的酱香大曲温度和湿度比较适合这些菌的生长。酱香大曲在发酵结束后,需要在干燥环境下储存并降低湿度,进一步优化大曲微生物菌系,从而积累大曲的酶系、香气和风味[3]。因此,从微生物的菌属特性、平衡角度分析,6个月储存期的陈曲更适合投入生产。
3 结论
本研究首次采用原位培养法和传统培养法技术对比分析不同储存期茅台镇酱香型高温大曲的细菌群落结构。与传统培养法相比,原位培养能培养出更多种类的细菌,分离效率是传统培养法的2倍。同时,原位培养基于高通量测序可筛选得到、难培养的功能微生物。尽管本研究只选取了不同陈化期的高温大曲,样品数较少,但研究结果较好地体现了原位培养技术在传统酿造环境中分离培养功能微生物、挖掘丰富的微生物资源所具有的技术优势和良好应用前景。本课题组接下来将继续利用原位培养技术分离筛选糟醅和窖泥中的酿酒微生物,并进一步研究功能微生物。