基于非靶向代谢组学的槟榔花香关键代谢物的筛选
辛晓栋 温欣宇 降佳君 王玲 杨国斌 杨福孙






摘 要:为了筛选出控制槟榔花香的关键代谢物,提升槟榔花香,吸引更多授粉者,从而提高槟榔产量。本研究采用顶空固相微萃取气相色谱-质谱联合分析技术对不同时期槟榔花进行非靶向代谢组学检测。结果共检测到236 种代谢物。利用VIP 值和差异倍数相结合的方法共筛选出75 种差异代谢物,主要包括萜类、酮类、醇类等。其中槟榔雌花的挥发性化合物从雌花未开期到初开期发生大量积累,在盛开期又发生轻微下降,所以雌花初开期可能是槟榔雌花花香形成的关键时期。槟榔雄花的挥发性化合物在雄花初开期到盛开期发生了大量积累,所以雄花盛开期可能是槟榔雄花花香形成的关键时期。之后对差异代谢物使用KEGG 数据库对其代谢途径进行分析,篩选与植物花香有关且富集显著的代谢通路。结果表明:槟榔雌花中富集显著且与花香合成有关的代谢途径为脂肪酸生物合成,在该通路上富集的物质为癸酸。癸酸是一种脂肪酸类物质,其多用于植物生理和信号传递等功能,槟榔雌花未开期到初开期癸酸含量上调,花香释放量也发生相应的提升,这可能是由于槟榔在雌花初开期开始授粉,需要传递更多的化学信号,从而吸引授粉者。所以癸酸可能是槟榔雌花为了授粉而释放的一种化学信号。槟榔雄花中富集显著且与花香合成有关的代谢途径分别为双萜类生物合成和脂肪酸降解,棕榈醛和(4aR,6aS,9R,11aR,11bR)-4,4,11b-三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘分别富集在这2 条代谢途径上。(4aR,6aS,9R,11aR,11bR)-4,4,11b-三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘为萜类物质,中文名为贝壳杉烯是双萜类物质,它的对映体ent-贝壳杉烯在贝壳杉烯合酶的作用下由反式-牻牛儿基牻牛儿焦磷酸开环而合成,是赤霉素的前体。雄花初开期到盛开期该物质含量发生下调,可能是由于雄花盛开期时所需赤霉素含量降低。棕榈醛为醛类物质,是脂肪酸生物降解释放出的代谢物,槟榔雄花初开期到盛开期花香释放量升高,同时棕榈醛的含量也发生上调,二者之间呈正相关关系。因此,以上3 种代谢物可能是影响槟榔花香的关键代谢物。
关键词:代谢途径;代谢组学;槟榔花;差异代谢物
中图分类号:S792.91 文献标识码:A
槟榔(Areca catechu L.)属棕榈科槟榔属常绿乔木,是海南农户的主要收入来源[1]。槟榔属被子植物,其传粉方式分为自花传粉和异花传粉2 种类型。异花传粉主要分为风媒花与虫媒花,以风作为授粉媒介称为风媒花,风媒花颜色通常较为暗淡,气味不明显,同时不能产生花蜜,花粉粒较为干燥不具有黏着性,而且质量小容易被风传送。虫媒花指以昆虫为授粉媒介。虫媒花多具美丽花瓣、蜜腺和特征香味,花粉具有黏着性容易附着在昆虫身体上的特点。槟榔雌雄花虽然同株同序,但雌雄花不同期开放,为异花授粉植物。由于槟榔授粉率较低,导致其产量低下。槟榔雌花颜色鲜艳、体型较大并有花香,雄花花粉质轻,易被风吹送,同时有大量香味溢出,前人认为槟榔为风媒花,但从表型分析发现槟榔花具有虫媒花特性,尤其槟榔雌雄花均有香味,且能产蜜。而花香作为一种化学信号有助于授粉者辨别植物的种类和位置[2],具有吸引授粉者的功能。
但由于槟榔花香味不足,吸引授粉者较少从而导致产量较低。
代谢组学是一门新兴学科,可将样品信息进行有效整合,具有所需时间短、精度高和涵盖面广的特点,能够更加准确、全面地检测样品中的小分子代谢物[3-5]。其中,非靶向代谢组学有助于更加全面地反映代谢物的变化,同时对于新的代谢通路的挖掘也有利[6]。固相微萃取(solidp phasemieroextraetion, SPME)技术是一种近年来新兴的处理技术,该技术对于食品香气分析意义重大[7-9]。
目前对槟榔花的研究主要集中在其药用成分和特殊功效方面[10-13]。现有研究只对槟榔雄花与花梗的香气成分进行了初步分析,并未明确控制槟榔雌雄花花香的关键代谢物及其各时期的花香释放规律[14]。
在植物中与花香有关的通路主要分为三大类,分别为萜烯类化合物的生物合成、苯丙烷/苯环类化合物的生物合成和脂肪酸衍生物的生物合成。因此本研究将采用顶空固相微萃取气相色谱-质谱联合技术,对不同时期的槟榔花进行代谢组学分析,明确槟榔花各时期的花香释放规律,同时筛选出与花香合成有关的通路,从而确定控制槟榔花花香的关键代谢物,为提升槟榔花香提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 槟榔花于2021 年4 月20 日至7 月20 日取于海南省琼中县槟榔园,经鉴定为海南本地品种。供试材料为雌花未开期(F1)、初开期(F2)、盛开期(F3),雄花初开期(M1)和盛开期(M2)共5 个时期的槟榔花(图1),每个时期3 次重复。采集的样品送至迈维(武汉)生物科技有限公司进行代谢组学检测。
1.1.2 主要仪器设备 本研究采用的仪器主要为安捷伦(Agilent)8890-5977B 型气相色谱-质谱联用仪、安捷伦(Agilent)DB-5MS 型色谱柱、安捷伦(Agilent)120 μm DVB 萃取头,均由安捷伦公司生产。
1.2 方法
本研究主要参考CHEN 等[15]和戴宇樵等[16]的实验方法,将所取样品使用液氮进行研磨,加入NaCl 溶液,使用全自动顶空固相微萃取对样本进行萃取,以供GC-MS 分析。
色谱条件:DB-5MS 毛细管柱,恒流流速为1.0 mL/min,进样口温度为250 ℃,不分流进样。
质谱条件:接口温度为280 ℃,电子能量为70 eV,扫描范围为50~500 amu。
1.3 数据处理
GC-MS 分析得到的原始数据先进行峰提取,获取特征峰的峰面积和保留时间等信息,然后采用迈维云平台和公共数据库对代谢物进行鉴定。
根据差异系数(variable importance inproject, VIP≥1,P<0.05)[17]和最大差异倍数值对检测到的代谢物进行筛选,同时对差异代谢物进行途径分析[18]。
2 结果与分析
2.1 槟榔花中的挥发性有机化合物分析
通过HS-SPMEGC/MS 方法,在不同时期的槟榔雌花、雄花中共鉴定出236 种挥发性有机化合物,包括酯类、萜类、酸类等物质(图2)。其中酯类的种类最丰富(约25%),其次为杂环化合物(约15%)和萜类(约15%)。在植物中杂环化合物一般对植物香味影响较小,但酯类物质与萜类物质的香气阈值较低对植物花香贡献很大,所以本研究认为这些挥发性有机化合物在促进槟榔花香气中起着非常重要的作用。
2.2 不同时期槟榔花的代谢判别分析
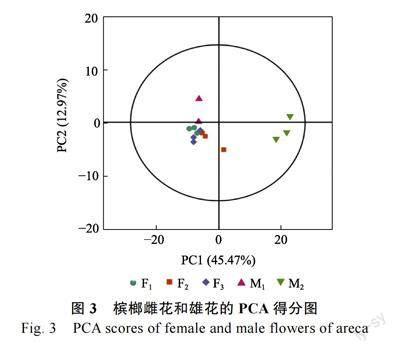
2.2.1 主成分分析 对所得数据使用主成分分析,PCA 得分如图3 所示。主成分1 的贡献率为45.47%,主成分2 的贡献率为12.97%。X 轴方向模型的累积解释率R2X=0.751,因此该PCA 模型拟合性较好。雄花M1 与M2 和雌花F1、F2、F3 基本分离,虽然M1 与雌花样本相距较近,可能是相同品种,代谢物种类相近导致的,但基本得到了有效区分,说明组间存在差异。
2.2.2 正交偏最小二乘判别分析 OPLS-DA 可以将与分类无关的影响信息过滤掉,有助于对组间差异进行更加精确的区分。采用OPLS-DA 对得到的质谱数据进行分析,发现槟榔雌花与雄花样品分布在置信区间的左侧和右侧,二者被明显区别,说明其存在显著差异,因此对槟榔雌雄花进行分类研究(图4)。模型累计预测率Q2=0.758,R2X=0.631,R2Y=0.992 说明该评估模型可靠有效(图5)。
2.3 槟榔雌花不同时期差异代谢物筛选
通过VIP≥1,P<0.05 对不同时期的槟榔雌花进行差异代谢物筛选,其中F1 VS F2 共筛选出17种差异代谢物,17 种差异代谢物全部发生上调,其中酯类物质4 种、杂环类化合物4 种、醛类2种、酮类2 种、卤代烃2 种、酸类1 种、醚类1种、萜类1 种。F2 VS F3 共筛选出6 种差异代谢物,6 种物质全部发生下调,其中烃类5 种、酸类1 种。F1 VS F3 共筛选出8 种差异代谢物,其中2 种物质发生下调,6 种物质上调,其中酮类物质2 种、酯类物质2 种、杂环类化合物2 种、醛类1 种、酸类1 种。由此可见,在槟榔雌花发育过程中,挥发性有机化合物在F2 时期发生大量积累,在F3 时期又发生了一定程度的下降,但相对于F1 时期,F2 和F3 时期挥发性有机化合物都发生了大量的积累,这些结果表明挥发性有机物在槟榔雌花的初开期和盛开期发生了大量积累。
差異表达的代谢物可能是槟榔雌花发育过程中香气形成的重要因素。
本课题组对这些差异代谢物进行研究发现(表1),相比与F1 时期,F2 时期的槟榔雌花中酯类物质发生了大幅度的提升,在植物中酯类物质主要通过脂肪酸氧化形成,使植物呈现花香味,这表明在F2时期槟榔雌花的香味也相应的大幅度提升。除酯类物质外,酸类物质的提升将近7 倍,在植物中酸类物质主要赋予植物酸味,在F2 时期差异表达的酸类物质为癸酸,癸酸属于脂肪酸物质在植物中一般具有脂香和柑橘味,同时用于传递化学信号,在F2 时期槟榔雌花刚刚开放将要授粉,此时癸酸含量激增,所以癸酸可能是槟榔雌花开放的一种化学信号物质。相比与F2 时期,F3时期挥发性化合物发生下降,但主要下降物质为烃类物质,在植物中烃类物质一般对香味影响较低,所以F3时期槟榔雌花香味只发生了轻微下降,不做具体分析。综上所述,F2 时期可能是槟榔雌花花香形成的关键时期。
2.4 槟榔雄花不同时期差异代谢物筛选
通过VIP≥1,P<0.05 对不同时期的槟榔雄花进行差异代谢物筛选,其中M1 VS M2 共筛选出44 种差异显著代谢物,其中萜类12 种、酯类10种、杂环化合物5 种、酮类物质4 种、芳烃3 种、酸类物质2 种、胺类物质2 种、醇类物质2 种、醛类2 种、酚类1 种、烃类物质1 种,其中40 种上调物质占91%,4 种下调物质占9%。由此可见,在M2 时期挥发性有机化合物开始大量积累,差异表达的代谢物可能是槟榔雄花香气形成的重要因素。
本课题组对雄花差异代谢物进一步研究发现(表2),相比于M1,M2 中萜类物质、酯类物质均发生了大幅度的提升,在植物中酯类物质和萜类物质其香气阈值普遍较低,对植物花香影响较大,所以在M2 时期槟榔雄花的花香发生了大幅度的升高,综上所述M2 时期可能是槟榔雄花花香形成的关键时期。
2.5 差异代谢物分类
为了对不同时期的槟榔雌雄花的差异代谢物进行进一步分析,本研究对富集在代谢通路上不同时期槟榔花的差异代谢物进行热图分析(图6,图7),图中行与代谢物质相对应,列与样本相对应,槟榔雌花9 个样本,雄花6 个样本。含量的高低使用不同颜色进行表示,上调为红色,下调为蓝色,从蓝色到红色是由低到高的表达。由图6 可知,槟榔雌花的聚类热图主要有3 种物质,分别为癸酸、L-α-松油醇、水杨酸,F1 VS F2 这3种物质均发生了上调,F2 VS F3 这3 种物质均发生了下调。由图7 可知,槟榔雄花的聚类热图主要有4 种物质,分别为(4aR,6aS,9R,11aR, 11bR)-4,4,11b-三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘、L-α-松油醇、对二甲苯、棕榈醛,在M1 VS M2中, (4aR,6aS,9R,11aR,11bR)-4,4,11b- 三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘发生了下调,L-α-松油醇、对二甲苯、棕榈醛3 种物质发生了上调。
2.6 差异代谢物KEGG 富集分析
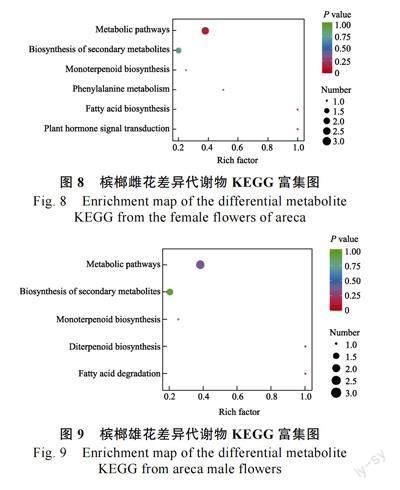
通过KEGG 数据库对槟榔雌雄花差异代谢物所在通路进行分析,雌花差异代谢物主要分布在6 条代谢通路中(图8)。雄花差异代谢物主要分布在5 条代谢通路中(图9)。
槟榔雌花中富集显著的通路分别为代谢物通路、脂肪酸生物合成和植物激素信号转导3 条通路。其中与花香合成有关的通路为脂肪酸生物合成,在该通路上富集的物质为癸酸,癸酸是一种脂肪酸类物质,植物多使用脂肪酸来合成酰基脂质,用于生理、防御和信号传递等功能。在槟榔雌花未开期到初开期开始授粉,此时癸酸含量发生上调,花香释放量也发生大幅度的提升。所以,癸酸可能是槟榔雌花释放的一种化学信号,用来吸引授粉者提升授粉率。
槟榔雄花中富集显著的通路分别为双萜类生物合成和脂肪酸降解2 条通路。2 条通路都与花香合成有关。有2 种物质分别被富集到这2 条通路中,分别为(4aR,6aS,9R,11aR,11bR)-4,4,11b-三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘和棕榈醛。(4aR,6aS,9R,11aR,11bR)-4,4,11b-三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘中文名为贝壳杉烯是双萜类物质,是植物花香的一种重要组成物质,它的对映体ent-贝壳杉烯在贝壳杉烯合酶的用作下由反式-牻牛儿基牻牛儿焦磷酸开环而合成,是赤霉素的前体。在雄花初开期到雄花盛开期该物质发生下调,可能是槟榔雄花此时已经过了脱落期,对赤霉素的需求发生了降低。棕榈醛是醛类物质有花和蜡的香气,是脂肪酸生物降解释出的代谢物,槟榔雄花初开期到盛开期花香释放量升高,同时棕榈醛的含量也发生上调,释放出大量香味,以吸引授粉者采集花粉。
3 结论
槟榔是海南省一种重要的农业经济作物,具有极高的经济价值。本研究建立了基于非靶向代谢组学对不同时期槟榔花差异代谢物的分析方法。研究表明,槟榔雌花中共检测出155 种芳香化合物,其中雌花初开期花香释放量最高、盛开期次之、未开期最低,不同时期的槟榔雌花代谢物差异主要来源是脂类和酸类,其中癸酸可能是控制槟榔雌花花香的关键代谢物。槟榔雄花中共检测出166 种芳香化合物,其中雄花盛开期的花香释放量高于初开期,不同时期的槟榔雄花代谢物差异主要来源是萜类、酯类、醛类, 其中(4aR,6aS,9R,11aR,11bR)-4,4,11b-三甲基-8-亚甲基十四氢-6a,9-甲基环庚[a]萘和棕榈醛可能是控制槟榔雄花花香的关键代谢物。本研究结果明确了控制槟榔雌雄花花香的关键代谢物和各时期的花香释放规律,而这些关键代谢物的具体合成机制有待进一步探索,从而为定向调控槟榔花香提高产量提供一定的理论参考价值。
参考文献
[1] CHEN W J, ZHANG C M, HUANG Y L, CHENG F F,SHEN Y, WANG R C, TANG M M, ZHENG Y J, ZHAO S L. The inhibiting activity of areca inflorescence extracts on human low density lipoprotein oxidation induced by cupric ion[J]. International Journal of Food Sciences and Nutrition,2012, 63(2): 236-241.
[2] KNUDSEN J T, ERIKSSON R, GERSHENZON J, STAHL B. Diversity and distribution of floral scent[J]. The Botanical Review, 2006, 72(1): 1-120.
[3] WISHART D S, FEUNANG Y D, MARCU A, GUO A C,LIANG K, VAZQUEZ-FRESNO R, SAJED T, JOHNSON D, LI C, KARU N, SAYEEDA Z, LO E, ASSEMPOUR N,BERJANSKII M, SINGHAL S, ARNDT D, LIANG Y,BADRAN H, GRANT J, SERRA-CAYUELA A, LIU Y,MANDAL R, NEVEU V, PON A, KNOX C, WILSON M,MANACH C, SCALBERT A. HMDB 4.0: the human metabolome database for 2018[J]. Nucleic Acids Research,2018, 46(D1): D608-D617.
[4] BINO R J, HALL R D, FIEHN O, KOPKA J, SAITO K,DRAPER J, NIKOLAU B J, MENDES P, ROESSNERTUNALIU, BEALE M H, TRETHEWEY R N, LANGE B M, WURTELE E S, SUMNER L W. Potential of metabolomics as a functional genomics tool[J]. Trends in Plant Science, 2004, 9(9): 418-425.
[5] 戴宇樵, 呂才有. 代谢组学技术在茶学中的应用研究进展[J]. 江苏农业科学, 2019, 47(2): 24-28.
[6] JOHNSON C H, IVANISEVIC J, SIUZDAK G. Metabolomics: beyond biomarkers and towards mechanisms[J]. Nature Reviews. Molecular Cell Biology, 2016, 17(7):451-459.
[7] 李洪波, 劉胜辉, 李映志, 毛琪, 叶春海. 顶空固相微萃取和气相色谱-质谱法测定菠萝蜜果肉中的香气成分[J].热带作物学报, 2013, 34(4): 755-763.
[8] 代毅, 须海荣. 采用SPME-GC/MS 联用技术对龙井茶香气成分的测定分析[J]. 茶叶, 2008, 34(2): 85-88.
[9] 刘拉平, 史亚歌, 张瑞明, 李岚, 杨蓉. 午子绿茶香气物质固相微萃取GC-MS 分析[J]. 西北植物学报, 2007, 27(2):371-376.
[10] 黄玉林, 陈洋平, 陈卫军, 张春梅. 响应面法优化提取槟榔花总酚的研究[J]. 热带作物学报, 2011, 32(6): 1158-1164.
[11] 战晴晴, 周亚奎, 刘洋洋, 卢丽兰, 甘炳春, 秦以国. 不同花期槟榔花槟榔碱的含量分析[J]. 精细化工, 2013, 30(3):285-287.
[12] 张春梅. 槟榔花提取物抗衰老作用研究[D]. 长沙: 湖南农业大学, 2011.
[13] 程芳芳, 海洪, 黄玉林, 张春梅, 陈卫军. 槟榔花沸水提取物对酪氨酸酶抑制作用的研究[J]. 热带作物学报, 2010,31(11): 1932-1936.
[14] 张明, 黄玉林, 宋菲, 陈卫军, 赵松林, 邓福明.SPME-GC/MS 联合分析槟榔花香气成分[J]. 热带作物学报, 2014, 35(6): 1244-1249.
[15] CHEN W, GONG L, GUO Z, WANG W, ZHANG H, LIU X,YU S, XIONG L, LUO J. A novel integrated method for large-scale detection, identification, and quanti of widely targeted metabolites: application in the study of rice metabolomics[J]. Molecular Plant, 2013, 6(6): 1769-1780.
[16] 戴宇樵, 吕才有, 何鲁南, 易超, 刘学艳, 黄雯, 陈加敏.基于代谢组学的‘云抗10 号’晒青茶加工过程代谢物变化[J]. 中国农业科学, 2020, 53(2): 357-370.
[17] 洪森荣, 吴夏俊鹏, 徐文慧, 占学林, 谢妮妮, 蒋妍, 汪金华, 凌飞, 吴丽霞, 万琳. 低温离体保存黄独微型块茎转录组、蛋白质组和代谢组的关联分析[J]. 浙江农业学报,2017, 29(11): 1827-1834.
[18] ARAPITSAS P, CORTE A D, GIKA H, NARDUZZI L,MATTIVI F, THEODORIDIS G. Studying the effect of storage conditions on the metabolite content of red wine using HILIC LC-MS based metabolomics[J]. Food Chemistry,2016, 197(10): 1331-1340.

