甘蔗CesA7基因的生物信息学分析及功能预测
匡博文 赵极瀚 李思程 韦妳 冯梦凡 杨细平

摘 要:纤维素是植物根系的主要成分之一,在植物抗倒伏中起到关键作用。CesA7 是控制纤维素合成的重要基因,在甘蔗中的功能未知。以水稻OsCesA7 基因为参考序列,在甘蔗割手密(Saccharum spontaneum)、甘蔗杂交栽培品种(Saccharum spp. hybrid)、甘蔗热带种(S. officinarum)3 个基因组中进行同源分析及功能预测。基于该基因及其同源基因的进化分析显示杂交栽培品种的CesA7 基因和热带种的CesA7 基因更为接近,禾本科植物有明显的聚类,但不能区分草本植物和木本植物。甘蔗CesA7 基因的启动子区域含有大量的光反应和茉莉酸甲酯元件,说明该基因可能参与植株的光形态建成和甘蔗抗逆反应。启动子和蛋白互作预测表明CesA7 基因与MYB 转录因子存在互作,说明其在作物生长发育和胁迫响应中起到一定作用。此外,水稻和高粱中CesA 蛋白的功能预测显示,其参与调控了纤维素合成和木质素降解过程。通过对7 个甘蔗及其近缘属代表种质的苗期根和叶的转录组数据分析,发现CesA7 基因在根中表达量远高于叶,推测该基因参与调控甘蔗根系的发育。在甘蔗及近缘属不同种质中对该基因进行SNP 变异检测,发现在割手密中核苷酸多态性最高。外显子区域的核苷酸多态性明显高于内含子区域,在基因第4 个外显子(2000 bp 左右)区域的多态性最高,推测在该位点可能经受平衡选择造成不同等位基因的功能分化。借助多序列比对结合重测序数据分析,本研究挖掘了2 个可区分割手密和热带种的潜在分子标记。该研究结果对进一步研究和利用CesA7 基因改良甘蔗品种提供理论指导。
关键词:甘蔗;纤维素;CesA7 基因;进化分析
中图分类号:S566.1 文献标识码:A
甘蔗是广西重要的经济作物,其占全国每年食糖产量的60%以上[1]。由于广西地处华南地区,受台风、季风影响较大,容易造成蔗区大面积倒伏。甘蔗倒伏是造成甘蔗减产的重要原因之一。倒伏的蔗茎含糖量降低,机械收获过程损失大[2]。李翔[3]在对甘蔗抗倒伏性评价的过程中发现,倒伏和抗倒伏品种中甘蔗的纤维素含量在茎秆和根部存在较大的差异。倒伏品种茎中纤维素的含量远高于其他品种;抗倒伏品种GT42 根中纤维素含量远高于其他品种。根系中纤维素和木质素含量越高,植物抗拉强度和固土效能越好[4]。
植物根中纤维素含量占根系主要成分的50%左右,有时甚至高达90%[5]。苹果和水稻中的相关研究表明,纤维素相关合成基因调控植物根系的发育[6-8]。
纤维素合成酶基因家族CesA 对植物纤维素的合成起到至关重要的作用。在拟南芥中,AtCesA7、AtCesA7 和AtCesA7 三个基因被认为与植物次生细胞壁中纤维素的合成有关[9-11] 。
ZHONG 等[12]在AtCesA7 基因突变型中发现,相对于野生型其细胞壁厚度和纤维素含量明显减少。通过在野生型中过表达该突变体的cDNA,不仅会导致次生细胞壁变薄和纤维素含量降低,还会阻碍细胞伸长和原生细胞壁增厚。同样,WANG 等[13]发现在水稻中OsCesA7 基因的突变会导致植株机械强度降低,节间伸长减少,在苗期造成轻度的矮化。由此可见,CesA 基因家族起着调控植物生长发育的作用。随着对该基因家族深入研究,发现其在植物生长发育过程中,还存在着组织特异性表达。巨龙竹是世界上已知最高大的竹类植物,其参与细胞壁合成的基因数量远大于处于同一亚科的竹类植物[14]。通过测定不同组织间的转录组表达量发现,参与初生壁合成的2 个基因从笋尖到幼嫩节组织的表达量呈上升趋势[15]。毛竹中CesA 基因表达也存在着组织差异,其在笋和根中的表达量较高,说明这些基因参与了次生壁的木质化过程。CesA 基因与MYB 转录因子存在强烈的共表达,王新悦等[16]通过qRTPCR、酵母单杂等实验证实了这一事实,MYB 转录因子能够与CesA 基因启动子的元件结合,进一步對基因进行调控。
纤维素相关基因对于植物生长发育,尤其是根的发育存在重要的影响。目前,在甘蔗中有关纤维素基因的研究相对较少。对纤维素性状改良有利于提高甘蔗的抗逆能力,实现产量提高。本研究以水稻中已完成功能验证的OsCesA7 基因在甘蔗基因组中进行同源分析,通过进化关系、蛋白结构域、启动子、表达量及蛋白互作等分析,对甘蔗CesA7 基因进行功能预测,探究该基因与植株生长发育和逆境胁迫的关系,以期为后续甘蔗研究和利用CesA7 基因提供基础数据和理论指导。
1 材料与方法
1.1 CesA7 同源基因的筛选及进化树构建
在水稻RGAP 数据库(http://rice.uga.edu/)下载OsCesA7 基因(LOC_Os10g32980.1)的蛋白序列,通过NCBI 的Blastp 功能在NR 数据库中进行同源比对分析,比对参数中Max target sequences设置为1000,其余参数均为默认值。使用BLAST(v.2.12.0)本地化程序,将OsCesA7蛋白与甘蔗割手密(AP85-441,四倍体基因组)[17]、热带种(LApurple,八倍体基因组,数据未发表)、栽培种(R570,二倍体基因组)[18]基因组数据库进行比对,分析甘蔗中的同源情况。比对结果中的物种分类主要参考中国科学院植物研究所植物物种信息系统–植物智(http://www.iplant.cn/)。
为了更好构建进化关系,结合文献查阅[19-20],保留在植物进化关系中较为关键的物种。对Blast结果进行筛选。筛选后的序列在MEGA-X 软件中使用ClustalW 比对程序进行比对,比对结果使用邻接法(neighbor-joining method, NJ)进行进化树构建。Bootstrap Replications 参数设置为1000。
建树结果在在线网页iTOL(https://itol.embl.de/)中进行美化。
1.2 甘蔗 CesA7 基因的保守结构域和启动子顺式作用元件分析
甘 蔗 CesA7 基因的蛋白保守结构域使用NCBI 中的CDD(conserved domain database)功能进行分析。选取基因位置前2 kb 作为基因的启动子。使用PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件对启动子顺势作用元件进行分析。以上结果使用TBtools(v1.098721)软件中的Gene Structure View(Advanced)功能进行作图。
1.3 甘蔗 CesA7 基因的SNP 变异检测
以 OsCesA7 在栽培种R570 的甘蔗同源基因Sh01_p017850 为参考序列,在实验室已有全基因组重测序数据中,挑选割手密、大茎野生种、热带种、栽培种各5 个样品进行SNP 变异检测。使用GATK(v.4.2.5.0)分析流程软件在Linux 系统中进行分析。设置窗口大小为200 bp,通过vcftools(v.0.1.16)软件计算核苷酸多态性(Pi)值,对物种间的SNP 进行评估。使用R(version4.1.2)软件中的ggplot 包对得到的Pi 值进行绘图。
1.4 甘蔗 CesA7 基因的可变剪切和表达水平分析
利用实验室现有的甘蔗参考转录本和转录组数据进行信息提取。将参考转录本使用BLAST(v.2.12.0)软件构建本地化数据库,以甘蔗CesA7基因作为query 序列进行比对,提取最优的比对结果并查看可变剪切事件。转录组数据分别来自于斑茅BM(Saccharum arundinaceum)、印度种KAT(S. barberi)、大茎野生种N57(S. robustum)、热带种NJ(S. officinarum)、割手密Y83(S.spontaneum)、中国种YBA(S. sinense)、杂交栽培品种ZZ1(Saccharum spp. hybrid)7 个甘蔗近缘属代表物种的苗期根和叶的转录组数据。不同转录组的表达量选用TPM(Transcripts PerKilobase Million)方法进行标准化后比较,TPM代表每百万mapped reads 中每kb 转录本上的reads 数。
1.5 甘蔗 CesA7 基因的蛋白质相互作用预测
通过 STRING(https://cn.string-db.org/)在线蛋白质互作数据库对同源蛋白的互作情况进行分析。水稻OsCesA7 基因选择对应的水稻数据库。
由于甘蔗在该库中不存在对应的数据库,因而选择和它亲缘关系较近的高粱CesA7 基因进行分析。
1.6 甘蔗 CesA7 基因的比较及分子标记预测
结合多序列比对结果和重测序数据变异检测对CesA7 等位基因进行分析,同时预测区分不同种群的分子标记。使用Jalview(v. 2.11.2.2)软件展示多序列比对结果,比较等位基因间序列结构差异;使用IGV(v. 2.11.6)软件可视化变异检测结果,查看不同群体间序列变异情况。
2 结果与分析
2.1 植物 CesA7 基因筛选及进化分析
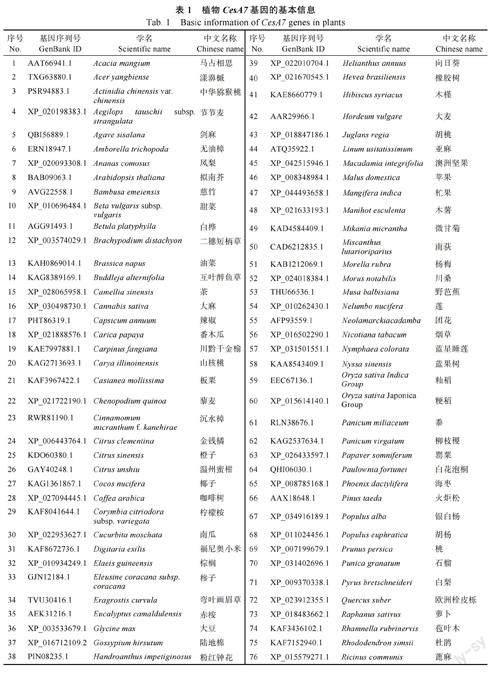
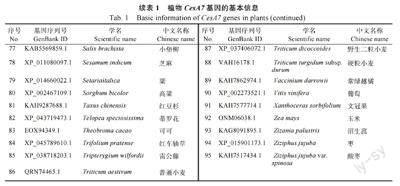
以 水 稻 OsCesA7 基因的编码蛋白序列为Query,在NCBI 数据库中通过Blastp 比对,筛选到95 个水稻OsCesA7 的同源基因(Score>1000,E 值均为0),其中49 个基因来自木本植物,46个来自草本植物(表1)。在甘蔗中,同样以水稻OsCesA7 基因的编码蛋白序列为Query,利用割手密、热带种、杂交栽培品种3 个物种的蛋白数据库进行本地化Blast 比对,筛选到该基因在甘蔗种内的同源基因(Score>1000,E 值均為0)。
由于割手密和热带种是多倍体基因组,目标基因在割手密中有2 个等位基因(Sspon.01G0026480-1A 和Sspon.01G0026480-2B),在热带种中有5 个等位基因(Soff.01G0006640-1A、Soff.01G0006640-2B、Soff.01G0006640-3C、Soff.01G0006640-4F 和Soff.01G0006640-5G),在杂交栽培品种R570 中有1 个等位基因(Sh01_p017850)。
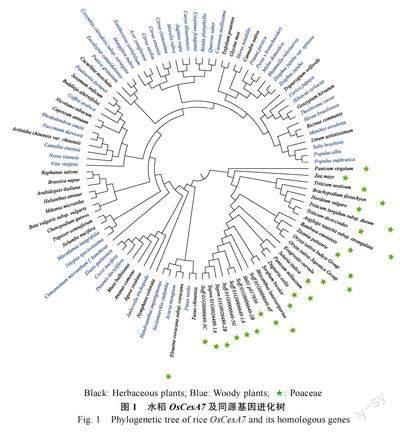
以 OsCesA7 及其同源基因序列构建进化树(图1),结果显示禾本科被聚为一类(穇子除外)。甘蔗CesA7 基因聚为一类,与多个黍亚科的物种同处一个分支,与高粱和芒的亲缘关系更为接近,与拟南芥的距离较远。纤维素和木质素含量在木本竹和草本竹中存在较大差异[21],纤维素合成基因CesA7 与植物细胞次生壁的合成密切相关[13]。以该纤维素基因构建的进化关系显示,除禾本科的物种单独聚类外,草本植物和木本植物融合在一起,推测可能需要多个纤维素和木质素合成相关基因才能更好地区分草本和木本植物。
2.2 甘蔗 CesA7 基因的保守结构域及启动子顺式作用元件分析
甘蔗 CesA7 基因含有5 个类型的结构域,其中 2 个与纤维素的合成有关(PLN02915 superfamily、Cellulose_synt superfamily),3 个与基因表达的调控有关(IF4E superfamily、RING_Uboxsuperfamily、Glyco_tranf_GTA_type superfamily)(图2A)。R570(Sh01_p017850)和割手密的一个单倍型(S.spon.01G0026480-2B)均缺少了真核生物启动因子的结构域(IF4E superfamily),可能导致二者与其他等位基因的功能分化。
甘蔗 CesA7 基因的启动子含有16 种类型的启动子顺式作用元件,其中光反应(light responsiveelement)和茉莉酸甲酯调控(MeJA-responsiveelement)的元件最多(圖2B)。热带种中Soff.01G0006640-4F 和生长素(auxin responsive element)、脱落酸(abscisic acid responsive element)、光反应调控的相关反应元件最多,热带种中光反应调控元件是割手密2 倍左右。割手密和栽培种每个等位基因茉莉酸甲酯的调控元件均含有4 个,而热带种平均仅存在1 个左右。茉莉酸甲酯能激发植物防御基因的表达,诱导植物的化学防御[22],与植物的环境适应能力有关。
2.3 甘蔗 CesA7 基因的核苷酸多样性分析
甘蔗 CesA7 基因(以栽培种R570 的等位基因Sh01_p017850 为参考序列)的SNP 数量从高到低为割手密(206)、热带种(155)、大茎野生种(144)和杂交栽培品种(122)。该基因的核苷酸多态(Pi)性在甘蔗种间的变化趋势相近,总体表现为割手密最高,杂交栽培品种最低(图3)。核苷酸多态性在基因不同区段存在差异,在第4 个外显子(2000 bp 左右)的核苷酸多态性最高,推测该基因在此位点经受平衡选择,导致不同等位基因的功能分化。杂交栽培品种的核苷酸多态性较低,低于其2 个祖先种割手密和热带种,说明杂交栽培品种CesA7 基因在高贵化育种过程中经受长期的人工选择,遗传基础相对狭窄。
2.4 甘蔗 CesA7 基因的可变剪切和表达量分析
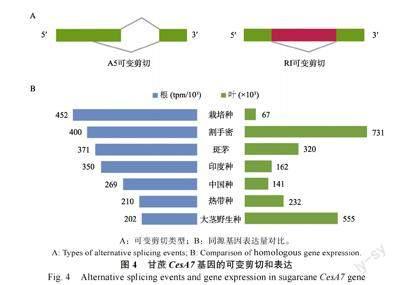
将甘蔗CesA7 基因与本实验室构建的甘蔗可变剪切数据库比对,仅有热带种的2 个单倍型存在可变剪切事件。Soff.01G0006640-1A 仅存在A5剪切事件;Soff.01G0006640-2B 同时存在A5 和RI 两个剪切事件(A5:一个外显子的3端存在剪切;RI:内含子保留事件,2 个外显子保留了中间的内含子组成一个新的外显子)(图4A)。
通过与本实验室构建的7 个甘蔗及近缘属材料苗期根和叶转录组数据库进行比较,发现该基因在不同物种间表达存在较大差异,且根中表达量要远高于叶(图4B)。根中表达量从高到低依次为杂交栽培品种、热带种和割手密等,叶中表达量最高为大茎野生种。割手密具有强大的根系,该基因在根系表达低于杂交栽培品种、热带种,推测其表达在不同时期会有差异,且割手密中的单倍型对根系发育起到更强的作用。
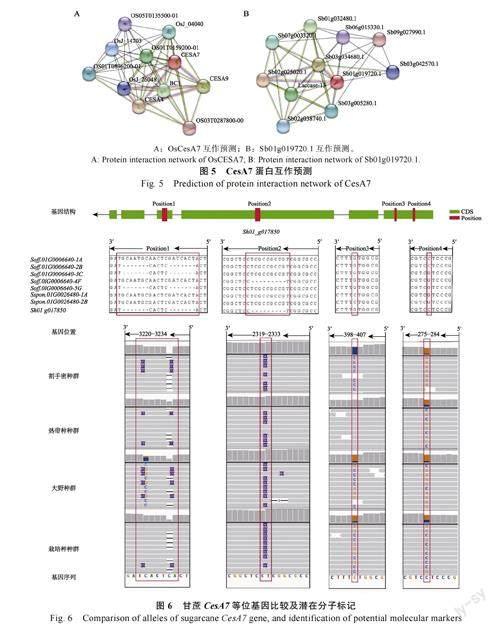
2.5 甘蔗 CesA7 蛋白相互作用预测
由于甘蔗缺少相应的蛋白数据库,本研究利用在线数据库分析了CesA7 基因在水稻和高粱中蛋白的互作关系。结果显示,水稻OsCesA7 基因在水稻中与OS05T0135500-01 蛋白(逆境胁迫响应有关,控制过氧化物分解、木质素的生物合成和降解),OsJ_04040 蛋白(与木质素降解有关),OsJ_26048(MYB 家族转录因子,调控纤维素基因表达),BC1 蛋白(与次生细胞壁中半纤维素的合成有关),OS03T0287800-00 蛋白(与纤维素在细胞表面累积有关),2 个CesA 蛋白(参与次生细胞壁的合成)存在互作关系(图5A)。同时,分析高粱CesA7 基因(Sb01g019720.1)的蛋白互作关系,发现其与Sb09g027990.1 蛋白(细胞色素b561 结构域蛋白),Sb07g003320.1 蛋白(MYB 家族转录因子),Laccase-13 蛋白(与木质素降解有关),Sb02g025020.1 和Sb03g034680.1蛋白(与纤维素合成有关)存在互作关系。水稻OsCesA7 基因及高粱CesA7 基因的蛋白互作预测均与纤维素合成、木质素降解有关,同时也受到MYB 家族转录因子的调控,这和启动子顺势元件分析中存在MYB 调控区域的结果相符合。
2.6 甘蔗 CesA7 的等位基因比较及分子标记预测
通过比较甘蔗CesA7 等位基因的序列差异,以设计分子标记进行区分。比较甘蔗CesA7 的8个等位基因,共筛选到4 个位点进一步分析(图6)。位点1 和位点2 为短的插入缺失,分别位于该基因的第3 和第4 号外显子上,在等位基因间分别存在14 bp 和9 bp 的差异。位点3 和位点4位于第6 号外显子上,为G/C 的单核苷酸多态性位点。将甘蔗割手密、热带种和杂交栽培品种的全基因组重测序数据比对到该基因上,以进一步验证这4 个潜在分子标记的真实性。比对结果均表明分子标记真实存在,特别是位点3 和位点4为热带种和割手密的特异性标记,可用于鉴定甘蔗种质是否为热带种、割手密或含有二者血缘。
甘蔗CesA7 的等位基因的分析显示位点1 和位点2 在热带种和割手密具有差异,但全基因组重测序数据显示该差异在2 个甘蔗种间均存在。因为全基因组重测序数据选取的样品更多,因而判定位点1 和位点2 不具备热带种和割手密种间差异。
3 讨论
甘蔗为多倍体植物,生物量大,其地上部庞大的生物量需要地下部强大的根系支持。植物根系的发育受到纤维素基因的调控,纤维素参与植物根系的壮大和营养吸收。纤维素含量越高,植物根系抗拉固土能力越强[23]。因而,增加甘蔗地下部纤维素的含量,有助于壮大甘蔗的根系,提高甘蔗抗倒伏、抗旱、养分吸收能力。
本研究以水稻中纤维素合成基因OsCesA7 为参考序列,在甘蔗和其他物种中进行比对及筛选到OsCesA7 的同源基因。本研究利用甘蔗7 种种质苗期不同部位的转录组数据,发现根中纤维素同源基因的表达量远远高于叶,说明该纤维素基因参与了甘蔗的根系发育。以单个纤维素基因构建进化树来看,仅有个别分支全为草本和木本植物。可见,单个基因对于区分草本和木本植物仍旧是有限的。
多个纤维素和木质素基因的效应累加可能才是导致草本和木本植物存在差异的原因[21]。
現代甘蔗商业品种,是由热带种和割手密杂交产生的,其基因组起源于割手密的部分仅占20%左右[24],说明甘蔗杂交栽培品种包含有更多的热带种血缘。从进化关系来看,甘蔗栽培品种R570 也和热带种LA Purple 更为接近。通过对甘蔗CesA7 等位基因的蛋白序列进行结构预测,发现每个等位基因均含有纤维素合成相关的结构域。启动子分析中发现等位基因含有MYB 转录因子的结合位点,这和蛋白互作预测中与MYB转录因子互作的结果相符合。MYB 转录因子在植物生长发育、物质代谢、胁迫响应过程中发挥重要作用,该基因可能参与调控这些过程[25]。同时,该纤维素基因还与其他纤维素基因存在互作,协同控制纤维素合成。在毛竹中也有类似发现的报道[16],推测禾本科中该类基因存在类似的调控模式。此外,在启动子分析中发现每个甘蔗CesA7等位基因都含有激素调控和逆境胁迫相关的元件,说明该基因可能与甘蔗抗逆有关。热带种中激素调控和光反应调控的元件最多,这可能是导致其和割手密纤维素含量存在较大差异的原因之一[26]。割手密CesA7 等位基因存在较多茉莉酸甲酯调控元件,对于逆境胁迫的响应更为灵敏。研究表明,割手密种质具有纤维素产量高等优良品质,是甘蔗近缘属中遗传变异潜力最大的物种[27]。
热带种鲜重高于割手密,但其干重仅为割手密一半左右,这种差异可能是由二者纤维素含量不同导致[26]。为了评估现有种质对甘蔗纤维素改良的效果,本研究对甘蔗割手密、大野、热带种及杂交栽培品种4 个物种进行了SNP 变异检测。结果显示,割手密中该基因的核苷酸多态性较高,说明针对纤维素性状改良来说,割手密种质有更大的潜在利用价值。
4 结论
本研究利用纤维素CesA7 基因的蛋白序列构建进化树,发现单个基因未能区分草本和木本植物。甘蔗CesA7 基因中存在纤维素合成相关结构域,其启动子区域的光反应调控和茉莉酸甲酯调控元件最多,同时还存在MYB 转录因子结合位点。蛋白互作预测显示CesA 蛋白与其他纤维素相关蛋白存在互作关系。转录组分析显示该基因在苗期根中表达量远高于叶。甘蔗近缘属种质中割手密CesA7 基因具有最高的核苷酸多态性。本研究通过多序列比对结果结合重测序比对,发现了2 个可区分割手密和热带种的潜在分子标记。
参考文献
[1] 李杨瑞. 关于广西的甘蔗育种[J]. 广西糖业, 2019(3): 3-9.
[2] 闫鹏, 董学瑞, 卢霖, 房孟颖, 李毅杰, 王维赞, 董志强. NAA/KT 浸种对新植蔗产量、根系发育及抗倒伏能力的影响[J]. 作物杂志, 2022(4): 99-106.
[3] 李翔. 甘蔗抗倒伏性评价及抗性机制研究[D]. 南宁: 广西大学, 2019.
[4] 朱锦奇, 王云琦, 王玉杰, 张会兰, 白雪琪, 李云鹏, 刘勇.根系主要成分含量对根系固土效能的影响[J]. 水土保持通报, 2014, 34(3): 166-170.
[5] BISCHETTI G B, CHIARADIA E A, SIMONATO T,SPEZIALI B, VITALI B, VULLO P, ZOCCO A. Root strength and root area ratio of forest species in Lombardy (Northern Italy)[J]. Plant and Soil, 2007, 278(1): 31-41.
[6] GENG D, CHEN P, SHEN X, ZHANG Y, LI X W, JIANG L J, XIE Y P, NIU C D, ZHANG J, HUANG X H, MA F W,GUAN Q M. MdMYB88 and MdMYB124 enhance drought tolerance by modulating root vessels and cell walls in apple[J]. Plant Physiology, 2018, 178(3): 1296-1309.
[7] 翟荣荣, 叶胜海, 朱国富, 陆艳婷, 叶靖, 张小明. 纤维素合成相关基因调控水稻根系发育机制的研究进展[J]. 分子植物育种, 2019, 17(20): 6691-6695.
[8] 李木英, 陈关, 潘晓华, 石庆华, 谭雪明, 陈志攀. 直播稻不同品种茎秆和根系性状与抗倒伏性关系[J]. 中国稻米,2012, 18(2): 17-21.
[9] 王振怡, 王金朋, 潘玉欣, 张家琦, 王希胤. 拟南芥和水稻CesA 基因家族的生物信息学分析[J]. 河南农业科学,2015, 44(6): 13-17.
[10] TAYLOR N G, SCHEIBLE W R, CUTLER S, SOMERVILLE C R, TURNER S R. The irregular xylem3 locus of Arabidopsis encodes a cellulose synthase required for secondary cell wall synthesis[J]. Plant Cell, 1999, 11(5):769-780.
[11] TAYLOR N G, LAURIE S, TURNER S R. Multiple cellulose synthase catalytic subunits are required for cellulose synthesis in Arabidopsis[J]. Plant Cell, 2000, 12(12):2529-2540.
[12] ZHONG R, MORRISON W H, FRESHOUR G D, HAHN M G, YE Z H. Expression of a mutant form of cellulose synthase AtCesA7 causes dominant negative effect on cellulose biosynthesis[J]. Plant Physiology, 2003, 132(2): 786-795.
[13] WANG D, QIN Y, FANG J, YUAN S, PENG L, ZHAO J,LI X. A missense mutation in the zinc finger domain of OsCESA7 deleteriously affects cellulose biosynthesis and plant growth in rice[J]. PLoS One, 2016, 11(4): e153993.
[14] PIOUCEAU J, BOIS G, PANFILI F, ANASTASE M,DUFOSSÉ L, ARFI V. Effects of high nutrient supply on the growth of seven bamboo species[J]. International Journal of Phytoremediation, 2014, 16(10): 1042-1057.
[15] 王文治, 王娟, 王昌命, 潘悦, 宋静, 栗宏林. 基于转录组的巨龙竹CesA 基因家族的生物信息学分析[J]. 分子植物育种, 2021, 19(9): 2912-2921.
[16] 王新悦, 朱成磊, 杨克彬, 李广柱, 李真, 袁婷婷, 高志民.毛竹CesA 基因鑒定及其表达调控研究[J]. 核农学报,2022, 36(4): 706-715.
[17] ZHANG J, ZHANG X, TANG H, ZHANG Q, HUA X, MAX, ZHU F, JONES T, ZHU X, BOWERS J, WAI C M,ZHENG C, SHI Y, CHEN S, XU X, YUE J, NELSON D R,HUANG L, LI Z, XU H, ZHOU D, WANG Y, HU W, LIN J,DENG Y, PANDEY N, MANCINI M, ZERPA D,NGUYEN J K, WANG L, YU L, XIN Y, GE L, ARRO J,HAN J O, CHAKRABARTY S, PUSHKO M, ZHANG W,MA Y, MA P, LV M, CHEN F, ZHENG G, XU J, YANG Z,DENG F, CHEN X, LIAO Z, ZHANG X, LIN Z, LIN H,YAN H, KUANG Z, ZHONG W, LIANG P, WANG G,YUAN Y, SHI J, HOU J, LIN J, JIN J, CAO P, SHEN Q,JIANG Q, ZHOU P, MA Y, ZHANG X, XU R, LIU J,ZHOU Y, JIA H, MA Q, QI R, ZHANG Z, FANG J, FANGH, SONG J, WANG M, DONG G, WANG G, CHEN Z, MAT, LIU H, DHUNGANA S R, HUSS S E, YANG X,SHARMA A, TRUJILLO J H, MARTINEZ M C, HUDSON M, RIASCOS J J, SCHULER M, CHEN L, BRAUN D M, LI L, YU Q, WANG J, WANG K, SCHATZ M C,HECKERMAN D, VAN SLUYS M, SOUZA G M, MOORE P H, SANKOFF D, VANBUREN R, PATERSON A H,NAGAI C, MING R. Allele-defined genome of the autopolyploid sugarcane Saccharum spontaneum L.[J]. Nature Genetics, 2018, 50(11): 1565-1573.
[18] GARSMEUR O, DROC G, ANTONISE R, GRIMWOOD J, POTIER B, AITKEN K, JENKINS J, MARTIN G, CHA RRON C, HERVOUET C, COSTET L, YAHIAOUI N,HEALEY A, SIMS D, CHERUKURI Y, SREEDASYAM A,KILIAN A, CHAN A, VAN SLUYS M, SWAMINATHAN K, TOWN C, BERGÈS H, SIMMONS B, GLASZMANN J C, VAN DER VOSSEN E, HENRY R, SCHMUTZ J,D’HONT A. A mosaic monoploid reference sequence for the highly complex genome of sugarcane[J]. Nature Communications,2018, 9(1): 1-10.
[19] CHASE M W, CHRISTENHUSZ M J M, FAY M F, BYNG J W, JUDD W S, SOLTIS D E, MABBERLEY D J,SENNIKOV A N, SOLTIS P S, STEVENS P F, THE A P G.An update of the angiosperm phylogeny group classification for the orders and families of flowering plants: APG IV[J].Botanical Journal of the Linnean Society, 2016, 181(1):1-20.
[20] 曾丽萍, 张宁, 马红. 被子植物系统发育深层关系研究:进展与挑战[J]. 生物多样性, 2014, 22(1): 21-39.
[21] GUO Z H, MA P F, YANG G Q, HU J Y, LIU Y L, XIA E H, ZHONG M C, ZHAO L, SUN G L, XU Y X, ZHAO Y J, ZHANG Y C, ZHANG Y X, ZHANG X M, ZHOU M Y,GUO Y, GUO C, LIU J X, YE X Y, CHEN Y M, YANG Y,HAN B, LIN C S, LU Y, LI D Z. Genome sequences provide insights into the reticulate origin and unique traits of woody bamboos[J]. Molecular Plant, 2019, 12(10): 1353-1365.
[22] 陳芳, 杨双龙, 张莉, 佟祎鑫, 张志华, 虞凡枫, 贾凌云.外源茉莉酸甲酯对盐胁迫下玉米幼苗AsA-GSH 循环的影响[J]. 生物学通报, 2021, 56(11): 44-48.
[23] 格日乐, 乌仁图雅, 左志严. 4 种植物枝条与根系生物力学特性及其影响因素研究[J]. 内蒙古农业大学学报(自然科学版), 2015, 36(1): 46-54.
[24] GLASSOP D, PERROUX J, RAE A. Differences in sugarcane stool branching within Saccharum spontaneum genotypes and compared to Saccharum officinarum and commercial varieties[J]. Euphytica, 2021, 217(3): 1-12.
[25] 林泳许, 于庆, 冯美嫦, 林嘉颖, 赵明明, 欧秋月, 郭晋隆,黄国强. 甘蔗MYB 转录因子基因ScMYB52-1 的克隆及表达特性分析[J]. 热带作物学报, 2022, 43(7): 1328-1337.
[26] TODD J, SANDHU H, HALE A, GLAZ B, WANG J. Phenotypic evaluation of a diversity panel selected from the world collection of sugarcane (Saccharum spp) and related grasses[J]. Maydica, 2018, 62(2): 10.
[27] SILVA J A G D, COSTA P M D A, MARCONI T G, BARRETO E J D S, SOLÍS-GRACIA N, PARK J W,GLYNN N C. Agronomic and molecular characterization of wild germplasm Saccharum spontaneum for sugarcane and energy cane breeding purposes[J]. Scientia Agricola, 2018,75(4): 329-338.

