枇杷外泌体及细胞液基于体外水平的护肤功效研究
李惠华 吴美芳 王伟 徐夙侠

摘 要:探索枇杷(Eriobotrya japonica L.)外泌体及细胞液对体外人皮肤细胞的生物活性,为其在护肤品上的开发提供科学依据。采用超高速离心法和机械破碎法分别获得枇杷外泌体和细胞液,以CCK8 法检测不同浓度枇杷叶来源外泌体、枇杷细胞悬浮培养来源的外泌体及其细胞液对人皮肤成纤维细胞(HSF)存活率的影响;对HSF 细胞采用脂多糖(lipopolysaccharide, LPS)处理进行炎症造模,选取显著促进细胞存活率的浓度,后续开展添加外泌体或细胞液处理,进行细胞凋亡及迁移能力检测。对黑色素瘤细胞(A375)开展外泌体或细胞液处理,进行黑色素含量及酪氨酸酶活性检测。结果表明:每克枇杷叶含8.54×109 个外泌体颗粒,粒径86.78 nm;每毫升(约1 g)枇杷悬浮细胞上清液中含8.67×108 个外泌体颗粒,粒径80.39 nm。浓度为20 μg/mL 时,枇杷叶外泌体、枇杷悬浮细胞外泌体、枇杷悬浮细胞液均顯著提高体外HSF 细胞存活率(P<0.05)。与阳性对照(LPS 处理)相比,枇杷叶外泌体浓度为20 μg/mL,枇杷悬浮细胞外泌体浓度为20 μg/mL 和枇杷悬浮细胞液浓度为10 μg/mL 时,均极显著降低LPS 处理引起的细胞凋亡(P<0.01),均显著促进细胞迁移(P<0.05)。浓度为5 μg/mL 的枇杷悬浮细胞外泌体和枇杷悬浮细胞液均可显著降低体外A375 细胞黑色素含量,枇杷细胞液还显著降低酪氨酸酶活性(P<0.05)。
关键词:枇杷;外泌体;悬浮细胞;细胞液;护肤功效
中图分类号:TS209 文献标识码:A
枇杷(Eriobotrya japonica L.)为蔷薇科枇杷属植物,其叶及花有清肺止咳、和胃降逆、止渴之功效[1],是传统药食同源植物。枇杷叶(果)提取物、叶原生质体已收录于《已使用化妆品原料目录(2021 年版)》。由于枇杷果期(保存期)短,分布地域狭窄,导致果实应用基本停留在鲜食和粗加工产品上,枇杷叶或花则在止咳清热的中药组方中长期无新的突破,大大降低了枇杷的高值利用。
研究表明,枇杷的应用还可以拓展到很多领域,如治疗寻常型痤疮[2-3],卷烟加香[4],挥发性成分可以直接吸入肺部给药[5-6]等。目前,有必要结合新热点和新技术对枇杷的应用进行新的拓展。
外泌体(exosome)首次发现于1983 年,是一种细胞内膜衍生的纳米级囊泡,存在于动物、植物以及微生物中[7]。它具有磷脂双分子层结构而高度稳定,可保护内含物(一般为复杂核酸和特异蛋白)免受降解并运送至受体细胞[8-9]。其自身也具有某些生物活性,如参与基因转录调控[10-11],通过细胞介质传递影响其他细胞功能[12],可作为癌症、免疫性疾病等早期诊断的生物学标志[13]。
此外,外泌体在跨界细胞或物种间有广泛的应用前景[14-15],如间充质干细胞外泌体可促进烫伤后皮肤的恢复及再生[16];人血小板外泌体可改善面部光损伤和皮肤老化的各种临床指标,并具安全性和良好耐受性[17]。生姜外泌体可重塑肠道菌群、缓解结肠炎[18];景天外泌体可抗肺纤维化[19];牛奶、生姜外泌体可作为天然纳米载体以提高药物利用率[20-21];外泌体可作为基因或细胞治疗中理想的药物或传送递质[22]。外泌体已成为生物学、医药学等研究的热点。
采用枇杷细胞悬浮培养技术生产三萜类次生物质,是不同于现有从枇杷叶提取的另一有效途径[22-24]。项目组前期研究表明,通过枇杷细胞悬浮培养,细胞内能够产生几倍至十几倍高于枇杷原植株的五环三萜类化合物,原废弃的细胞培养液中易分离制备丰富的外泌体。目前缺乏枇杷外泌体和细胞液功能的相关研究报道。本研究基于已建立的优良的枇杷悬浮细胞系,分离外泌体及其细胞液,以鲜枇杷叶分离外泌体,探索这3 种材料对体外人皮肤成纤维细胞(HSF)的功效以及对黑色素含量和酪氨酸酶活性的影响,以期为枇杷细胞今后在护肤品领域的开发提供科学依据。
1 材料与方法
1.1 材料
已有悬浮培养的枇杷细胞系(早钟6 号),诱导自幼果,由福建省亚热带植物研究所诱导、优化并长期继代培养,具体技术参见文献[25-26]。
液体培养基为MS 培养液附加NAA 0.5 mg/L,茉莉酸甲酯(MeJ)375 mg/L,蔗糖2%,pH 5.8,培养条件为:接种量8 g/100 mL,温度25 ℃,白炽灯400 Lux,转速130 r/min,于250 mL 三角瓶(装液量130 mL)中。接种后10 d 收获。
选取早钟6 号枇杷顶端第2 对嫩叶,2021 年9 月采收于福建省亚热带植物研究所药用植物资源圃。
人皮肤成纤维细胞(HSF)、人黑色素瘤(A375)细胞购自赛百慷(上海)生物技术股份有限公司。
1.2 方法
1.2.1 外泌体分离及鉴定 采用超高速离心法分离外泌体。对数生长期的枇杷悬浮细胞液250 mL,于4 ℃,5000 r/min,离心5 min,收集上清200 mL(约为200 g);4 ℃,150 000 r/min,离心120 min,弃上清,预冷PBS 300 μL 重悬沉淀,0.45 μm 滤膜除菌,–80 ℃备用。取枇杷叶片65 g,破壁机研磨获取汁液,4 ℃,5000 r/min,离心20 min,收集上清;4 ℃,10 000 r/min,离心40 min,收集上清;4 ℃,150 000 r/min,离心120 min,弃上清,预冷PBS 300 μL 重悬沉淀,0.45 μm 滤膜除菌,–80 ℃备用。
利用透射电子显微镜Hitachi HT-7700 观察外泌体形态;采用粒径分析仪NanoFCM N30E 检测外泌体的粒径和浓度信息;利用多功能酶标仪Thermo Varioskan LUX 采用BCA 法测定蛋白浓度,具体步骤如下:(1)在37 ℃中速融外泌体,并迅速加入5×RIPA 裂解液;(2)混匀后在冰上裂解30 min,期间混匀;(3)配制BCA 法测蛋白浓度的标准样品,并取5 μL 样品加至BCA 混合液中,混匀;(4)37 ℃孵育30 min,酶标仪上,在562 nm 处测吸光值并记录;(5)根据标准曲线算出待测样品的蛋白浓度。
1.2.2 枇杷悬浮细胞液的分离鉴定 取1 g 对数生长期的枇杷悬浮细胞在超净台中研磨破碎,加入1 mL PBS 重悬得到细胞液,4 ℃,5000 r/min,离心5 min,收集上清获得枇杷悬浮细胞液,0.45 μm 过滤除菌,采用BCA 法测蛋白浓度,具体方法同1.2.1,于–80 ℃保存,备用。
1.2.3 细胞培养 人皮肤成纤维细胞(HSF)、人黑色素瘤(A375)在含有1%双抗、10%胎牛血清的完全培养液(HSF 使用1640 培养基,A375 使用DMEM 培养基),37 ℃、5% CO2 保持饱和湿度培养,细胞密度约80%~90%时进行常规传代。
1.2.4 CCK8 法检测细胞活力 HSF 细胞按照5000 个/ 孔铺于96 孔板, 待细胞贴壁后用10 μg/mL 脂多糖(lipopolysaccharide, LPS)处理HSF 细胞20 h 进行炎症造模,添加含或不含外泌体或细胞液的完全培养基处理细胞48 h。模型细胞作阳性对照,正常未处理细胞为阴性对照,设置6 个生物学重复。处理48 h 后,加入CCK8 试剂进行细胞活力检测,2 h 内读取OD450 值。HSF细胞按照3×105 个/孔铺板至6 cm 板,待细胞贴壁后使用。
1.2.5 流式双染检测细胞凋亡 采用生工生物工程(上海)股份有限公司生产的E606336-0020Annexin V 凋亡检测试剂盒,FITC/PI 双染法,胰酶消化细胞,1200 r/min 离心5 min 收集细胞,PBS洗涤2 次;195 μL 1×Binding buffer 悬浮细胞,加入5 μL Annexin V-FITC , 4 ℃ 避光孵育10~15 min;加入200 μL 1×Binding buffer 洗涤细胞、1200 r/min 离心5 min,弃上清;190 μL 1×Bindingbuffer 悬浮细胞,加10 μL PI 混匀后上机检测。
设置3 次生物学重复。
1.2.6 Transwell 法检测细胞迁移能力 (1)取消化HSF 细胞,无血清培养基洗3 次,计数,配成浓度为5×105 个/mL 的细胞悬液;上室每孔加入100 μL 细胞悬液。(2)下室中加入500 μL 含10%血清及工作浓度为10 μg/mL 的LPS 完全培养基。(3)37 ℃培养箱中,培养20 h 后,去除下室培养基,添加含5 μg/mL 外泌体进行处理,48 h后,检测穿过的细胞数。取上室,以棉签拭去小室滤膜上的细胞。用PBS 洗后将小室置于4%多聚甲醇固定20 min,弃固定液,用1%结晶紫乙醇溶液孵育30 min 进行染色,用1×PBS 洗后倒置于普通显微镜下随机拍照。设置3 次生物学重复。
1.2.7 黑色素含量检测 将人黑色素瘤(A375)细胞按照2×107 个/孔铺板至15 cm 板,待细胞贴壁后添加含/不含外泌体或细胞液的完全培养基处理细胞72 h。将所有样本蛋白浓度调整为5.77 μg/μL,取100 μL 用于测定OD470。设3 次生物学重复。
1.2.8 酪氨酸酶活性检测 在总体积3.0 mL 的酶活反应体系中,加入200 μL 含577 μg 蛋白样本和0.5 mmol/L 左旋多巴底物溶液2.8 mL,充分混匀,37 ℃水浴保温10 min 后,于波长475 nm处测得样品吸光度值(A)。设3 次生物学重复。
相对酪氨酸酶活性=加药处理组A475/空白对照组A475。
1.3 数据处理
采用SPSS 软件进行数据统计与分析,利用Duncan’s 法进行多重比较。
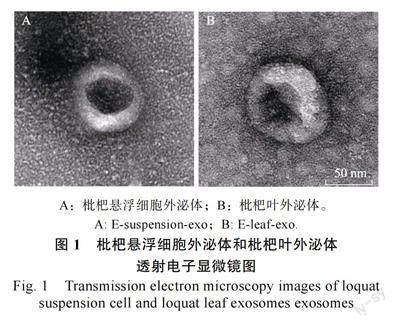
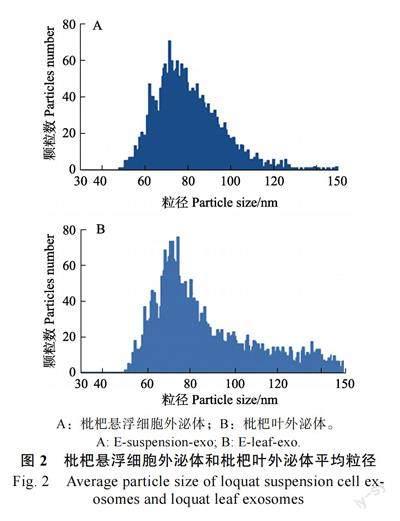
2 结果与分析2.1 外泌体形态及大小由鲜枇杷嫩叶分离的外泌体(E-leaf-exo)和枇杷悬浮细胞培养液上清分离获得的外泌体,即枇杷悬浮细胞外泌体(E-suspension-exo)具体形态见图1,从图1 可看出二者外部形态类似,均呈现典型的茶托状外泌体。利用粒径分析仪检测外泌体的粒径和颗粒数(图2),结合方法1.2.1中起始样本量,枇杷叶外泌体和枇杷悬浮细胞外泌体粒径分别为86.78、80.39 nm;每克枇杷叶含8.54×109 个外泌体颗粒;每毫升(约1 g)枇杷悬浮细胞上清中含8.67×108 个外泌体颗粒。利用该方法获得的枇杷叶外泌体平均粒径大于枇杷悬浮细胞外泌体平均粒径。每克枇杷叶中外泌体的颗粒含量约是每毫升(约1 g)枇杷悬浮细胞上清液外泌体含量的10 倍。基于形态上的完整性判断,以上2 种材料提取的外泌体均可用于后续研究。
2.2 蛋白指标检测结果
采用BCA 法检测蛋白浓度,结果表明,枇杷叶外泌体、枇杷悬浮细胞外泌体、枇杷悬浮细胞液蛋白浓度分别为0.683、2.766、0.212 μg/μL,并根据此数据进行后续定量实验。结合以上蛋白浓度和样本的起始量可知,每克枇杷细胞中含蛋白2.766×103 μg,每克枇杷叶外泌体中含蛋白3.152 μg,每毫升(约1 g)枇杷悬浮细胞上清液提取的外泌体中含蛋白0.318 μg,单位质量的枇杷叶和枇杷悬浮细胞上清液的外泌体蛋白含量相差约10 倍。
2.3 CCK8 法检测
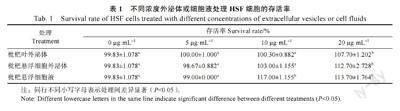
细胞存活率采用CCK8 法检测不同浓度外泌体或细胞液对人皮肤成纤维细胞(HSF)存活率的影响,结果如表1 所示,与空白对照(0 μg/mL)相比,20 μg/mL 的枇杷叶外泌体和枇杷悬浮细胞外泌体能够显著提高HSF 细胞存活率(P<0.05),10 μg/mL 枇杷悬浮细胞液能够显著提高HSF 细胞存活率(P<0.05)。20 μg/mL 的枇杷叶外泌体、枇杷悬浮细胞外泌体、枇杷悬浮细胞液均显著提高体外HSF 细胞存活率(P<0.05)。枇杷悬浮细胞液10、20 μg/mL 浓度水平组间的HSF 细胞存活率無显著差异,未呈现出剂量效应。
根据以上结果,选取对细胞存活率有显著影响的浓度:20 μg/mL 枇杷叶外泌体、20 μg/mL 枇杷悬浮细胞外泌体和10 μg/mL 枇杷悬浮细胞液作为后续研究。后续将采用脂多糖(lipopolysaccharide, LPS)处理HSF 细胞进行炎症造模,添加外泌体或细胞液处理,进行细胞凋亡及迁移能力检测。
2.4 细胞凋亡检测
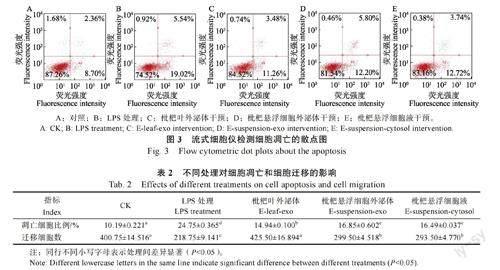
流式细胞术检测结果如图3 所示,LPS 处理后,右下象限的凋亡细胞比例增加。对HSF 细胞进行炎症造模,再加入枇杷叶外泌体、枇杷悬浮细胞外泌体以及枇杷细胞液处理后,与LPS处理组比较,右下象限的凋亡细胞比例减少。表明HSF 细胞经过LPS 处理后,细胞凋亡水平显著上调;继而进行药剂干预,细胞凋亡均显著降低,其中,枇杷叶外泌体对细胞凋亡的抑制程度显著优于枇杷悬浮细胞外泌体和枇杷细胞液,而枇杷悬浮细胞外泌体和枇杷细胞液组间无显著性差异(表2)。
2.5 细胞迁移能力检测
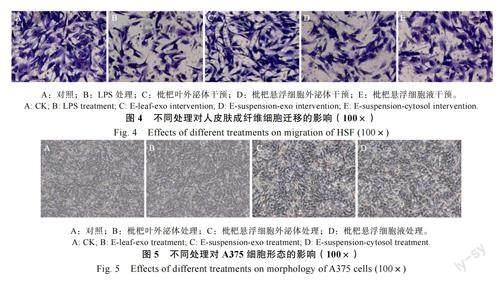
在Transwell 检测人皮肤成纤维细胞LPS 炎症模型中,外泌体或细胞液共孵育48 h 后,细胞迁移能力发生变化,结果如图4 所示,与对照相比,LPS 处理后细胞迁移的数量明显减少,外泌体和细胞液处理有恢复炎症模型中细胞迁移数量的趋势。研究表明,LPS 处理显著降低了迁移细胞数量,枇杷叶外泌体干预与LPS 炎症处理(阳性对照)呈差异显著,恢复迁移细胞数量至与对照(0 μg/mL,阴性对照)无显著差异;枇杷悬浮细胞外泌体和枇杷悬浮细胞液处理均与LPS 炎症处理呈显著性差异,能够恢复迁移细胞数量但显著低于阴性对照,且枇杷悬浮细胞外泌体和枇杷悬浮细胞液组间无显著性差异(表2)。
2.6 黑色素含量检测
分别采用5 μg/mL 枇杷叶外泌体、枇杷悬浮细胞外泌体和枇杷悬浮细胞液处理A375 细胞细胞72 h 后,各处理细胞生长状态均良好(图5)。
通过测定细胞黑色素含量和酪氨酸酶(黑色素合成限速酶)活性,由表3 可知,枇杷叶外泌体对黑色素含量无显著影响。枇杷悬浮细胞外泌体和枇杷悬浮细胞液均可显著降低体外A375 细胞黑色素含量,且组间存在差异显著,枇杷悬浮细胞外泌体的效果优于枇杷悬浮细胞液。而枇杷叶外泌体和枇杷悬浮细胞外泌体对酪氨酸酶活性无显著影响,枇杷悬浮细胞液可显著降低酪氨酸酶活性,枇杷懸浮细胞外泌体有降低酪氨酸酶活性的趋势但未达到显著水平。
3 讨论
3.1 枇杷叶外泌体、枇杷悬浮细胞外泌体、枇杷悬浮细胞液在体外水平的护肤功效
已有研究表明,外泌体在化妆品领域有很好的应用前景,如,间充质干细胞外泌体可以促进伤口愈合还可以显著促进烫伤后皮肤的恢复及再生[27];毛囊乳头细胞球来源的外泌体可促进毛发生长[28]。本研究中枇杷叶外泌体、枇杷悬浮细胞外泌体、枇杷悬浮细胞液也表现出在护肤领域有益的方面:均为水溶性;枇杷叶外泌体在人皮肤成纤维细胞LPS 炎症模型中抑制细胞凋亡以及恢复细胞迁移方面较为突出,适合研发抗炎和促修复功能护肤品;枇杷悬浮细胞液在显著提高细胞存活率、抑制酪氨酸酶活性方面较为突出,适合研发美白功能护肤品;枇杷悬浮细胞外泌体在所有处理中均与对照有显著差异,适合研发复合以上功能的护肤产品。
另外,本研究中枇杷叶外泌体并未减少黑色素含量、抑制酪氨酸酶活性,而枇杷悬浮细胞液和枇杷悬浮细胞外泌体却具有这方面的功能。已有研究表明,枇杷叶酸性成分能够抑制酪氨酸酶活性且呈现剂量依赖性[29];枇杷叶中熊果酸能清除自由基、抑制酪氨酸酶活性具有美白功能[30]。
表明枇杷叶的美白归因于熊果酸等成分。已有研究表明枇杷悬浮细胞中熊果酸等五环三萜类化合物是原植株的几倍到十几倍[23-24],并且转录组测序表明熊果酸等三萜类的代谢增强[31]。而生姜外泌体优异的抗炎作用很大程度归因于外泌体内含物中含有大量6-姜酚等生物活性成分[23]。推测其原因可能是:①枇杷叶外泌体处理达到显著性差异的浓度应大于5 μg/mL;②原植株枇杷叶中熊果酸等物质含量少,所以其外泌体内不含熊果酸等物质;③而经过悬浮培养之后,枇杷细胞代谢途径发生变化,胞内富含熊果酸等三萜类物质,推测枇杷悬浮细胞外泌体和枇杷悬浮细胞液可能含熊果酸等物质而具有美白功能。今后可以开展枇杷叶及悬浮细胞来源外泌体组成研究。
3.2 枇杷悬浮细胞外泌体的特性
外泌体作为活性成分成为研究热点有以下原因:它不仅能激活细胞表面受体,还能将活性物质导入细胞内部,激活细胞内信号;最重要的是它含有miRNA 等核酸成分,microRNA 被磷脂双分子层结构包裹免受降解,能在核酸层面调节细胞功能[21, 32-33]。而且动物或微生物来源、药食同源植物来源的外泌体在跨界调节细胞功能的安全性上具有很强的优势[34-35]。本研究中枇杷叶外泌体和枇杷悬浮细胞外泌体的平均粒径约为80 nm,有利于皮肤吸收用,均显著提高HSF 的细胞存活率,更重要的是其外泌体中包含丰富的microRNA(数据未发表),可能会对皮肤进行基因层面的调控,这一点也是今后的研究方向。另外,本研究首次采用枇杷细胞悬浮培养技术获得外泌体,区别于以往研究中多采用新鲜植物分离外泌体的方法。本研究表明,从外泌体浓度以及外泌体中蛋白含量角度,每克枇杷叶中的颗粒含量是每毫升(约1 g)枇杷悬浮细胞上清含量的约10 倍。但源自枇杷悬浮细胞的外泌体仍具有其特有的优势,即枇杷悬浮细胞外泌体可以周年生产;可以通过生物反应器放大培养[23, 36];且由原废弃的培养液中提取(枇杷悬浮培养后细胞内富含五环三萜类次生物质,原方法只收获细胞),增加了枇杷悬浮细胞的使用场景和使用率。
3.3 枇杷悬浮细胞液的特性
采用枇杷细胞悬浮培养技术生产熊果酸等三萜类次生物质,是不同于现有从枇杷叶提取的另一有效途径。已有研究及项目组前期工作表明,通过枇杷细胞悬浮培养能够产生几倍至十几倍高于枇杷原植株的五环三萜类化合物[23-24],并且通过此途径产生的五环三萜类化合物已证实具有消炎[37]、抑制高血糖高血脂[38]、体外抗肝癌细胞[24]等功能。如,其主要成分委陵菜酸含量约是枇杷叶片中含量的18.40 倍,且为培养细胞干重的6%以上[24]。从相对含量和绝对含量角度,值得今后以枇杷细胞悬浮系为研究体系进行理论研究和应用研究。但熊果酸属非水溶性,生物利用率低,限制了其应用[39]。可能这也是市面上鲜见相关产品的原因。基于本研究,枇杷悬浮细胞液和枇杷悬浮细胞外泌体无菌、水溶性、不含色素、具有良好的益肤功能,适合进一步用于研发护肤品,今后还可以通过枇杷悬浮培养,分离制备外泌体和熊果酸等,以其外泌体为载体装载其熊果酸等成分或microRNA,以进一步增强其功效。
3.4 枇杷作為药食同源植物的高值应用
植物药是中药的主要组成部分,由于中药多成分、多靶点、多途径的作用特点,许多中药的有效成分及作用机制仍未得到有效阐释[40]。枇杷作为药食同源植物,在以往中医药利用中多为组方[1-3],组方成分或协同或拮抗,功效模糊,很大程度制约了枇杷的利用。本研究将枇杷外泌体或细胞液以蛋白含量进行科学量化,功效明确,成份简单,低剂量,不仅可以用作组方还可以单方使用,为枇杷作为中药药方在更广泛领域的利用提供科学依据。
4 结论
本研究分离了枇杷叶外泌体、枇杷悬浮细胞来源的外泌体和细胞液。枇杷外泌体和细胞液能够促进体外HSF 细胞生长,抑制细胞凋亡,促进细胞迁移,适合研发抗炎和促修复功能护肤品;悬浮细胞来源的枇杷外泌体和细胞液可以降低体外A375 细胞黑色素含量,细胞液同时还抑制酪氨酸酶活性,适合研发美白功能护肤品。研究结果对今后这3 种材料在护肤品上的应用具有参考意义。
参考文献
[1] 朱兆云, 赵毅. 滇南本草(第3 卷)[M]. 昆明: 云南科学技术出版社, 2010.
[2] 王建湘, 朱明芳, 边鲜丽. 金土冲剂内服方用于治疗寻常型痤疮120 例临床观[J]. 中医药导报, 2006, 12(9): 44-45.
[3] 熊洁勤. 枇杷清肺饮加减治疗寻常性痤疮的临床研究[D].南京: 南京中医药大学, 2006.
[4] 倪跃新, 梁俪恩, 孙胜南, 黄艳, 周仲良. 枇杷叶中致香成分的提取分离及其在卷烟加香中的应用[J]. 香料香精化妆品, 2012, 2: 17-19.
[5] 宋艳丽, 于慧斌, 姬志强, 康文艺. 枇杷花挥发性成分分析[J]. 河南大学学报(医学版), 2009, 28(2): 104-106.
[6] 林朝展, 柴玲, 祝晨蔯, 赵钟祥, 张翠仙. 枇杷叶紫珠叶挥发油化学成分的研究[J]. 时珍国医国药, 2010, 21(9):2275-2277.
[7] PAN B T, JOHNSTONE R M. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor[J]. Cell, 1983, 33(3):967-978.
[8] THERY C, ZITUOGEL L, AMIGORENA S. Exosomes:composition, biogenesis and function[J]. Nature Reviews Immunology, 2002, 2: 569-579.
[9] RAPOSO G, STOORVOGE W. Extracellular vesicles: exosomes, microvesicles, and friends[J]. Journal of Cell Biology,2013, 200(4): 373-383.
[10] PREKER P, NIELSEN J, KAMMLER S, LYKKEANDERSENS, CHRISTENSEN M S, MAPENDANO C K,SCHIERUP M H, JENSEN T H. RNA exosomedepletion reveals transcription upstream of active human promoters[J]. Science, 2008, 322: 1851-1854.
[11] HUGHES P W. Exosome-deficient mutants reveal rare promoter upstream transcripts (PROMPTs) in Arabidopsis[J]. Plant Cell, 2020, 32(6): 1775-1776.
[12] KAHLERT C, KALLURI R. Exosomes in tumor microenvironment influence cancer progression and metastasis[J]. Journal of Molecular Medicine, 2013, 91(4): 431-437.
[13] GOWDA R, ROBERTSON B M, IYER S, BARRY J,DINAVAHI S S, ROBERTSON G P. The role of exosomes in metastasis and progression of melanoma[J]. Cancer Treatment Reviews, 2020, 85: 101975.
[14] MAN F, WANG J, LU R. Techniques and applications of animal-and plant-derived exosome-based drug delivery system[J]. Journal of Biomedical Nanotechnology, 2020, 16(11):1543-1569.
[15] SUHARTA S, BARLIAN A, HIDAJAH A C, NOTOBROTO H B, ANA I D, INDARIANI S, WUNGU T D K, WIJAYA C H. Plant-derived exosome-like nanoparticles: a concise review on its extraction methods, content, bioactivities, and potential as functional food ingredient[J]. Journal of Food Science, 2021, 86(7): 2838-2850.
[16] ZHANG B, WU X, ZHANG X, SUN Y, YAN Y, SHI H,ZHU Y, WU L, PAN Z, ZHU W, QIAN H, XU W. Human umbilical cord mesenchymal stem cell exosomes enhance angiogenesis through the Wnt4//β-catenin pathway[J]. Stem Cells Translational Medicine, 2015, 4(5): 513-522.
[17] PROFFER S L, PARADISE C R, DEGRAZIA E, HALAAS Y, DURAIRAJ K K, SOMENEK M, SIVLY A, BOON A J,BEHFAR A, WYLES S P. Effieacy and tolerability of topical platelet exosomes for skin rejuvenation: six-week results[J]. Aesthetic Surgery Journal, 2022, 42(10): 1185-1193.
[18] ZHANG M, VIENNOIS E, PRASAD M , ZHANG Y,WANG L, ZHANG Z, HAN M K, XIAO B, XU C,SRINIVASAN S, MERLIN D. Edible ginger-derived nanoparticles: a novel therapeutic approach for the prevention and treatment of inflammatory bowel disease and colitis-associated cancer[J]. Biomaterials, 2016, 101: 321-340.
[19] DU J, LIANG Z, XU J, ZHAO Y, LI X, ZHANG Y, ZHAO D, CHEN R, LIU Y, JOSHI T, CHANG J, WANG Z,ZHANG Y, ZHU J, LIU Q, XU D, JIANG C. Plant-derived phosphocholine facilitates cellular up take of anti-pulmonary fibrotic HJT-sRNA-m7[J]. Science China-Life Sciences,2019, 62(3): 309-320.
[20] AGRAWAL A K, AQIL F, JEYABALAN J, SPENCER W A, BECK J, GACHUKI B W, ALHAKEEM S S, OBEN K, MUNAGALA R, BONDADA S, GUPTA R C. Milk-derived exosomes for oral delivery of paclitaxel[J]. Nanomedicine,2017, 13(5): 1627-1636.
[21] AQIL F, JEYABALAN J, AGRAWAL A K,KYAKULAGA A H, MUNAGALA R, PARKER L,GUPTA R C. Exosomal delivery of berry anthocyanidins for the management of ovarian cancer[J]. Food & Function, 2017, 8(11): 4100-4107.
[22] SHAO J, ZARO J, SHEN Y. Advances in exosome-based drug delivery and tumor targeting: from tissue distribution to intracellular fate[J]. International Journal of Nanomedicine,2020, 15: 9355-9371.
[23] HO H Y, LIANG K Y, LIN W C, KITANAKA S, WU J B.Regulation and improvement of triterpene formation in plant cultured cells of Eriobotrya japonica Lindl[J]. Journal of Bioscience and Bioengineering, 2010, 110(5): 588-592.
[24] LI H H, SU M H, YAO D H, ZENG B Y, CHANG Q, WANG W, XU J. Anti-hepatocellular carcinoma activity of tormentic acid derived from suspension cells of Eriobotrya japonica (Thunb.) Lindl[J]. Plant Cell, Tissue and Organ Culture, 2017, 130(2): 427-433.
[25] GEORGIEV M I, WEBE J, MACIUK A. Bioprocessing of plant cell cultures for mass production of targeted compounds[J]. Applied Microbiology and Biotechnology, 2009,83: 809-823.
[26] 李惠華, 刘小英, 常强, 王伟, 姚德恒, 苏明华. 枇杷细胞悬浮培养生产熊果酸的调控[J]. 热带作物学报, 2015,36(7): 1247-1253.
[27] LI Q, SHAO Y, ZHANG X, ZHENG T, MIAO M, QIN L,WANG B, YE G, XIAO B, GUO J. Plasma long noncoding RNA protected by exosomes as a potential stable biomarker for gastric cancer[J]. Tumor Biology, 2015, 36(3): 2007-2012.
[28] HU S Q, LI Z H, LUTZ H, HUANG K, SU T, CORES J, DINH P C, CHENG K. Dermal exosomes containing miR-218-5p promote hair regeneration by regulating β-catenin signaling[J]. Science Advances, 2020, 6(30): eaba1685.
[29] 张理平, 张海燕, 李孝栋, 王英豪. 28 味中药酸性成分提取物影响黑素合成的实验研究[J]. 中华中医药杂志, 2009,24(11): 1443-1445.
[30] 刘亚男, 许有瑞. 熊果酸美白功能性研究进展[J]. 广州化工, 2021, 49(19): 31-34.
[31] 李惠华, 常强, 王伟, 曾碧玉, 徐剑, 苏明华. 基于转录组测序的枇杷五环三萜合成途径差异基因的分析[J]. 农业生物技术学报, 2018, 26(2): 222-233.
[32] 王磊, 曹蕾, 顾永, 范卫新. 外泌体与皮肤科相关疾病的研究进展[J]. 临床皮肤科杂志, 2017, 46(5): 375-377.
[33] POTESTA M, ROGLIA V, FANILLI M, PIETROBONO E, GISMONDI A, VUMBACA S, NGUEDIA TSANGUEU RG, CANINI A, COLIZZI V, GRELLII S, MINUTOLO A,MONTESANO C. Effect of microvesicles from Moringa oleifera containing miRNA on proliferation and apoptosis in tumor cell lines[J]. Cell Death Discovery, 2020, 6: 43.
[34] DAD H A, GU T W, ZHU A Q, HUANG LQ, PENG L H.Plant exosome-like nanovesicles: emerging therapeutics and drug delivery nanoplatforms[J]. Molecular Therapy, 2021,29(1): 13-31.
[35] XU X H, YUAN T J, DAD H A, SHI M Y, HUANG Y Y,JIANG Z H, PENG L H. Plant exosomes as novel nanoplatforms for microRNA transfer stimulate neural differentiation of stem cells in vitro and in vivo[J]. Nano Letters, 2021,21(19): 8151-8159.
[36] 李惠華, 姚德恒, 徐剑, 王伟, 常强, 苏明华. 波浪式WAVE 生物反应器悬浮培养枇杷细胞生产熊果酸的研究[J]. 中国杂志, 2015, 40(9): 1693-1698.
[37] CHANG C T, HUANG S S, LIN S S, AMAGAYA S, HO HY, HOU W C, SHIE P H, WU J B, HUANG G J.Anti-inflammatory activities of tormentic acid from suspension cells of Eriobotrya japonicaex ex vivo and in vivo[J]. Food Chemistry, 2011,127 (3): 1131-1137.
[38] SHIH C C, CIOU J L, LIN C H, WU J B, HO H Y. Cell suspension culture of Eriobotrya japonica regulates the diabetic and hyperlipidemic signs of high-fat-fed mice[J]. Molecules,2013, 18(3): 2726-2753.
[39] 刘改枝, 李金鑫, 史礼君, 刘萌芽, 蔡邦荣. 熊果酸的结构修饰与生物活性研究进展[J]. 有机化学, 2021, 41(8):2974-2989.
[40] XIE W, WENG A, MELZIG M F. Micrornas as new bioactive components in medicinal plants[J]. Planta Medica, 2016, 82(13): 1153-1162.

