3种青香蕉粉经压热处理后的消化性与结构研究
张思维 赵康云 王金梦 徐飞 陈小爱 申铉日 张彦军





摘 要:香蕉(Musa spp.)是全球消耗量最大的水果之一,因其味美香甜、营养丰富而广受喜爱,其食用方式以熟果鲜食为主。香蕉在成熟之前富含90%以上的抗性淀粉,有效利用青香蕉中的抗性淀粉可以显著提高香蕉种植产业附加值。此外,青香蕉在采收过程中易产生大量残次果,造成淀粉资源的严重浪费。本研究拟探究压热处理对不同品种青香蕉中抗性淀粉(resistant starch,RS)消化性能影响,选取天然青大蕉、粉蕉和贡蕉为原料,对压热处理前后的青香蕉粉采用扫描电子显微镜、动态光散射仪、快速糊化粘度测试仪、差示扫描量热仪、傅里叶变换近红外光谱、X-射线衍射分析等手段,探究其结构变化与消化性的关系。结果表明:经压热处理后, 青香蕉粉中抗性淀粉含量由91.50%~93.33%(RS2 型)下降至39.17%~44.63%(RS3 型),扫描电镜结果显示,青香蕉粉中的颗粒完全糊化崩解,颗粒表面粗糙,粒径分布不一,形状不规则;直链淀粉含量由23.3%~28.3%增加至32.7%~37.0%;青香蕉粉的热稳定性和凝胶焓显著下降(P<0.05),峰值黏度和崩解值升高,糊化温度降低。经压热处理后青香蕉粉仍维持B 型结晶结构,相对结晶度由28.98%~32.56%下降至20.66%~22.26%。经过压热处理的青香蕉粉与天然青香蕉粉相比,未产生新的化学键或官能团,短程有序性R1047/1022 由1.031~1.166 降低至1.016~1.122。研究结果表明,尽管经过压热处理后RS 含量降低,但抗性淀粉由RS2 转变为RS3,表明经过高压处理后抗性淀粉的稳定性显著提升。该研究可为热稳定性香蕉抗性淀粉的制备提供理论依据,有助于天然淀粉基材料的开发,对缓解香蕉产业中的产销矛盾具有重要意义。
关键词:青香蕉粉;压热处理;抗性淀粉;淀粉消化
中图分类号:TS235.4 文献标识码:A
未成熟的香蕉中富含大量淀粉,尤其含有大量RS2 型抗性淀粉(resistant starch,RS),但香蕉是一种典型的呼吸跃变型果实,且青香蕉在成熟过程中易受机械损伤,在运输和储存中会导致不同程度的损耗[1]。采摘的香蕉一般有15%~20%的残次果[2],难以作为商品蕉直接销售,可以作为天然淀粉的来源,从而避免次品蕉的浪费。青香蕉粉中含有淀粉、果胶、纤维素和微量元素等营养物质[3],淀粉是青香蕉的主要组成成分,含量高达80%以上,淀粉中70%以上的抗性淀粉均为RS2 型抗性淀粉[4]。这些抗性淀粉随着香蕉的采摘后熟过程而被降解为小分子糖,导致此类抗性淀粉的严重损失。
抗性淀粉是指在健康个体小肠中难以被消化的淀粉,作为一种特殊的膳食纤维,具有减轻体重、预防便秘、降低血脂、提高胰岛素敏感性等保健作用[5]。根据淀粉的来源及其抗酶解特性,目前抗性淀粉主要分为以下5 类[6-8]:(1)RS1,物理包埋淀粉,主要来自于不完全研磨的谷粒、种子及豆科植物,这类抗性淀粉经咀嚼或加工后,抗酶解性消失,极易转变为易消化淀粉;(2)RS2,抗性淀粉颗粒,来源于生土豆、豌豆和青香蕉,其热稳定性差,正常加工温度会破坏其晶体结构从而失去抗酶解性;(3)RS3,重结晶抗性淀粉,指糊化后再冷却或低温贮藏过程中产生的重结晶淀粉,其热稳定性良好,制备方法简单,安全性好;(4)RS4,化学改性淀粉,包括交联淀粉、酯化淀粉和磷酸化淀粉,这种淀粉热稳定性良好,但制备周期长,产品性质不稳定;(5)RS5,指淀粉链与脂质、氨基酸形成的复合物,存在于稻米、大豆和玉米等作物中,热稳定性较高且难以与消化酶结合。天然青香蕉粉中的抗性淀粉属于RS2 型[9],这类抗性淀粉热稳定性较差,正常烹饪温度下会使其淀粉颗粒的结构破坏,导致淀粉结构的改变而易于消化,使得抗性淀粉含量下降。
目前,针对青香蕉的研究主要集中在青香蕉淀粉的分离及其理化、结构和功能性质方面,ZHANG 等[2]和JIANG 等[10]分离得到青香蕉淀粉并对其理化和结构性质进行表征。TASLIMAD等[11]利用香蕉残次果提取出的淀粉利用脱支和高压的方法制备成RS3 型抗性淀粉。青香蕉粉中虽然含有丰富的抗性淀粉,但分离淀粉需要耗费大量资源,不符合生产实际。直接利用青香蕉粉可以保留其全部营养成分,对人体健康更有益。
因此,本研究擬采用高压处理对不同品种的青香蕉进行改性,采用差式扫描量热仪(differentialscanning calorimeter, DSC)、快速黏度分析仪(rapid viscosity analysis, RVA)、X-射线衍射仪(X-ray diffraction, XRD)和衰减全反射傅里叶变化红外光谱( attenuated total reflection-fouriertransformed infrared, ATR-FTIR)等手段探究压热处理前后青香蕉粉结构和理化特性的变化,为解析高压热处理对青香蕉淀粉消化性的影响提供参考,以期为新型RS 的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 青香蕉:大蕉、粉蕉及贡蕉,购于海南省万宁市兴隆中心市场。抗性淀粉试剂盒和猪胰α-淀粉酶(酶活100 000 U/g),爱尔兰Megazyme 公司生产;其余试剂均为国产分析纯。
1.1.2 主要仪器设备 G154DW 型自动高压蒸汽灭菌锅:厦门市致微仪器有限公司;Phenom ProX台式显微能谱一体机:荷兰Phenom 公司;Q2000型差式扫描量热仪:美国TA 公司;TechMaster型快速黏度分析仪:澳大利亚Perten 公司;Nicolet6700 型衰减全反射傅里叶变换近红外光谱:美国Thermo 公司;LXJ-IIB 型离心机:上海安亭科学仪器厂;Scientz-18ND 型冷冻干燥机:宁波新芝生物科技股份有限公司;SHZ-C 型水浴恒温振荡器:上海博迅实业有限公司医疗设备厂;Bluepard 型电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;HH-SJ2CD 型数显恒温磁力搅拌锅:常州市金坛友谊仪器研究所;HX-PB908 型多功能磨浆机:佛山市海迅电器有限公司。
1.2 方法
1.2.1 压热处理青香蕉粉的制备 青香蕉鲜果清洗干净去皮切片与蒸馏水以1∶3 打浆,取350.0 g置于锥形瓶中,在121 ℃,高压处理15 min。将天然青香蕉浆液和高压处理后冷却的香蕉浆液置于4 ℃冰箱24 h,樣品冷冻干燥后研磨过100 目筛,得到青香蕉粉,密封保存在干燥器中备用。
1.2.2 微观形貌 截取导电胶于载物台上,将样品附着于导电胶上吹扫掉多余样品,并使用离子溅射装置中喷金进行导电处理,然后将载物台放在扫描电镜下观察,加速电压为10 kV,在3000×下进行拍摄。
1.2.3 青香蕉粉粒径分布 使用动态光散射仪(mastersizer 3000, malvern instruments ltd., UK)来确定青香蕉粉的尺寸分布。在环境条件下将淀粉样品与超纯水(0.01% m/V)混合。分散剂和样品的折射率分别为1.33 和1.53,遮光参数设置为1%~2%,并记录D(10)、D(50)和D(90),分别表示淀粉颗粒的累计粒度分布百分数分别达到10%、50%、90%时所对应的粒径大小(μm),表面积平均直径D[3, 2]和体积平均直径D[4, 3]。
1.2.4 直链淀粉含量测定 依据GB/T 15683—2008,取100.0 mg 样品于100 mL 锥形瓶中,加入1.0 mL 乙醇,将粘在瓶壁上的试样冲下,加入9.0 mL 1 mol/L NaOH 溶液,摇匀后水浴10 min,冷却至室温后转移至100 mL 容量瓶并定容。移取5.0 mL 样液于另一100 mL 容量瓶,加入50 mL纯净水,加入1.0 mL 0.1 mol/L 乙酸溶液和2.0 mL碘试剂,定容并显色10 min,利用碘比色法测定直链淀粉的含量。
1.2.5 青香蕉粉抗性淀粉含量测定 淀粉和抗性淀粉的测定采用抗性淀粉试剂盒,按照AOAC2012.02 的方法测定。
1.2.6 差式扫描量热仪分析 取3.00 mg 样品于铝坩埚中,加入6.0 μL 蒸馏水,将铝盘封闭,室温下平衡24 h。用一个空的铝盘作为参考,以15.0 mL/min 氮气作为吹扫气体。在30~120 ℃范围内,以10 ℃/min 的速度进行扫描,记录升温曲线。记录糊化起始温度(To, ℃)、糊化峰值温度(Tp, ℃)、糊化终止温度(Tc, ℃))和糊化焓(ΔH,J/g)。
1.2.7 糊化特性 将3.0 g 样品加入铝筒,加入25.0 mL 蒸馏水。前10 s 浆速960 r/min 分散样品,整个试验的剩余时间浆速保持在160 r/min。浆液50 ℃平衡1 min 后,以6 ℃/min 加热至95 ℃,保持5 min,再以6 ℃/min 冷却至50 ℃,保持2 min。
记录峰值黏度(peak viscosity, PV, cP)、谷值黏度(trough viscosity, TV, cP)、崩解值(breakdown,BD, cP)、最终黏度(final viscosity, FV, cP)、回生值( setback, SB, cP )、糊化温度( pastingtemperature, PT, ℃)和峰值时间(peak time, min)。
1.2.8 短程有序性 将样品及以1∶100 的比例混合样品和KBr 粉末烘干水分,置于玛瑙研钵中研磨混匀。将研磨好的混合物粉末灌注于压模中,抽真空,缓慢除去压力,取出样品薄片,放入样品架上,置于傅里叶变换红外光谱仪内扫描,分辨率4 cm–1,扫描64 次,以KBr 为背景。在1200~800 cm–1 范围内傅里叶自去卷积,半峰宽19 cm–1,增强因子1.9,计算1047 cm–1 和1022 cm–1处的吸光度之比。
1.2.9 X-射线衍射仪分析 室温下采用X-射线衍射仪分别测定样品淀粉的结晶特性。Cu-Kα 铜靶(40 kV,20 mA),扫描速度15 °/min,扫描范围5~30 °,步长0.02 °。
1.3 数据处理
每个实验重复3 次,采用SPSS 19.0 软件对数据进行统计分析,采用Origin 8.5 软件绘图。
2 结果与分析
2.1 压热处理对青香蕉粉微观形貌的影响
天然青香蕉粉与压热处理的青香蕉粉表面微观结构如图1 所示。从图1A~图1C 可以看出,3种天然青香蕉粉均含大量淀粉颗粒,大蕉粉(A)的淀粉颗粒多呈扁球形,粉蕉粉(B)的淀粉颗粒多呈钟型,贡蕉粉(C)的淀粉颗粒结构多呈棒状。3 种青香蕉粉的淀粉颗粒均呈现表面光滑,个别颗粒呈现出有裸露生长环,表面附着有破碎的细胞壁、果胶、纤维素和少量蛋白(如箭头所示)。经压热处理后,3 种青香蕉粉样品的淀粉颗粒均已破坏,形成片层结构,大蕉粉表面较为光滑,粉蕉粉表面呈现鱼鳞状和沟壑状,贡蕉粉表面较为粗糙,有少许沟壑状。
与天然青香蕉粉相比,经改性后的青香蕉粉的淀粉颗粒已完全糊化崩解,无完整淀粉颗粒(图1D~图1F)。张翔等[12]混合不同种类淀粉,利用压热-酶法制备高抗性复合淀粉,扫描电镜显示经处理后抗性淀粉的颗粒形貌亦呈现不规则片状结构。
这可能是在热和高压作用下淀粉吸水溶胀,高压促进淀粉颗粒膨胀,导致淀粉颗粒破裂,最终完全糊化。表明压热处理是一种良好的淀粉改性方法。
2.2 压热处理对青香蕉粉粒径分布的影响
3 种不同品种青香蕉粉经高压处理后粒径分布的粒度分布如表1 所示。D(10)、D(50)和D (90)是按体积直径小于10%、50%和90%的颗粒尺寸来计。D[3, 2]和D[4, 3]分别是表面积平均直径和体积平均直径。天然青香蕉粉的D[3, 2]和D[4, 3]值分别为12.32~16.14 μm、53.16~58.79 μm,大蕉粉、粉蕉粉和贡蕉粉之间的值无显著差异。根据REN 等[13]的报道,植物的科是影响淀粉粒径的关键因素,3 种青香蕉同属于芭蕉科,因此平均粒径无差异。据周童童等[14]的报道,常见的马铃薯淀粉的粒径分布范围为28.57~ 44.88 μm,低于3 种青香蕉的粒径分布,这可能是因为它们的淀粉来源、种植环境和淀粉成分不同[15]。
压热处理后的青香蕉粉的D[3, 2]和D[4, 3]值分别为47.09~51.24 μm 和119.72~144.55 μm,3种改性后的青香蕉粉的粒径具有显著差异(P<0.05),已有研究表明,淀粉粒径的大小在一定程度上影响着淀粉的糊化特性[16]。粉蕉粉的D[3, 2]值顯著高于大蕉粉与贡蕉粉,可能是改性后的粉蕉粉中的分子排列较为疏松,导致粒径较大。
经过压热处理后的青香蕉粉的D[4, 3]-D[3, 2]值由原来的38.45~49.47 μm增加到84.49~93.31 μm,与天然青香蕉粉相比显著增加(P<0.05),表明改性后的青香蕉粉的粒径分布不一致,形状不规则,与扫描电镜观察到的结果一致。
2.3 压热处理对青香蕉粉直链淀粉含量的影响
3 种天然和压热处理后青香蕉粉的直链淀粉含量如表2 所示。结果表明,天然青香蕉粉的直链淀粉含量为23.3%~28.3%,低于毕玉[17]报道的青香蕉直链淀粉含量,可能是由于青香蕉的品种、产地和分布范围不同,导致青香蕉粉中的直链淀粉含量的不同。
改性后青香蕉粉直链淀粉含量增加至32.7%~37.0%,大蕉粉与贡蕉粉中的直链淀粉含量显著高于粉蕉粉(P<0.05)。与天然青香蕉粉相比,改性后的青香蕉粉显著高于天然青香蕉粉中直链淀粉含量(P<0.05)。
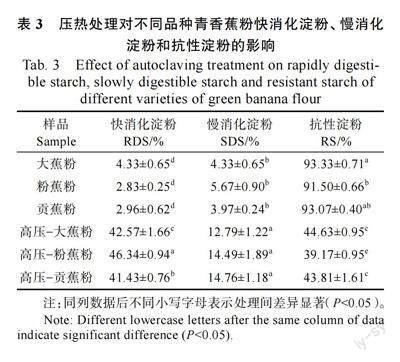
2.4 压热处理对青香蕉粉抗性淀粉含量的影响
表3 显示了压热处理前后青香蕉粉的快消化淀粉(rapidly digestion starch, RDS),慢消化淀粉( slowly digestion starch, SDS ) 和抗性淀粉(resistant starch, RS)含量变化。3 种天然青香蕉粉的RDS 含量为2.83%~4.33%,SDS 含量为3.97%~5.67%,RS 含量为91.50%~93.33%,表明天然青香蕉粉中抗性淀粉含量较高,类型均为RS2 型。大蕉粉RS 含量显著高于粉蕉粉与贡蕉粉(P<0.05),可能是不同品种间直链淀粉或晶型结构的差异。据毕玉[17]的报道,青香蕉淀粉RS含量低于本实验结果,可能是青香蕉粉中果胶、纤维素等其他成分形成了物理屏蔽作用,阻碍了酶的结合位点,导致RS 含量的提高。
经压热处理后,青香蕉粉的RDS、SDS 和RS的含量分别为42.57%~46.34%、12.79%~14.76%和39.17%~44.63%,大蕉粉及贡蕉粉的RS 含量显著高于粉蕉粉(P<0.05)。经压热处理后的青香蕉粉与天然青香蕉粉相比,均具有更高含量的SDS 及更低含量的RS,RS 转化为SDS 和RDS,这些结果表明经处理后的淀粉分子链部分被破坏,影响了晶体结构。
2.5 压热处理对青香蕉粉热特性的影响
如表4 所示,天然青香蕉粉的糊化起始温度(To, ℃)、糊化峰值温度(Tp, ℃)、糊化终止温度(Tc, ℃)和糊化焓(ΔH, J/g)的范围分别为75.21~76.94 ℃,80.67~81.91 ℃,86.09~87.97 ℃和12.13~15.11 J/g,贡蕉粉的To、Tc 最高,可能是由于贡蕉粉中直链淀粉比例较高,同时贡蕉粉的凝胶焓(ΔH)也反映了淀粉颗粒的晶体结构较为完整,需要更多的能量以破坏晶体结构。经压热处理后青香蕉粉的To、Tp、Tc、ΔH 的范围分别为50.60~51.24 ℃ , 57.39~60.13 ℃ , 65.55~70.06 ℃和6.01~7.51 J/g,大蕉粉的ΔH 显著高于其他2 种青香蕉粉。
与天然青香蕉粉对比,经高压处理后的青香蕉粉To、Tp、Tc 较低,可能是由于高压处理的过程中淀粉结构改变,经低温回生形成的晶体结构不完整,双螺旋结构被破坏。同时,ΔH 降低,说明压热处理破坏了淀粉颗粒内部的双螺旋结构及结晶区的有序性,淀粉颗粒从有序状态变为无序状态,导致结晶度降低。
2.6 压热处理对青香蕉粉糊化特性的影响
经过压热处理的青香蕉粉经快速糊化黏度仪(RVA)测定的结果如表5 所示。天然青香蕉粉的峰值黏度、崩解值、回生值分别为2418.37~3020.33 cP、314.04~547.77 cP、955.48~1120.11 cP,大蕉粉的峰值黏度最高,粉蕉粉最低,先前的一项研究表明,峰值黏度的差异可能是淀粉颗粒中直链淀粉含量和颗粒大小的差异,导致在加热过程中吸水率和溶胀力的变化[18]。闫斯亮[19]之前报道的香蕉淀粉的峰值黏度值为7914 cP,高于本研究结果,可能是因为样品中含有果胶、纤维素等物质,限制了淀粉链的溶出,导致与本研究中青香蕉粉的糊化特性相比有较大差异。经压热处理后的青香蕉粉的峰值黏度、崩解值和回生值分别为3821.56~4144.78 cP 、1508.33~1722.78 cP 、735.67~1109.33 cP。改性后的大蕉粉的峰值黏度、崩解值和回生值显著高于粉蕉粉、贡蕉粉(P<0.05)。表明改性后的大蕉粉黏度下降较快,成糊后稳定性较好,凝胶性高。与天然青香蕉粉相比,经高压处理的青香蕉粉的峰值黏度和崩解值显著升高, 回生值和糊化温度显著降低(P<0.05)。
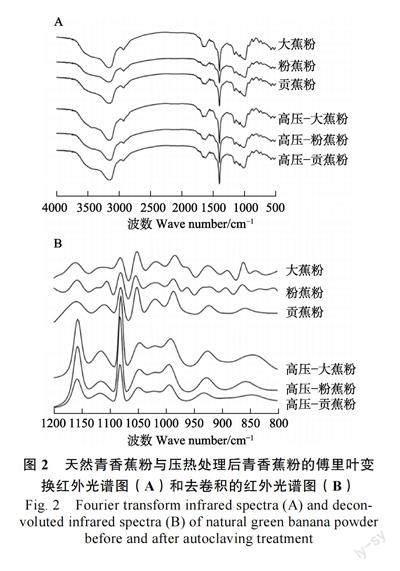
2.7 压热处理对青香蕉粉近红外光谱图的影响
如图2A 所示,天然与压热处理后的青香蕉粉主要特征峰基本相同,说明压热处理未发生化学反应,没有在淀粉分子内部或分子之间产生新的官能团或化学键。
谱图在1200~800 cm–1 处去卷积得到图2B,R1047/1022 已广泛应用于研究淀粉的短程有序性,其比值越大,淀粉分子短程有序性越高。天然青香蕉粉在1047 cm–1 和1022 cm–1 的吸光度比值(R1047/1022),如表6 所示,从高到底依次为贡蕉粉(1.166)、大蕉粉(1.043)、粉蕉粉(1.031),三者均有显著性差异(P<0.05),根据LI 等[20]的报道,R1047/1022 与峰值黏度呈显著正相关,与本研究中糊化特性的趋势一致。压热处理后青香蕉粉样品的去卷积谱图在R1047/1022 值均有所下降,表明经高压处理后青香蕉粉的短程有序性降低。
2.8 压热处理对青香蕉粉晶体结构的影响
天然青香蕉粉和压热处理后的青香蕉粉的X-射线衍射图、相对结晶度如图3 和表6 所示。天然青香蕉粉在5.8°、15.1°、17°和23°(2θ)处具有强衍射峰,为典型的B 型结构,与FAISANT 等[21]和UTRILLA 等[22]的研究结果一致。经压热处理后,5.8°和17°处仍保持强衍射峰,15.1°、23°处的衍射峰强度减弱,晶型结构未改变。本研究结果表明,压热处理会削弱天然青香蕉粉的晶型结构,不仅影响淀粉颗粒的无定形区,且破坏其结晶区。
天然青香蕉粉的相对结晶度从高到底依次为贡蕉粉(32.56%)、大蕉粉(30.75%)、粉蕉粉(28.98%),三者均有显著性差异(P<0.05)。与前面直链淀粉含量研究结果相一致,即贡蕉粉>大蕉粉>粉蕉粉。APOSTOLIDIS 等[23]的研究亦表明,直链淀粉含量与相对结晶度显著正相关,直链淀粉会促进支链淀粉的重排形成结晶结构。
3 讨论
青香蕉粉中富含大量RS2 型抗性淀粉,这类抗性淀粉热稳定性差,正常烹饪温度下会使这类抗性淀粉颗粒结构遭到破坏。而压热处理的方法不仅便于青香蕉粉的直接利用,压力作用下还使青香蕉粉中的抗性淀粉颗粒结构改变,获得较好的抗酶解性。本试验利用压热方法处理不同品种的青香蕉,并与青香蕉原粉对比其结构与消化性的变化。
3 种天然青香蕉粉RS 含量为91.50%~93.33%,经压热处理后,RS 含量降低至39.17%~44.63%,其中,大蕉粉和贡蕉粉的RS 含量显著高于粉蕉粉(P<0.05)。尽管压热处理后RS 含量降低,但其类型由RS2 转变为RS3 型。
微观形貌的结果表明,经压热处理后的3 种青香蕉粉的淀粉颗粒均被破坏,大蕉粉和贡蕉粉的表面较为光滑,粉蕉粉表面呈现粗糙,比表面积增加,利于酶的结合,导致大蕉粉和贡蕉粉的RS 含量高于粉蕉粉。压热处理后的青香蕉粉粒径显著增加,粒径分布不一,形状不规则,与扫描电镜的结果一致,可能是高压处理过程中青香蕉粉中的淀粉颗粒吸水并膨胀,导致改性颗粒彼此聚集,使得青香蕉粉颗粒尺寸的增加。然而,AHMES 等[24]利用高压法在600 MPa 的条件下处理板栗淀粉,结果显示淀粉粒径显著降低,可能是过度加压会削弱淀粉的凝胶结构所致。改性后贡蕉粉的直链淀粉含量显著高于大蕉粉和粉蕉粉(P<0.05),可能是导致其RS 含量較高的原因。
刘誉繁[25]的研究表明,在高压下对淀粉分子的α-1,6 糖苷键的剪切破坏作用有较大影响,导致α-1,6 糖苷键比例降低,剪切作用力使得更多的α-1,6 糖苷键被切断,直链淀粉含量的比例上升。
然而,MOORTHY[26]对圆薯淀粉进行蒸气压力处理,结果显示直链淀粉含量下降,与本研究结果相反。可能是本研究中压热处理改变了淀粉颗粒组织结构,使可溶性直链淀粉分子的流动性提高,导致表观的直链淀粉含量提高。改性后的的大蕉粉的ΔH 显著高于粉蕉粉和贡蕉粉,表明改性后的大蕉粉在低温回生的过程中由双螺旋形成的结晶结构比例较大,晶体结构更完美[27]。许丽娜[28]在研究湿热法玉米淀粉处理时发现湿热处理后的淀粉,其Tp 提高,同时糊化温度范围变化加大,ΔH 下降,与本试验结果一致。RVA 的测定结果显示,改性后的青香蕉粉的峰值黏度和崩解值显著升高,回生值和糊化温度显著降低,可能是压力作用下使得淀粉链暴露了大量羟基,增加了淀粉与水分子的相互作用,使回生值降低,稳定性增强。糊化温度的降低,可能是由于淀粉颗粒中相互作用力较弱,淀粉颗粒或淀粉链在高压处理后重新取向,重新取向会导致淀粉结晶区的结构疏松,使得淀粉糊化时所需能量减少,这与本研究中热特性的结果一致。王雨生等[29]探讨压热协同海藻酸钠处理对普通玉米淀粉糊化性质和晶体结构的影响,发现玉米淀粉的糊化特性随着压热时间的增加而显著增加,与本文的研究结果一致。
改性前后的傅里叶近红外光谱图主要特征峰相似,表明压热处理过程中只发生物理变化,改性前后仅有淀粉分子链间重组或链间氢键的变化。
SUN 等[30]利用傅里叶近红外光谱研究了不同处理方式对紫甘薯抗性淀粉的结构特性,经高压热处理后的紫甘薯抗性淀粉没有形成新的基团,与本研究的结果一致。压热处理后青香蕉粉样品的去卷积谱图在R1047/1022 值均有所下降,可能是淀粉在压热处理过程中,原有分子链排列方式受到破坏,颗粒内部直链淀粉溢出,另一方面分子链受热和高压影响又会取向重新排列成有序化结构域,这与RVA 表明的结果一致。GUO 等[31]利用高压均质处理技术(HPH)对莲子淀粉进行改性,发现单独HPH 处理会破坏莲子淀粉的结构,使得淀粉颗粒的抗酶解性降低,RS 含量大幅减少,与本研究结果趋势一致。压热处理前后X-射线衍射图的强衍射峰一致,张守文等[32]指出,压热处理使淀粉颗粒破裂重组,不同淀粉颗粒中的链淀粉形成氢键,削弱了原淀粉的结晶结构。经压热处理后,青香蕉粉的相对结晶度降低至20.66%~22.26%,贡蕉粉的相对结晶度显著高于大蕉粉与贡蕉粉(P<0.05)。表明贡蕉粉在冷却回生过程中形成更多的结晶,不利于消化酶的结合,与本研究中抗性淀粉的结果趋势一致。经高于改性后的青香蕉粉相对结晶度低于天然青香蕉粉,表明形成的结晶数量减少。由于在压热处理过程中,水分子在压力的作用下进入淀粉颗粒,使得青香蕉粉结晶类型不变的前提下,部分有序晶体结构被破坏,在低温回生过程中分子链的重排不如天然淀粉晶体结构完美,导致了相对结晶度的降低。
高压处理后的青香蕉粉糊化温度低,使得食品生产更为方便快捷,并提供可观的RS 含量及其功能特性,有效降低食品的血糖指数。本研究结果可为压热处理对淀粉结构的影响提供新的研究方向和理论参考。
参考文献
[1] 袁德保, 李芬芳, 郑晓燕, 许桂莺, 郑丽丽, 宋顺, 郭刚,金志强. 香蕉深加工在香蕉产业中的作用、发展现状与趋势及存在问题[J]. 热带农业科学, 2012, 32(8): 54-57.
[2] ZHANG P Y, ROY L W, JAMES N B, BRUCE H. Banana starch: production, physicochemical properties, and digestibility-a review[J]. Carbohydrate Polymers, 2005, 59(4):443-458.
[3] KUMAR P S, SARACANAN A, SHEEBA N, UMA S.Structural, functional characterization and physicochemical properties of green banana flour from dessert and plantain bananas (Musa spp.)[J]. LWT-Food Science and Technology,2019(116): 108524.
[4] 谭思敏, 王娟, 陈平生, 朱小花. 香蕉成熟度对抗性淀粉理化性能的影响[J]. 食品工业科技, 2017, 38(23): 23-28.
[5] 魏常锦. 农产品抗性淀粉制备的研究进展[J]. 农业与技术,2021, 41(17): 28-30.
[6] 王寧, 阮长青, 张东杰, 李志江. RS3 型抗性淀粉制备方法研究进展[J]. 中国粮油学报, 2021, 36(12): 185-193.
[7] 宿玲恰, 吴敬. 淀粉基未来食品及其制备方法研究进展[J].食品与生物技术学报, 2021, 40(12): 5-16.
[8] 张婧婷. 抗性淀粉的类型及其制备技术研究进展[J]. 现代面粉工业, 2021, 35(6): 26-33.
[9] 米红波, 邓婷月, 李毅, 陈敬鑫, 李学鹏, 仪淑敏, 励建荣.抗性淀粉的消化特性及其在食品中的应用[J]. 食品与生物技术学报, 2021, 40(9): 9-15.
[10] JIANG H H, ZHANG Y Y, HONG Y BI Y, GU Z B, CHEN L, LI Z F, LI C M. Digestibility and changes to structural characteristics of green banana starch during in vitro digestion[J]. Food Hydrocolloids, 2015, 49: 192-199.
[11] TASLIMA A A M, ANIL K. Resistant starch III from culled banana and its functional properties in fish oil emulsion[J]. Food Hydrocolloids, 2014, 35(3): 403-409.
[12] 张翔, 陈彦君, 刘家宏, 陈晓平, 崔敬爱. 压热-酶法制备高抗性复合淀粉的结构分析及加工特性研究[J]. 食品科技, 2021, 46(4): 216-221.
[13] REN Y H, GUO K, ZHANG B, WEI C X. Comparison of physicochemical properties of very small granule starches from endosperms of dicotyledon plants[J]. International Journal of Biological Macromolecules, 2020(154): 818-825.
[14] 周童童, 梁单, 刘伟, 张婷婷, 张良, 刘倩楠, 胡小佳, 胡宏海. 不同中薯系列马铃薯淀粉组成与理化性质的差异分析[J]. 核农学报, 2022, 36(4): 766-776.
[15] LU Z H, DONNER E, YADA R Y, LIU Q. Physicochemical properties and in vitro starch digestibility of potato starch/protein blends[J]. Carbohydrate Polymers, 2016,10(154): 214-222.
[16] 梁丽松, 徐娟, 王贵禧, 马惠铃. 板栗淀粉糊化特性与淀粉粒粒径及直链淀粉含量的关系[J]. 中国农业科学, 2009,42(1): 251-260.
[17] 毕玉. 成熟度对香蕉粉理化性质及其淀粉消化性和精细结构的影响[D]. 无锡: 江南大学, 2018.
[18] ZHANG Y J, HU M J, ZHU K X, WU G, TAN L H. Functional properties and utilization of Artocarpus heterophyllus treatments[J]. Food Science, 2006(10): 118-121. (in Chinese)

