基于内质网应激探讨番茄红素对帕金森病细胞模型的预防效果
鲍 波,柴星星,邓子亮,刘露露,朱少平,李莉莉,4
(1.广东医科大学病理学与病理生理学教研室,广东 湛江 524023;2.广东医科大学实验动物中心,广东 东莞 523808;3.广东医科大学组织学与胚胎学教研室,广东 东莞 523808;4.东莞市生物医药产业实验动物资源开发与应用研究重点实验室,广东东莞 523808)
帕金森病(Parkinson's disease,PD)是继阿尔兹海默病之后的第二大中老年神经系统退行性疾病[1],全球患者超过600 万人[2]。相关研究表明PD已经成为神经系统疾病中增长速度最快的一种[3],已有研究表明,多种因素的共同作用可能导致PD的发生[4],年龄、遗传因素、环境因素等是导致PD 发病的关键性因素。近年多方面研究表明,内质网应激(endoplasmic reticulum stress,ERS)在PD 的发病过程中起到重要作用[5-9]。Stefani 等[10]的研究发现ERS 初期旨在恢复细胞内稳态,若应激过度可以触发促凋亡信号,促进神经元细胞死亡。目前PD的治疗以控制症状为主[11],无法从根本上阻止疾病的病理进展[12],并且随着治疗期的延长会出现疗效减退、不良反应的情况[13]。随着对PD 发病机制的日益了解,提出了潜在的神经保护策略假说,若在早期采用神经保护或疾病改善疗法,可能有利于改变疾病的进展[14]。综上,本研究预测早期干预内质网应激对PD 的预防和治疗具有重要意义。
番茄红素(lycopene)是一种具有药理活性的类胡萝卜素,具有抗癌、抗氧化、保护心脏和降压等药理作用[15,16]。近年越来越多的研究报道番茄红素具有神经保护作用[17-19]。已有研究表明番茄红素的神经保护作用机制主要涉及抗氧化、抑制炎症反应、抑制凋亡和恢复细胞内Ca2+稳态等方面[20],这提示番茄红素的神经保护作用可能与ERS 有相关性,而目前少有相关研究报道。因此,本研究基于内质网应激探讨番茄红素对帕金森病细胞模型的预防效果,旨在为PD 的防治提供有价值的思路。
1 材料与方法
1.1 材料
DMEM 高糖培养基、胎牛血清、胰蛋白酶、青/链霉素(100×)(美国GIBCO 公司);Dimethyl sulfoxide (细胞冻存级)、鱼藤酮(批号:R8875,纯度≥95%,西格玛奥德里奇(上海)贸易有限公司);番茄红素(纯度≥98%,西安飞达生物技术有限公司);CCK-8 检测试剂(日本同仁);RIPA 裂解液、BCA蛋白浓度测定试剂盒、DAPI、超敏ECL 化学发光试剂盒(江苏碧云天生物技术有限公司);β-Actin 单克隆抗体、CHOP 单克隆抗体(批号:3700、2895,美国CST 公司);GRP78 单克隆抗体(批号:ARG54026,arigo 公司);辣根酶标记山羊抗兔IgG(H+L)、辣根酶标记山羊抗鼠IgG(H+L)(批号:ZB-5301、ZB-5305,中杉金桥生物技术有限公司);山羊抗兔IgG (H+L),DyLightTM488、山羊抗鼠IgG(H+L),DyLightTM633(批号:35552、35512,美国Pierce 公司)。人神经母瘤细胞(SH-SY5Y)来自本课题组。鱼藤酮和番茄红素溶于DMSO 中配成母液,使用时用无血清的DMEM 培养基稀释至工作浓度。
1.2 方法
1.2.1 SH-SY5Y 细胞的培养 复苏冻存的SH-SY5Y 细胞,用含10%的胎牛血清、1%双抗的DMEM 培养基,置于5% CO2,37 ℃的培养箱中培养。及时更换培养液,待细胞汇合度至80%~90%,用0.25%胰蛋白酶消化传代。采用处在对数生长期的细胞进行实验。
1.2.2 细胞分组及处理方法 对照组细胞加入不含药物的培养液,番茄红素组细胞加入20 μmol/L番茄红素作用2 h 后更换正常的培养液,鱼藤酮组细胞加入含0.5 μmol/L 鱼藤酮的培养液培养24 h,不同浓度的番茄红素(低、中、高)预处理组的处理方法是分别用含5、10、20 μmol/L 番茄红素处理作用2 h 后更换0.5 μmol/L 鱼藤酮继续作用24 h。
1.2.3 番茄红素对SH-SY5Y 细胞活力的影响 将细胞按5×104个/ mL 密度接种于96 孔板,每孔的接种量为100 μL,同时设3 个复孔。待细胞完全贴壁后,将20 mmol/L 番茄红素稀释至20 μmol/L,随后以2 为稀释倍数进行7 个梯度稀释,将各浓度的番茄红素作用于SH-SY5Y 细胞,同时设立细胞中只加含培养液的对照组和无细胞空白对照组。番茄红素处理结束后,吸走原来的培养液,向各孔中加入含10 μL CCK-8 试剂的新培养液,放入培养箱中继续孵育,注意观察各孔颜色变化。在酶标仪波长为450 nm 下测定各孔OD 值。计算细胞相对活力:细胞相对活力=(实验组OD 均值-空白组OD均值/(对照组OD 均值-空白组OD 均值×100%
1.2.4 番茄红素预处理对鱼藤酮损伤的SH-SY5Y细胞活力的影响 将细胞按5×104个/ mL 密度接种于96 孔板,每孔100 μL 细胞悬液,同时设3 个复孔。待细胞完全贴壁后,按照实验分组进行。细胞处理结束后吸走原来的培养液,向各孔中加入10 μL 的CCK-8 试剂,放入培养箱中继续孵育,注意观察各孔颜色变化。在酶标仪波长为450 nm 下测定各孔OD 值。计算细胞相对活力方法同上。
1.2.5 Hoechst 染色观察细胞凋亡 将SH-SY5Y细胞按1×105个/mL 的密度接种在24 孔板中,每孔总体积500 μL。观察细胞完全贴壁后,根据实验设计对各孔细胞分别加药处理。药物处理结束后,弃去旧的培养液,PBS 洗细胞2 次。加入适量的4%多聚甲醛,室温固定细胞15 min。弃去固定液,加入PBS,放在低速摇床上洗2 次,每次5 min,尽可能吸尽残余液。将Hoechst 33 258 染色液稀释成5 μg/mL,每孔加入适量,室温避光染色10 min。弃去染色液,加入PBS,放在低速摇床上洗3 次,每次5 min。荧光显微镜下在激发波长350 nm,发射波长460 nm 观察和拍照。
1.2.6 免疫印迹法检测目的蛋白的表达 细胞经药物处理结束后,弃去旧的培养液,预冷的PBS 洗细胞2 遍,吸尽PBS,加入含终浓度为1 mmol/L PMSF 的RIPA 裂解液冰浴裂解细胞半个小时,于4 ℃离心机,14 000 r/min 离心15 min,收集上清液,采用BCA 试剂盒测定细胞蛋白的浓度,SDS-聚丙烯酰胺凝胶电泳、转膜、封闭后进行免疫反应β-actin(1∶1 000)、GRP78(1∶1 000)和CHOP(1∶1 000)4 ℃孵育过夜。辣根过氧化物酶标记的山羊抗兔抗体或者山羊抗鼠抗体(稀释比例为1∶1 000),室温孵育2 h。ECL 化学发光试剂盒进行曝光检测,采用图像分析软件ImageJ 分析条带的灰度值。
1.2.7 细胞免疫荧光 将SH-SY5Y 细胞以5×104个/mL 的密度接种在激光共聚焦专用培养皿中,每皿1 mL 细胞悬液,待细胞贴壁后,根据实验设计进行加药处理。药物处理结束后,弃去旧的培养液,加入PBS 洗细胞2 次,尽可能吸尽PBS。每皿加入适量冷丙酮和甲醇等体积混合液,室温固定通透处理细胞20 min。弃去丙酮和甲醇混合液,PBS 洗细胞3 次,每次5 min。每皿加入适量5% 的BSA(PBS 配制),室温封闭30 min。加一抗GRP78(1∶100),CHOP(1∶70),4 ℃过夜。回收一抗,PBS 洗3次,每次5 min。加入荧光标记的二抗(1% BSA 配制):兔抗(1∶300)或鼠抗(1∶300),室温孵育1 h。PBS 洗3 次,每次5 min,每皿加入适量1 μg/mL 的DAPI(1%BSA 配制)染核10 min。PBS 洗3 次,每次5 min。每皿加入少量PBS,尽早在激光共聚焦工作站观察并拍照。
1.2.8 统计学处理 用GraphPad Prism5.0 软件进行数据的统计分析,数据采用(±s)表示,两组之间比较t检验,多组样本比较采用方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 番茄红素对SH-SY5Y 细胞生长活力的影响
为了更好地研究番茄红素在鱼藤酮损伤的SH-SY5Y 细胞中的作用,首先检测番茄红素对SH-SY5Y 细胞活力的影响。结果如图1 所示,对照组相比,各浓度的番茄红素作用SH-SY5Y 细胞24 h,细胞活力未发生明显改变(P>0.05),表明 0~20 μmol/L 浓度范围内,番茄红素处理SH-SY5Y 细胞24 h,细胞的生长活力不受影响,因此可将番茄红素用于下一步的研究。

图1 不同浓度的番茄红素对细胞活力的影响(n=3,±s)Fig 1 Effects of different concentrations of lycopene on cell viability(n=3,±s)
2.2 番茄红素预处理对鱼藤酮损伤的SH-SY5Y细胞的影响
确认番茄红素的安全作用浓度范围后,进一步研究番茄红素预处理对鱼藤酮损伤SH-SY5Y 细胞的干预作用,结果如图2 所示,和对照组相比,鱼藤酮组的细胞活力明显下降(P<0.01);不同浓度的番茄红素预处理均可提高细胞活力(分别为(74.74±0.47)%、(81.70±1.90 )%和(83.17±1.37)%),与鱼藤酮组相比,差异具有统计学意义(P<0.05,P<0.01)。显微观察细胞形态变化(图3),番茄红素单独处理组的细胞和对照组的细胞一样生长旺盛,形态好,可见细胞突起;鱼藤酮单独处理组细胞生长受到抑制:细胞数量明显减少,细胞边界模糊、突起减少,部分细胞缩小变圆;而番茄红素预处理组与鱼藤酮单独处理组在细胞形态变化上无明显差异,表明番茄红素预处理在改善细胞形态上的作用并不明显。
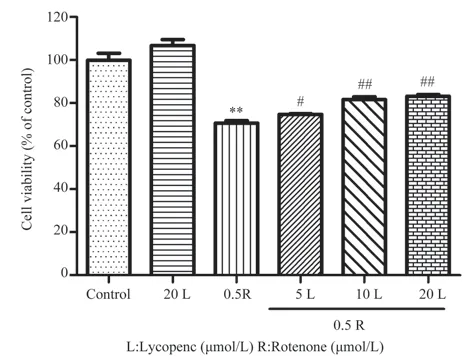
图2 番茄红素预处理对鱼藤酮诱导的SH-SY5Y 细胞活力的影响(n=3,±s)Fig 2 Effects of lycopene pretreatment on rotenone-induced SH-SY5Y cell viability(n=3,±s)

图3 番茄红素预处理对鱼藤酮诱导的SH-SY5Y 细胞形态的影响(100×)Fig 3 Effects of lycopene pretreatment on rotenone-induced SH-SY5Y cell morphology (100×)
2.3 番茄红素预处理对鱼藤酮损伤的SH-SY5Y 细胞凋亡情况的影响
为了进一步明确番茄红素预处理后对SH-SY5Y 细胞的影响,采用Hoechst 染色后在荧光显微镜下观察细胞的凋亡情况,结果如图4,对照组和番茄红素单独处理组的细胞呈正常染色,荧光均匀;鱼藤酮组的细胞出现较多的致密浓染,荧光变亮,颜色发白,表明细胞内染色质高度凝聚,边缘化,即将裂解为碎块状的凋亡小体;与鱼藤酮组相比,番茄红素预处理组细胞出现致密浓染的情况减少。

图4 Hoechst 染色检测细胞凋亡(200×)Fig 4 Cell apoptosis was detected by Hoechst staining (200×)
2.4 番茄红素预处理对鱼藤酮诱导SH-SY5Y 细胞产生内质网应激的影响
研究结果如图5A、B,与对照组的GRP78(0.50±0.17)相比,鱼藤酮组的GRP78(1.13±0.16)表达明显升高(P<0.01)。5 μmol/L 的番茄红素预处理组GRP78 的表达量(1.25±0.23)有所升高,但与鱼藤酮组相比无统计学意义(P>0.05);10 μmol/L 的番茄红素预处理组GRP78 的表达量(1.02±0.23)有所下降,但与鱼藤酮组相比无统计学意义(P>0.05);20 μmol/L 的番茄红素预处理组GRP78的表达量(0.58±0.15)明显降低,与鱼藤酮单独处理组相比差异有统计学意义(P<0.05)。细胞免疫荧光结果如图5E,GRP78 在胞浆中表达,各实验组GRP78 的表达情况与Western blot 结果相符。
研究发现鱼藤酮组CHOP 的表达量(1.33±0.04)明显比对照组(0.53±0.03)增多(P<0.01),如图5C、D 所示;而低浓度、中浓度、高浓度番茄红素预处理组CHOP 的表达量分别为(1.10±0.02)、(0.98±0.08)、(0.86±0.03),比鱼藤酮组降低(P<0.01)。细胞免疫荧光的结果如图5F,CHOP 主要定位于细胞核中,鱼藤酮处理会增强CHOP 的荧光信号,番茄红素预处理则使CHOP 的荧光信号减弱。
3 讨论
番茄红素因其极强的抗氧化能力而受到关注,被广泛应用于疾病的抗氧化应激研究中。Liu 等[21]研究发现番茄红素可以提高鱼藤酮诱导的PD 模型小鼠抗氧化应激的能力,改善小鼠的认知以及运动功能障碍。此外也有研究表明番茄红素通过抑制氧化应激激活的AMPK/mTOR 通路,保护缺糖缺氧诱导的SH-SY5Y 细胞免受自噬性死亡[22]。以上研究均表明番茄红素具有神经保护作用,但其机制并未完全明确。内质网是真核生物许多重要的蛋白质合成、加工、转运的重要场所。在PD 病人的样本中检测到了内质网应激[23]。研究发现鱼藤酮可以引发内质网发生应激[24-26],Chen 等[24]报道了活性氧并不参与鱼藤酮诱导的SK-N-MC 细胞的早期死亡,可能ERS 在其中发挥更大的作用。因此本研究基于内质网应激探讨番茄红素预处理对鱼藤酮所致PD 细胞模型的影响及其机制。结果显示低浓度番茄红素预处理可提高细胞活力,与鱼藤酮组相比,差异有统计学意义(P<0.05);中浓度、高浓度番茄红素预处理可以显著提高细胞的活力(P<0.01)。此外番茄红素预处理组细胞凋亡减少,表明番茄红素预处理可以提高SH-SY5Y 细胞应对鱼藤酮损伤的能力,对细胞有保护作用。该结果同Li 等[22]以及Feng 等[27]的研究结果充分说明了番茄红素对受损的SH-SY5Y 细胞有保护作用。
为了探究番茄红素预处理对鱼藤酮损伤的SH-SY5Y 细胞发挥保护作用的可能机制,研究了细胞产生内质网应激的情况。GRP78 是定位于内质网的一种蛋白分子,其表达上调是内质网发生应激的一种标志[28]。在本研究中,鱼藤酮诱导的SH-SY5Y 细胞,GRP78 的表达量明显上调(P<0.01),说明在鱼藤酮诱导SH-SY5Y 细胞发生了内质应激。低浓度番茄红素预处理组GRP78 的表达量有所升高,但与鱼藤酮组相比无统计学意义(P>0.05);中浓度番茄红素预处理组GRP78 的表达量有所下降,但与鱼藤酮组相比无统计学意义(P>0.05),高浓度番茄红素预处理组GRP78 的表达量下降明显,与鱼藤酮单独处理组相比有统计学意义(P<0.05)。考虑到早期的ERS 可能对神经细胞具有保护作用,为了解鱼藤酮诱导细胞发生内质网应激的程度,同时检测了内质网应激的另一代表指标CHOP,也称GADD153,为内质网应激诱导的一种促凋亡的分子[29]。本研究中,鱼藤酮损伤的SH-SY5Y 细胞表达CHOP 的量明显增多(P<0.01),这表明鱼藤酮诱导SH-SY5Y 细胞发生了过度的内质网应激,使细胞发生了ERS 引起的凋亡。番茄红素预处理组CHOP 表达下调,提示番茄红素预处理使内质网应激得到缓解,从而避免了细胞凋亡的发生。因此本研究发现番茄红素可以在一定程度上缓解鱼藤酮引起的细胞内质网应激,从而避免了细胞走向凋亡。
综上所述,番茄红素预处理可以明显提高细胞活力、降低鱼藤酮诱导的细胞凋亡,说明番茄红素预处理可以提高SH-SY5Y 细胞应对鱼藤酮损伤的能力,对细胞有保护作用。番茄红素预处理下调了内质网应激指示蛋白GRP78 的表达,降低内质网应激凋亡蛋白CHOP 的表达,说明番茄红素可以通过缓解PD 细胞模型的内质网应激,避免细胞因内质网应激过度导致的细胞凋亡,实现对细胞的保护作用,但其作用的详细机制有待进一步的研究。
作者贡献度说明:
鲍波、柴星星、李莉莉:参与实验设计,鲍波、柴星星、邓子亮、刘露露、朱少平、李莉莉:实验实施,鲍波、邓子亮、李莉莉:文章撰写。
所有作者声明无任何利益冲突。

