铝致大鼠认知功能障碍中miR-9-5p、RHOA 的表达研究
贾芸菁,钟 斌,李晨羽,甘珏方,廉春容,李莎莎,凌雁武
(右江民族医学院,广西 百色 533000)
铝(aluminum,Al)是一种人体内的非必需元素,但由于它的丰富性,加上人类的广泛使用,使得与Al 相关的毒性与人类健康特别相关。随着我国经济的发展及广西铝矿的开发规模不断扩大,铝矿区人群高铝暴露的压力不断增大。根据流行病学资料显示,长期接触Al 可导致认知功能障碍(mild cognitive dysfunction,MCD)。轻度认知功能障碍是大脑正常老年性改变与痴呆的中间阶段,被广泛认为是阿尔兹海默病(Alzheimer’s disease,AD)的前驱期,了解轻度认知功能障碍发病机制对于早发现、早干预AD 具有重要意义[1]。
微小RNA(microRNA,miRNA)是一类非编码RNA,其广泛分布于真核生物中。已被证明具有发育、生长、分化和神经退行性过程的调节作用[2],单个miRNA 分子可以调节各种基因,使miRNA 成为多因素疾病(如脑部疾病)的潜在治疗靶点。
本研究探究在Al 致大鼠认知功能障碍中miR-9-5p、RHOA 的表达。
1 材料与方法
1.1 实验动物
SPF 级Wistar 大鼠48 只,雌雄各半,体重160~220 g,周龄6~8 周(购自湖南省长沙天勤生物技术有限公司,许可证号:SCXK(湘)2022-0011)。
1.2 主要试剂
AlCl3(广东光华化学厂有限公司);BCA 试剂盒(碧云天生物技术有限公司);RHOA、BDNF 抗体(杭州华安生物技术有限公司);ECL 显影试剂盒(莫纳生物科技有限公司);PCR 引物(上海生工生物股份工程有限公司、广州复能基因有限公司);总RNA 提取试剂盒(北京索莱宝科技有限公司);实时荧光定量PCR(莫纳生物科技有限公司);cDNA 合成试剂盒(莫纳生物科技有限公司)。
1.3 方法
1.3.1 分组与动物模型构建 大鼠编号,适应性饲养一周,根据随机数表的方法将48 只大鼠分为4组,即对照组(n=12)、低剂量组(n=12)、中剂量组(n=12)、高剂量组(n=12),按照参考文献造模方法[3,4],用生理盐水配置10 g/L 的AlCl3溶液,按照25 mg/kg、50 mg/kg、100 mg/kg 分别给低剂量组、中剂量组、高剂量组灌胃3 个月,建立认知障碍模型。
1.3.2 Morris 水迷宫定位航行试验 大鼠染毒结束后,开始进行水迷宫定位航行试验,水迷宫中加满没过平台的水,水中加入墨水。正式实验开始前一天,将每只大鼠放入水迷宫中游泳来提前适应水中环境。正式实验开始后,将每只大鼠分别从4 个象限沿边缘放入水中,并开始计时,大鼠游上平台后计时结束,游上平台的时间即潜伏期(s)。对于没有游上平台的大鼠,1 min 后将其放在平台休息20 s来形成记忆,共5 d。根据潜伏期,可检测大鼠的学习记忆能力。
1.3.3 HE 染色及尼氏染色 用3%戊巴比妥钠腹腔注射来麻醉大鼠,先从心尖处灌注生理盐水,然后滴注4%多聚甲醛固定大鼠组织,结束后立即断头开颅,取出脑组织,放入4%多聚甲醛固定48 h 后开始梯度脱水、包埋制作蜡块、切片(4 μm)、铺片、烤片、脱蜡后进行苏木精-伊红、尼氏染色,然后进行200 倍光镜下观察。
1.3.4 RT-qPCR 麻醉处死大鼠后立即断头,提取新鲜海马组织,使用低温高速研磨仪研磨后,用总RNA 试剂盒提取总RNA,使用分光光度计检测其浓度和纯度,用cDNA 合成试剂盒以总RNA 为模板合成cDNA 后,进行扩增。miR-9-5p 以U6 为内参(U6 验证引物购于复能基因公司,货号RmiRQP9003),反向引物为cDNA 合成试剂盒中的Universal-qPCR-3' primer(购买于莫纳生物科技有限公司,货号MR05301S),RHOA、BDNF 以GAPDH 为内参,采用2-△△Ct分析miR-9-5p、RHOA、BDNF 表达水平。引物名称及序列见表1。

表1 引物名称及序列Tabl 1 Primer names and sequences
1.3.5 Western blot 大鼠处死后,剪开右心耳,心尖灌注生理盐水至右心耳处流出生理盐水,断头并取出新鲜脑组织,随即进行冰上操作剥离出新鲜海马组织,可放入-80 ℃冰箱保存,实验开始前,将组织匀浆裂解来提取总蛋白,根据BCA 试剂盒的操作说明书,测定每组蛋白样品浓度后,加入上样缓冲液和PBS 使蛋白样品达到同一浓度,然后加入沸水中煮沸10 min 后变性,样品制作完毕。按照每孔40 g蛋白样品经过10% SDS-PAGE 进行电泳,电泳结束后转到PVDF 膜进行封闭(5%脱脂奶粉)2 h,用TBST 洗膜3 次,4 ℃孵育一抗,一抗过夜后TBST洗膜5 次,二抗孵育1 h,TBST 洗膜5 次,滴加ECL溶液发光以进行成像,利用Image J 软件对条带进行分析灰度值。
1.4 统计学处理
使用SPSS26.0 软件进行统计分析,所有实验结果表示为(±s),组间数据比较采用单因素单因素ANOVA 检验,检验水准α=0.05。
2 结果
2.1 各组大鼠Morris Water Maze 定位航行实验潜伏期比较
低、中、高3 个剂量组分别给予AlCl3水溶液灌胃(25 mg/kg、50 mg/kg、100 mg/kg),空白对照组给予生理盐水灌胃。
实验记录了定位航行实验训练第1、3、5 天的潜伏时间,染毒组的找到平台时间明显大于对照组。其中,训练第1 天与空白对照组相比,低、中剂量组不具有统计学意义,高剂量组具有统计学意义(P<0.05);训练第3 天,与空白对照组相比,低剂量组的结果不具有统计学意义,中、高剂量组具有统计学意义(P<0.05);训练第5 天,与空白对照组相比,低剂量组不具有统计学意义,中、高剂量组具有统计学意义(P<0.05)。结果见表2。
表2 4 组大鼠 Morris Water Maze 定位航行实验训练后的潜伏时间比较(s,±s)Tab 2 Comparison of latency after training in the Morris Water Maze positioning navigation experiment in four groups (s,±s)
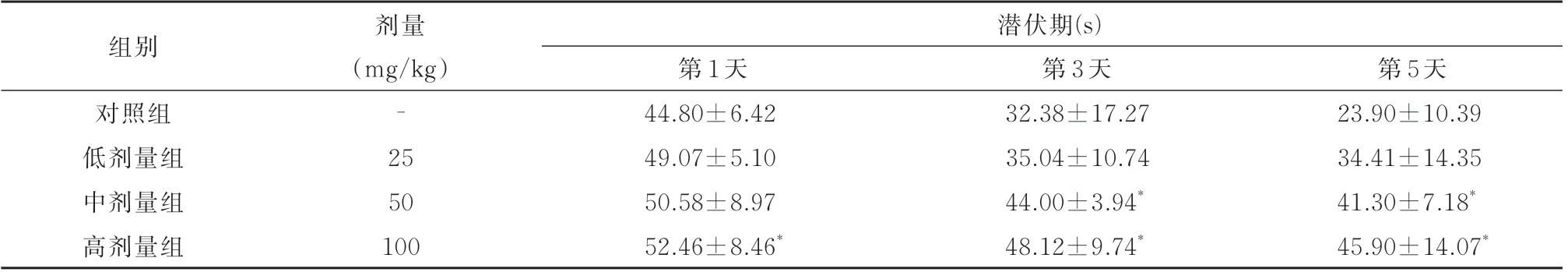
表2 4 组大鼠 Morris Water Maze 定位航行实验训练后的潜伏时间比较(s,±s)Tab 2 Comparison of latency after training in the Morris Water Maze positioning navigation experiment in four groups (s,±s)
注:与对照组相比,*P<0.05。
组别潜伏期(s)剂量(mg/kg)-25 50 100第3 天32.38±17.27 35.04±10.74 44.00±3.94*48.12±9.74*第5 天23.90±10.39 34.41±14.35 41.30±7.18*45.90±14.07*对照组低剂量组中剂量组高剂量组第1 天44.80±6.42 49.07±5.10 50.58±8.97 52.46±8.46*
2.2 对照组与剂量组海马切片HE 染色实验结果对比
HE 染色结果显示,对照组大鼠神经细胞无水肿,排列有序,结构正常,核仁清晰可见,有丰富的胞质,且染色清晰,胞膜边缘锐利清楚,无明显病理改变。
染毒组随着增加染毒剂量,神经细胞开始出现损伤,低剂量组、中剂量组、高剂量组开始出现不同程度的,神经细胞排列紊乱,胞核固缩,破裂,溶解,核质深染,胞膜边缘模糊不清,出现若干病理性改变,神经细胞损伤加重。与对照组相比,高剂量组变化最为明显。见图1。
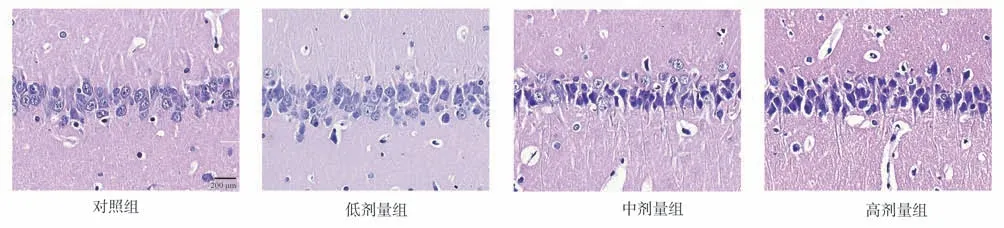
图1 各组大鼠海马组织HE 染色比较(×200)Fig 1 Comparison of HE staining of hippocampal tissues in rat groups (×200)
2.3 对照组与剂量组海马切片尼氏染色实验结果对比
尼氏染色结果显示,对照组海马神经元排列紧密,染色清晰,胞浆内的Nissl 体颗粒染色清晰,细胞形态正常。随着染毒剂量的增加,可见染毒组的细胞排列紊乱,胞内的Nissl 体颗粒消散减少,细胞形态不一的情况。见图2。

图2 各组大鼠海马组织尼氏染色比较(×200)Fig 2 Comparison of Nymphali staining of hippocampal tissue in rat groups(×200)
2.4 对照组与剂量组大鼠海马组织miR-9-5p、RHOA、BDNF mRNA 表达比较
与对照组相比,低、中、高剂量组miR-9-5p 的表达均明显下降,其中低剂量组无统计学意义中、高剂量组具有统计学意义(P<0.05 或P<0.001);与对照组相比,RHOA 的表达均明显上升,差异均具有统计学意义(P<0.05 或P<0.001);与对照组相比,BDNF 的表达均明显下降,其中低剂量组差异无统计学意义,中、高剂量组差异具有统计学意义(P<0.05)。见图3,表3。

图3 各组大鼠miR-9-5p、RHOA、BDNF mRNA 表达比较Fig 3 Comparison of miR-9-5p,RHOA and BDNF mRNA expression in rat groups

表3 各组大鼠RT-qPCR 结果P 值Tab 3 P values of RT-qPCR results in each group
2.5 对照组与剂量组大鼠海马组织RHOA、BDNF蛋白表达比较
与对照组比较,染毒组的RHOA 蛋白表达量均有所提高,其中中剂量组和高剂量组的相对表达量与对照组的统计学差异P<0.05;染毒组的BDNF蛋白表达量均有所下降,其中中、高剂量组与对照组统计学差异P<0.05。见表4,图4。

图4 各组大鼠海马组织RHOA、BDNF蛋白的相对表达情况Fig 4 Relative expression of RHOA and BDNF proteins in rat hippocampal tissues of each group

表4 各组大鼠海马组织RHOA、BDNF 蛋白相对表达量的比较Tab 4 Comparison of relative expression of RHOA and BDNF proteins in rat hippocampal tissues
3 讨论
Al 是地壳中延伸最广泛的金属之一。它的丰富性,加上人类的广泛使用,使得与Al 相关的毒性与人类健康特别相关。Al 已被反复证明具有神经毒性,加速脑衰老,进而导致脑部疾病,最开始的表现为认知功能障碍,进而可能会发展为AD、帕金森病等。Al 所致认知障碍的相关研究在众多学者的努力下虽然已取得初步胜利,但其机制尚未完全明确。
AD 是目前最常见的痴呆病,其特点是记忆力和智力下降、行为怪异、喜怒无常等,最终导致患者失去自理能力,在全球范围内估计痴呆病人的占60%~70%,情况不容乐观[5]。根据目前的研究发现,AD 的主要发病机制为淀粉样蛋白和早老素蛋白这两类基因的突变加速导致了β 淀粉样多肽转化为神经斑块的过程,其主要病理特征表现为形成淀粉样蛋白β 肽的神经质斑块和过度磷酸化tau 组成的神经原纤维缠结[6,7]。轻度认知障碍发生在从正常认知到痴呆的过程中,老年人认知能力随着年龄增长可分为4 个阶段:具有正常认知能力、主观认知功能障碍、轻度认知功能障碍,最后发展为痴呆[8]。由此可见,AD 是一种表现为进行性认知障碍的痴呆症。本研究中,通过水迷宫行为学实验、HE 染色和尼氏染色证明3 个Al 染毒组均存在不同程度的学习记忆障碍,以及海马区神经元均受到了不同程度的损伤。证实了本实验认知障碍模型建立成功。
miRNA 作为非编码RNA,可以调节多种靶基因,使miRNA 成为多种脑疾病的潜在治疗靶点。研究表明,miRNA 参与了多种与AD 发病机制相关的信号通路,包括β-淀粉样蛋白产生和清除、神经炎症和神经发生的信号通路。而认知功能障碍又会进一步发展为AD,所以研究miRNA 与认知功能障碍的机制尤为重要。有研究发现,miR-9-5p 与多种认知障碍相关神经退行性疾病相关,如AD[9]、帕金森病[10]。已有研究表明miR-9-5p 在AD 小鼠的早期下调[9]。并且在本课题组前期研究中,通过第二代高通量测序技术分析高铝认知障碍人群血清外泌体miRNAs 表达谱,使用Cytoscape 软件构建了miRNAs 与铝致认知障碍中MAPK 信号通路信相关靶基因之间的网络调控图,并筛选出了has-miR-9-5p 通过下调控制RHOA 在高血铝认知障碍患者的血清外泌体表达[11]。本实验为了验证该结果,故创建了铝致认知障碍大鼠与正常大鼠做对比,来验证这一结论。
RHOA 及其许多下游蛋白在神经系统参与多种信号转导途径。有证据表明异常的RHOA 信号在AD、亨廷顿病和帕金森病等神经退行性疾病中的作用[12]。RHOA 的激活可能会导致神经元的生长发育、抑制轴突再生功能等活动[13-15]。研究发现,在APP/PS1 转基因和原纤维Aβ 注射小鼠模型中,反应性小胶质细胞的RHOA 表达增加[16]。还有研究发现,非甾体[17,18]、他汀类药物[19]可通过抑制RHOA 相关信号通路,来减少Aβ 的生成,这表明抑制RHOA 表达,可为AD 治疗提供参考依据。这与本次实验中RHOA 的RT-qPCR 和Western Blot 结果一致。
BDNF 是哺乳动物大脑中分布最广、研究最广泛的神经营养因子之一,在将突触活动转化为长期突触记忆方面至关重要。据报道,BDNF 信号传导的缺陷有助于几种主要疾病的发病机制,例如亨廷顿病,AD,抑郁症,精神分裂症,双相情感障碍和焦虑症[20]。因此,BDNF 的表达直接影响脑的认知水平。本实验中Al 染毒组的BDNF 与对照组相比均有不同水平的下调。
本实验中,给实验组大鼠灌胃AlCl3来建立实验模型,然后通过水迷宫行为学实验,检测出低剂量组、中剂量组、高剂量组的大鼠均有不同程度的学习记忆能力下降。表明Al 致认知障碍模型建立成功。随后,本研究通过病理学技术直观地发现,3 个染毒组的海马区神经元受到损伤。接下来,通过分子生物学实验将本课题组前期在人群数据筛选中得出的结论验证到动物模型上,结果表明,低剂量组、中剂量组、高剂量组的miR-9-5p 均下调,RHOA表达水平均上调。因此,笔者猜测在铝致大鼠认知障碍的机制可能与miR-9-5p 下调导致RHOA 上调有关。关于miR-9-5p 靶向调控RHOA 还需要实验进一步证明。
作者贡献度说明:
贾芸菁:实验设计与实操,数据整理与统计分析,论文撰写修改;李晨羽:实验操作助手;凌雁武、钟斌、甘珏方、廉春容、李莎莎:研究指导,论文修改,经费支持。
所有作者声明不存在利益冲突关系。

