隐丹参酮调节AMPK/Nrf2信号通路治疗小鼠非酒精性脂肪性肝病作用机制
赵梦溪,罗 斌,吕建瑞,王 宁
(西安交通大学第二附属医院,陕西 西安 710004)
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是一种临床常见的代谢性疾病,与代谢障碍、氧化应激密切相关,主要特征为脂肪过度蓄积于肝脏,肝细胞脂肪变性[1]。流行病学报道,近年来NAFLD的患病率显著上升,当前在全球范围内,NAFLD的患病率约为25%[2]。本病与长时间高脂高糖饮食密切相关,此外,还与体内胰岛素受体对胰岛素敏感性降低有关[3]。若NAFLD不加以控制,可逐渐进展至非酒精性脂肪性肝炎[4]。目前,NAFLD的治疗以改变生活方式为基础,临床暂未发现具有显著疗效的药物,多数药物在改善肝脏脂质的同时给肝脏带来一定的负担,不适合长期使用,因此需要不断探索新疗法、开发新药物[5-6]。绝大多数西药是通过化学方法合成的药物,是在现代工艺下合成的药物;而中药多来源于自然界中的植物、动物、矿石等,不良反应较少[7-8]。此外中医对非酒精性脂肪肝有独特见解,认为本病属“肝癖”范畴,病位在肝,与脾、肾相关,病理因素为痰湿瘀聚于胁下所致,其中“瘀”又是核心之一[9]。丹参属活血化瘀药,具有祛瘀活血、养血安神的作用,丹参酮是中药丹参的主要成分之一。既往研究表明,丹参酮具有保护肝脏的作用。本研究基于腺苷酸活化蛋白激酶(Adenosine monophosphate-activated protein kinase,AMPK)/核因子E2相关因子2(Nuclear factor-erythroid 2-related factor 2,Nrf2)信号通路,从氧化应激角度探究隐丹参酮对NAFLD的治疗作用,以为临床NAFLD的药物治疗提供一定的理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:60只雄性6周龄C57BL/6小鼠清洁级,体重18~22 g,购于西安交通大学医学部动物实验中心[SCXK(陕)2020-001]。小鼠饲养于西安交通大学动物实验中心,饲养于12 h/12 h光、暗交替环境,湿度50%~60%,温度25 ℃,日常自由觅食。
1.1.2 实验试剂:隐丹参酮(含量98%,批号35825-57-1,上海同田生物);谷草转氨酶(Aspartate aminotransferase,AST)、谷丙转氨酶(Alanine aminotransferase,ALT)、总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)、超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)和谷胱甘肽(Glutathione,GSH)检测试剂盒(批号C010-2-1、C009-2-1、A111-1-1、A110-1-1、A001-3-2、A003-1-2、A006-1-1,南京建成生物);HE染色试剂盒(批号ST2023,上海尚宝生物);ECL发光液(批号34578、赛默飞世尔);PVDF膜(0.45 μm)(批号IPFL00010,默克西格玛奥德里奇公司);OCT包埋剂(批号4583,北京索莱宝);AMPK、磷酸化腺苷酸活化蛋白激酶(p-AMPK)、Nrf2、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号AHO1332、PA5-17831、PA5-88084、MA5-15738-D680,赛默飞世尔科技中国公司);二抗(批号HRPDS-0003,北京中杉金桥)。
1.1.3 实验仪器:常规垂直电泳仪(型号Mini-PROTEAN,美国Bio-Rad);酶标仪(型号BIO-DL K3 Plus,上海素秋仪器);精密电子天平(型号WT20003,常州万泰天平仪器);化学发光成像系统(型号Chemi Doc XRS+,美国Bio-Rad);组织石蜡包埋机(型号ES500,美国Them Fisher Scietific);石蜡切片机(型号HM 325,美国Them Fisher Scietific);冰冻切片机(型号EM FC7,德国徕卡)。
1.2 实验方法
1.2.1 造模、分组与给药:60只小鼠随机分为正常组12只和造模组48只,造模时用普通饲料喂养正常组,造模组小鼠给予高脂饲料+5%的红糖水日常饮用喂养,高脂饲料喂养8周后,正常组处死2只,造模组处死8只,通过肝脏HE染色和油红O染色检测造模结果,结果示本研究小鼠均造模成功。造模成功后,将造模组剩余的40只小鼠随机分为模型组、隐丹参酮低剂量组、隐丹参酮中剂量组和隐丹参酮高剂量组,每组10只。治疗时,正常组和模型组小鼠给予0.9%氯化钠溶液1 ml/(kg·d)腹腔注射,隐丹参酮低、中、高剂量组小鼠分别给予隐丹参酮7.5、15、30 mg/(kg·d)腹腔注射,治疗4周后,进行后续实验。
1.2.2 取材:治疗结束后,所有大鼠禁食不禁水12 h,次日取出小鼠称重后麻醉,打开腹腔,心脏取血法收集小鼠血液,收集血液后将其置入冰块中,以3000 r/min离心10 min取上清液,存放于-80 ℃冰箱中备用。收集血液后取出肝脏,其中左外侧叶的肝脏保存于组织固定液中用于肝脏组织病理学观察,其余肝脏组织放入超低温冰箱中,备用于Western blot检测。
1.3 观察指标
1.3.1 小鼠肝脏组织和血清TG、TC检测:称取100 mg肝脏组织,将其用组织提取液提取后收集上清液,定量并调平,然后采用TG和TC检测试剂盒检测TG、TC水平;心脏取血,离心后取上清液,检测血清TG、TC水平。
1.3.2 小鼠血清AST、ALT、MDA、SOD水平检测:将血清从超低温冰箱中取出,按照试剂盒说明书,依次检测AST、ALT、MDA、SOD水平,然后依次计算其表达水平。
1.3.3 小鼠肝脏组织HE染色和油红O染色:从组织固定液中取出肝脏组织,用超纯水将其反复冲洗后,依次将其置入70%、80%、90%、95%、100%乙醇中浸润并脱水,然后将其浸入二甲苯溶液中进行透明处理,最后采用石蜡包埋制作成石蜡块。使用切片机将其切成3~5 mm薄片,切片脱蜡后,进行HE染色和油红O染色,然后收集图像在光学显微镜下观察,每个切片选取4个不同的视野。
1.3.4 Western blot检测Nrf2、AMPK、p-AMPK蛋白表达:称取100 mg肝脏组织,将其用组织提取液提取后,收集上清液,定量并调平,然后采用SDS-PAGE垂直电泳将蛋白进行电泳分离,电泳条件为80 V恒压电泳30 min,120 V恒压电泳60 min,电泳完成后,将目的蛋白转移到预先用甲醇浸泡过的PVDF膜上,转膜完成后,将其取出用5%的脱脂牛奶封闭30 min,加入一抗过夜孵育,次日取出,加入二抗孵育30 min,最后采用ECL发光液进行反应,凝胶成像仪收集图像。
1.4 统计学方法 采用SPSS 23.0统计学软件进行数据分析。计数资料采用均数±标准差表示,两组间比较采用Oneway ANOVA进行,多组间比较采用LSD 方法进行;P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况比较 正常组小鼠体毛光滑发白,反应灵敏,喂食时精神活跃,观察垫料湿度平均;模型组小鼠有明显的毛色发黄干枯,反应相对迟缓,同时垫料湿度高且明显发臭;与模型组比较,隐丹参酮治疗后,小鼠毛发、活动等均明显改善,其中隐丹参酮高剂量组改善最为明显。
2.2 各组小鼠AST、ALT水平比较 见表1。模型组相较于正常组小鼠血清AST、ALT水平均呈明显升高趋势(P<0.05);隐丹参酮各治疗组相较于模型组小鼠AST、ALT水平均明显降低(P<0.05);隐丹参酮高剂量组与正常组小鼠ALT、AST水平比较差异无统计学意义(P>0.05)。
2.3 各组小鼠肝脏、血清TG及TC水平比较 见表2。与正常组比较,模型组小鼠血清及肝脏组织TG、TC水平均呈显著升高趋势(P<0.05);与模型组比较,隐丹参酮低、中、高剂量组小鼠肝脏和血清组织TG、TC水平均呈明显降低趋势(P<0.05)。
2.4 各组小鼠MDA、SOD、GSH水平比较 见表3。与正常组比较,模型组小鼠血清MDA水平明显升高,SOD、GSH水平明显降低(P<0.05);与模型组比较,隐丹参酮低、中、高剂量组小鼠MDA水平明显降低,SOD、GSH水平明显升高(P<0.05);隐丹参酮高剂量组与正常组小鼠MDA、SOD、GSH水平比较差异无统计学意义(P>0.05)。
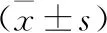
表3 各组小鼠MDA、SOD、GSH水平比较
2.5 各组小鼠肝脏组织病理学改变 肝脏组织病理学HE染色可见,正常组小鼠肝脏组织细胞结构完整,细胞核分布于细胞中间,细胞也未见明显的脂肪空泡;模型组小鼠有明显的肝脏脂肪变性,大量弥漫性的脂肪空泡聚集;与模型组比较,隐丹参酮低、中、高剂量组小鼠肝脏组织空泡数量明显减少。肝脏组织油红O染色可见,正常组小鼠切片未见红色脂滴;模型组小鼠则表现有大量的脂滴;与模型组比较,隐丹参酮低、中、高剂量组小鼠红色脂滴数量明显降低,尤其是隐丹参酮高剂量组红色脂滴数量与正常组相近。见图1。
2.6 各组小鼠AMPK/Nrf2信号通路相关蛋白表达比较 与正常组比较,模型组小鼠Nrf2蛋白表达明显降低(P<0.05);与模型组比较,隐丹参酮低、中、高剂量组小鼠Nrf2表达明显升高(P<0.05)。隐丹参酮低、中、高剂量组与模型组小鼠AMPK蛋白表达比较,差异无统计学意义(P>0.05);与正常组比较,模型组小鼠p-AMPK蛋白表达明显降低(P<0.05);与模型组比较,隐丹参酮低、中、高剂量组小鼠p-AMPK表达明显升高(P<0.05)。见表4(图2)。
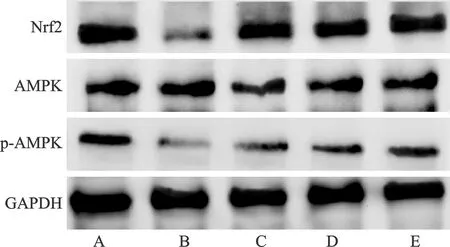
A:正常组;B:模型组;C:隐丹参酮低剂量组;D:隐丹参酮中剂量组;E:隐丹参酮高剂量组
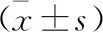
表4 各组小鼠AMPK/Nrf2信号通路相关蛋白表达比较
3 讨 论
本实验通过高脂高糖饮食构建NAFLD动物模型。本造模相对于其他造模方法,造模时间稍长,病变程度较轻,但其简便易行,且造模成功率高,所构建的NAFLD动物模型与临床NAFLD患者的病理特征相似[10-11]。因此本研究采用高脂高糖饮食构建NAFLD小鼠模型,小鼠肝脏组织病理学观察显示,正常组没有任何脂肪空泡,而模型组则出现大量的弥漫性脂肪空泡,这与文献报道结果相符,说明采用高脂高糖饮食8周能够构建NAFLD小鼠模型。该种造模与中医饮食不节、情志失调等因素相关,由于小鼠长期的饮食不节,过食肥甘厚味,导致脾失健运,水湿内停,聚而为痰;加上长期关于鼠笼情志失调,肝气郁滞,导致气滞血瘀,日久痰瘀互结为病[12-14]。
NAFLD的首要病理因素为痰瘀,治疗以活血化瘀为治疗总纲。诸多医家在使用活血化瘀方剂治疗NAFLD时,丹参使用频率较高且多作为君药。隐丹参酮是从丹参酮中分离得到的一种具有药理活性的单体化合物[15-16]。研究显示,隐丹参酮具有较高的药理活性,其具有抗癌、抗氧化、抗衰老作用,对部分肿瘤、冠心病、心绞痛、心肌损害有一定疗效;隐丹参酮可通过抑制基质金属蛋白酶的表达,抑制活性氧的产生和激活NF-κB,此外其对肝脏也具有一定的保护作用[17-18]。但是尚无相关研究将隐丹参酮用于NAFLD的治疗,基于此本研究探讨隐丹参酮治疗NAFLD的作用机制。NAFLD最显著的病理特征为肝功能和血脂指标的异常以及抗氧化应激能力的降低[19-20]。为此本研究观察了氧化应激指标、肝功能和血脂指标的变化特点,研究结果显示高脂高糖饮食喂食小鼠后,小鼠血清和肝脏组织TG、TC水平明显升高,肝功能AST、ALT水平也明显升高,同时氧化应激指标MDA水平明显升高,而抗氧化应激指标SOD、GSH水平则明显降低,这进一步证实了高脂高糖饮食8周确实可以构建NAFLD模型[21]。采用不同剂量隐丹参酮治疗后,小鼠肝功能指标AST和ALT、血清和肝脏TG、TC及氧化应激指标MDA则明显降低,与模型组比较,抗氧化应激指标SOD和GSH水平明显升高,以上研究结果证实隐丹参酮对NAFLD有一定的治疗作用。
AMPK/Nrf2信号通路是近年来研究较多的信号通路,目前研究已经证实在NAFLD发生和发展过程中,AMPK/Nrf2信号通路参与了NAFLD脂肪蓄积、炎症反应以及氧化应激等多条信号轴,通过调控AMPK/Nrf2信号通路能够较好地实现对NAFLD的治疗[22-23]。AMPK可表达于机体的任何器官中,能被包括细胞压力、运动以及激素等影响细胞代谢的物质所激活,进而参与炎症与氧化应激反应,维持葡萄糖代谢的平衡[24-25]。而Nrf2主要参与氧化应激反应,Nrf2能够通过上调其自身的表达,进而减少氧化应激相关指标的生成,维持机体氧化/抗氧化平衡[26-27]。Nrf2与AMPK相互协调共同促进了NAFLD的发生与发展[28-29]。本研究结果发现,采用隐丹参酮治疗后,与正常组比较,模型组小鼠Nrf2蛋白表达明显降低;与模型组比较,隐丹参酮低、中、高剂量组小鼠Nrf2表达明显升高。模型组小鼠p-AMPK蛋白表达相较于正常组明显降低;相较于模型组,隐丹参酮各治疗组小鼠p-AMPK表达显著升高。以上研究结果证实隐丹参酮对AMPK/Nrf2信号通路具有明显的调节作用,进而发挥保护肝脏作用。
综上所述,隐丹参酮可能通过调节AMPK/Nrf2信号通路,提高抗氧化能力,减少肝脏脂质蓄积发挥肝脏保护作用。

