雷公藤乙素对糖尿病肾病足细胞损伤自噬作用及免疫代谢的影响
张 磊,刘超楠,韩秀涛,赵静宇,周晓霜
(1.山西中医药大学,山西 晋中 030619;2.山西省人民医院,山西 太原 030012;3.首都医科大学附属北京佑安医院 北京肝病研究所,北京 100069)
糖尿病肾病(Diabetic kidney disease,DKD)是临床常见的糖尿病并发症,在DKD发病早期常常会出现少量蛋白尿,在疾病发展的后期,DKD患者会出现尿毒症和心血管的损伤,并且有较高的病死率[1-2]。DKD在中医学可归于消渴病范畴,其病机核心为虚、瘀、浊,而虚是消渴病发病的基本条件[3]。中医理论认为DKD早期病机以气阴两虚为主,逐渐引起脾肾两虚。虚实寒热、阴阳病损的复杂病理机制会促进DKD的发展进程[4]。中医的辨证分型与DKD的生存率有密切关联,DKD最常见的证型为气虚血瘀证和气阴两虚证,而DKD生存率低的证型为阴阳俱虚证和血瘀痰凝证,预后不良[5]。《景岳全书》指出消渴病的下消又称作肾消,病位在肾,肾消会使精津大量外泄,导致津液输布障碍,出现尿浊、水肿等并发症[6]。西医认为自噬在DKD中发挥至关重要的作用,自噬又称为巨自噬,会导致胞质实体溶酶体降解[7]。DKD、局灶节段性肾小球硬化症和多囊肾病的发病机制均归结于自噬的失调[8]。葡萄糖转运蛋白-1(Glucose transporter 1,GLUT-1)是肾小球系膜细胞上主要的葡萄糖转运蛋白,和糖尿病肾病的发病密切相关,其可通过多种机制导致糖尿病肾病的发生[9]。树突状细胞(DC)发挥提呈传递抗原的作用,是机体内功能最强的免疫细胞,能够抑制炎症因子的产生和维持机体免疫平衡[10]。DKD发病机制复杂,自身免疫功能异常影响DKD的发生和发展[11]。目前,临床针对DKD主要有降糖、降压、减少尿蛋白、生活干预等治疗手段,但是疗效欠佳。近年来,越来越多的研究发现雷公藤能够治疗自身免疫性疾病,比如类风湿性关节炎、皮肌炎等,具有很好的临床疗效[12]。雷公藤主要通过影响免疫调节作用、激活MAPK通路、改变肾脏的蛋白表达等途径来保护肾脏[13]。雷公藤甲素和雷公藤乙素都是雷公藤的有效成分。研究表明,雷公藤甲素能够保护足细胞,能够激活足细胞的活性,从而抑制炎症反应[14]。研究发现,雷公藤乙素能够降低转化生长因子β1的表达,改善肾功能[15]。目前,对于雷公藤乙素的研究还比较局限,因此,本文主要研究足细胞的自噬水平,探讨雷公藤乙素促进自噬减轻足细胞损伤机制,并在此基础上进一步研究高糖条件下炎症因子、免疫功能的变化和GLUT-1表达,为雷公藤乙素治疗DKD提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞系:小鼠肾足细胞系MPC5由山西省人民医院肾病研究所赠予。
1.1.2 实验试剂:RPMI 1640培养基(美国Gibco公司);VIVO培养基(美国Gibco公司);胎牛血清(FBS,美国Hyclone公司);葡萄糖(美国Merck Millipore公司);LC3A/B Antibody抗体(美国Sigma公司);Anti-p62抗体(美国Cell signaling公司);重组Anti-mTOR抗体(美国Cell signaling公司);Percp mouse anti-human CD3、PE Mouse Anti-Human CD4、FITC Mouse Anti-Human CD8(美国BD公司);雷公藤乙素(上海繁泰生物科技有限公司);RNA提取试剂TRIzol Reagent(美国Merck Millipore公司);逆转录试剂盒(美国Takara公司);人重组白介素-4(IL-4)、人重组粒细胞巨噬细胞集落刺激因子(GM-CSF)蛋白(美国Peprotech公司);人MHC-Ⅱ抗体(美国PTG公司);APC mouse anti-human CD54、FITC Mouse Anti-Human CD86、GLUT-1(美国BD公司);Maker(美国Sigma公司);2× Loading buffer(上海生物工程股份有限公司);β巯基乙醇(美国Merck Millipore公司);β-actin Rabbit mAb抗体(北京索莱宝科技有限公司);TRITC标记的羊抗兔IgG(美国Sigma公司)。
1.1.3 实验仪器:离心机(格罗贝尔机电有限公司);流式细胞仪(美国BD公司);成像流式细胞仪(美国Merck Millipore公司);实时荧光定量PCR仪(美国Sigma公司)。
1.2 实验方法
1.2.1 足细胞培养及分组:复苏足细胞系,用RPMI 1640培养基(含10%FBS)培养足细胞,在37 ℃、5% CO2培养箱中传代增殖,继而接种至10 cm培养皿(5.0×106个/皿),随后分为三组进行实验,分别为正常对照组、高糖组(葡萄糖30 mmol/L)、高糖+雷公藤乙素组。
1.2.2 Western blot检测足细胞蛋白表达:收集各组细胞,用PBS洗涤细胞2次,按100∶1比例加入细胞裂解液和蛋白酶抑制剂,刮下细胞,裂解30 min,然后4 ℃、12000 r/min离心10 min,弃去沉淀,加入2×Loading buffer,置于100 ℃水浴锅中变性10 min。然后样本置于4 ℃保存。配制6%~12%的SDS-PAGE凝胶,待各组上样、凝胶分离后转移到PVDF膜上,一抗、二抗分别孵育。兔抗鼠哺乳动物雷帕霉素靶蛋白(mTOR)、p62、LC3、肾小球足细胞裂隙膜蛋白(Podocin)、肾病蛋白(Nephrin)均按抗体说明书1∶1000稀释。24 h室温下复温后1×TBST洗一抗3次,每次20 min,室温孵育兔二抗1 h,1×TBST洗二抗3次,每次20 min,加发光液,用凝胶成像系统进行图像扫描,并计算LC3、p62、mTOR、Podocin、Nephrin蛋白表达。
1.2.3 RT-PCR检测足细胞各炎症因子mRNA表达:TRIzol试剂提取各组细胞 RNA,并进行逆转录。设定逆转录条件:30 ℃ 10 min,42 ℃ 30~60 min,95 ℃ 5 min。然后在PCR扩增仪上进行实时定量PCR反应,反应条件为95 ℃ 5 min,95 ℃ 15 s,60 ℃ 30 s,44个循环;计算炎症因子白介素-1α(IL-1α)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6) mRNA相对表达量。
1.2.4 DC细胞培养与测定:取DKD患者和健康者外周静脉血,PBS等量稀释后,2000 r/min离心20 min,收集外周血单个核细胞,按2×106细胞/孔种植于12孔板中,加入RPMI 1640培养液,置于含5%CO2、37 ℃孵箱中,2 h后移除非贴壁细胞,将非贴壁细胞冻存,保留贴壁细胞,贴壁细胞加入内含终浓度GM-CSF(800 U/ml)和IL-4(1000 U/ml),继续培养,隔日换液,观察细胞的生长情况,在第5日,更换培养基(含细胞因子),第6日加入TNF-α(1000 U/ml),第7日收集细胞,离心后PBS重悬细胞并加入HLA-DR MHCⅡ、CD86、CD54抗体各2.5 μl于流式上机管中,混匀,室温染色30 min,PBS洗涤细胞。离心后,PBS重悬细胞,4 ℃保存,流式细胞仪检测细胞HLA-DR MHCⅡ、CD54和CD86抗体荧光表达情况。或者将收集的细胞置于1.5 ml的EP管中,离心后用PBS重悬细胞加入HLA-DR MHCⅡ和GLUT-1抗体各2.5 μl,放在涡旋仪上混匀,室温染色30 min,PBS洗涤。离心后,PBS重悬细胞,成像流式细胞仪测定用HLA-DR标记的DC细胞GLUT-1的表达情况。
1.2.5 T淋巴细胞的培养与测定:第7日收集DC细胞,复苏非贴壁细胞,即淋巴细胞,DC细胞与T淋巴细胞按1∶10的比例加入,三组DC细胞与对应的T淋巴细胞共培养于12孔板中,加IL-2 (50 U/L)培养4 d。然后将悬浮细胞加入流式上机管中,离心后PBS重悬细胞,加入CD3、CD4和CD8抗体各3 μl,室温染色30 min,PBS洗涤细胞。离心后,PBS重悬细胞,4 ℃保存,流式细胞仪测定T淋巴细胞CD3+、CD4+和CD8+表达情况。
1.3 统计学方法 采用Graphpad Prism 7.0统计学软件进行数据分析。各组间比较采用单因素方差分析;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组足细胞LC3、p62、mTOR、Podocin、Nephrin蛋白表达比较 见表1(图1)。与正常对照组比较,高糖组LC3、mTOR、Podocin、Nephrin蛋白表达量显著降低,p62蛋白表达增强(均P<0.05);与高糖组比较,高糖+雷公藤乙素组Nephrin、mTOR蛋白表达升高,p62表达降低(均P<0.05),LC3、Podocin蛋白表达虽升高,相比较差异无统计学意义(均P>0.05)。
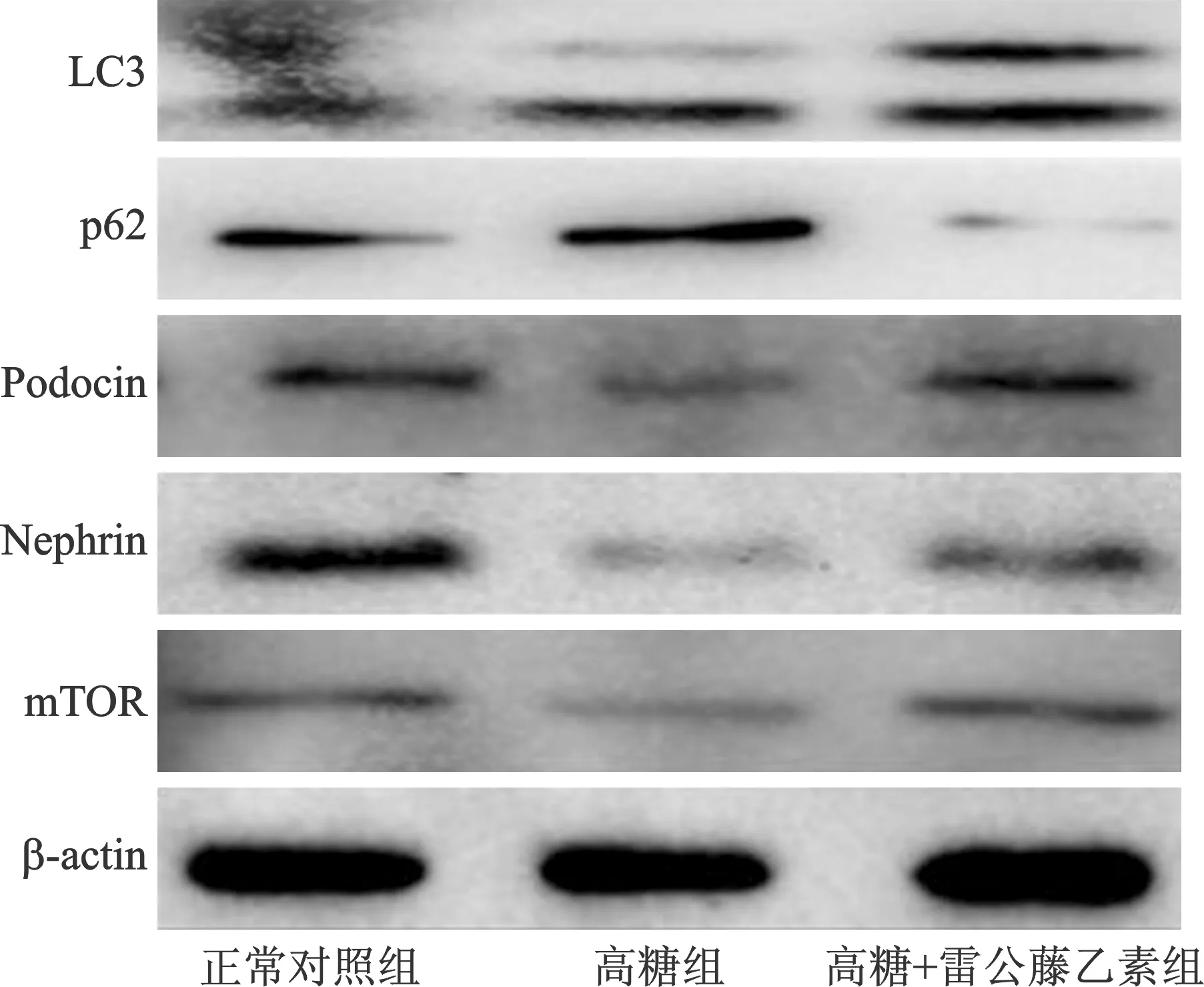
图1 各组足细胞LC3、p62、Podocin、Nephrin、mTOR蛋白表达电泳图
表1 各组足细胞LC3、p62、Podocin、Nephrin、mTOR蛋白表达比较
2.2 各组足细胞IL-1α、IL-1β、IL-6、TNF-α mRNA表达比较 见表2。与正常对照组比较,高糖组IL-1α、IL-1β、IL-6、TNF-α等炎症因子mRNA表达水平明显升高(均P<0.05);与高糖组比较,高糖+雷公藤乙素组IL-1α、TNF-α mRNA表达水平明显改善(均P<0.05),IL-1β、IL-6 mRNA表达水平虽有改善,但是相比较差异无统计学意义(均P>0.05)。
表2 各组足细胞IL-1α、IL-1β、IL-6、TNF-α mRNA表达比较
2.3 各组DC细胞表面分子HLA-DR MHCⅡ、CD86、CD54表达比较 见表3。与正常对照组比较,DKD患者外周血单个核细胞向DC细胞分化,分化成的DC细胞表达HLA-DR MHCⅡ、CD86、CD54的平均荧光值明显降低(均P<0.05);与DKD组比较,DKD+雷公藤乙素组DC细胞表达HLA-DR MHCⅡ、CD86、CD54平均荧光值较高(均P<0.05)。
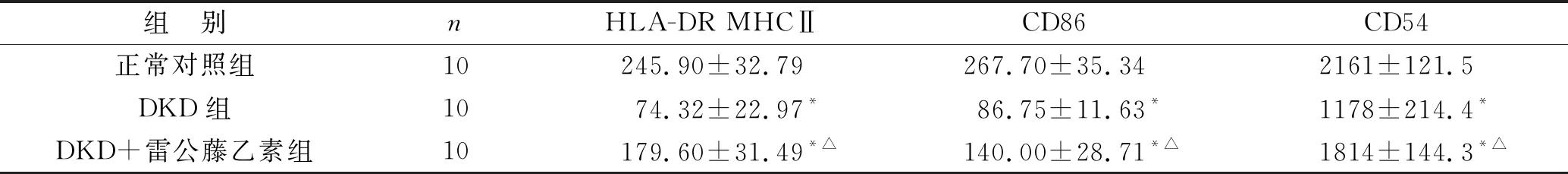
表3 各组DC细胞表面分子HLA-DR MHCⅡ、CD86、CD54表达比较(%)
2.4 各组T淋巴细胞CD3+、CD4+和CD8+表达比较 见表4。与正常对照组比较,DKD组T淋巴细胞CD3+、CD4+和CD8+表达降低(均P<0.05);与DKD组比较,DKD+雷公藤乙素组T淋巴细胞CD3+、CD4+和CD8+表达升高(均P<0.05)。

表4 各组T淋巴细胞CD3+、CD4+和CD8+表达比较(%)
2.5 各组DC细胞GLUT-1表达比较 见表5。与正常对照组比较,DKD组用HLA-DR荧光标记DC细胞GLUT-1表达量较低(P<0.05);与DKD组比较,DKD+雷公藤乙素组用HLA-DR荧光标记DC细胞GLUT-1表达量升高(P<0.05)。

表5 各组DC细胞GLUT-1表达比较(%)
3 讨 论
DKD是一种微小血管的持续性病变[16]。DKD发病机制较为复杂,主要包括糖代谢紊乱、肾脏血流动力学的改变、多种细胞因子等因素导致肾小球功能不可逆地下降,从而患者出现大量的蛋白尿[17-18]。研究表明,自噬在肾脏疾病中发挥关键性的作用,在机体高糖条件下,失调的自噬会加重肾脏肾小球和肾小管间质的恶性病变[19]。自噬是一种细胞内分解代谢,对维持细胞内环境发挥重要的作用,目前调控自噬的主要有mTOR、AMPK以及SIRT1三条通路,DKD足细胞损伤的相关信号通路包括mTOR/自噬、TGF-β1以及Notch等[20]。吴冰等[21]运用枸杞多糖抑制Notch通路,改善DKD大鼠肾脏纤维化,减轻足细胞损伤和肾功能。另外,DKD的发生和发展与免疫系统的破坏密切相关,DC细胞是一类独特的免疫细胞,是先天免疫和适应性免疫之间的桥梁,主要发挥提呈传递抗原的作用[22-23]。DKD是由于机体内葡萄糖水平急剧升高而造成的肾脏损害,葡萄糖不能自由出入细胞,需要借助膜蛋白进行转运,GLUT-1是位于肾小球系膜上的一种葡萄糖转运蛋白,能够调控细胞内葡萄糖的代谢以及葡萄糖的摄取[24-25]。因此,GLUT-1表达水平可用于评估DKD肾脏损伤程度。
在中医学范畴,DKD又称“消渴”“水肿”“虚劳”“关格”,中医认为肾虚是DKD的根本,血瘀是DKD的病机,肾虚血瘀贯穿DKD发展的始终[26]。中医学认为DKD属于本虚标实,其病位主要在肝肾,中医有肝肾同源之说,二者相互累及,但与其他脏腑也有密切的关系[27]。DKD疾病发展的各个阶段其证候各异,中医根据患者不同时期的症状表现进行辨证论治取得显著疗效。刘晶等[28]采用益肾固摄活血通络法治疗DKD,可改善患者蛋白尿,降低血糖水平。魏华娟等[29]运用通络解毒汤灌服DKD大鼠,结果表明DKD大鼠血肌酐、尿素氮和空腹血糖水平均下降。刘芳等[30]研究结果表明,养生益肾汤治疗DKD可显著降低甘油三酯、低密度胆固醇以及血清细胞因子等指标水平,改善肾功能。目前研究发现,雷公藤制剂能够治疗多种肾脏疾病,雷公藤所含的化学物中五环三萜羧酸能够治疗自身免疫性疾病[31-32]。雷公藤可以抑制炎症因子的分泌,避免氧化应激,从而发挥对肾脏、足细胞的保护作用[33]。雷公藤的提取物主要为雷公藤多苷、雷公藤甲素和雷公藤乙素。雷公藤及其提取物影响T淋巴细胞子集的比率、巨噬细胞引起的炎症反应、单核细胞分化成DC的免疫反应以及多种细胞因子的分泌[34]。艾丽曼等[35]研究结果表明,雷公藤多苷联合小剂量激素治疗特发性膜性肾病,能够降低尿微量白蛋白、血清肾损伤分子水平,改善肾功能。任凌燕等[36]研究发现,雷公藤甲素能够抑制TLR/NF-κB信号通路中相关因子的表达,使DKD小鼠模型足细胞损伤减轻,改善蛋白尿,发挥肾脏保护作用。杨朔等[37]研究显示,雷公藤乙素能够改善DKD大鼠肾脏损伤,降低炎症因子表达,下调肾组织p-p38MAPK蛋白表达。但是目前尚无雷公藤乙素通过减轻足细胞损伤来激活自噬活性以及改善免疫代谢功能的相关研究,故本研究对其进行探讨。本研究在高糖条件下培养足细胞,促使足细胞损伤,足细胞表面标志Podocin、Nephrin蛋白表达下降,雷公藤乙素干预后,其蛋白表达增强;高糖足细胞自噬指标LC3、mTOR蛋白表达也下降,p62蛋白表达增强,雷公藤乙素干预后,LC3、mTOR蛋白表达增强,p62蛋白表达下降。高糖足细胞会产生促炎症因子,IL-1α、IL-1β、TNF-α、IL-6 mRNA表达水平较正常对照组升高,雷公藤乙素干预后,各炎症因子mRNA表达下降,但是未接近正常水平。DKD组DC细胞表面标志HLA-DR MHCⅡCD86、CD54和T淋巴细胞CD3+、CD4+、CD8+的表达较正常对照组降低,雷公藤乙素可上调其表达。DKD组GLUT-1表达较正常对照组下降,表明雷公藤乙素可促进糖代谢,上调GLUT-1表达。
综上所述,雷公藤乙素能够减轻DKD足细胞损伤,激活自噬的活性,能够使DC有效激活T淋巴细胞,改善免疫功能,并能够调节糖代谢。

