清肺抗敏合剂下调RORγt及SOCS1/3表达改善哮喘小鼠炎症反应机制研究
刘 智,李巧慧,唐 菲,谢辉辉,杨 蕾
(衡水市人民医院,河北 衡水 053099)
哮喘患者多伴随慢性气道炎症和气道高反应性[1]。既往多数学者从Th17/Treg和Th1/Th2失衡方面进行了大量研究,并发现转录因子维甲酸孤儿核受体γt(Retinoic acid receptor-related orphan receptor γt,RORγt)及信号传导抑制因子1/3(Suppressor of cytokine signaling1/3,SOCS1/3)在哮喘中具有重要作用[2]。RORγ是维甲酸孤儿核受体(ROR)的成员之一,RORγt是RORγ在免疫细胞上特异性表达的亚型,调控人类Th17关键性的转录因子,而Th17与呼吸道合胞病毒(Respiratory syncytial virus,RSV)感染后哮喘有密切关系[3-4]。SOCS蛋白家族成员与炎症反应及自身免疫性疾病的发生发展具有密切关系,SOCS1和SOCS3是SOCS家族重要的成员,其对多种炎性因子的表达水平均有一定的抑制作用[5]。痰瘀互结是哮喘反复发作的主要病因[6]。清肺抗敏合剂以麻杏石甘汤为主方,由麻黄、杏仁、石膏、虎杖、桑白皮、柴胡、黄芩、败酱草、芦根、桔梗组成,具有抗炎及改善免疫功能的效果,且可以降低气道高反应性[7]。本研究通过诱发小鼠哮喘模型,研究清肺抗敏合剂对RORγt及SOCS1/3 mRNA的影响及对RSV诱发哮喘小鼠炎症反应的作用,进而探讨清肺抗敏合剂改善RSV诱发哮喘小鼠炎症反应的生物学机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:60只SPF级雄性BALA/c小鼠,体重18~20 g,购于上海西普尔-必凯实验有限公司,动物使用许可证号:SYKX(浙)2018-0099。
1.1.2 实验试剂:氢氧化铝(批号20200421,成都科龙);卵清蛋白(OVA,批号WXBD2568Z,美国Sigma);乙酰甲胆碱(Mch,批号SKZX37517,美国Sigma);免疫球蛋白E(IgE)、白介素-4(IL-4)、血小板内皮细胞黏附分子(CD31)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒和髓过氧化物酶(MPO)试剂盒(批号20200721、20200618、20200422、20200319、20200513,南京建成生物);兔抗SOCS1/3多克隆抗体(批号ab62632,美国Abcam);RORγt引物由上海市生物工程有限公司合成并提供。
1.1.3 实验仪器:动物肺功能仪(Flexivent型,德国Emka);显微镜(CKX41型,日本Olympus);多功能酶标仪(Spectra Max M4型,美国Molecular Devices);压缩空气式雾化器(SS-7B型,江苏双盛医疗器械有限公司)。
1.2 实验方法
1.2.1 清肺抗敏合剂制备:清肺抗敏合剂由浙江中医药大学中药制剂室制备。处方如下:麻黄3 g,杏仁、黄芩各5 g,石膏15 g,虎杖、败酱草各10 g,桑白皮、柴胡、芦根、桔梗各8 g;加水煎煮、抽滤、浓缩至1 g/ml,高温灭菌后备用。
1.2.2 分组:将60只小鼠适应性饲养3 d后随机分为对照组、模型组、地塞米松组(0.5 mg/kg)和清肺抗敏合剂低剂量组(17.5 mg/kg)、清肺抗敏合剂中剂量组(35.0 mg/kg)、清肺抗敏合剂高剂量组(70.0 mg/kg),每组10只。
1.2.3 哮喘模型小鼠的制备:于实验开始第1天,模型组和各给药组小鼠采用多点致敏法皮下注射2%OVA-氢氧化铝凝胶制备哮喘模型。致敏后第14天,各组分别腹腔注射0.2 ml的0.2% OVA,加强致敏7 d后,予1% OVA雾化激发,并进行灌胃给药,每日给药1次,连续14 d;于实验第21天和第35天以50 μl 1×106PFU的RSV滴入小鼠鼻腔;第35天检测肺功能后处死小鼠并取出肺组织。
1.3 观察指标
1.3.1 小鼠气道反应性检测:采用Emka动物肺功能仪对小鼠的基础肺功能进行检测。
1.3.2 肺组织病理学改变:末次给药后,将小鼠麻醉后取出左肺小叶,固定、包埋、切片后进行HE染色,观察肺组织病理学改变。
1.3.3 炎症因子及炎症细胞水平检测:末次给药并麻醉后,将小鼠右侧肺叶取出并结扎,用于制备肺泡灌洗液(BALF)。离心BALF并提取上清液,采用ELISA测定BALF中CD31、IgE、IL-4、TNF-α水平,采用比色法测定MPO含量。下层沉淀稀释后,采用瑞士-吉姆萨染色分类计数炎症细胞,包括中性粒细胞、淋巴细胞、嗜酸性粒细胞、巨噬细胞。
1.3.4 RT-PCR法检测肺组织RORγt mRNA表达水平:取肺组织100 mg,加入0.5 ml TRIzol后提取细胞总RNA。采用紫外分光光度计测量总mRNA的纯度和含量后,根据逆转录试剂盒逆转录合成cDNA,-20 ℃冻存,然后以此为模板进行PCR扩增。反应条件如下:95 ℃预变性3 min,94 ℃变性0.5 min,60 ℃退火0.5 min,72 ℃延伸0.5 min,循环30次,然后72 ℃延伸10 min。RORγt上游和下游引物序列分别为5’-CGCGGAGCAGACACACTTA-3’和5’-CCCTGGACCTCTGTTTTGGC-3’,片段长度167 bp;β-actin上游和下游引物序列分别为5’-CTCTTTGATGTCACGCACGATTTC-3’和5’-GTGGGCCGCCCTAGGCACCA-3’,片段长度540 bp。以β-actin为内参,比较RORγt和β-actin的相对吸光度值,同时对RORγt mRNA的表达水平进行半定量分析。采用2-ΔΔCt法对数据进行处理。
1.3.5 qPCR法测定肺组织SOCS1/3 mRNA表达水平:采用TRIzol试剂盒提取总mNRA,测定纯度和含量后进行qPCR扩增:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸40 s,循环40 s,进行40个循环,45~95 ℃末端延伸,温度升高0.1 ℃/s。引物序列见表1。

表1 目的基因引物序列
1.4 统计学方法 以SPSS 22.0统计学软件分析处理数据。计量资料以均数±标准差表示,比较采用重复测量数据的方差分析,两组间比较和多组间比较分别采用独立t检验和F检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组小鼠相对肺阻力比较 见表2。对照组小鼠吸入梯度浓度的Mch后气道阻力无显著变化,而模型组吸入梯度浓度的Mch后气道阻力与对照组比较显著增加(均P<0.05);地塞米松组及清肺抗敏合剂不同剂量组吸入梯度浓度的Mch后气道阻力与模型组比较显著降低(均P<0.05)。

表2 各组小鼠相对肺阻力比较(%)
2.2 各组小鼠肺组织病理学改变 HE染色结果显示(图1),不同剂量的清肺抗敏合剂处理后均可以改善小鼠肺组织的病理学损伤,对炎性细胞浸润具有明显的缓解作用。病理学评分结果显示,模型组HE评分显著高于对照组(P<0.05);地塞米松组和清肺抗敏合剂不同剂量组HE评分显著低于模型组(均P<0.05),且随着清肺抗敏合剂剂量的增加,HE评分降低。见表3。

表3 各组小鼠HE评分比较(分)
2.3 各组小鼠BALF中炎症细胞数量比较 见表4。与对照组比较,模型组小鼠中性粒细胞、淋巴细胞、嗜酸性粒细胞和巨噬细胞数量显著增加(均P<0.05);与模型组比较,地塞米松组及清肺抗敏合剂小鼠中性粒细胞、淋巴细胞、嗜酸性粒细胞和巨噬细胞数量显著降低(均P<0.05)。

表4 各组小鼠BALF中炎症细胞数量比较(×105/ml)
2.4 各组小鼠BALF中CD31、IgE、IL-4、MPO和TNF-α水平比较 见表5。与对照组比较,模型组小鼠BALF中CD31、IgE、IL-4、MPO和TNF-α水平显著增加(均P<0.05);与模型组比较,地塞米松组及清肺抗敏合剂不同剂量组小鼠BALF中CD31、IgE、IL-4、MPO和TNF-α水平显著降低(均P<0.05)。
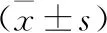
表5 各组小鼠BALF中CD31、IgE、IL-4、MPO和TNF-α水平比较
2.5 各组小鼠肺组织RORγt、SOCS1/3 mRNA表达水平比较 见表6。与对照组比较,模型组小鼠肺组织RORγt及SOCS1/3 mRNA表达水平显著增加(均P<0.05);地塞米松组及清肺抗敏合剂不同剂量组小鼠组织RORγt及SOCS1/3 mRNA表达水平显著低于模型组(均P<0.05)。
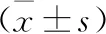
表6 各组小鼠肺组织RORγt、SOCS1/3 mRNA表达水平比较
3 讨 论
哮喘在中医学里属于“哮病”范畴[8]。清肺抗敏合剂主方为麻杏石甘汤[9-10]。麻杏石甘汤主药为麻黄、杏仁、石膏,解表清肺,宣肺降气;全方寒热并用,再配伍黄芩等药使得清肺平喘之功更甚[11-12]。此外,虎杖的有效单体白藜芦醇对RSV的RNA聚合酶有较好的抑制作用。全方具有补虚效果,进而改善免疫功能,使气道高反应性降低,且可以活血化瘀,消除气道的慢性炎症反应,进而发挥抗哮喘效果。支气管哮喘是一种气道慢性变态反应性炎症,以气道高反应性及气道炎症为主要临床特征[13]。哮喘反复发作的主要病理基础是气道慢性变应性炎症,其主要是以嗜酸性粒细胞为主,多种炎症介质和炎症细胞参与其中[14]。Th2细胞因子,如IL-4等,作为主要的促炎因子,可以促进IgE大量分泌,加剧气道的炎症反应[15]。
本研究采用BLAB/c小鼠为模型动物,既往研究显示其哮喘模型与人哮喘病理特征接近,且有相近的生物学特性[16-17]。本研究采用OVA致敏并激发哮喘,模型组小鼠表现出典型的气道高反应和气道炎症。建模成功与否的关键是气道高反应,测定肺功能气道阻力等参数是评判基础实验中气道高反应性的“金标准”[18]。本研究结果显示,模型组小鼠气道阻力显著高于对照组,且炎症因子水平明显提高,证实哮喘模型建立成功。本研究结果显示,不同剂量清肺抗敏合剂处理后均可以改善小鼠肺组织的病理学损伤,缓解炎性细胞浸润;清肺抗敏合剂不同剂量组小鼠肺组织病理半定量评分均显著低于模型组,且具有一定的剂量依赖性。与模型组比较,清肺抗敏合剂不同剂量组小鼠中性粒细胞、淋巴细胞、嗜酸性粒细胞和巨噬细胞数量均显著降低,CD31、IgE、IL-4、MPO和TNF-α水平均显著降低。既往研究显示,清肺抗敏合剂中柴胡具有治疗咳嗽变异性哮喘的作用。现代药理学研究显示,清肺抗敏合剂中柴胡可抗病毒、抗炎,提高免疫功能。柴胡提取物对NF-κB信号途径具有抑制作用,进而降低Th2/Th17细胞因子如IL-4、TNF-α、RORγ等的表达水平,减少炎症细胞的积聚,进而起到改善哮喘炎症反应的作用[19]。方中黄芩中多种活性成分如黄芩苷等具有抵抗RSV病毒感染的作用,进而改善炎症反应,减轻肺损伤。桑白皮的有效成分可以调控RSV肺炎小鼠PI3K/Akt信号通路与血清IFN-γ、IL-4的表达。
目前,Th17/Treg失衡学说在哮喘的发病机制中受到广泛关注。RORγt是由Th17分化而来的特异性转录因子,可以促进IL-17细胞因子表达和分泌,促进Th17细胞的分化,在免疫性疾病、感染性疾病及肿瘤等多种疾病的发生发展过程中都具有重要的参与作用[20]。RORγt可以通过诱导和促进外周和淋巴组织,促进Th0向Th17细胞的分化[21]。RORγt表达过量会增加IL-17的表达水平,而RORγt表达不足会降低IL-17的表达水平[22]。SOCS已被证实与多种炎性疾病有关,且在Th1/Th2失衡学说中有重要作用。SOCS1在Th1细胞中的表达水平显著高于Th2细胞,而SOCS3在Th1细胞中表达水平低于Th2细胞[23]。本研究结果显示,与模型组比较,清肺抗敏合剂组小鼠组织RORγt及SOCS1/3 mRNA表达水平均显著降低。方中败酱草和麻黄对气道炎症细胞浸润具有抑制作用;桔梗中总皂苷能改善RSV感染所致的小鼠肺部炎症反应;芦根水提取物具有治疗支气管哮喘功效,可以调节Th1/Th2免疫失衡,缓解气道慢性炎症[24]。
综上所述,清肺抗敏合剂可以通过下调RORγt及SOCS1/3 mRNA表达改善呼吸道合胞病毒诱发哮喘小鼠炎症反应。

