益气养阴通络方通过lncRNA UCA1靶向调控miR-485-5p抑制糖尿病肾病大鼠肾小管上皮细胞凋亡及炎症反应作用机制
宇汝翠,陆智慧,李金虎,张 雁
(1.中国科学技术大学附属第一医院 安徽省立医院中医科,安徽 合肥 230001;2.解放军联勤保障部队901医院,安徽 合肥 230071)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病患者的主要死亡原因之一,其发病率逐年上升,主要表现为尿液蛋白定性试验阳性、高血压和肾功能进行性损害[1-2]。DN的发病与代谢和血液在心血管系统中流动改变、体内氧化与抗氧化作用失衡、炎症等因素的相互调控有着密切联系,其中最关键的是基因诱导细胞死亡[3-4]。目前,该病的治疗手段主要包括控制血压、血糖、血脂水平,但并不能阻止其最终发展为终末期肾病[5]。因此,寻找DN有效的治疗靶点和方法十分重要。中医认为,DN是虚实夹杂之证,初期以阴虚燥热为主,日久则气阴两虚,后期可致阴阳俱损。DN的基本病机为气阴两虚,以阴虚为本,血瘀阻络等标实之邪贯穿其中[6-7]。故而调整阴阳、益气养阴、补脾益肾兼活血化瘀通络是DN的主要治法。长链非编码RNA(Long-chain non-coding RNA,lncRNA)是一类非编码RNA分子,其可参与调控DN的进展[8-9]。有研究发现,lncRNA MALAT可上调ELAVL1的表达,促进炎症因子的生成和释放,从而促进DN的焦亡[10]。尿路上皮癌相关分子1(Urothelial carcinoma associated 1,UCA1)是源于人内源性逆转录病毒家族的lncRNA分子,其广泛参与肿瘤、帕金森病、系统性红斑狼疮等疾病的进展[11-12]。但是,UCA1在DN中的作用尚不明确。因此,本研究探讨益气养阴通络方通过lncRNA UCA1靶向调控miR-485-5p抑制DN大鼠肾小管上皮细胞凋亡和炎症反应的作用机制,为DN的治疗提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:雄性Wistar大鼠50只,购自锐赛生物技术有限公司,体重180~220 g,在室温24 ℃、湿度60%的实验动物房内适应性喂养。将大鼠分为空白组、模型组和益气养阴通络方低、中、高剂量组,每组10只。空白组大鼠使用普通饲料喂养,其余组大鼠予高糖高脂饮食,于第8周分别予模型组和益气养阴通络方低、中、高剂量组大鼠一次性腹腔注射等量柠檬酸缓冲液和链脲佐菌素30 mg/kg,监测大鼠血糖和24 hUTP水平,24 hUTP>30 mg表示DN模型建立成功。
1.1.2 实验药物:益气养阴通络方由黄芪 20 g,党参 15 g,丹参、麦冬、五味子、天花粉、山药、南沙参、北沙参、地龙、生地黄、车前子、泽泻、山萸肉各10 g,三七粉(冲)3 g组成。以上药物加水煎煮,收汁,配制2 g/ml生药浓缩液。分别提取浓缩液32.4 ml(含生药64.8 g)、64.8 ml(含生药129.6 g)、129.6 ml(含生药259.2 g),然后再加蒸馏水至200 ml,搅拌均匀,分别灌胃益气养阴通络方低、中、高剂量组大鼠,空白组、模型组每天均灌胃等体积蒸馏水。干预期间大鼠自由进食、饮水。干预8周。
1.1.3 主要实验试剂与仪器:蒸馏水(批号201902237103SJ);柠檬酸缓冲液(批号20180403,上海索莱宝生物科技有限公司);链脲佐菌素(批号S0130,美国Sigma公司);全自动生化分析(型号7600-020,日立公司);ELISA试剂盒(批号20150301,武汉华美生物);离心机(型号6000i,德国Thermo公司);EP管(型号502-GRD-Q,Thermo QSP公司);裂解液(批号C1053,北京普利莱);双荧光染色试剂盒(批号0629A20,北京雷根生物);流式细胞仪(型号CytoFLEX,美国贝克曼库尔特);BCA试剂盒(批号20190325,江苏凯基生物);PCR仪(型号C1000Touch,美国Bio-Rad公司);电泳仪(型号1645050,美国Bio-Rad公司)。
1.2 实验方法
1.2.1 大鼠肾功能指标和炎症因子水平检测:大鼠摘眼球取血,全血静置40 min后,离心机4000 r/min离心10 min分离血清,全自动生化分析仪检测24 h尿蛋白(24 hUTP)、血清肌酐(SCr)水平。采用ELISA法检测大鼠血清白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)水平。血清在37 ℃条件下孵育,洗涤4次,然后加入标记物抗体,37 ℃反应30 min,避光显色后检测吸光值。
1.2.2 双荧光染色法检测细胞凋亡:提取大鼠肾小管上皮细胞,试剂盒检测细胞凋亡。收集高糖处理后48 h的细胞,消化、离心、收集沉淀移至EP管,将细胞重悬后分别加入5 μl异硫氰酸荧光素和10 μl碘化丙啶。避光染色15 min后,停止染色,并轻轻混合细胞,以防止高混合力引起的细胞碎片,荧光双染色流式细胞仪检测细胞凋亡率。
1.2.3 WB检测大鼠细胞NLRP3、Caspase-1蛋白表达:提取大鼠肾小管上皮细胞,提取总蛋白,2000 r/min离心3 min,收集沉淀;采用6孔板每孔加入裂解液裂解,再次离心20 min,根据BCA试剂盒测定总蛋白浓度,将各组总蛋白含量调整为30 μg/μl。取每组样品进行电泳、转膜,BSA封闭PVDF膜1 h,加入一抗,过夜后加入二抗,洗膜、显色、凝胶成像。
1.2.4 PCR检测大鼠细胞UCA1、miR-485-5p mRNA水平:提取大鼠肾小管上皮细胞,提取总RNA,然后将其逆转录为cDNA。以β-actin为内参,进行PCR检测,PCR扩增27个循环。用2-ΔΔCt法对目的基因进行定量分析。
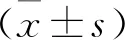
2 结 果
2.1 各组大鼠肾功能指标比较 见表1。与空白组比较,模型组和益气养阴通络方低、中、高剂量组24 hUTP、SCr水平较高(均P<0.05);与模型组比较,益气养阴通络方低、中、高剂量组24 hUTP、SCr水平明显降低,且呈剂量依赖性(均P<0.05)。
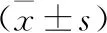
表1 各组大鼠肾功能指标比较
2.2 各组大鼠炎症因子水平比较 见表2。与空白组比较,模型组大鼠血清IL-1β、TNF-α水平较高(均P<0.05);与模型组比较,益气养阴通络方低、中、高剂量组大鼠血清IL-1β、TNF-α水平下降,且呈剂量依赖性(均P<0.05)。
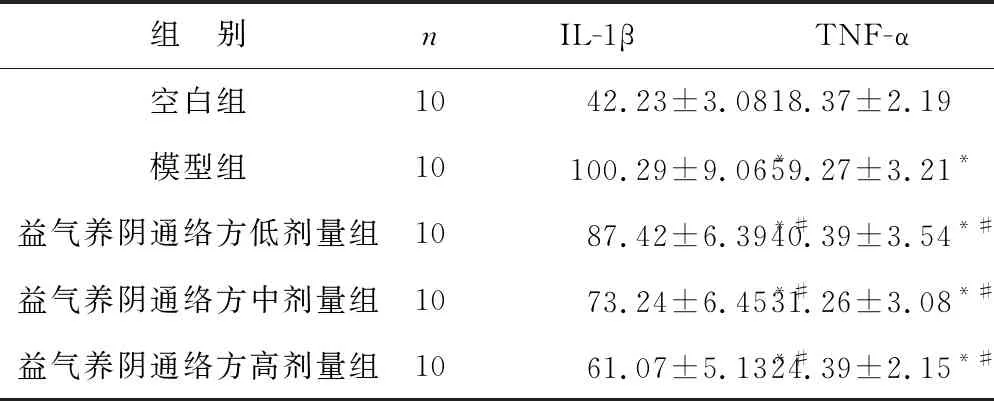
表2 各组大鼠炎症因子水平比较(ng/L)
2.3 各组大鼠肾小管上皮细胞凋亡率比较 见表3(图1)。与空白组比较,模型组凋亡率较高(P<0.05);与模型组比较,益气养阴通络方低、中、高剂量组大鼠肾小管上皮细胞凋亡率下降,且呈剂量依赖性(均P<0.05)。
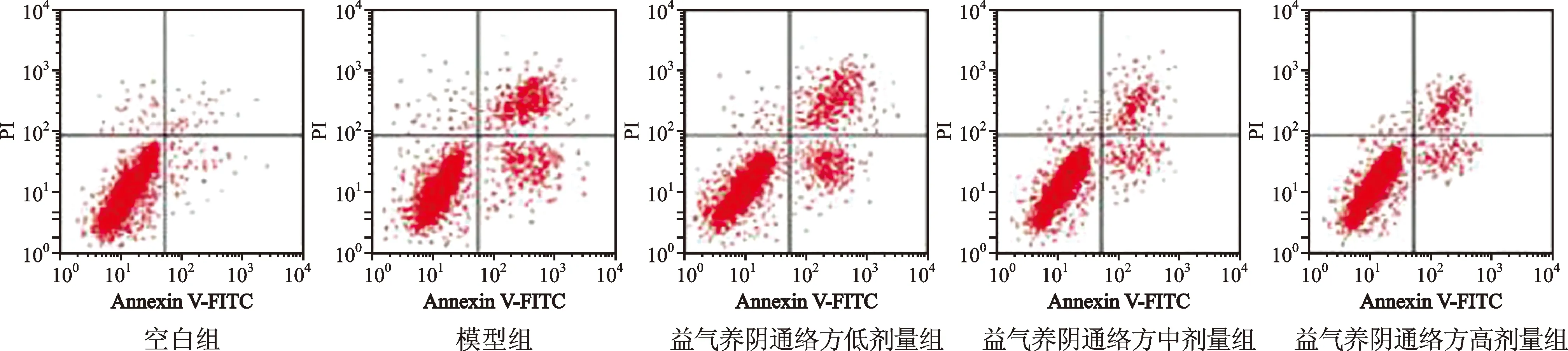
图1 各组大鼠肾小管上皮细胞凋亡率比较
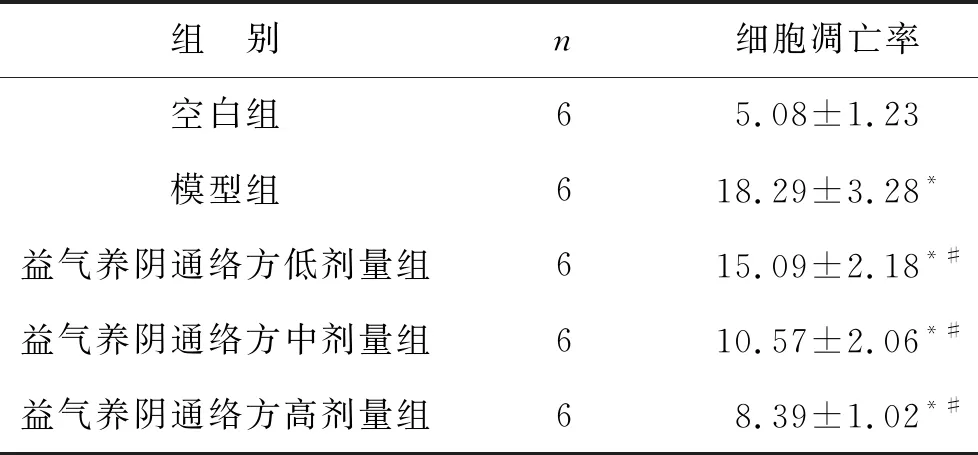
表3 各组大鼠肾小管上皮细胞凋亡率比较(%)
2.4 各组大鼠NLRP3、Caspase-1蛋白表达比较 见表4(图2)。与空白组比较,模型组大鼠NLRP3、Caspase-1蛋白表达水平较高(均P<0.05);与模型组比较,益气养阴通络方低、中、高剂量组大鼠NLRP3、Caspase-1蛋白表达水平降低,且呈剂量依赖性(均P<0.05)。
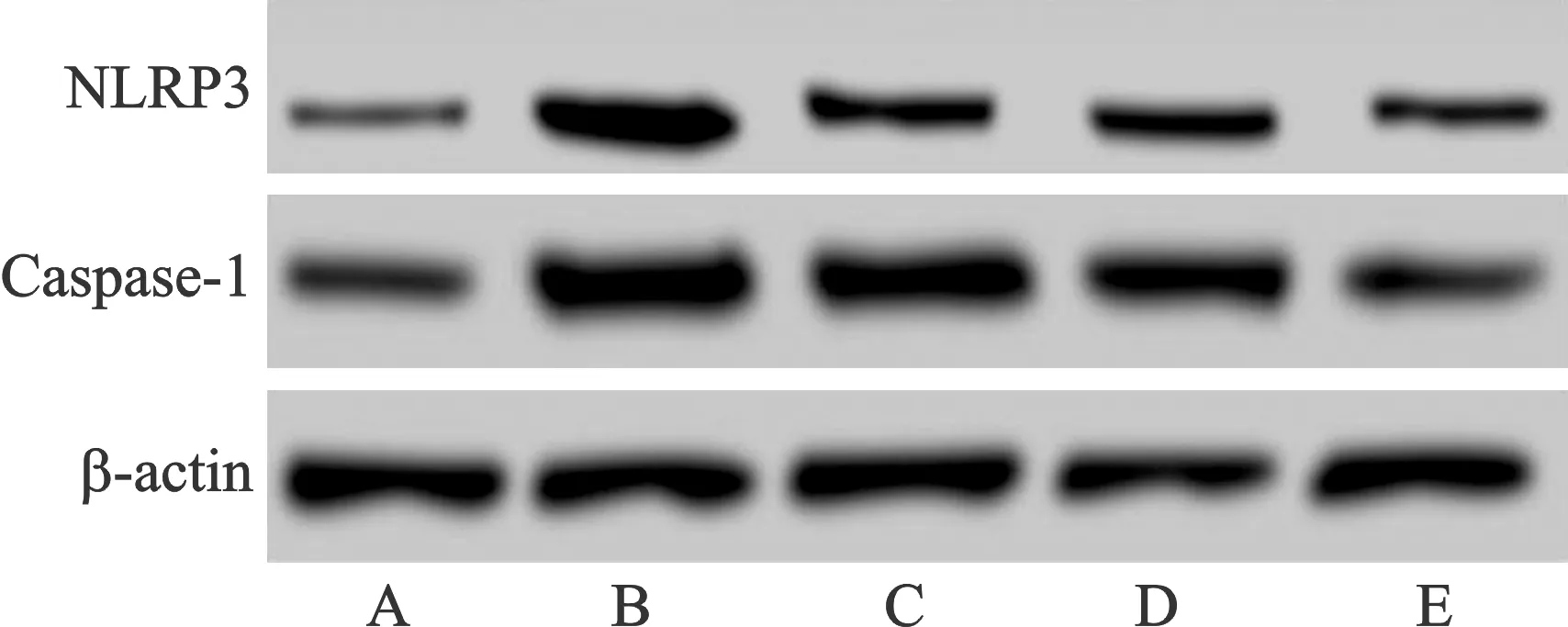
A:空白组;B:模型组;C:益气养阴通络方低剂量组;D:益气养阴通络方中剂量组;E:益气养阴通络方高剂量组
表4 各组大鼠NLRP3、Caspase-1蛋白表达比较
2.5 各组大鼠UCA1、miR-485-5p mRNA表达水平比较 见表5。与空白组比较,模型组UCA1 mRNA表达较低,miR-485-5p mRNA表达较高(均P<0.05);与模型组比较,益气养阴通络方低、中、高剂量组UCA1 mRNA表达升高,miR-485-5p mRNA表达降低,且呈剂量依赖性(均P<0.05)。
表5 各组大鼠UCA1、miR-485-5p mRNA表达水平比较
2.6 UCA1与miR-485-5p 的结合位点 UCA1是miR-485-5p的潜在靶基因之一。本实验构建了其结合位点的UCA1-3’ UTR-WT载体和UCA1-3’ UTR-MUT序列突变载体。UCA1-3’ UTR-NC、UCA1-3’ UTR-WT和UCA1-3’ UTR-MUT分别与miRNA negative control和miR-485-5p共转染肾小管细胞。与空载对照组比较,共转染miR-485-5p的细胞UCA1-3’UTR-WT相对荧光酶活性降低(P=0.001)。经证实,miR-485-5p特异性结合UCA1的3’UTR端,抑制UCA1的表达。见图3、4。
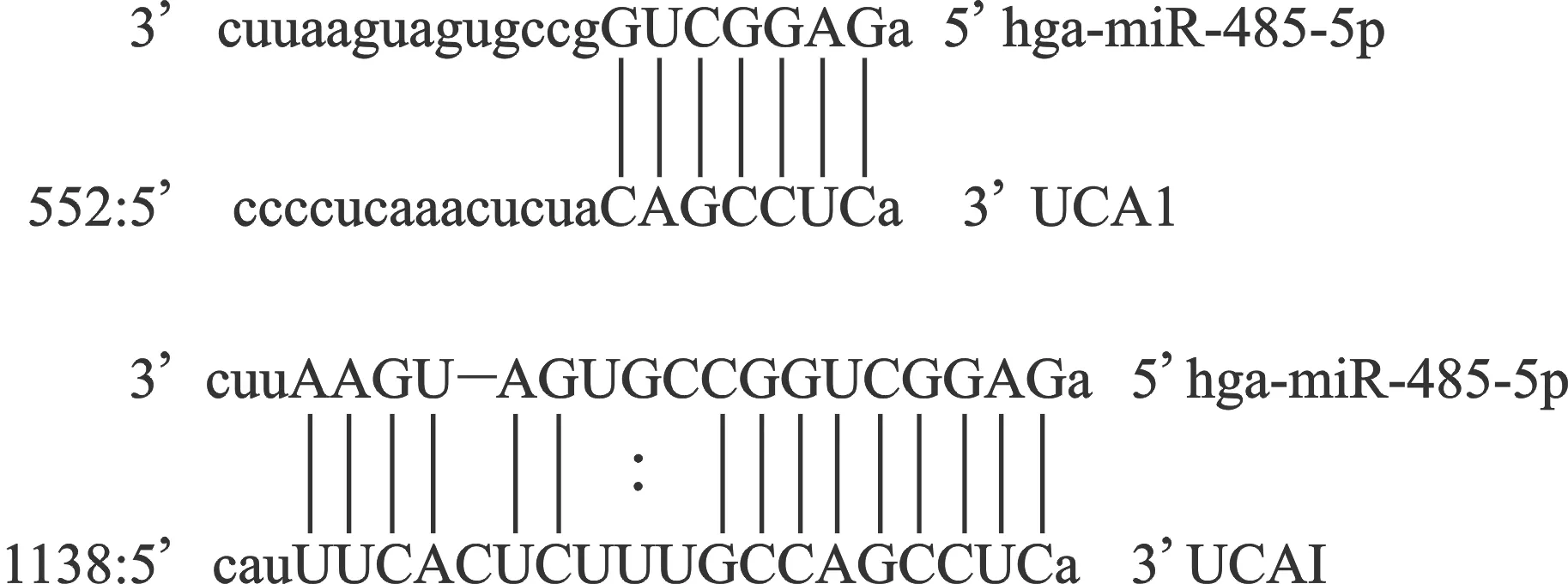
图3 UCA1与miR-485-5p 的结合位点
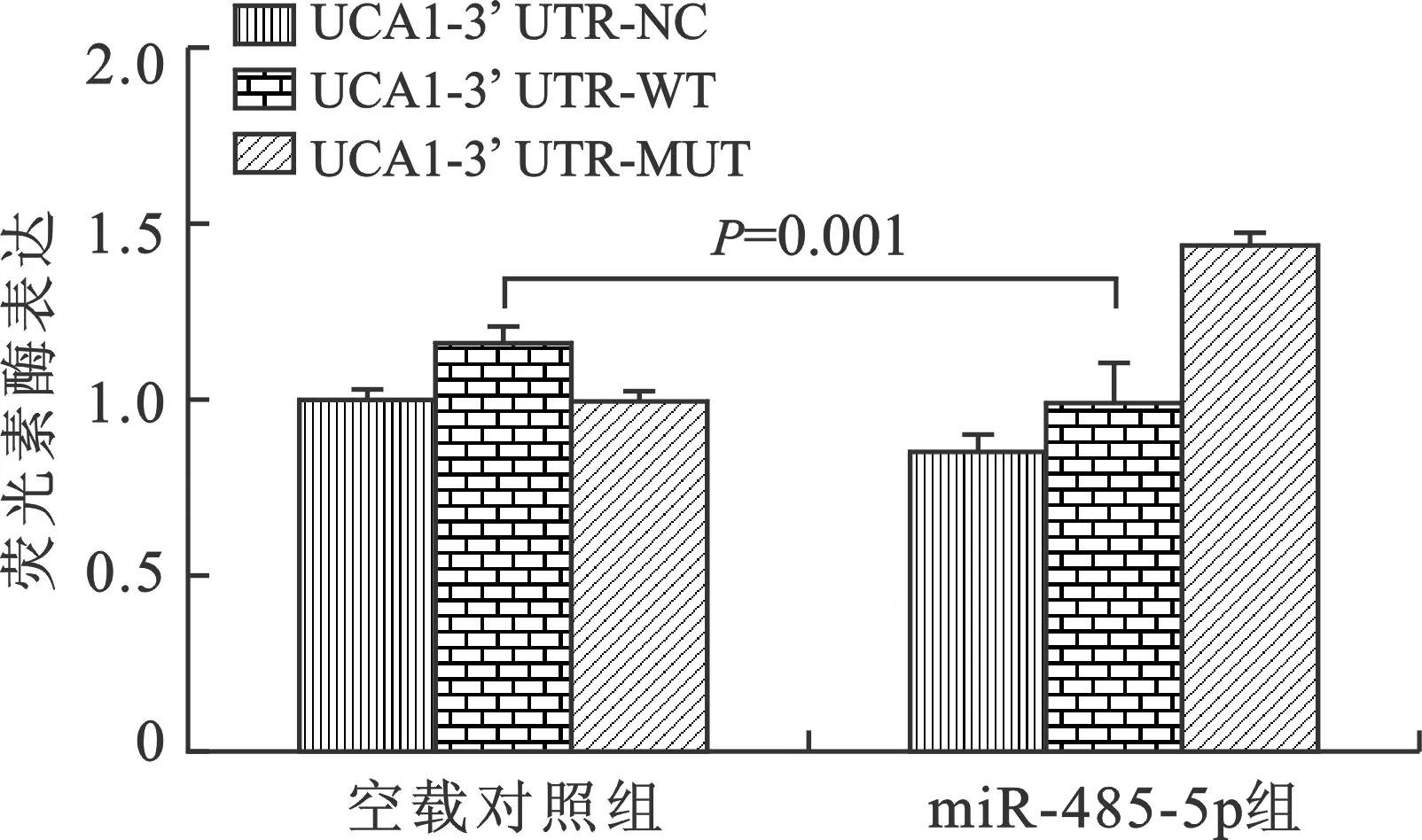
图4 UCA1与miR-485-5p双荧光素酶报告基因结果
3 讨 论
DN是糖尿病的常见并发症,也是终末期肾病最主要的原因[13-14]。有研究认为,DN患者肾小管上皮细胞转化为间质表型细胞、肾小囊脏层上皮细胞脱落并死亡与肾小囊脏层上皮细胞功能和形态学改变有关[15-16]。目前,DN的治疗方式西医主要以降糖、调脂为主,而中医药对于蛋白尿及临床症状的改善有一定优势,对于预防DN发病、减慢肾功能衰竭进程有着独特疗效[17]。中医根据DN临床表现,可将其归于“消渴”“水肿”“虚劳”等疾病范畴[18-19]。DN基本病机为气虚和阴虚[20]。有研究指出,益气养阴通络方治疗DN临床效果较佳,方中党参可以有效减轻炎症反应,抑制系膜细胞和基质的弥漫性增生,减少细胞周围由多种大分子组成的复杂网络的积聚,从而达到缓解DN病情的目的[21]。本研究采用益气养阴通络方干预DN大鼠模型,观察其对肾小管上皮细胞凋亡和炎症反应的作用机制。
本研究结果显示,益气养阴通络方可显著改善DN大鼠肾功能指标和炎症因子水平,且呈剂量依赖性。有研究显示,炎症反应可以刺激肾小管上皮细胞,使外周血液中的单核免疫细胞在肾脏积聚,促进疏松结缔组织的主要细胞增多,导致肾小球基质广泛聚集并伴有结构塌陷,加速DN发展[22-23]。本研究检测了各组大鼠肾小管上皮细胞凋亡率,结果显示,经不同剂量益气养阴通络方治疗后,DN大鼠肾小管上皮细胞凋亡率均有所降低,提示益气养阴通络方可能通过减少肾小管细胞尤其足细胞的凋亡,延缓DN的进展。在基因控制下细胞自主有序的死亡对DN的发生发展有重要意义,在高糖高脂状态下机体可产生许多危险因子。NLRP3炎症小体激活后,会使Caspase-1活化,而其会剪切IL-1β为成熟因子,诱导细胞膜损伤,从而启动细胞凋亡[24]。因此,本研究对各组大鼠肾小管细胞内NLRP3、Caspase-1蛋白表达进行检测,结果显示,治疗后,益气养阴通络方低、中、高剂量组NLRP3、Caspase-1蛋白表达水平降低,且随着剂量的增加而降低。以上研究结果进一步明确益气养阴通络方可以抑制肾小管上皮细胞凋亡和炎症反应。有研究表明,lncRNA UCA1的主要作用机制有遗传印迹、复合物介导以染色质上核小体变化为基本特征的生物学过程、基因降解调控等[25]。lncRNA UCA1最初在膀胱癌中发现,后续研究显示其在多种癌症中均高表达。miR-485-5p是一种抑癌基因,其与肿瘤细胞生物学行为关系密切。研究显示,miR-485-5p可以通过下调TPD52L2抑制胶质瘤细胞的生物学行为[26]。因此,本研究采用PCR检测UCA1 mRNA和miR-485-5p mRNA在肾小管细胞中的表达水平,结果显示,与模型组比较,治疗后益气养阴通络方低、中、高剂量组UCA1 mRNA表达和miR-485-5p mRNA表达均升高,且呈剂量依赖性。其次,本研究验证了UCA1与miR-485-5p存在结合位点,存在靶向调控关系,说明益气养阴通络方可以通过lncRNA UCA1调控miR-485-5p。
综上所述,益气养阴通络方可以通过lncRNA UCA1调控miR-485-5p表达抑制肾小管上皮细胞凋亡和炎症反应,从而发挥肾保护作用。

