利用氧化还原电势传感器测定加碘食盐中的碘含量
刘雯 丁伟

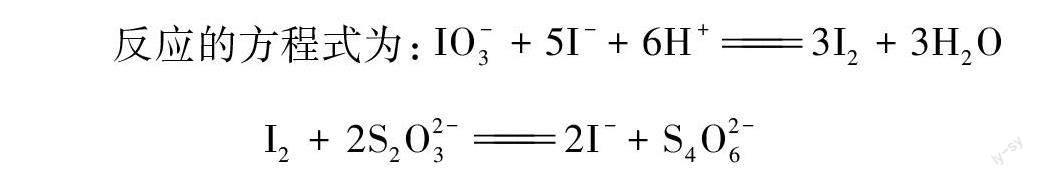
摘要: 基于碘量法原理,采用硫代硫酸鈉标准溶液测定被测物中碘元素的含量。借助氧化还原电势传感器和液滴数传感器获得滴定曲线图并确定滴定终点,从而测得加碘食盐中碘元素的含量。与传统实验相比,运用数字化实验数据进行表征使氧化还原滴定过程可视化,帮助学生深入理解氧化还原滴定的原理,提升学生的化学思维品质。
关键词: ORP传感器; 氧化还原滴定; 碘盐; 碘含量测定; 实验探究
文章编号: 10056629(2023)07006904
中图分类号: G633.8
文献标识码: B
1 问题提出
碘是人体必需的微量元素之一,它是人体合成甲状腺素的主要原料,对维持人体新陈代谢起着极为重要的作用。人体自身不能合成碘,需要从外界摄入,最常见的方法就是合理摄入加碘食盐。苏教版高中化学必修一教材将加碘食盐中碘元素的定性检验安排为课后兴趣实验。其原理是碘在加碘盐中以IO-3形式存在,在酸性条件下IO-3和I-发生反应,生成碘单质,利用淀粉溶液变蓝色将碘元素定性检验出来。
碘元素的定量测定有很重要的应用价值。食用盐中加入一定量的碘酸钾,是为了满足人体对碘的需要。但值得注意的是,人体摄入过多的碘也是有害的。《食品安全国家标准食用盐碘含量》(GB 26878—2011)[1]中规定了加碘食盐中碘含量的平均水平(以碘元素计)为20~30mg/kg。
数字化实验是信息技术发展和科学教育研究相结合的产物。与传统实验相比,数字化实验最大的特色就是借助传感器和信息处理终端进行实验数据的实时采集与分析,实现了人类感官的延伸[2]。本文运用氧化还原电势传感器手持技术展开加碘盐中碘元素含量测定的研究,作为对教材实验的扩展和补充。
2 实验设计
2.1 碘量法
碘量法[3]是以I2的氧化性和I-的还原性为基础的一种氧化还原方法,可分为直接碘量法和间接碘量法。
2.1.1 直接碘量法(碘滴定法)
当E<E(I2/I-),用I2标准溶液直接滴定还原剂(如Sn2+、 As2O3、 S2-、 SO2-3)的滴定方法称为直接碘量法,又称为碘滴定法。该反应原理为:
I2+Red2I-+Ox
该种方法滴定应在酸性或中性介质中进行,因为在碱性条件下I2易发生歧化反应:3I2+6OH-IO-3+5I-+3H2O。但是如果溶液的酸度过高,处于强酸性介质中,I-会发生氧化导致终点拖后。由于I2的氧化性不强,能被其氧化的物质不多,所以直接碘量法应用有限。
2.1.2 间接碘量法(滴定碘法)
直接碘量法只能够测定还原性的物质,而间接碘量法是利用I-的还原性间接测定氧化性物质(如MnO-4、 Cr2O2-7、 H2O2、 Cu2+等含量)的方法。该法是用Na2S2O3标准溶液滴定析出的I2,所以又称滴定碘法。该反应原理为:
2I-+OxI2+Red(析碘反应)
I2+2S2O2-32I-+S4O2-6(滴碘反应)
与直接碘量法类似,反应的酸度也需严格控制,必须在中性或弱酸性条件下进行。
2.2 实验原理
2.2.1 氧化还原电势(ORP)传感器工作原理
氧化还原电势(ORP)传感器能够测量溶液中氧化剂的氧化能力或还原剂的还原能力。ORP传感器有两个组件,其一是铂金属,浸在所测溶液中,另一组件为密封的银/氯化银凝胶(用作铂半电池的标准),测量时通过电压放大器呈现出电势差,从而确定该溶液氧化性或还原性的强弱[4]。
2.2.2 实验滴定原理
先在一定量食盐样品中加入过量醋酸酸化的碘化钾溶液,把碘酸钾中的碘元素还原为碘分子,再用硫代硫酸钠标准溶液滴定生成的碘分子即可。碘化钾可以防止碘的挥发,增大碘在水中的溶解度;稀醋酸则为硫代硫酸钠和碘反应提供弱酸性环境;最后用硫代硫酸钠标准溶液滴定处理好的样品溶液。
用硫代硫酸钠标准溶液滴定加碘盐样品溶液时,ORP电极测量的电势将迅速下降,形成“突跃”。通过滴数传感器可以得到反应终点时消耗的硫代硫酸钠标准溶液的体积,根据硫代硫酸钠标准溶液的浓度和体积,测得加碘盐中碘元素的含量。
反应的方程式为:IO-3+5I-+6H+3I2+3H2O
I2+2S2O2-32I-+S4O2-6
2.2.3 传统滴定方法
传统的滴定方法是用标准液硫代硫酸钠溶液滴定待测液中的碘单质,选择淀粉溶液为指示剂,当待测液恰好由蓝色变为无色,且充分振荡溶液不变色时即到达滴定终点,此时准确记录消耗的标准液体积。滴定实验的关键,一是正确判断滴定的终点;二是准确测定液体的体积。传统方法存在如下问题:(1)用肉眼判断滴定终点和读取液体的体积均存在一定误差;(2)应在临近终点时加入淀粉指示剂,滴定至溶液蓝色消失为终点[5]。如果淀粉指示剂加入过早,溶液中大量的碘分子被淀粉表面牢固地吸附着,会出现终点迟钝现象而产生滴定误差。
2.2.4 氧化还原电位滴定
本实验用氧化还原电势(ORP)传感器,在氧化还原电位滴定中,随着氧化剂的加入,物质氧化态和还原态的浓度逐渐改变,有关电对的电位也随着不断改变,其变化情况可以用滴定曲线表示[6]。当硫代硫酸钠溶液滴定生成的碘分子时,当两者恰好完全反应时,ORP传感器测得的电势将迅速增加,此时电势的变化最大。我们可以根据氧化还原滴定曲线,通过数据处理,计算碘分子的物质的量,进而计算样品中碘元素的质量分数。
3 实验过程
3.1 实验仪器及药品
仪器:电子天平、25.00mL滴管、烧杯、ORP传感器、滴数传感器、磁力搅拌器、数据采集器(VENIER LabPro)、计算机及其相配套软件LoggerPro3
药品:加碘盐样品、0.0100mol/L硫代硫酸鈉标准溶液、除氧蒸馏水
3.2 实验步骤及数据处理
3.2.1 待测样品处理
(1)电子天平称取10.00g加碘食盐样品,用除氧蒸馏水50mL溶解。
(2)再加10%稀醋酸10mL酸化,最后加碘化钾0.5g,搅拌使其充分反应,待测。
3.2.2 氧化还原电势传感器滴定
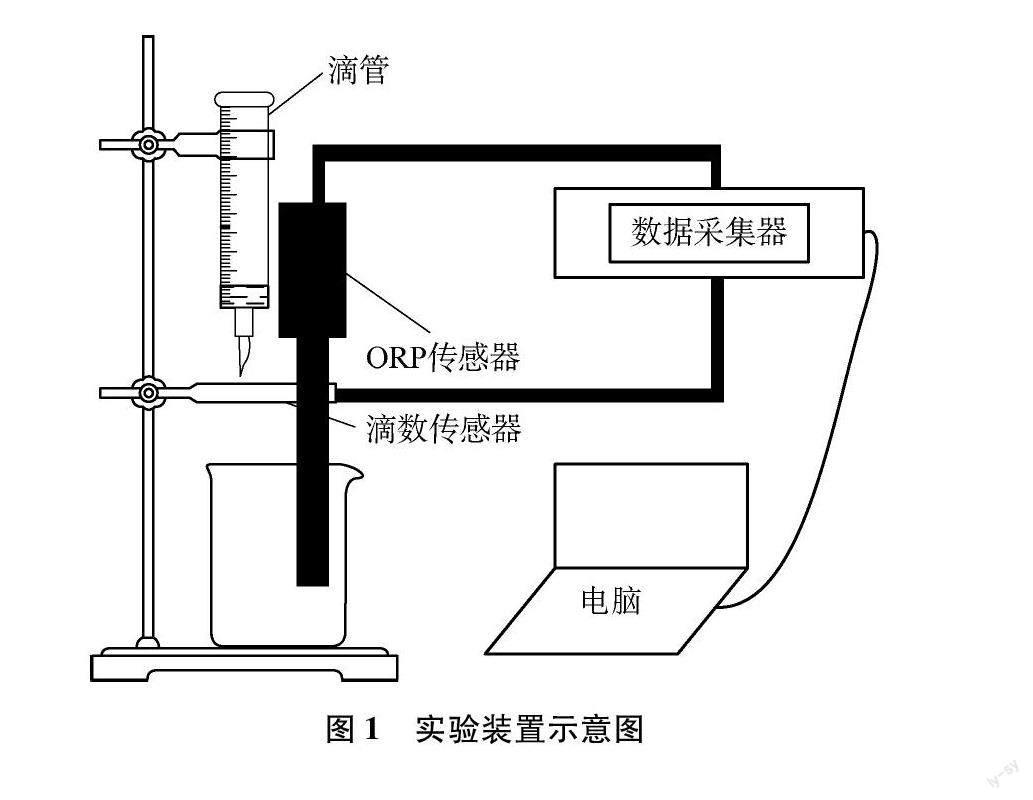
(1) 实验装置如图1所示,将ORP传感器、滴数传感器分别与数据采集器相连,数据采集器再与计算机相连,之后将磁力搅拌器、小烧杯、ORP传感器、滴管依次放好,打开LoggerPro3(软件)。
(2) 先用硫代硫酸钠标准溶液润洗滴管,装液25.00mL,排气泡。再将上述酸化的待测样品溶液置于小烧杯中,准备滴定。
(3) 打开软件中数据采集功能,为使反应物混合均匀,采用磁力搅拌器搅拌溶液。
(4) 打开滴液器开关,缓慢打开滴管活塞,让硫代硫酸钠标准溶液逐滴滴入烧杯中,数据采集器自动记录数据,并自动绘制滴定曲线。
(5) 重复三次实验,完成实验数据记录(如表1所示)。
4 实验结果与讨论
4.1 实验结果
硫代硫酸钠溶液滴定生成的碘单质溶液过程中ORP传感器测量溶液的电势随硫代硫酸钠溶液体积增加的曲线图如图2(a)所示,利用软件所带的程序对图2(a)中的曲线进行求导,得到一次导数曲线如图2(b)所示。
因此,由计算得知10.00g样品中碘元素的含量为0.243mg/kg,与食盐包装袋所示含量(18~33mg/kg)相符合。
4.2 实验创新点
(1) 滴定分析中的定量计算是高中化学教学的重难点之一。中学化学教材所涉及的滴定实验仅限于酸碱中和滴定,而氧化还原滴定也是一种重要的滴定方法,可以作为对酸碱中和滴定的深化和拓展。此外,中学化学教材中只有对加碘食盐中碘元素的定性检验而缺少定量测定。笔者基于此内容设计了该实验,帮助学生学习氧化还原滴定的原理和方法,以弥补教材实验内容的不足。
(2) 在氧化还原滴定的定量测定中,利用ORP传感器测量电势变化,可以不需要指示剂就能精确测量出氧化还原反应恰好进行完全的等量点,消除指示剂颜色变化带来的误差,使氧化还原滴定的实验结果更准确[7](见表2)。与滴数传感器结合使用,精准记录滴加标准溶液的体积,同时利用自带软件生成图像并处理数据,更准确地得到所消耗标准溶液的体积。
(3) 在教学过程中,可以用四重表征(宏观表征、微观表征、符号表征、曲线表征)来加深对氧化还原滴定的理解(见表3)。滴定过程中溶液由蓝色变为无色这一宏观表征与曲线中的“突跃”这一现象的完美结合,既有效消除了由淀粉溶液作指示剂带来的误差问题,同时也使氧化还原滴定可视化,加深学生对“突跃”的理解[8]。数字化实验能够极大地激发学生求知的欲望,进一步培养学生的思维能力,培养学生的实验创新能力,使其更深入地思考和分析物质的定性检验与定量测定,对学科知识的理解得到升华。
4.3 误差分析
4.3.1 介质的选择
间接碘量法的滴定应在中性或弱酸性溶液中进行。因为在碱性溶液中会发生如下副反应:
S2O2-3+4I2+10OH-2SO2-4+8I-+5H2O
3I2+6OH-IO-3+5I-+3H2O
在强酸性溶液中,S2O2-3容易分解,I-也容易被空气中的O2缓慢氧化,发生的反应如下:
S2O2-3+2H+S↓+SO2↑+H2O
4I-+O2+4H+2I2+2H2O
4.3.2 I2易挥发
I2易挥发,可能是造成误差的原因。因此为了防止碘挥发,可采取如下措施:①过量加入KI溶液助溶,防止挥发,提高速率;②溶液温度不宜高;③在碘量瓶中进行反应,快滴慢摇。
4.3.3 I-具有强还原性
I-具有强还原性,可能是造成误差的原因。在酸性条件下易被空气中的O2氧化,为此可采取下列措施:①暗处放置避免强光;②除去催化性杂质(NO、 NO2、 Cu2+);③控制溶液酸度;④密塞放置;⑤I2完全析出后立即滴定。
5 结语
和传统实验相比,运用手持技术数字化实验进行表征使氧化还原滴定过程可视化,使定量实验设计便捷、测定结果更准确,提升学生的实验创新能力。在实际教学中,氧化还原电势传感器不仅可以测定加碘盐中碘元素的含量,还可应用于其他氧化还原滴定教学中。
参考文献:
[1]中华人民共和国卫生部制定. 食品安全国家标准. 食用盐碘含量: GB 26878—2011[S]. 北京: 中国标准出版社, 2011.
[2]项佳敏, 钱华, 马宏佳等. 信息技术与化学学科教学深度融合的案例研究——以数字化实验为例[J]. 化学教学, 2020, (9): 21~27.
[3]周公度主编. 化学辞典[M]. 北京: 化学工业出版社, 2004: 108~109.
[4]朱成东, 戈益超. 利用氧化还原电势(ORP)传感器定量测定亚硫酸钠含量创新实验[J]. 安徽教育科研, 2021, (12): 98~99.
[5]孟静. “食盐中碘元素含量测定的实验探究”的教学设计与反思[J]. 上海课程教学研究, 2017, (2): 50~52, 65.
[6]倪霞. 运用手持技术测定果蔬中维生素C含量的研究性学习[J]. 教育与装备研究, 2019, 35(7): 77~79.
[7]乔金锁, 刘延华, 白燕燕. 碘盐在模拟烹调过程中碘损失的实验探究[J]. 化学教学, 2016, (9): 54~56.
[8]刁卓, 钱扬义, 王立新, 唐文秀. 发展学生“宏观辨识与微观探析”素养的数字化实验设计[J]. 化学教学, 2022, (5): 62~64.

