聚多巴胺功能化大肠杆菌生物电催化剂的构建及其氧还原性能
白正宇,邢宝凤,牛洋娣
(河南师范大学 化学化工学院,河南 新乡 453007)
随着化石能源造成的环境污染问题日益严重,探索和开发可再生及环境友好的新型替代能源技术成为研究领域的热点[1-2].微生物燃料电池(MFC)作为一种绿色可持续的新兴生物电化学技术而备受关注[3-5],其利用微生物细胞呼吸过程中复杂的氧化还原反应将化学能直接转换为电能,在污水处理、生物修复和清洁电能生产方面展现了巨大的潜力[6-7].氧还原反应(ORR)是发生在MFC阴极上的主要反应[8].因此,研发高效率和低成本的ORR电催化剂是促进MFC进一步发展的关键.生物电催化剂具有绿色、高效和可再生的生物学特性,利用生物系统材料来催化MFC阴极上发生的氧还原反应对于可持续能源发展具有重要意义[9-11].分离的氧化还原酶和电活性微生物细胞是两种最常见和应用最广泛的生物电催化剂.相对于氧化还原酶的易失活和易脆性,微生物细胞具有自我复制和自我修复的特性,增强了生物催化平台的运行稳定性[9].然而,电活性微生物自身的细胞膜导电性较差,这将导致微生物细胞之间的跨细胞膜界面以及微生物与电极之间的生物/非生物界面细胞外电子转移(EET)速率缓慢,限制了微生物细胞的生物电催化活性和产电效率[12-15].
对微生物细胞进行导电纳米修饰,不仅能对细胞提供保护作用,增强其耐受性和稳定性,而且能提升它们的本征催化活性和导电性[16-17],从而提高生物电催化ORR能力和MFC的整体性能.在微生物细胞表面涂覆多功能导电纳米材料,可以改善活细胞的代谢或增强其对恶劣环境的抵抗力[18-19].含有共轭双键和离域π轨道的导电聚合物作为生物电极和生物系统之间的中介材料,可以与生物系统发生密切的相互作用,并且能增强细胞的稳定性,如在细胞表面原位合成的聚吡咯(PPy)“导电细胞壁”可以有效地加速EET,而不损害生物催化活性或产电效率,因此,MFC的电流或发电量可以大大增强.然而,一个被忽视的问题是,PPy的疏水性导致电活性细菌黏附性降低,增加了生物膜形成的难度.具有黏附性的导电纳米材料可以直接影响内部细胞和外部环境之间的质量和能量交流,不仅能够作为连接相邻细胞的电子桥梁,同时赋予其良好的附着力,使功能化后的细胞密集附着在电极表面[20].研究表明,多巴胺前体在电极表面沉积为多功能和强黏附膜的独特特征是由于其分子结构中存在儿茶酚和胺基.聚多巴胺(PDA)和不同种类的生物分子之间的相互作用,如氢键、疏水相互作用和芳香-阳离子相互作用,已被用于促进各种物质的黏附,如蛋白质、核苷酸、低聚糖和脂类.另外,PDA具有丰富的官能团,例如氨基、酚羟基等亲水基团,可以提高底物的亲水性.PDA还具有大量的醌基,是氧化还原活性功能配体,进一步适用于加速细胞外呼吸过程中的电子转移,改善细胞与电极之间的界面电子转移[21-22].此外,PDA具有优异的生物相容性,良好的黏附力,可以保护微生物细胞的生存能力[23].
本文通过在单个大肠杆菌表面原位聚合得到PDA功能性涂层(E.colicell@PDA),可以改善生物/无机界面的电子转移,并对其生物电催化能力进行评估.PDA功能性涂层的成功制备在不降低细菌细胞活力的情况下提高细菌细胞的导电性,EET效率显著提高.电化学测试结果显示,PDA功能性涂层可以提高大肠杆菌的ORR电催化活性,E.colicell@PDA在MFC中作为生物阴极,氧还原电流密度明显提高,由天然大肠杆菌(nativeE.colicell)的2.13 mA·cm-2增加到2.62 mA·cm-2,最大输出功率密度达到95.3 μW·cm-2,为功能化生物电催化剂的构建及性能调控提供了一种有效策略.
1 实验部分
1.1 细菌培养
大肠杆菌在LB培养基(10.0 g·L-1胰蛋白胨、10.0 g·L-1NaCl、5.0 g·L-1酵母粉)中,在37 ℃的摇床(200 r·min-1)上复苏7~8 h,再经过扩大培养7 h左右到达生长平台期,通过离心(4 000 r·min-1,4 min)收集细菌沉淀以供进一步使用.
PDA涂层包覆大肠杆菌的过程:将收集到的细菌沉淀悬浮于10 mL Tris-HCl缓冲溶液(pH=8.5)中,加入10.0 mg的盐酸多巴胺,在摇床上振荡4 h(37 ℃,200 r·min-1),离心(6 000 r·min-1,4 min)获得E.colicell@PDA的细菌沉淀.
1.2 生物电极的构建
将依次通过丙酮、无水乙醇和混酸(V(浓硫酸)∶V(浓硝酸)=3∶1)超声处理、洗至中性并干燥过的碳布(2 cm×2 cm)放入被PDA包覆的大肠杆菌的LB培养基悬浮液中,在摇床上(37 ℃,200 r·min-1)摇36 h左右,使细菌牢固地附着在碳布上.为了进行比较,天然大肠杆菌的电极也按照同样的步骤制备.
1.3 材料表征
细菌悬浮液用超纯水洗涤3次,接着在戊二醛中固定8 h左右,离心,再用超纯水洗涤3次,然后依次用不同体积浓度的乙醇(体积分数分别为30%、50%、70%、85%、90%、100%)梯度洗脱,每个体积浓度洗脱3次,每次持续10 min.利用SU8010扫描电子显微镜(SEM)观察制备的生物电催化剂的表面形貌,JEM-2100高分辨透射电子显微镜(TEM)观察生物电催化剂的内部结构.利用LabRAM HR Evolution高分辨拉曼光谱仪和NEXUS红外光谱仪进行结构测试,利用P200/P200+紫外可见分光光度计对物质的组成进行测定和分析.
1.4 细菌活力测试
使用LIVE/DEAD染色细菌活力试剂盒对细胞活力进行检测.按照产品说明书配制染色工作液(V(NucGreen)∶V(EthD-Ⅲ)=1∶2),将细菌悬液稀释到合适的体积浓度,取1 mL细菌悬液,加入10 μL的染色工作液,充分混合,室温避光孵育15 min,之后取10 μL细菌悬液滴在带有盖玻片的载玻片上,使用FV1200MOE激光共聚焦显微镜进行拍照.
1.5 微生物燃料电池的组成
采用双室MFC(内腔容积50 mL),由质子交换膜Nafion117膜隔开,阳极为40%Pt/C|CC,阴极为E.colicell@PDA|CC或nativeE.colicell|CC.阳极室中加入含1 mol·L-1葡萄糖的10×PBS缓冲溶液(7.518 0 g Na2HPO4·12H2O,1.496 0 g KH2PO4,2.480 0 g NaCl,0.060 0 g MgSO4,0.005 6 g CaCl2),通入氮气,阴极室中加入含4 g·L-1葡萄糖的10×PBS缓冲溶液,2 mL的LB培养基和适量菌液,通入氧气.MFC的外电阻均为1 000 Ω,均在37 ℃下操作.每次测试都要准备3个独立的MFC.
阳极的制备过程为:称取0.004 6 g的40%(质量分数)铂碳分散于2 mL异丙醇中,超声混匀,接着加入293 μL Nafion溶液继续超声均匀.用微量注射器分多次移取上述400 μL分散液涂至预先处理好的碳布上,在室温下晾干即可.
1.6 电化学测试
使用上海辰华CHI760E电化学工作站,37 ℃下采用标准三电极体系(对电极为铂片电极,参比电极为银/氯化银电极,工作电极为负载细菌的碳布电极),在氧气或氮气饱和的M9溶液中进行ORR电化学测试.循环伏安法(CV)和线性扫描伏安法(LSV)均在-0.6~0.3 V电压之间进行测试.
电极的制备过程为:将天然的大肠杆菌或PDA包覆的大肠杆菌悬浮于50 mL的LB培养基中,加入预先处理好的碳布,置于摇床(37 ℃,200 r·min-1)中振荡36 h,此时细菌已经附着碳布上,将碳布取出,室温下晾干,即为所制备的工作电极.
2 结果与讨论
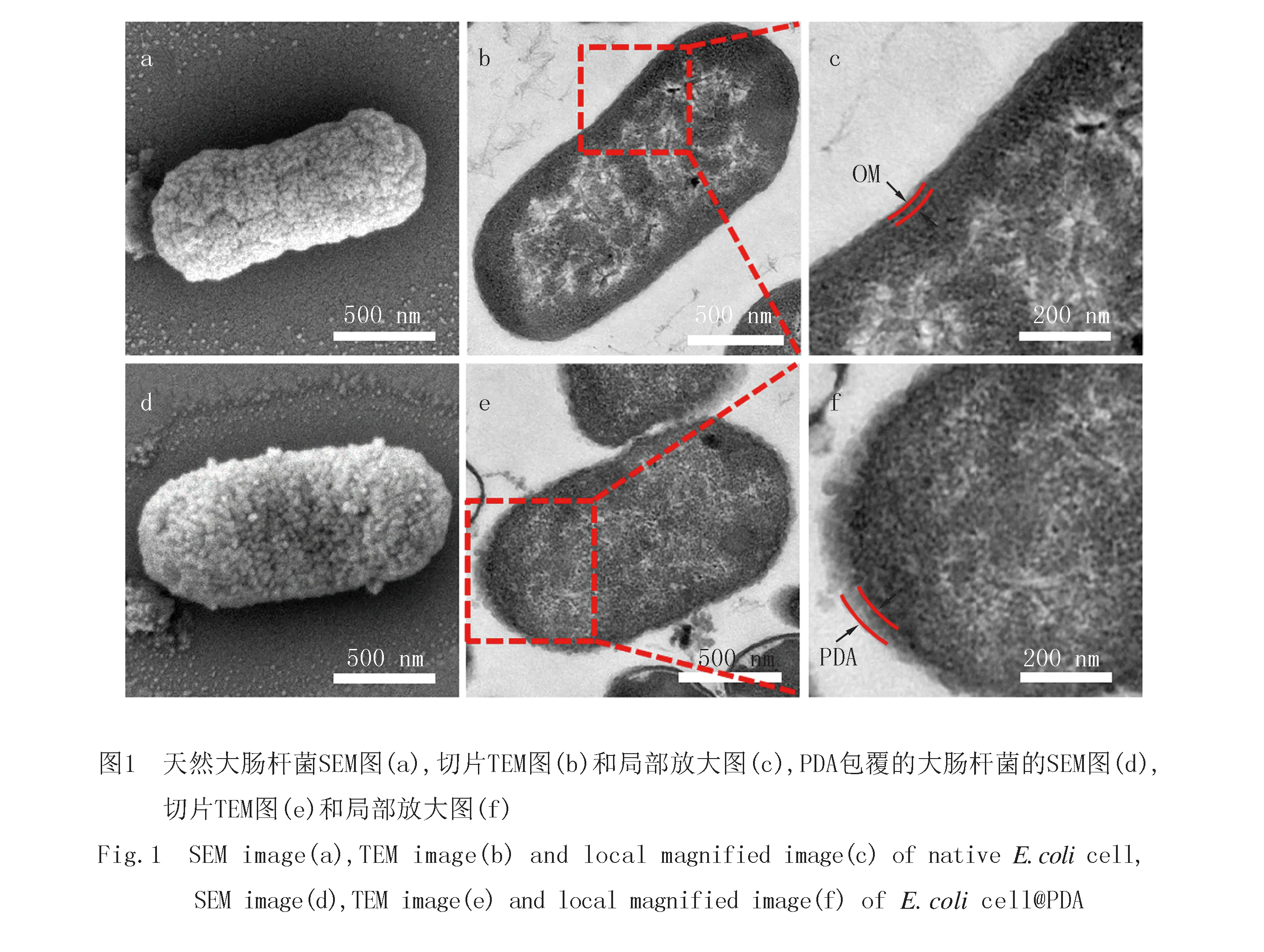
PDA功能性涂层是在单个细菌表面通过多巴胺单体原位氧化聚合得到,经过优化聚合时间,在大肠杆菌表面形成均匀的PDA纳米壳层.通过扫描电子显微镜和超薄切片的透射电子显微镜测试可以观察到PDA纳米涂层包覆前后的细菌表面的形态变化(如图1所示).从扫描电子显微镜(SEM)图(图1a)可以看出,天然的大肠杆菌细胞由于脱水表面出现褶皱,但整体表面相对光滑.而经过PDA功能涂层包覆的大肠杆菌细胞更加圆润(图1d),这归因于PDA涂层对细胞的保护作用,此外,可以明显看到包覆后细胞表面比较粗糙,布满了纳米颗粒.通过切片的透射电子显微镜(TEM)图(图1b)和切片TEM图的局部放大图(图1c)可观察到大肠杆菌细胞表面相对光滑,细胞的内膜和外膜可以清晰看到。由PDA功能涂层包覆后的大肠杆菌细胞切片的透射电子显微镜(TEM)图(图1e)和其局部放大图(图1f)可清晰地看到,PDA纳米颗粒与细菌细胞外膜紧密连接并均匀包裹在细胞膜上,证明了在大肠杆菌细胞表面成功形成了PDA纳米颗粒.另外,PDA纳米颗粒具有丰富的活性官能团,易与材料表面共价交联,有希望连接细菌的电子导管,可以改善生物/电极界面间的电子转移[24].
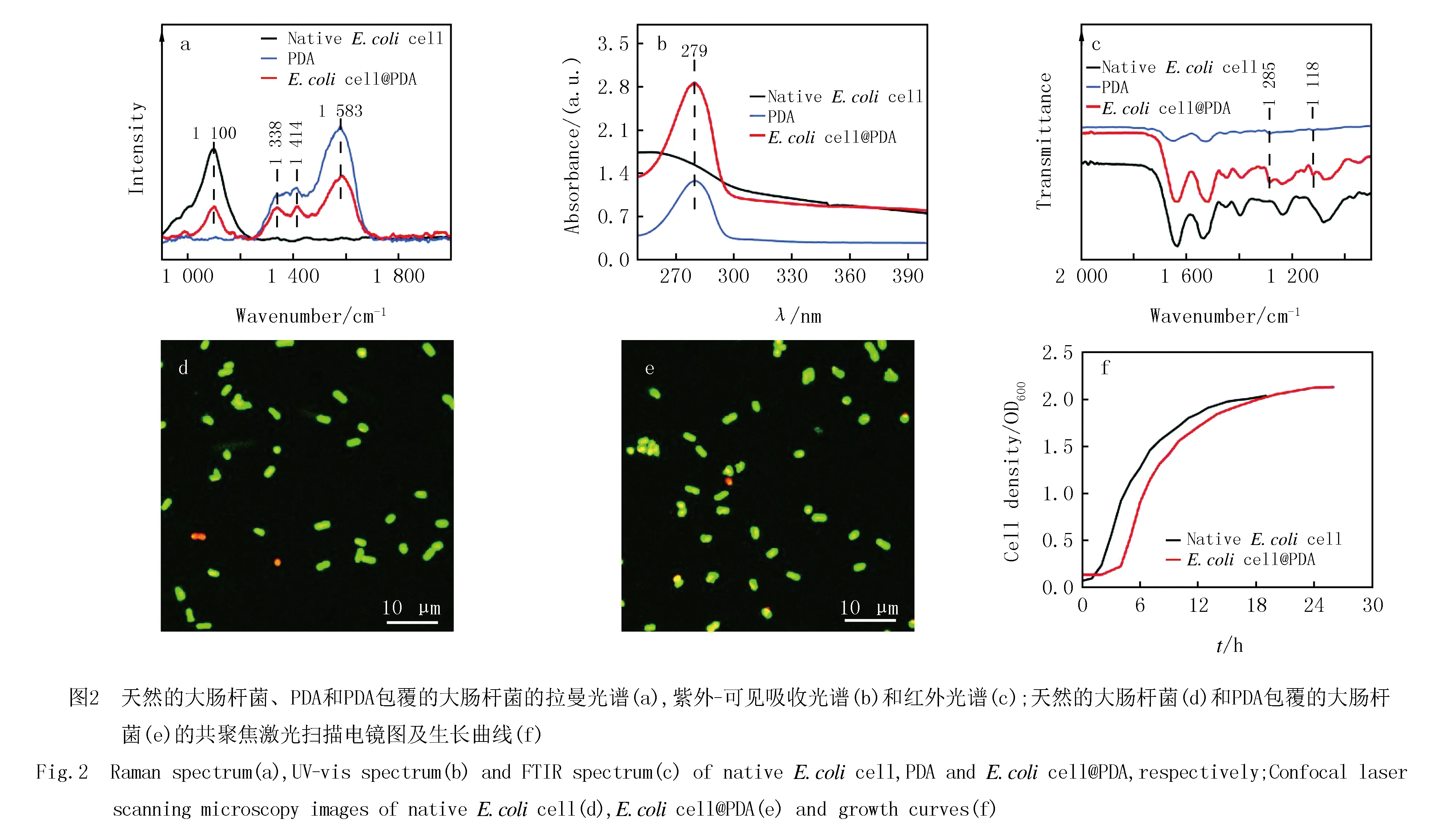
为进一步确定细菌表面形成的聚合物涂层的组成结构,对其进行了光谱分析.首先利用拉曼光谱(图2a)分析PDA涂层的分子结构,在单纯的PDA聚合物的拉曼光谱中,1 338 cm-1和1 414 cm-1的吸收峰归属于C=O键的特征峰,1 583 cm-1的吸收峰归属于芳烃C=C键的特征峰[25],这些特征峰在PDA包覆的大肠杆菌细胞(E.colicell@PDA)的拉曼光谱中均存在,而在天然的大肠杆菌细胞(NativeE.colicell)的拉曼光谱中未观察到PDA的特征峰,同时,在1 100 cm-1处的特征峰是大肠杆菌自身的特征峰,这些结果表明PDA聚合物成功包覆在大肠杆菌细胞表面.另外,由UV-vis光谱(图2b)可看出大肠杆菌自身没有明显的吸收峰,而合成的纯PDA纳米颗粒与PDA包覆的大肠杆菌都有一个强烈的吸收峰(279 nm)该吸收峰归因于PDA的特征峰,证实了PDA涂层在大肠杆菌细胞上的存在.通过傅里叶变换红外光谱(图2c)对形成的聚合物涂层做进一步的分析,在1 118 cm-1和1 285 cm-1处的吸收峰归因于PDA的C-O键的伸缩振动[26-27],这些吸收峰在天然的大肠杆菌中均未发现,这些结果都证明了PDA成功地包覆在大肠杆菌表面.
为了探讨PDA纳米涂层对细菌细胞生存活力的影响,通过LIVE/DEAD染色细菌活力试剂盒对细胞染色,进行共聚焦激光扫描显微镜(CLSM)的分析,发现经过PDA修饰的细菌细胞表现出强烈的绿色荧光和较弱的红色荧光(图2e),与天然的大肠杆菌相似(图2d),说明包覆前后均具有较高的活细胞比例.因此PDA涂层对大肠杆菌的活力几乎没有影响.接着通过UV-vis光谱分析比较了天然的大肠杆菌和PDA包覆的大肠杆菌在LB培养基中在600 nm处的光学密度(OD600),来进一步监测细胞的生长情况(图2f),从图2f中可看出PDA包覆的大肠杆菌的孵育时间后进入了与天然细胞相似的繁殖阶段,说明PDA纳米涂层对大肠杆菌细胞的自分裂性能几乎没有影响,具有良好的生物相容性[28].
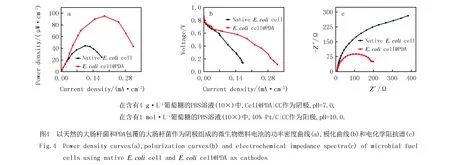
为了进一步探究PDA纳米涂层对大肠杆菌ORR电催化活性功能的促进作用,在PDA成功包覆大肠杆菌表面后,通过使用三电极电化学测试系统对功能化的大肠杆菌进行半电池电化学分析,结果表明与天然的大肠杆菌相比,E.colicell@PDA具有更高的电催化ORR活性,这归因于其显著增强了直接电子转移能力,以及电极上更密集的细菌附着量.为了证明E.colicell@PDA的电催化活性,在氧气或氮气饱和的M9溶液中进行循环伏安(CV)测试.图3a显示,在氧气饱和的M9溶液中进行CV测试时,扫描速率为50 mV·s-1,不同的大肠杆菌均在0.35 V vs.RHE有一个明显的阴极还原峰,与天然的大肠杆菌(2.13 mA·cm-2)相比,E.colicell@PDA的还原电流(2.62 mA·cm-2)增加了约23 %.通过线性扫描(LSV)测试(图3b)结果可看出,E.colicell@PDA生物催化剂的极限电流密度比天然的大肠杆菌增加了约0.1 mA·cm-2,这些结果表明E.colicell@PDA有更好的ORR催化活性,归因于PDA具有良好的导电性以及丰富的活性官能团,产生了更多的催化活性位点,有助于大肠杆菌催化活性的提高.为了探究生物-非生物界面的电荷转移电阻,进行了电化学阻抗谱(EIS)分析测试,对比两种生物催化剂的Nyquist图(图3c)可以发现,E.colicell@PDA的电阻要小于天然的大肠杆菌,进一步证明了PDA功能性涂层的修饰显著提高了细胞与电极间的电子转移效率.在氮气饱和的M9溶液中进行CV测试时,天然的大肠杆菌在约0.19 V和0.30 V(vs.RHE)处有一对明显的氧化还原峰(图3d),这是由于大肠杆菌中的催化活性蛋白细胞色素c(Cyt c)通过Fe3+和Fe2+之间的电子转移增强细胞的氧化还原活性.而E.colicell@PDA的氧化还原峰更加明显,说明具有更强的直接电子转移能力以及电化学氧化还原活性.在氮气饱和的M9溶液中,以0.01到1.00 V·s-1的不同扫描速率来记录氧化还原峰值电流(图3e).根据峰值电流与扫描速率的对应关系(图3f),发现峰值电流随扫描速率的增加呈线性增加,表明E.colicell@PDA的电催化ORR过程为表面控制过程.
为了评估不同细菌的生物发电能力,构建了双室微生物燃料电池(MFC).当MFC电压输出稳定时,在阴极和阳极之间连接不同的外部负载,得到功率密度曲线(图4a)和电流-电压(I-V)的极化曲线(图4b).结果表明,采用天然的大肠杆菌作为生物阴极的MFC的最大输出功率密度为44.5 μW·cm-2,E.colicell@PDA生物阴极的MFC的最大输出功率密度为95.3 μW·cm-2,其产电性能远高于天然的大肠杆菌,进一步说明E.colicell@PDA的电催化还原能力更好.从极化曲线可以看出,采用E.colicell@PDA的MFC比天然的大肠杆菌的MFC的极化曲线的斜率更小,说明其内阻较小,有利于细菌与电极之间的电子转移.对这两种类型的MFC进行电化学阻抗谱(EIS)测试,EIS的Nyquist图如图4c所示,可以看出E.colicell@PDA生物阴极的电荷转移电阻明显低于天然的大肠杆菌,表明PDA的修饰提高了MFC的电荷转移速率,大大降低了MFC的电荷转移电阻.
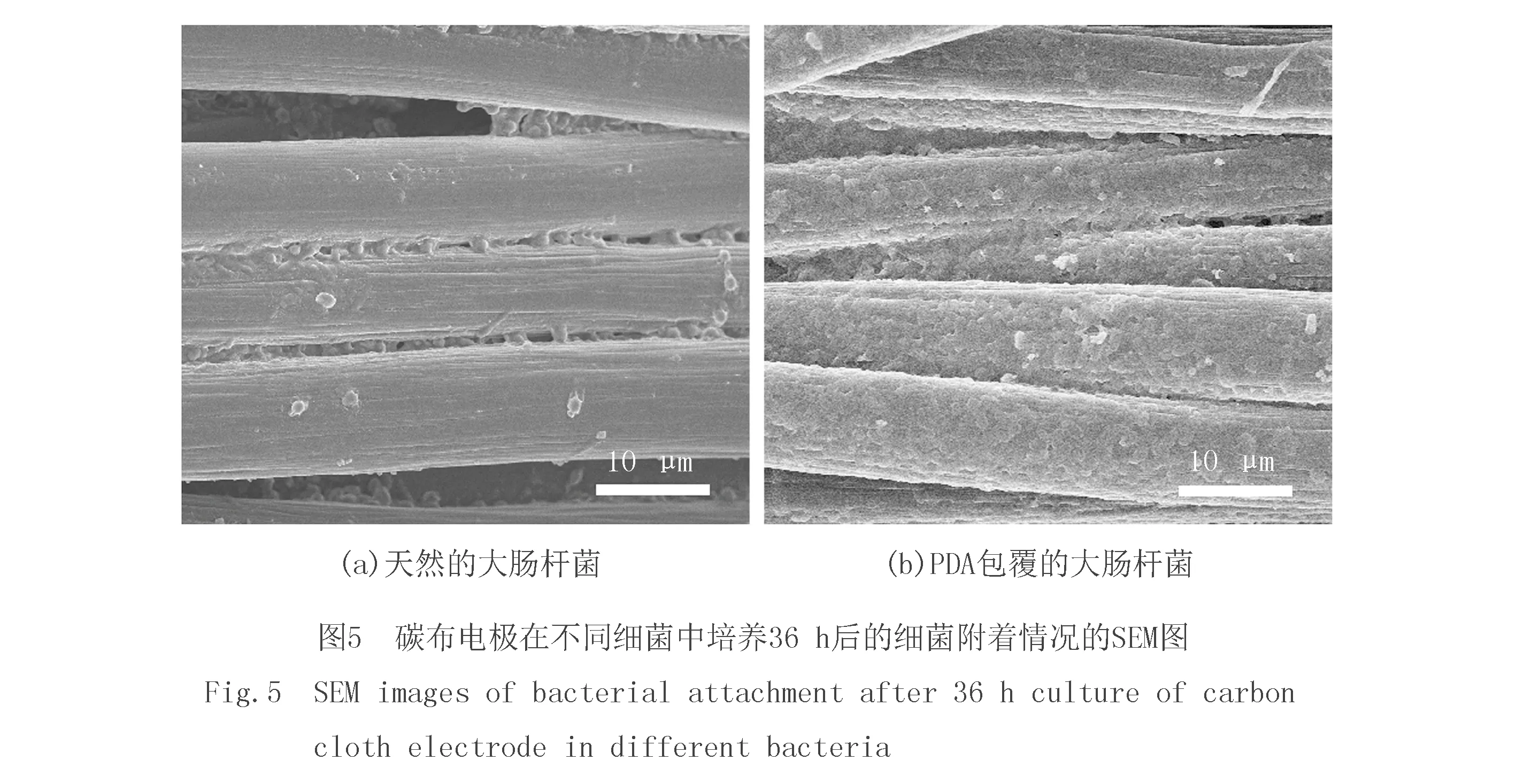
为了证明PDA功能性涂层的黏附性,通过SEM图对细菌在碳布电极上的附着情况进行了分析.可以观察到天然的大肠杆菌在光滑的碳布纤维上附着量相对较少(图5a),而E.colicell@PDA在光滑的碳布纤维上形成了致密的生物膜(图5b),结果表明PDA具有良好的黏附力,使细菌更大程度附着在电极上,从而改善了MFC的产电性能.
3 结 论
氧化还原活性的聚多巴胺通过原位聚合包覆在单个大肠杆菌细胞表面,在不影响细菌细胞活力的情况下增强了ORR电催化活性以及最大输出功率密度.PDA功能性涂层的引入不仅促进了细胞的生物电催化活性,而且PDA具有许多亲水基官能团,增强了细胞的黏附性,与细胞膜紧密接触并均匀包裹在细胞表面,增强了细胞外电子转移速率.本文研究为制备高活性生物电催化材料提供了一种方法,有利于促进新型生物电催化剂的设计合成与性能探索.

