CircDUSP16调控肝癌细胞增殖和凋亡的机制
孔义华 王显河 师海瑞 吴秋阳 梅艳 吴治平 戴志敏
(贵州医科大学第二附属医院临床检验中心,贵州 凯里 556000)
肝细胞癌(HCC)是全球最常见的肝原发性恶性肿瘤,也是癌症相关死亡率第三大主要原因,严重威胁人们的健康和生命〔1,2〕。尽管有多种治疗方式可用于治疗HCC,例如手术切除或靶向治疗等,但由于其肿瘤浸润性,HCC通常被诊断为晚期,预后较差。手术切除后的复发和转移与不良预后有关〔3〕。因此,检测HCC早期新型生物标志十分必要〔4〕。大量证据表明,非编码RNAs(ncRNAs)的表达与HCC进程有关〔5〕。环状RNAa(circRNAs)是ncRNA的一种新亚型,具有共价的闭环结构,其反向剪接位点位于5′-3′端之间,并且比相应的线性RNAs对RNase R的抵抗力更高,具有更高的保守性〔6〕。circRNA在多种分子机制中起关键作用,包括肿瘤生物标志物、调控基因表达和使miRNA呈海绵状〔7~9〕。微小RNA(miRNA)作为小型ncRNA的另一个亚组,负调控其靶基因,并在HCC中起癌基因或抑癌作用。研究表明,hsa_circ_0009910、hsa_circ_0049783和hsa_circ_0089172在HCC组织和血浆中上调,其表达增加与HCC患者的预后不良相关〔10〕。另有研究也证实,hsa_circ_0003855(circDUSP16)通过刺激miR-145-5p促进胃癌的发生和侵袭〔11〕,但在HCC中的作用未见报道。此外,miR-136-5p被报道在HCC中表达下调,作为抗癌miRNA,通过对各种通路的调节,影响肝癌的进展。
Yes相关蛋白(YAP)1过表达与HCC的血管浸润、细胞分化、肿瘤大小和TNM肿瘤分期有关,可能是HCC形成的危险因素〔12〕。YAP1在人类HCC中高表达,其通过上调Jagged1和激活Notch途径来促进HCC的发展和进程〔13〕。通过Circular RNA Interactome及Targetscan在线软件预测发现miR-136-5p同时具有circDUSP16和YAP1的结合位点。并且,前期研究证实circDUSP16在HCC肿瘤组织中显著高表达,且其表达与YAP1呈正相关;双荧光素酶实验证实miR-136-5p与circDUSP16和YAP1存在相互作用。因此,本研究旨在探讨circDUSP16在肝癌中的表达特征并探讨其与miR-136-5p和YAP1的潜在关系,以期为HCC患者提供预后生物标志物。
1 材料和方法
1.1细胞株 LO2细胞系(人类永生化的正常肝细胞系)和人类HCC细胞系(MHCC97、Huh7、SK-Hep1、Hep3B和HepG2)购自中国科学院。
1.2细胞培养 将细胞培养在含有100 U/ml青霉素(Sigma),100 μg/ml链霉素(Sigma)和10%胎牛血清(Gibco, Thermo Fisher Scientific)的DMEM(Gibco, Thermo Fisher Scientific)中,并在含5%CO2的潮湿气氛中保持在37 ℃。
1.3细胞转染 慢病毒介导的sh-circDUSP16(靶序列:ACCTGCTTGCAGGCTTTCAGT),质粒介导的circDUSP16,miR-136-5p模拟物(mimic),miR模拟对照(NC),miR-136-5p抑制剂(inhibitor)和miR抑制剂对照(inhibitor NC)购自Genomeditech(上海,中国)。根据制造商说明,在转染之前,将HCC细胞种植在6孔板中24 h,然后在HCC细胞中融合。将Lipofectamine2000试剂(Invitrogen,美国)用于细胞转染测定。
1.4实时荧光定量聚合酶链反应(qRT-PCR) 根据制造商说明,使用RNAiso Plus试剂盒(Takara)从HCC细胞中提取总RNA,使用RNAiso试剂盒(Takara)提取miRNA。为了评估circDUSP16、miR-136-5p和YAP1在HCC细胞系中的表达水平,进行qRT-PCR分析。使用PrimeScript RT Reagent试剂盒(Takara)通过逆转录总RNA,合成提取总RNA的互补DNA(cDNA);使用Mix-X miRNA第一链合成试剂盒(Takara)合成miRNA的cDNA;使用SYBR Premix Ex Tap(Takara)进行qPCR,并在LightCycler 480Ⅱ(Roche,Switzerland)中扩增。磷酸甘油醛脱氢酶(GAPDH)用作内源对照。使用2-ΔΔCt方法计算基因的相对表达。
1.5细胞活力、菌落形成和凋亡 根据制造商说明,使用四甲基偶氮唑蓝(MTT)分析0、24、48和72 h细胞活力。使用分光光度计评估每个样品在450 nm处的吸光度(OD)值。为了评估菌落形成,在转染后48 h将低细胞密度接种到培养皿中,并形成可见的菌落,然后用1%结晶紫染色后对菌落计数。将细胞以5×105个细胞/孔的密度铺在6孔板中,并且当细胞生长至对数生长期时,收获细胞并计数。离心后,通过添加195 μl膜联蛋白Ⅴ-异硫氰酸荧光素(FITC)结合溶液重悬细胞。加入5 μl膜联蛋白V-FITC和10 μl碘化丙啶染色溶液以混合。将细胞在黑暗中孵育10~20 min,然后进行流式细胞仪分析。
1.6Western印迹法 RIPA缓冲液(Beyotime,中国上海)用于提取细胞中的蛋白质。使用二喹啉甲酸(BCA)试剂盒确定蛋白质浓度,并使用上样缓冲液使蛋白质变性。蛋白样品(20 μg)在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中电泳,并转移到聚偏氟乙烯(PVDF)膜(Millipore,美国)上。用5%脱脂牛奶封闭,然后与特异性一抗在4 ℃下孵育过夜。抗体是抗YAP1(1∶1 000,目录号ab52771,Abcam)和抗GAPDH(1∶3 000,目录号5174S,Cell Signaling Technology)。将膜与二抗在室温下孵育2 h。增强化学发光试剂〔PierceTM电化学发光(ECL),Thermo ScientificTM,美国〕用于检测蛋白质。
1.7荧光素酶报告基因检测 将HCC细胞系接种到24孔板中。孵育24 h后,将含有野生型(WT)或突变体(MUT)circDUSP16和YAP1的3′非翻译区(UTR)的报告载体与miR-136-5p mimic共转染到Huh7和Hep3B细胞系中。转染48 h后,使用Luc-Pair TM双荧光素酶测定试剂盒(Genecopoeia)定量荧光素酶活性。
1.8统计学分析 采用SPSS20.0软件和GraphPad Prism进行独立或配对t检验及方差分析(ANOVA);Pearson相关分析用于分析相关性;Kaplan-Meier方法和对数秩检验分析生存曲线。
2 结 果
2.1circDUSP16在不同HCC细胞系中表达水平 qRT-PCR结果表明,与LO2正常细胞系circDUSP16相对表达量(1.00±0.12)比较,HCC细胞系MHCC97(1.34±0.23)、Huh7(2.76±0.14)、SK-Hep1(1.84±0.16)、Hep3B(2.81±0.26)及HepG2(2.43±0.28)显著升高(t=2.27、16.53、7.27、10.95、8.13;P=0.07、<0.001、0.001、<0.001、<0.001)。
2.2抑制circDUSP16可抑制HCC细胞的增殖并促进凋亡 与sh-NC组比较,sh-circDUSP16组circDUSP16基因表达水平明显降低(1.00±0.09 vs 0.35±0.05,t= 10.94,P<0.001;1.00±0.11 vs 0.42±0.08,t=7.39,P<0.001),说明转染成功。通过在Huh7和Hep3B细胞系中转染sh-circDUSP16发现,相比于sh-NC组,sh-circDUSP16显著抑制了Huh7和Hep3B细胞系在48 h和72 h的细胞活力(均P<0.05),抑制菌落形成并促进细胞凋亡(均P<0.05)。见表1、图1、表2。

A.在Huh7和Hep3B细胞系中转染sh-circDUSP16后对细胞菌落数的影响。B.在Huh7和Hep3B细胞系中转染sh-circDUSP16后对细胞凋亡的影响图1 抑制circDUSP16可抑制HCC细胞的增殖并促进凋亡

表1 转染sh-circDUSP16后对肝癌细胞活力的影响
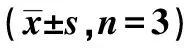
表2 转染sh-circDUSP16后对肝癌细胞菌落数和凋亡的影响
2.3circDUSP16在HCC中靶向miR-136-5p miR-136-5p与circDUSP16的3′UTR结合位点见图2。将miR-136-5p mimic和WT、MUT circDUSP16共转染到Huh7和Hep3B细胞系中,发现miR-136-5p显著降低了Huh7和Hep3B细胞系中WT circDUSP16的荧光素酶活性(均P<0.001),但在MUT circDUSP16中没有改变(均P>0.005)。见表3。

图2 miR-136-5p与circDUSP16的3′UTR结合位点
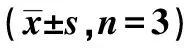
表3 转染miR-136-5p mimic后对肝癌细胞WT、MUT circDUSP16及YAP1 WT、MUT荧光素酶活性的影响
2.4circDUSP16和miR-136-5p调控HCC中Hippo/YAP信号通路 miR-136-5p与YAP1的3′UTR结合位点见图3。将miR-136-5p mimic和YAP1 WT、MUT共转染到Huh7和Hep3B细胞系中,发现miR-136-5p显著降低了Huh7和Hep3B细胞系中YAP1 WT的荧光素酶活性(均P<0.05),但在YAP1 MUT中没有改变(均P>0.05)。过表达Huh7和Hep3B细胞系中miR-136-5p后,与mimic-NC组比较,miR-136-5p mimic组miR-136-5p表达明显升高(P<0.001);而抑制Huh7和Hep3B细胞系中miR-136-5p后,与Inhibitor NC组比较,miR-136-5p inhibitor组miR-136-5p表达明显下降(P<0.001),见表4。Western印迹结果表明,过表达miR-136-5p可以降低细胞中YAP1表达,而抑制miR-136-5p可以增加细胞中YAP1表达。见图4。

图3 miR-136-5p与YAP1的3′UTR结合位点
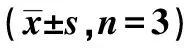
表4 过表达或抑制miR-136-5p后对肝癌细胞中miR-136-5p表达影响

1~4:mimic-NC组、miR-136-5p mimic组、Inhibitor NC组、miR-136-5p inhibitor组;图5同图4 Western印迹检测Huh7和Hep3B细胞系中YAP1表达
2.5circDUSP16通过靶向miR-136-5p/YAP1调控HCC细胞增殖和凋亡 在Huh7和Hep3B细胞系中同时干扰circDUSP16和miR-136-5p表达,Western印迹结果表明,转染sh-circDUSP16降低细胞中YAP1表达,而抑制miR-136-5p可以逆转YAP1表达,见图5。MTT分析发现,sh-circDUSP16显著降低Huh7及Hep3B细胞系48、72 h细胞活力,而抑制miR-136-5p可以显著逆转细胞活力(均P<0.05)。见表5。此外,菌落分析和流式分析表明,sh-circDUSP16显著抑制Huh7及Hep3B细胞系菌落形成并促进细胞凋亡,而抑制miR-136-5p可以显著逆转这些变化(均P<0.05)。见图6、图7、表6。

图5 Western印迹法检测Huh7和Hep3B细胞系中同时干扰circDUSP16和miR-136-5p后YAP1表达

图6 在Huh7和Hep3B细胞系中同时干扰circDUSP16和miR-136-5p后对细胞菌落数的影响(结晶紫染色)

图7 在Huh7和Hep3B细胞系中同时干扰circDUSP16和miR-136-5p后对细胞凋亡的影响
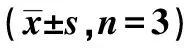
表5 同时干扰circDUSP16和miR-136-5p后对肝癌细胞活力的影响
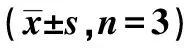
表6 同时干扰circDUSP16和miR-136-5p后对肝癌细胞菌落数和凋亡的影响
3 讨 论
越来越多的证据表明,circRNAs可作为HCC患者潜在的生物标志物〔14~16〕。例如,在具有较高体脂比的HCC患者中,circ-DB表达上调,而circ-DB抑制miR-34a,激活泛素特异性蛋白酶(USP)7/细胞周期蛋白(Ciclin)A2信号传导途径,加速肿瘤生长并减少DNA损伤〔17〕。TWIST1通过增加CIRC-10720表达,从而促进上皮-间质转化(EMT)在HCC波形蛋白表达〔18〕;circ-ADD3通过细胞周期蛋白依赖性激酶(CDK)1介导的泛素化促进zeste基因增强子同源物(EZH)2降解,从而抑制HCC细胞的转移〔19〕。本研究发现,抑制circDUSP16表达可抑制HCC细胞的增殖并促进凋亡,可能通过竞争性结合miR-136-5p,调控YAP1的表达,进而参与HCC进展。这些结果表明,circDUSP16可能是HCC的潜在生物标志物。
在功能上,circRNA可以充当HCC中的癌基因或抑癌基因。一方面,环状RNA同源结构域相互作用蛋白激酶(circ_HIPK)3、circ_UBXN7和circ-PRKCI促进肿瘤细胞的增殖、迁移和侵袭,并加速HCC细胞的凋亡〔20~22〕。另一方面,circZKSCAN1抑制HCC细胞的肿瘤发生和侵袭〔23〕。但是,circDUSP16在HCC中的功能作用仍不清楚。本研究发现,抑制circDUSP16表达可抑制Huh7和Hep3B细胞系的增殖并促进凋亡。这些研究表明,circDUSP16可能是HCC细胞中的肿瘤促进因子。
MiRNA参与各种生理和病理过程〔24~26〕。据报道,多种miRNA调节癌细胞的恶性生物学行为,包括HCC在内的多种癌症的增殖、迁移、凋亡、自噬,耐药性和血管生成〔27~29〕。miR-136-5p是miRNA(非编码RNA家族)的成员,可以通过使目标mRNA的3′-非翻译区沉默来调节靶基因,从而抑制或促进肿瘤发生和发展〔30〕。研究表明,miR-136-5p在上皮性卵巢癌和神经胶质瘤细胞系中的表达下调〔31,32〕,而在非小细胞肺癌中miR-136-5p被上调〔33〕。此外,miR-136-5p可以促进化疗诱导的神经胶质瘤细胞凋亡〔31〕。根据上述研究,miR-136-5p可能在不同的癌症中异源表达。本研究发现,在HCC细胞系中miR-136a-5p表达下调。与预期一致,证明circDUSP16靶向HCC细胞中miR-136-5p表达。
在当前研究中,YAP1被确定为miR-136a-5p的靶标。YAP1在Hippo信号通路中起着重要作用,该通路是细胞增殖、凋亡和器官生长调节中必不可少的通路〔34〕。YAP1也据报道参与了癌症的发展,因为它可以促进细胞增殖、抑制细胞凋亡并诱导癌细胞的EMT和耐药性〔35〕。这项研究发现,YAP1是circDUSP16和miR-136-5p的靶基因。miR-136-5p过表达降低了YAP1表达水平,而抑制miR-136-5p增加了YAP1表达水平。此外,转染circDUSP16可以增加YAP1表达水平,而miR-136-5p的异位表达逆转了这一变化,并进一步影响HCC细胞的增殖和凋亡。这些数据表明,circDUSP16通过靶向miR-136-5p/YAP1调控HCC细胞增殖和凋亡。
综上,circDUSP16的异位表达通过竞争性结合miR-136-5p,从而调控YAP1的表达,参与HCC进展。本研究可能为HCC患者提供预后生物标志物。

