改良腹主动脉瘤大鼠模型的制作方法
刘新农,杨根欢,廖鹏志,汪 岩,贾玉龙,沈晨阳
首都医科大学附属北京天坛医院血管外科,北京 100070
腹主动脉瘤(abdominal aortic aneurysm,AAA)定义为腹主动脉直径超过正常腹主动脉直径的1.5倍及以上或≥3.0 cm[1-2]。破裂出血是AAA患者死亡的主要原因,美国流行病学研究表明AAA引起的死亡在65岁以上老年人死因中居第10位[3-5]。腹主动脉瘤的发病机制尚不明确,目前仍缺乏抑制腹主动脉瘤进展的有效药物[6-7]。动物模型是研究疾病分子机制及治疗方法的重要工具[8]。腹主动脉腔内灌注猪胰蛋白酶(elastase from porcine pancreas,PPE)是制作AAA 动物模型的主要方法之一,但传统的腹主动脉腔内灌注PPE 制作AAA 模型的方法仍存在成瘤率低、实验动物病死率高等不足[9-11]。本研究报道一种改良腹主动脉腔内灌注PPE 制作AAA 大鼠模型的方法,该方法具有成瘤率高、成瘤时间短等优点,可为研究者提供更加有效的AAA大鼠模型,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
成年雄性SD大鼠20只,体重550~600 g,购自北京维通利华实验动物技术有限公司,饲养在SPF级标准动物房,24 h提供高压灭菌水和固体棒状饲料。按照美国国立卫生研究院1996年修订的《实验动物护理和使用指南》[12]进行动物实验。动物实验于2021年1—8月进行。
1.1.2 主要试剂
Ⅰ型PPE购自美国Sigma公司;山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体购自北京中杉金桥生物技术有限公司;抗CD68抗体购自美国Abcam 公司。
1.2 方法
1.2.1 实验动物分组
采用随机数字表法将20只SD大鼠随机分为两组,每组10只。改良腹主动脉腔内灌注PPE组(改良法):验证目标段腹主动脉腔内密闭性良好后,经大鼠腹主动脉穿刺进行腹主动脉腔内灌注PPE。传统腹主动脉腔内灌注PPE 组(传统法):经大鼠左侧髂总动脉穿刺进行腹主动脉腔内灌注PPE。PPE 的浓度为40 U/ml,灌注压力为100 mmHg(1 mmHg=0.133 kPa),灌注时间为30 min。
1.2.2 改良AAA模型的制作方法
麻醉与切口:大鼠麻醉后取平卧位,将其头部及四肢固定于手术操作板,常规消毒铺巾,于腹部正中做1个长度为4~5 cm的切口,逐层切开皮肤及皮下组织。关键手术步骤如下:(1)切开腹膜后组织,显露腹主动脉,长度约为1.5 cm,为目标腹主动脉;(2)充分阻断目标腹主动脉的近端、远端及其间发出的分支动脉,保证目标腹主动脉腔内形成良好的密闭性;(3)腹主动脉分支血管采用非接触式阻断,即连同分支血管周围的组织一并结扎,避免引起分支血管损伤,防止PPE在灌注过程中外溢至腹腔内;(4)采用4-0尼龙线临时阻断生殖动脉等较大的分支血管,采用6-0血管缝合线临时缝扎腹主动脉后壁发出的腰动脉等细小分支及其周围组织;(5)于目标腹主动脉远端植入穿刺套管针并固定,采用生理盐水检测目标腹主动脉腔内密闭性,证实其密闭性良好后可进行PPE灌注;(6)PPE 灌注结束后吸出腹主动脉腔内残余的PPE溶液,并使用生理盐水反复冲洗3遍,解除所有分支血管的阻断以恢复血流;(7)撤出穿刺针,采用7-0血管缝合线缝合腹主动脉穿刺点,逐层缝合手术切口,待大鼠麻醉苏醒后置于动物房。
1.2.3 传统AAA模型制作方法
传统腹主动脉腔内灌注PPE制作腹主动脉瘤模型的步骤参考既往研究[13]。简要步骤如下:游离显露目标段腹主动脉,结扎其近端、远端及其分支血管,于一侧髂动脉或股动脉处穿刺,将穿刺针植入目标段腹主动脉腔内进行PPE灌注。灌注结束时,吸出腹主动脉腔内的PPE 并用生理盐水冲洗3遍,撤除套管针,采用7-0血管缝合线缝合穿刺点,恢复腹主动脉血流,检查穿刺点无出血,使用生理盐水冲洗腹腔后逐层关闭腹壁。
1.2.4 腹主动脉多普勒超声检查
于术后7、14 d分别对大鼠腹主动脉进行彩色多普勒超声检查,测量腹主动脉瘤直径并计算腹主动脉扩张率,步骤如下:大鼠吸入异氟醚麻醉,使用脱毛剂去除其腹部皮毛并将其固定在超声检查的操作平台。采用Vevo 2100成像系统进行腹主动脉超声成像,使用MS-250超声探头(频率为13~24 MHz)采集心脏收缩期末期左肾静脉至腹主动脉分叉处的腹主动脉图像,测量腹主动脉最大直径。使用Vevo LAB 1.7.1软件进行图像分析。在造模前通过超声测量获得术前腹主动脉直径。腹主动脉扩张率(%)=(AAA最大直径/术前腹主动脉直径)×100%,腹主动脉扩张率大于150%视为AAA,腹主动脉成瘤率(%)=腹主动脉扩张率大于150%的大鼠数量/接受造模手术的大鼠总数×100%。
1.2.5 弹性纤维染色
通过对AAA 组织进行弹性纤维染色来观察AAA 组织中弹性纤维的降解情况。弹性纤维染色的关键步骤:(1)将酒精苏木素、三氯化铁和碘液以5∶2∶2的比例混合成弹性纤维染液,切片浸入弹性纤维染液30 min;(2)进行背景分化,即采用三氯化铁分化液进行组织分化,至弹性纤维呈紫黑色;(3)将饱和苦味酸与酸性品红以9∶1的比例混合成复染溶液,将切片浸入复染溶液1~3 min后以无水乙醇脱水;(4)使用干净的二甲苯透明5 min,使用中性树胶封片。采用全自动数字切片扫描系统进行图像采集。使用Image J软件进行弹性纤维的定量分析。
1.2.6 免疫组织化学染色(immunohistochemical staining,IHC)
CD68是巨噬细胞的特异性标志物,使用抗CD68(1∶1000)抗体进行IHC染色,鉴定AAA 组织中巨噬细胞浸润情况,实验步骤参照抗体产品说明书。使用全自动数字切片扫描系统进行图像采集,每个切片随机选取10个高倍镜视野,使用Image J软件进行炎症细胞的定量分析。
1.3 观察指标
比较两组大鼠的手术相关指标,大鼠存活率,术后7、14 d的AAA成瘤率和腹主动脉扩张率。观察腹主动脉弹性纤维情况和炎性细胞浸润情况。
1.4 统计学方法
应用GraphPad Prism 8.0软件对数据进行统计学分析。计数资料以n(%)表示,组间比较采用χ2检验;计量资料以(±s)表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 手术相关指标及大鼠存活率
两组大鼠均成功实施手术,手术过程中无大鼠死亡。改良腹主动脉腔内灌注PPE组的手术时间为(53.63±6.46)min,明显短于传统腹主动脉腔内灌注PPE 组的(68.43±7.32)min,差异有统计学意义(t=-6.548,P<0.01)。改良腹主动脉腔内灌注PPE组每只大鼠PPE 用量为(2.68±0.57)U,明显少于传统腹主动脉腔内灌注PPE 组(7.86±1.14)U,差异有统计学意义(t=-24.596,P<0.01)。术后14 d,传统腹主动脉腔内灌注PPE组和改良腹主动脉腔内灌注PPE组的大鼠存活率分别为80%(8/10)和100%(10/10),差异无统计学意义(χ2=2.222,P>0.05)。改良AAA 模型制作的关键手术步骤及结果见图1。

图1 改良AAA模型的关键步骤与结果
2.2 AAA 成瘤率与腹主动脉扩张率
超声检查结果显示,术后7 d,改良腹主动脉腔内灌注PPE组的腹主动脉扩张率、AAA 成瘤率均高于传统腹主动脉腔内灌注PPE组,差异均有统计学意义(P<0.05)。术后14 d,改良腹主动脉腔内灌注PPE组的腹主动脉扩张率明显高于传统腹主动脉腔内灌注PPE组,差异有统计学意义(P<0.01),但改良腹主动脉腔内灌注PPE组和传统腹主动脉腔内灌注PPE组的AAA 成瘤率比较,差异无统计学意义(P>0.05)。(表1,图2)

表1 两组大鼠模型不同时间AAA成瘤率与腹主动脉扩张率的比较
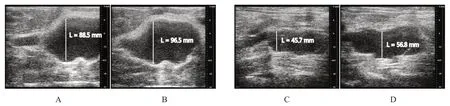
图2 两组大鼠的AAA超声影像图
2.3 弹性纤维情况的比较
弹性纤维染色结果显示,改良腹主动脉腔内灌注PPE组大鼠AAA内弹性纤维降解明显,仅残留极少量的弹性纤维,血管内膜、中膜、外膜之间的弹力层消失;传统腹主动脉腔内灌注PPE组大鼠AAA内弹性纤维部分降解,呈不连续状,血管内膜、中膜、外膜之间的弹力层部分可见(图3)。弹性纤维定量分析结果显示,改良腹主动脉腔内灌注PPE组大鼠AAA内弹性纤维含量为(6.45±2.37)%,明显低于传统腹主动脉腔内灌注PPE组大鼠的(14.54±6.31)%,差异有统计学意义(t=-5.599,P<0.01)。

图3 不同大鼠模型AAA内弹性纤维染色图(×10)
2.4 炎性细胞浸润情况的比较
IHC结果显示,改良腹主动脉腔内灌注PPE组大鼠AAA 内的巨噬细胞浸润明显,主要聚集在血管外膜区域;传统腹主动脉腔内灌注PPE 组大鼠AAA 内存在明显的巨噬细胞浸润,集中在血管外膜和中膜交界区域(图4)。每个高倍镜视野下,改良腹主动脉腔内灌注PPE组与传统腹主动脉腔内灌注PPE组大鼠AAA 内巨噬细胞数量分别为(32.44±15.72)个和(29.64±12.12)个,差异无统计学意义(t=0.685,P>0.05)。

图4 不同大鼠模型腹主动脉组织的IHC图
3 讨论
理想的疾病动物模型不仅应表现出疾病的病理学特征,还应具有操作简单可行、经济实用的特点[14-15]。根据本研究结果可得出以下结论:第一,改良腹主动脉腔内灌注PPE制作AAA 大鼠模型具有弹性纤维降解及炎症细胞浸润等AAA 典型的病理特征。第二,与传统腹主动脉腔内灌注PPE制作的AAA 相比,改良AAA 大鼠模型的制作方法简单可行,具有成瘤时间短、成瘤率高的优点。第三,改良腹主动脉腔内灌注PPE制作AAA 模型的手术时间和PPE用量更少,节省财力和人力成本。因此,改良AAA 大鼠模型可为研究者探索AAA 发病机制、相关治疗方案等提供可靠的研究工具。
传统腹主动脉腔内灌注PPE 制作AAA 模型的主要技术要点是需从大鼠一侧髂动脉或股动脉穿刺,将穿刺针送至目标段腹主动脉腔内并灌注PPE,分离髂动脉或股动脉需要更多的手术时间,实验动物也需经受更大的手术创伤[16]。本研究所述的改良腹主动脉腔内灌注PPE 制作AAA 大鼠模型采用直接穿刺目标段腹主动脉的方式,减少了因分离髂动脉或股动脉而引起的创伤。本研究结果显示,改良腹主动脉腔内灌注PPE 制作的AAA 大鼠模型的手术时间明显短于传统腹主动脉腔内灌注PPE 制作的AAA 大鼠模型,每只小鼠消耗的PPE 用量明显少于传统AAA 大鼠模型,这主要得益于目标段腹主动脉腔内良好的密闭性进而减少了PPE 外溢[17]。
超声检查结果显示,术后7 d,改良腹主动脉腔内灌注PPE制作AAA 模型组的AAA 成瘤率为100%,而传统腹主动脉腔内灌注PPE制作AAA 大鼠模型组的AAA 成瘤率仅为40%。既往研究发现,传统腹主动脉腔内灌注PPE制作的AAA 大鼠模型多于术后2周形成,本研究所述的改良腹主动脉腔内灌注PPE 制作的AAA 大鼠模型能够加速AAA的形成[18]。术后14 d,改良腹主动脉腔内灌注PPE制作AAA 模型的腹主动脉扩张率均明显高于与传统腹主动脉腔内灌注PPE 制作AAA 大鼠模型,两组腹主动脉瘤的成瘤率比较,差异无统计学意义,这可能与实验动物样本量少有关,仍待后续大样本量研究进一步证实。
弹性纤维染色结果显示,改良腹主动脉腔内灌注PPE制作AAA 模型组腹主动脉壁内弹性纤维降解程度较传统腹主动脉腔内灌注PPE 制作AAA 模型组更严重,这可能与改良腹主动脉腔内灌注PPE 制作的AAA 模型在灌注过程中具有稳定的灌注压力及渗入腹主动脉壁内的PPE 更多有关[19]。明显的弹性纤维降解是改良腹主动脉腔内灌注PPE制作AAA 模型AAA 成瘤率和腹主动脉扩张率更高的潜在原因,但仍需更多的研究进一步证实[20]。IHC 结果显示,两种模型腹主动脉壁内的炎症细胞类型主要为巨噬细胞,且两组的巨噬细胞数量比较,差异无统计学意义。
改良腹主动脉腔内灌注PPE制作AAA的注意事项包括以下4个方面:第一,完全阻断目标段腹主动脉的侧支血管,其目的是保持腹主动脉的腔内密闭性,避免PPE溶液在灌注过程中随着侧支血管进入体循环,这样既有利于PPE灌注压力的维持,也能避免PPE溶液进入体循环而引起实验动物死亡[21]。第二,目标段腹主动脉的侧支血管采用非接触式血管阻断,即侧支血管连同其周围组织一并阻断,避免侧支血管损伤导致PPE溶液渗漏至腹腔内,这是降低实验动物病死率的又一个关键环节。第三,目标段腹主动脉的侧支血管阻断均是暂时性操作,待PPE灌注结束以后均解除侧支血管的阻断并恢复血流。第四,在PPE灌注结束时,吸出腹主动脉腔内的PPE并使用生理盐水冲洗3遍,以减少残余PPE进入血液循环而引起实验动物死亡。
本研究存在一定的不足之处:(1)纳入的实验动物数量有限,未来的研究可纳入更多的实验对象进一步验证改良腹主动脉腔内灌注PPE制作AAA 模型的有效性;(2)随访周期短,今后可通过延长随访时间来观察改良AAA大鼠模型的远期存活率。
综上所述,改良腹主动脉腔内灌注PPE制作AAA 大鼠模型具有典型AAA 病理特点,该模型制作方法具有成瘤率高、成瘤时间短、造模成本低的优点。此外,改良腹主动脉腔内灌注PPE制作AAA 模型的腹主动脉扩张率明显高于传统腹主动脉腔内灌注PPE制作AAA 模型,改良腹主动脉腔内灌注PPE有望成为制作巨大AAA 模型的潜在方法,但仍需更多的研究证实。

