苦荞抗立枯病基因FtABCG12的克隆及其功能分析
李光胜 卢翔 赖弟利 张凯旋 王海华 周美亮
(1 湖南科技大学生命科学与健康学院,411201,湖南湘潭;2 中国农业科学院作物科学研究所,100081,北京;3 贵州大学农学院,520025,贵州贵阳)
苦荞[Fagopyrum tataricum(L.)Gaertn.]属于蓼科荞麦属,为一年生双子叶作物[1]。苦荞营养丰富,富含蛋白质、维生素、矿物质以及药用类黄酮,如芦丁、槲皮素、异槲皮素和表儿茶素等[2]。此外,苦荞及其制品在预防高血压、增强机体免疫力及改善亚健康状态等方面具有较好的功效[3]。随着人们生活质量的提高和社会健康观念的加强,苦荞及其加工产品逐渐成为当今重要的保健食品。然而,近年来随着苦荞种植面积的不断扩增,苦荞病害的发生种类和危害程度逐年增长[4]。其中,以立枯丝核菌(Rhizoctonia soflani)引起的苦荞立枯病害较为突出[5]。
立枯丝核菌的无性态属于无孢目(Agonomycetales)丝核菌属(Rhizoctonia),有性态属于担子菌门(Basidiomycota)[6]。立枯丝核菌一般在田间多为无性态,很难发现有性态。荞麦立枯病由立枯丝核菌侵害造成,现已成为荞麦一大病害,阻碍了荞麦产业的高品质发展[4]。目前,防治荞麦立枯病的传统方法是化学药物喷施,可杀死致病菌或者抑制病菌的生长,该方法效果显著,然而长期使用化学药物会导致土壤微生物种群减少、土壤板结、肥力下降,且后期修复困难,还会带来农药残留等问题[7-8]。对作物资源的筛选及抗病基因的发掘是水稻抗病性研究的关键之一[9-10],大豆抗病基因的生物信息学分析有利于获得抗病虫害的新材料[11],而苦荞立枯病的发生与其自身抗病性密切相关。
ATP 结合盒(ATP-binding cassette,ABC)转运蛋白是广泛存在于生物体中的一类大家族转运蛋白,其中ABCG 是最大的亚家族,它们在植物器官的生长发育、激素运输、抵御生物和非生物胁迫等方面扮演着重要作用[12]。例如,木质素在植物病原体防御中起关键作用,而拟南芥中的AtABCG36转运蛋白参与木质素的合成[13];AtABCG14 参与调控拟南芥的抗旱反应[14]。本研究从苦荞中克隆到FtABCG12基因,并进行了一系列功能分析,最后将FtABCG12过表达至拟南芥,分析了转基因植株的抗病性,为进一步研究抗病基因调控苦荞抗立枯病的分子机制奠定基础。
1 材料与方法
1.1 试验材料
试验材料为川荞1 号。选取饱满且大小均匀的种子,剥去种皮,用8% NaClO 溶液消毒8min;然后用无菌水清洗数次,采用MS 培养基,在22℃、光照/黑暗16h/8h、湿度75%~80%的培养间中培养。
苦荞麦立枯丝核菌菌株(Rhizoctonia soflani,RS)、大肠杆菌菌株DH5α、转化农杆菌菌株GV3101 和植物过表达载体pCAMBIA1307 均由荞麦基因资源创新研究组提供。
1.2 苦荞总RNA 的提取及cDNA 的合成
取苦荞幼苗80~100mg,按照植物组织RNA 提取试剂盒[天根生化科技(北京)有限公司]说明书提取总RNA。测定RNA 的OD260/280值,用1.2%琼脂糖凝胶电泳对RNA 进行检测,对检测合格的RNA 进行反转录得到cDNA,将cDNA 保存于-20℃冰箱中。
1.3 苦荞FtABCG12 基因的克隆与生物信息学分析
利用Primer 5 设计FtABCG12基因全长扩增引物对FtABCG12-F/R(表1),以反转录后的cDNA为模板进行PCR 扩增。PCR 反应总体系为50μL。反应条件为94℃预变性2min;94℃变性30s,55℃退火60s,72℃延伸1min,30 个循环;最后72℃延伸7min。PCR 产物经琼脂糖凝胶电泳检测后,回收纯化。纯化产物连接至pTOPO-Blunt Simple Vector 并转化大肠杆菌DH5α感受态细胞,挑选单菌落,经菌液PCR 鉴定后送公司进行测序,得到FtABCG12-T 载体的质粒。
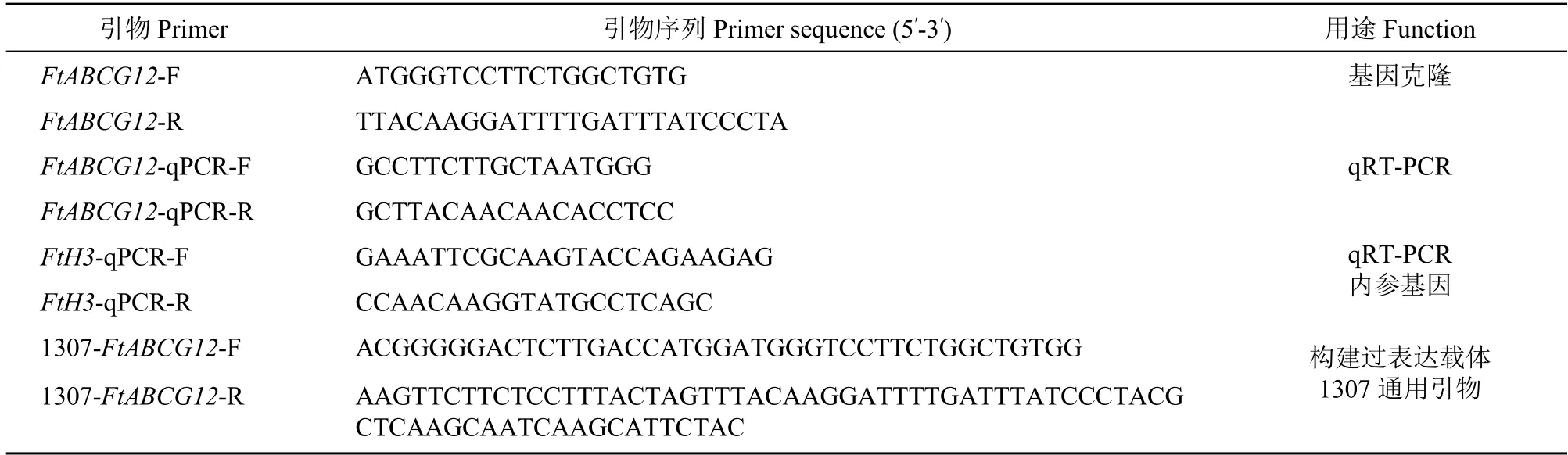
表1 引物序列汇总Table 1 Summary of primer sequence
对测序得到的正确序列进行生物信息学分析,首先利用GSDS(gene structure display server 2.0,gao-lab.org)对FtABCG12的基因结构进行预测和分析;通过Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对基因启动子序列进行分析;通过NCBI(https://www.ncbi.nlm.nih.gov/)中BLASTP 搜索与该基因同源性较高的序列,并利用MEGAX 软件构建进化树。
1.4 立枯丝核菌的培养和活化
1.4.1 PDB 培养基的制备 称取马铃薯葡萄糖肉汤(potato dextrose broth,PDB)粉末(北京酷来博科技有限公司)26g 于蒸馏水中充分溶解,定容至1000mL,摇匀后分装到250mL 锥形瓶中,封口,121℃高压灭菌20min,4℃冰箱中保存备用。
1.4.2 PDA 培养基的制备 称取马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)(北京酷来博科技有限公司)粉末11.5g 于蒸馏水中,充分溶解后定容至250mL,封口,高压灭菌锅灭菌,倒板,4℃保存备用。
1.4.3 菌株的活化 将立枯丝核菌接种于PDA 培养基上,置于28℃恒温培养箱中活化,暗培养3~5d,得到立枯丝核菌菌株。取PDA 培养基上2 块长势一致的立枯丝核菌菌株分别接种于PDB 培养基中,28℃恒温摇床暗培养2~3d,过滤,得到立枯丝核菌菌液。
1.5 FtABCG12 的表达分析
1.5.1 苦荞FtABCG12基因的组织特异性表达分析 选取生长15d 的长势良好、大小一致的苦荞无菌苗,用立枯丝核菌菌液侵染,于28℃恒温培养箱培养,侵染0、6、12、24、48h 后取材,分别提取样品叶片、茎段和根系组织中的总RNA,再反转录成cDNA,对FtABCG12基因在苦荞不同组织中的表达量进行分析。
1.5.2 实时荧光定量PCR 根据FtABCG12基因的非保守区间,设计荧光定量引物对FtABCG12-qPCR-F/R(表1)。荞麦组成型表达基因FtH3作为内参基因,引物名称为FtH3-qPCR-F/R(表1)。采用南京诺唯赞生物技术有限公司Taq Pro Universal SYBR qPCR Master Mix 荧光定量试剂盒和7500 Real Time PCR System 仪器进行RT-qPCR 检测和分析。相对表达量(RQ)计算公式为RQ=2-ΔΔct。
1.6 转基因拟南芥的构建
1.6.1 pCAMBIA1307-FtABCG12过表达载体的构建 根据基因克隆测序结果正确的FtABCG12序列和过表达载体pCAMBIA1307 图谱设计引物对pCAMBIA1307-FtABCG12-F/R,以FtABCG12-T 质粒为模板进行PCR 扩增反应。同时,用限制性内切酶XbaI、PstI酶切pCAMBIA1307 载体。二者均用琼脂糖凝胶电泳检测,纯化回收,再进行同源重组连接,然后转化于DH5α感受态细胞,挑取单克隆菌落,经菌液PCR 检测及测序结果比对正确,即得到过表达载体pCAMBIA1307-FtABCG12。
1.6.2 转化农杆菌GV3101 及侵染拟南芥pCAMBIA1307-FtABCG12重组质粒转化至农杆菌GV3101 感受态细胞中,挑取单克隆菌落,筛选鉴定得到阳性克隆。将阳性菌液摇至吸光度OD600到0.6~0.8,然后用蘸花法[15]对野生型拟南芥进行侵染试验。收取转基因植株T0代种子,使用潮霉素抗性筛选获得T1代转基因拟南芥。提取T1代幼苗叶片基因组DNA,以其为模板,以pCAMBIA1307载体通用引物TLF 为正向引物,基因特异性引物1307-FtABCG12-R 为反向引物进行PCR 反应,检测后获得单株阳性过表达植株(GOE)。
1.7 转基因拟南芥株系抗病性的鉴定
将过表达株系GOE 和野生型对照WT 种子经消毒晾干后点播在MS 固体培养基上。将生长7d的幼苗转到蛭石:营养土为1:1 的培养盆中,16h光照/8h 黑暗,22℃培养3 周。为鉴定FtABCG12过表达转基因株系的抗病性,用立枯丝核菌侵染转基因株系和对照株系的离体叶片,在培养皿中放置滤纸,用水润湿,保持叶片湿度,取2 种株系的叶片置于滤纸上,一部分用病菌侵染,一部分不处理,将已侵染与未侵染的培养皿分开,均用保鲜膜封住,置于28℃培养箱暗培养,24h 后观察病害情况。进一步做DAB 染色试验以观察病斑情况。检测立枯丝核菌侵染和未侵染条件下拟南芥AtABCG12基因的相对表达量、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性。
1.8 数据处理
运用Excel 软件和Origin 2019b 64Bit 等生物信息学软件对数据进行计算、处理和统计分析。
2 结果与分析
2.1 苦荞抗病基因FtABCG12 的序列扩增与生物信息学分析
从川荞1 号幼苗中提取RNA,经反转录得到cDNA。以该cDNA 为模板、FtABCG12-F/R 为PCR引物,扩增获得约1734bp 的条带。GSDS 基因结构分析结果(图1)表明,FtABCG12基因由7 个外显子和6 个内含子组成。
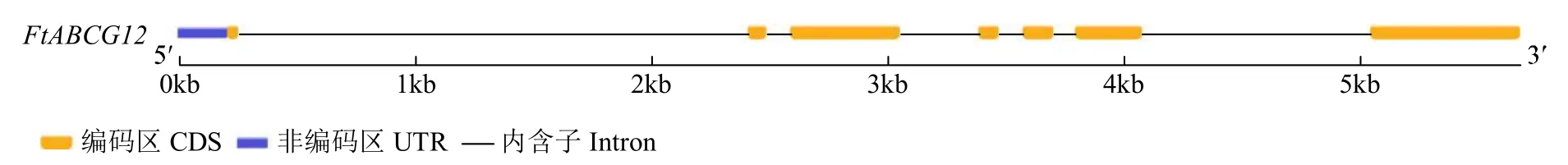
图1 FtABCG12 基因结构Fig.1 Gene structure of FtABCG12
使用Plant CARE 软件对基因ATG 上游2000bp序列进行分析,发现FtABCG12基因启动子中存在大量TATA-box 和CAAT-box 核心启动子元件,除此之外,还包含一系列顺式作用元件,包括MeJA反应响应元件TGACG-motif、脱落酸反应响应元件ABRE、水杨酸反应响应元件TCA-element 等激素相关顺式作用元件、光照响应元件G-box 和损伤诱导响应元件WRE3 等,结果如表2 所示。有研究报道,大部分激素都与植物抗病性相关,其中MeJA可刺激桃根霉腐烂病的特异性防御机制[16],水杨酸可在体外抑制灵芝茎腐病病原体[17],脱落酸抑制剂可增强番茄对灰叶斑病的抗性[18]。因此,推测FtABCG12基因在苦荞中存在一定的抗病性。
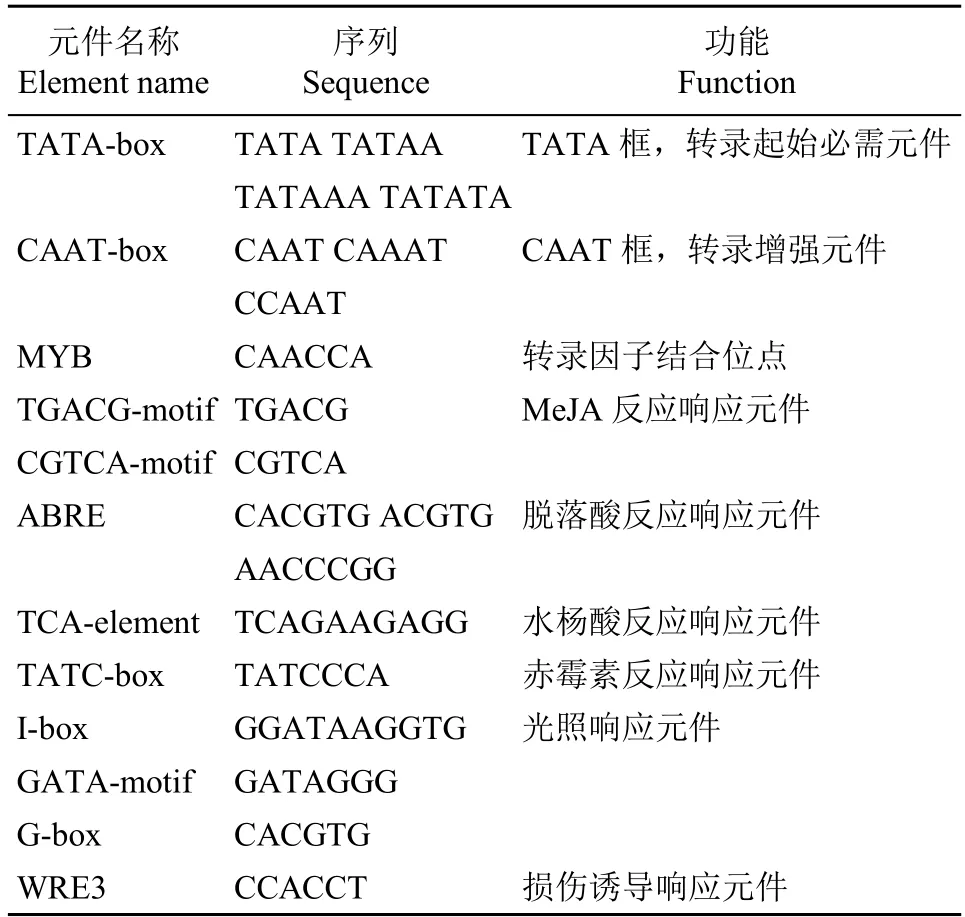
表2 FtABCG12 基因启动子序列中的顺式作用元件Table 2 Cis-acting elements in FtABCG12 gene promoter sequence
2.2 FtABCG12 蛋白同源比对与进化树分析
利用TAIR 在线数据库,选取多条相似度较高的蛋白与FtABCG12(FtPinG0404610000)进行比对,进一步构建系统发育树(图2),结果表明,FtABCG12 与拟南芥AtABCG11、AtABCG12、AtABCG13 和AtABCG15 亲缘关系较近。
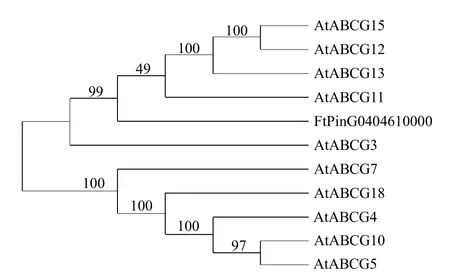
图2 FtABCG12 及其同源蛋白的系统发育树Fig.2 Phylogenetic tree of FtABCG12 and its homologous proteins
2.3 立枯丝核菌处理下FtABCG12 基因的表达
在新的PDA 培养基上继代培养之前所用的立枯丝核菌,于28℃培养箱培养2d 后,取PDA 培养基上的2 块大小一致的立枯丝核菌菌饼分别接种到100mL PDB 培养基中,28℃摇床220 转/min 培育2~3d 得到立枯丝核菌菌液。使用该菌液侵染苦荞幼苗0、6、12、24 和48h,分别选取不同时间段苦荞幼苗的根系、茎段和叶片提取RNA。采用qRT-PCR方法检测FtABCG12对立枯丝核菌侵染条件的响应模式(图3)。结果表明,FtABCG12受立枯丝核菌胁迫诱导表达。在立枯丝核菌侵染6~24h 期间FtABCG12基因表达显著上调。
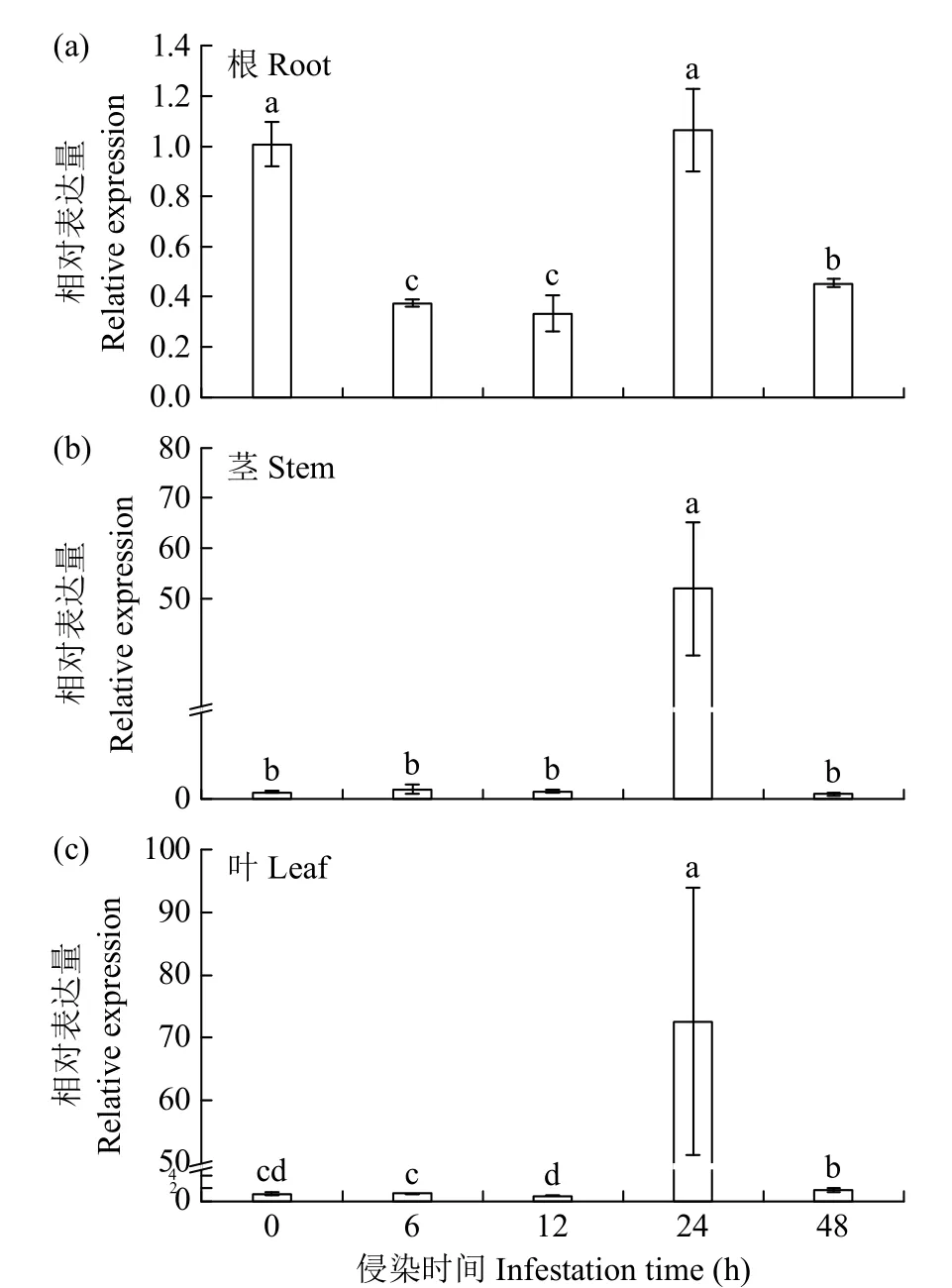
图3 不同处理下FtABCG12 的表达模式Fig.3 Expression patterns of FtABCG12 under different treatments
通过研究在立枯丝核菌侵染条件下,FtABCG12基因在苦荞不同组织中的表达情况(图3),发现FtABCG12基因在苦荞幼苗的根、茎和叶中均有不同程度的表达。通过立枯丝核菌的胁迫处理,在侵染24h,FtABCG12基因在茎和叶中的表达量均显著高于在根系中的表达量。随着立枯丝核菌侵染时间的增长,根系中0~12h 期间FtABCG12基因表达下调,12~24h 期间表达上升;在茎段和叶片中,0~24h 期间FtABCG12基因表达量均有所变化,12~24h 期间上调最显著。在侵染24~48h 期间,根、茎、叶中FtABCG12基因表达量均下降。由此推测,在立枯丝核菌侵染苦荞幼苗时,FtABCG12基因受到胁迫而诱导表达。在一定时间内,FtABCG12基因表达上调,随着立枯丝核菌侵入时间增长,苦荞幼苗体内可能发生了其他生理反应,导致FtABCG12基因表达下调。
2.4 FtABCG12 过表达拟南芥的抗病性鉴定
2.4.1 过表达拟南芥离体叶片侵染试验 将转基因拟南芥和野生型拟南芥正常培育3 周,取大小相近的叶片均分成2 组,分别用于立枯丝核菌离体侵染和无处理对照。如图4 所示,发现24h 后对照转基因株系和野生型没有任何差别;而在立枯丝核菌侵染条件下,转基因株系的离体叶片抗病性明显高于野生型拟南芥。

图4 转基因拟南芥的抗病性表型验证Fig.4 Phenotypic verification of disease resistance in transgenic A.thaliana
2.4.2 DAB 染色试验 选取转基因植株和野生型的离体叶片一部分进行立枯丝核菌侵染处理,一部分不侵染。28℃培养箱培育24h 后,用DAB 染色液对离体叶片染色20min,再用叶绿体脱色液脱色至叶片透明。如图5 所示,被立枯丝核菌侵染的叶片有明显病斑,呈棕褐色。在24h 病菌侵染条件下,经DAB 染色后,转基因株系离体叶片的病斑明显少于野生型株系。在0~24h 期间,转基因植株的离体叶片抗病性明显强于野生型的离体叶片。
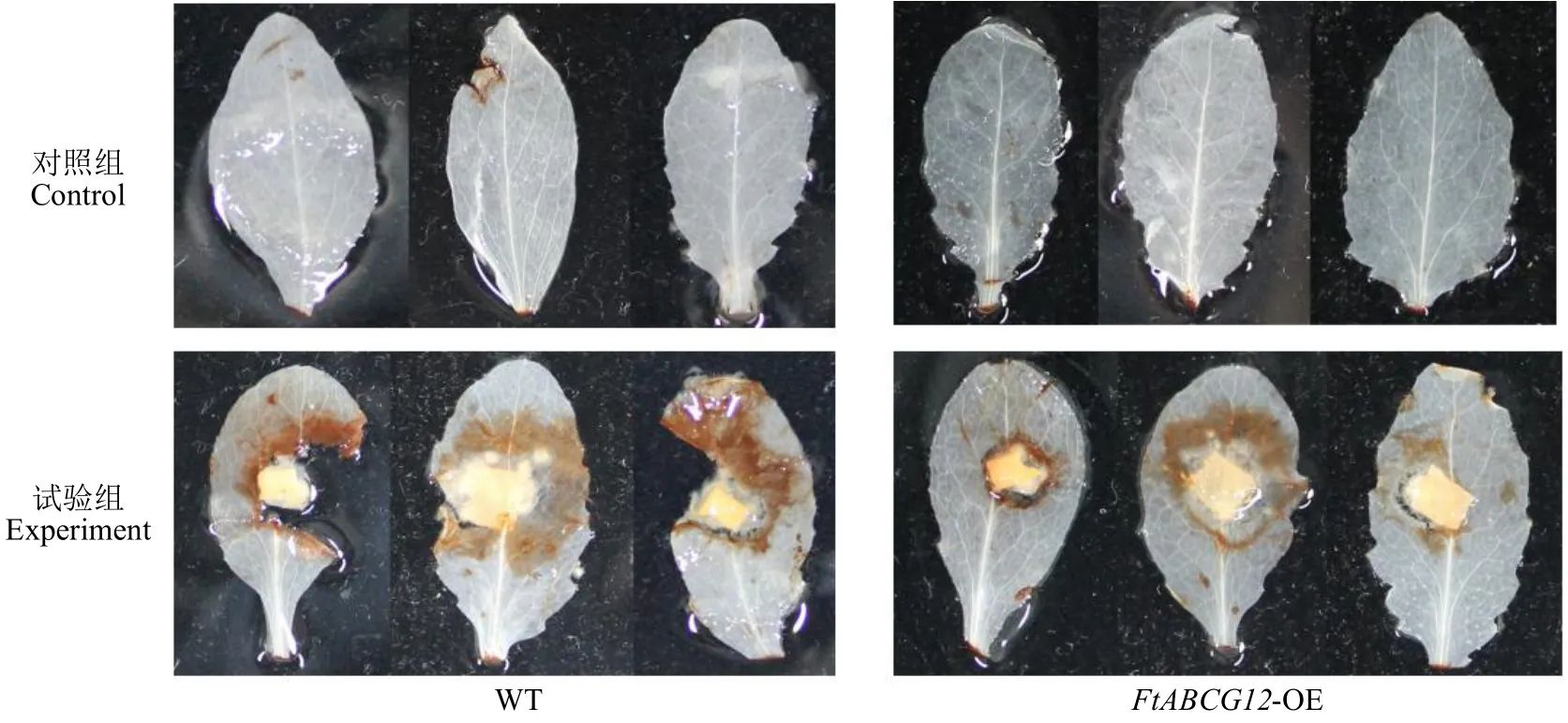
图5 转基因拟南芥的抗病性DAB 染色验证Fig.5 DAB staining for resistance of transgenic A.thaliana
2.5 立枯丝核菌侵染FtABCG12 过表达拟南芥的表达模式
将转基因拟南芥和野生型在相同条件下培养3周,每4 株拟南芥为一组。取4 组拟南芥进行离体叶片侵染(RS-vitro),4 组离体叶片不处理(vitro),4 组拟南芥进行活体侵染(RS-living),4 组正常培养(living)。24h 后提取转基因拟南芥和野生型的RNA,反转录得到cDNA。采用qRT-PCR 方法检测转基因拟南芥和野生型在不同处理下的表达模式。
如图6 所示,离体情况下,野生型不处理(WT-V)和立枯丝核菌侵染后(WT-RS-V)相对表达量变化不显著;相反,转基因拟南芥相较于不处理(GOE-V),立枯丝核菌侵染(GOE-RS-V)后的相对表达量显著提高。活体条件下的结果与之一致,在野生型中,正常培养的拟南芥(WT-L),其FtABCG12基因的相对表达量较低,当被立枯丝核菌侵染24h(WT-RS-L)后,相对表达量有轻微的上升;而在转基因拟南芥中,正常培养的转基因拟南芥(GOE-L),其FtABCG12基因的相对表达量较高,侵染条件下(GOE-RS-L)相对表达量有显著提高。在被立枯丝核菌侵染时,相对于野生型,转基因拟南芥的FtABCG12基因表达量显著提高。当转基因拟南芥被立枯丝核菌侵染时,其体内FtABCG12基因会作出对应的生物化学反应,但具体的反应模式尚不清楚。
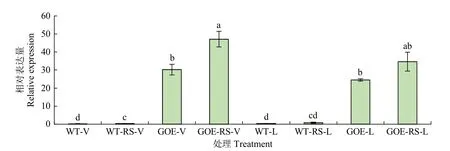
图6 转基因拟南芥中的表达模式Fig.6 Expression patterns in transgenic A.thaliana
2.6 拟南芥抗病性相关生理生化指标分析
如图7 所示,在野生型拟南芥WT 未经处理和经立枯丝核菌侵染24h 条件下,POD 活性没有显著性差异;而在FtABCG12-1307 过表达株系GOE 中,拟南芥POD 活性在经立枯丝核菌侵染24h 后显著升高。野生型拟南芥WT 在病菌侵染下,其体内SOD 活性的变化与正常培养下无显著差异;而在过表达株系GOE 中,与正常生长条件相比,被立枯丝核菌侵染24h 后,GOE 体内的SOD 活性显著升高。结果表明,过表达株系GOE在被立枯丝核菌侵染时,其体内的POD 和SOD活性均会提高,表明过表达株系GOE 抗病性较野生型WT 强。
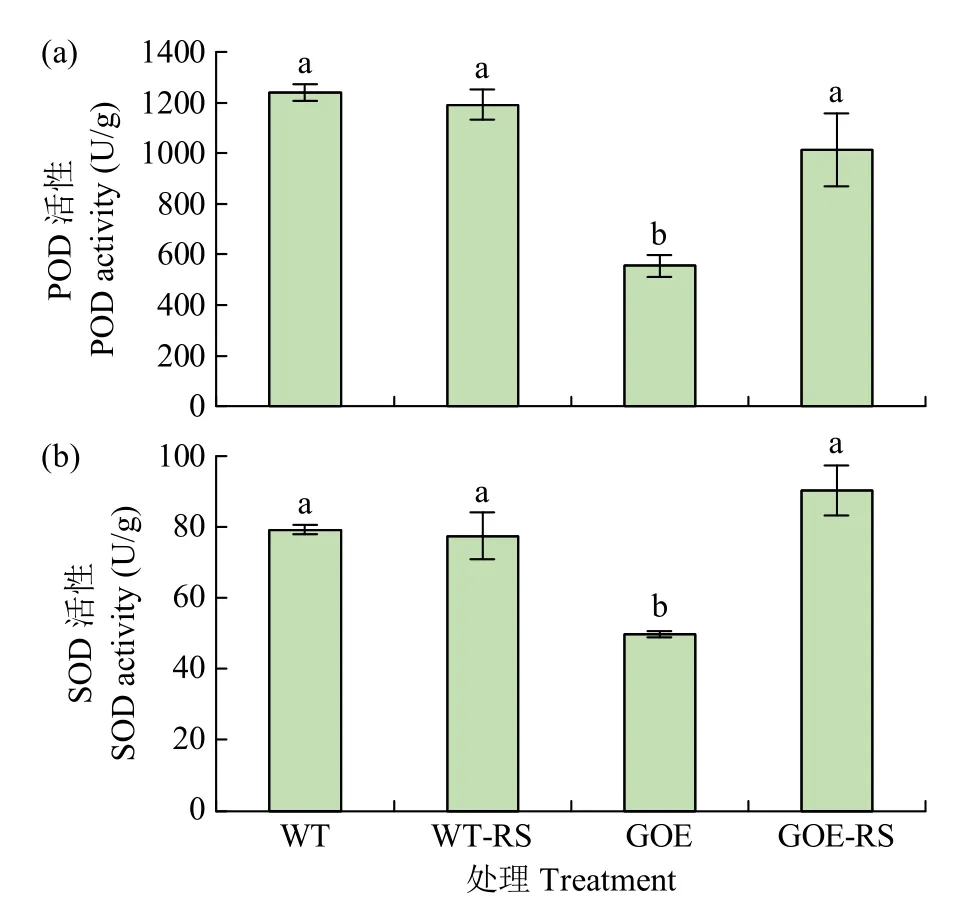
图7 转基因拟南芥的抗病性相关生理生化指标分析Fig.7 Analysis of physiological and biochemical indices related to disease resistance in transgenic A.thaliana
3 讨论
立枯丝核菌是广泛存在于世界各地的植物土传病原真菌,能够感染多种作物,引起种子腐烂、幼苗萎蔫和根腐病等,严重危害植物的生长进而影响产量和品质[19-20]。
刘博等[21]在分析玉米纹枯病病菌γ-谷氨酰转肽酶基因表达特性时,发现不同时间点该基因均有表达,且在立枯丝核菌侵染玉米叶片24h 表达量最高。受到立枯丝核菌侵染时,FtABCG12在苦荞根、茎和叶中各个时间点也都有表达,且在24h表达量同样达到最高。因此,推测FtABCG12基因在病菌侵入时受立枯丝核菌诱导,且基因的表达与立枯丝核菌的侵染时间密切相关,进而可以调节植物本身的抗病性。
本研究中,FtABCG12基因的表达量明显受立枯丝核菌侵染的诱导,且在叶中表达量最高,具有明显的组织特异性,说明在苦荞中FtABCG12基因是奢侈基因。Olga 等[22]对大蒜进行病菌侵染时,发现大蒜体内的AsPR1基因表达量明显增加,植物本身形成了一定的防御机制。推测在立枯丝核菌侵染苦荞时,苦荞自身形成了防御机制,FtABCG12基因表达量增加,提高了苦荞的抗病性。
为进一步研究拟南芥中FtABCG12基因的生理生化性质,在不同处理下对野生型和过表达植株GOE 中的POD 及SOD 活性进行测定,试验结果显示,野生型中立枯丝核菌侵染前后POD 和SOD 活性均无显著变化,而GOE 中在病菌侵染后POD 和SOD 活性明显增强。POD 和SOD 可降低自由基对细胞膜的损伤[23]。李易初等[24]发现,大豆菌核病致病菌致病力的强弱与POD 和SOD 活性相关。因此,推测POD 和SOD 活性可能与立枯丝核菌致病性相关。综上,过表达植株GOE 在立枯丝核菌侵染后,其POD 和SOD 活性增加,提高了植物的抗病性。
4 结论
从苦荞中克隆得到FtABCG12基因,在立枯丝核菌侵染24h 后,其在苦荞根、茎和叶中表达量均有显著增加,且在叶中表达量最高,表明FtABCG12基因受立枯丝核菌诱导表达。过表达拟南芥离体叶片侵染和DAB 染色结果说明FtABCG12基因具有显著的抗病性。在立枯丝核菌侵染条件下,FtABCG12转基因拟南芥植株GOE的POD 和SOD 活性较对照植株野生型显著提高,其抗病能力显著高于对照。

