玉米抗真菌病害基因挖掘与分子育种利用研究进展
温胜慧 杨俊伟 王洋 李公建 翁建峰 段灿星 贾鑫 王建军
(1 山西农业大学玉米研究所/国家植物保护忻州观测实验站,034000,山西忻州;2 中国农业科学院作物科学研究所,100081,北京)
玉米是我国主要粮食作物之一,可作饲料、食品原料和工业原料等,对国民经济发展有巨大的推动作用。根据国家统计局数据,2020 年我国玉米播种面积达4126 万hm2,约占粮食作物播种面积的35%,产量达26 067 万t,约占粮食总产量的39%[1]。近年来,在全球气候变化的背景下,耕作制度的转变、种植品种过于单一以及种植面积逐渐增加等因素使得玉米病虫害流行加重,给生产带来了巨大挑战[2]。例如,2015 年玉米南方锈病大爆发,全国发病面积约523.9 万hm2,其中黄淮海夏玉米发病面积占全国发病面积的87.8%,且大部分地区发生程度均比往年严重[3]。2020 年全国锈病发病面积约273.19 万hm2,比2019 年增加78.1%,尤其在黄淮海及西北部分地区发生较重[4]。据统计,目前我国玉米病害已有40 余种,在不同地区均有分布,严重影响玉米的产量与品质[5]。因此,控制玉米病害对于保障玉米的安全生产具有重要意义,而种植抗病品种是控制病害的安全有效措施。筛选和鉴定抗病种质资源,研究病害抗性遗传、挖掘抗病优异等位基因并解析其抗病机制,对推进玉米抗病品种培育具有重要意义[6]。
1 常见玉米真菌病害抗性遗传与基因克隆
1.1 叶部真菌病害
由真菌侵染造成的玉米病害有多种,其中发生玉米叶部常见的病害有圆斑病、大斑病、小斑病、灰斑病和锈病等,许多国内外学者针对上述病害开展了生理小种的分离鉴定和抗性遗传研究,定位了一批抗病位点,克隆了候选抗病基因。
1.1.1 圆斑病 圆斑病是由玉米生平脐蠕孢(Bipolaris zeicola)侵染引起的病害[7],目前已报道的圆斑病菌生理小种有5 个,我国主要在东北地区发现CCR1 和CCR2 生理小种,在西南地区发现CCR3 小种,暂未报道CCR0 和CCR4 生理小种[8]。马秉元[9]研究表明,玉米对圆斑病病原菌1 号生理小种的抗性是显性单基因控制的,而对3 号生理小种的抗性受多基因控制。1992 年,Johal 等[10]和Sindhu等[11]通过转座子标签技术克隆了玉米第1 个抗病基因Hm1,该基因表现出对玉米圆斑病菌1号小种的抗性。另外,位于玉米9 号染色体上的抗性基因Hm2 对生理小种CCR1 具有抗性,但仅在成熟期发挥作用[11-12]。
1.1.2 大斑病 玉米大斑病是由大斑凸脐蠕孢(Exserohilum turcicum)侵染引起的病害[7],Weems等[13]在美国鉴定了20 个不同的玉米大斑病菌生理小种,目前我国已鉴定的生理小种有16 个[14]。大斑病的抗性遗传一般受多基因控制,且不同抗性基因对生理小种具有特异性。Chung 等[15]研究表明,DK888 的抗性基因qNLB8.06 与Ht2 基因功能相关且紧密连锁,其抗性具有小种特异性且表现为不完全显性,仅对0 号和1 号生理小种具有抗性。Chen等[16]利用K22 和By815 构建重组自交系(RIL),在2 个环境中均鉴定到了QTL qNCLB1.03 和qNCLB5.04,其中5 号染色体上(bin5.04)的qNCLB5.04 效应最大。Wang 等[17]利用掖478 和齐319 重组自交系在2 个环境中共检测到与0 号生理小种抗性相关的11 个QTL,人工接种后每个QTL可以解释抗病性表型变异的3.53%~15.29%,其中7号染色体上的qNCLB7.02 效应最大。Xia 等[18]分别以BB(B73×B97)和BC(B73×CML322)为群体材料,在3 号和1 号染色体上鉴定到最多的抗性基因/QTL。Ranganatha 等[19]以抗性自交系SKV50 和感病自交系CML153 进行杂交,在2、5、8 号染色体上检测到3 个抗病QTL,其中qNCLB-8-2 可以解释16.34%的表型变异。目前,Hurni 等[20]以B37Htn1 与SE、RP1、RP3、RP4 为亲本成功克隆到位于8 号染色体上的Htn1 基因;Yang 等[21]以A619Ht2×RP5 和A619Ht3×RP6 为亲本成功克隆到Htn1 的等位基因Ht2/Ht3,Htn1 与Ht2/Ht3 基因均为编码细胞壁相关受体蛋白激酶ZmWAK-RLK1 的等位基因,其氨基酸的多态性导致胞外结构域的差异。
1.1.3 小斑病 小斑病是由玉蜀黍平脐蠕孢(Bipolaris maydis)侵染引起的病害[7],其病原菌主要包括4 种生理小种[22],目前鉴定到的抗病基因较少。蒋锋等[23]以玉米抗、感自交系T14 和T18为亲本,分别在4 号和6 号染色体上定位了4 个和1 个抗小斑病的QTL。之后又以甜玉米T8 和T33为亲本,在3 号染色体标记区间umc1746~bnlg1523和5 号染色体标记区间umc1746~bnlg1523 检测到3个主效QTL[24]。Balint-Kurti 等[25]研究表明,染色体上bin3.04 和bin6.01 是鉴定小斑病抗性QTL 的重要区域。Zhao 等[26]以H95rhm与H95 为亲本构建群体,将6 号染色体上的玉米小斑病隐性抗病基因座rhm1 定位在InDel 标记IDP961-503 与SSR 标记A194149-1 之间的8.56kb 区间,并鉴定到rhm1 的1 个关键候选基因LHT。Xu 等[27]在玉米自交系B73的10 号染色体上克隆到1 个与小斑病抗性相关的NBS 基因ZmNBS42,该基因作为抗病性的重要调节剂,在玉米根、叶和茎等多个组织的生长发育过程中均有较高的表达。
1.1.4 灰斑病灰斑病主要由玉蜀黍尾孢(Cercospora zeae-maydis)或玉米尾孢(Cercospora Zeina)侵染引起[7],其抗性多表现为加性遗传效应。Liu 等[28]以抗、感自交系YML 32 和掖478 为亲本构建群体,鉴定了抗灰斑病主效QTL qRgls.yaas-8-1/qFt.yaas-8。Du 等[29]以抗、感自交系Q1 和掖478、郑58 构建DH 群体,并检测到22 个QTL,其中qGLS_YZ2-1 位于2 号染色体上2.40Mb 的基因组区域内。Sun 等[30]以抗、感自交系WGR 和DZ01 为亲本构建群体,在1 号染色体上2.38Mb 区域内鉴定了灰斑病主效抗性QTL qRgls1.06,该位点为灰斑病抗性热点区域,可解释55.0%的表型变异。Lü等[31]在齐319 自交系的1 号染色体约314kb 基因组区域内鉴定了主效抗病QTL qGLS1.02,可解释6.86%~36.24%的表型变异。Xu 等[32]利用高抗自交系Y32与高感自交系Q11 构建群体,在8 号染色体1.4Mb区间精细定位了主效QTL qRgls1,病情指数降低12.2%~29.0%,并通过筛选Y32BAC 文库等鉴定了qRgls1 的抗病候选基因ZmWAK-RLK 以及与其互作的ZmHR-like 蛋白[33-34];在5 号染色体(bin5.03-5.04)上鉴定的灰斑病抗性QTL qRgls2 表现显性加性遗传效应,能够提高20.6%~24.6%的抗病性,进一步利用分子标记及PCR 技术筛选Y32BAC 文库,通过指纹图谱分析及序列比对等技术鉴定了qRgls2 的主效基因ZmPK,其表达量与抗病性呈负相关[32,35]。Welgemoed 等[36]将10 号染色体上鉴定的抗性QTL 导入B73 产生B73-QTL,并通过RNAseq 分析鉴定到抗灰斑病候选基因L-RLK-CML,该基因为编码凝集素受体样激酶的新型等位基因。
1.1.5 锈病玉米普通锈病由高粱柄锈菌(Puccinia sorghi)侵染引起,南方锈病由多堆柄锈菌(Puccinia polysora)侵染引起[7]。Collins 等[37]通过基因标记和转座子标签等技术成功克隆了抗玉米锈病的基因Rp1-D。张小利[38]以冀库12 和黄早四进行杂交,通过田间接种鉴定表明冀库12 的抗性由一对显性基因控制,并在10 号染色体(bin10.02)上鉴定了Rpp12。Lu 等[39]通过掖478和齐319 构建的RIL 群体及高密度遗传图谱定位了5 个抗南方锈病的QTL,其中qSCR6.01 效应值最高,为主效抗性位点。Deng 等[40]在自交系CIMBL83的4 号染色体上鉴定到qSCR4.01,其可以解释总表型变异的48.0%~65.0%。陈文娟等[41]利用黄早四和W456 为亲本构建的遗传群体检测到6 个抗病QTL,位于10 号染色体上的qSCR10 能够解释表型变异的24.19%。Zhou 等[42]将齐319 自交系10 号染色体上鉴定到的抗性基因RppQ 定位在SCAR 标记MA7 和AFLP 标记M-CCG/E-AGA 157 之间。Zhao等[43]以自交系P25 和F349 为亲本在10 号染色体上鉴定了一个约40kb 的抗南方锈病基因座RppP25及一个编码NBS-LRR 蛋白的候选基因。另外,在自交系W2D、SCML205、P25、1484(Jing2416k)、CML470 及CML496 的10 号染色体上也分别定位了抗南方锈病的基因RppD[44]、RppS[45]、Rpp3[46]、RppM[47]、RppC[48]及RppCML496[49],并将RppM定位在110kb 的区域,主效抗病QTL RppCML496可解释43.0%~78.0%的表型变异。上述研究表明10号染色体是富含南方锈病抗性基因的主要染色体,尤其在染色体bin10.00-10.02 区域含有多个抗南方锈病基因。
1.1.6 多种病原菌同时侵染 自然界中植物往往会同时受到多种病原菌的侵染,在自然选择压力下会进化出广谱抗性基因。目前,对玉米真菌病害广谱抗性的研究主要集中在大斑病、小斑病与灰斑病上,Martins 等[50]对这3 种病害的抗病性QTL 进行共定位,并构建F2:3群体对病害相关的抗性标记进行基因分型,确定了与3 种病害抗性相关的2 个多重抗病性(multiple disease resistance,MDR)QTL。Yang 等[51]在玉米自交系NC292(NC250×B73)的9 号染色体上鉴定了与上述3 种叶斑病相关的抗病基因qMdr9.02,并鉴定了与小斑病和灰斑病抗性相关的微效持久性抗病基因ZmCCoAOMT2。Wang等[52]在大刍草中成功克隆了抗3 种病害的基因ZmMM1,该基因编码含MYB-DNA 结合域的转录抑制因子,并在含有大刍草基因组片段的导入系C117 的7 号染色体上克隆了控制ZmMM1 蛋白翻译水平与病斑表型的稀有主效QTL qLMchr7,揭示了玉米广谱抗病的分子机制。另外,Chung 等[15]研究表明,玉米染色体bin8.05-8.06 是与多种病害抗性相关的重要区域。Ranganatha 等[19]研究发现,抗性自交系SKV50 的染色体bin8.03、bin5.03、bin5.04 以及bin3.04 区域存在对玉米大斑病和南方锈病等多种病害共同抗性的目标QTL。Chung等[53]在自交系B73 上鉴定到qNLB1.02 与大斑病、斯图尔特枯萎病和普通锈病抗性有关,在Tx303 上鉴定的qNLB1.06 与大斑病和斯图尔特枯萎病抗性有关。
1.2 茎部真菌病害
1.2.1 茎腐病 茎腐病主要是由镰孢菌(如禾谷镰孢Fusarium graminearum)或腐霉菌(如肿囊腐霉Pythium inflatum)单独或复合侵染引起[7],较多学者对此病害进行了抗性基因定位及遗传机制的解析。Song 等[54]首次在自交系齐319 中鉴定到2 个独立遗传的显性抗腐霉茎腐病基因RpiQI319-1 和RpiQI319-2,分别定位于bin1.03 和bin10.02;有研究者[55]在自交系X178 中也鉴定到2 个新的显性抗腐霉茎腐病基因RpiX178-1 和RpiX178-2,分别定位于bin1.09 和bin4.08。Pè等[56]利用抗、感自交系B89 和33-16 构建的群体鉴定了5 个抗性QTL。Ma 等[57]以抗、感自交系H127R 和昌7-2 构建的RIL 群体,在3 号染色体上约350kb 区域内检测到镰孢茎腐病的隐性抗性基因座qRfg3,占表型变异的10.7%~19.4%,可将病害发生严重程度降低约1/4。Chen 等[58]以自交系18237 和S72365 为亲本在8 号染色体上精细定位了抗镰孢茎腐病QTL Rgsr8.1,并在该区域鉴定到2 个候选抗性基因。也有研究者[34,59-61]以1145 和Y331 为亲本,分别在10和1 号染色体上鉴定了qRfg1 和qRfg2,qRfg1 插入Y331 基因组可以将植株的抗性稳定提高32.0%~43.0%,其抗性基因ZmCCT10 包含CCT 结构域,通过修饰启动子区的作用元件可以导致抗性基因表达量发生变化,从而调控植物光周期与抵御禾谷镰孢菌侵染之间的平衡;qRfg2 的抗性基因ZmAuxRP1 编码质体基质定位的生长素调节蛋白,可以快速响应病原菌的侵染,其表达量与茎腐病抗性呈负相关。另外,Frey 等[62]通过转座子标签在MP305 自交系4 号染色体上鉴定了与炭疽茎腐病抗性相关的基因Rcg1。
1.2.2 纹枯病 纹枯病是由茄丝核菌(Rhizoctonia solani)、禾谷丝核菌(Rhizoctonia cerealis)、玉蜀黍丝核菌(Rhizoctonia zeae)等病原菌侵染引起的病害[7],唐海涛[63]研究表明,玉米纹枯病的抗性遗传不仅受到主效基因的控制,也受微效基因的影响,其抗性基因的表达为组成型表达,不受病原菌的诱导而表达。程伟东等[64]研究表明,玉米纹枯病的抗性遗传由2 对主效基因与多个微效基因混合控制。赵茂俊等[65]以抗、感自交系R15 和掖478 为亲本构建的群体检测到9 个QTL,其中2 个抗病QTL位于染色体抗性基因簇6.01 附近。林海建等[66]以抗、感自交系R15 和掖478 为亲本构建群体,以病情指数与病斑高(病斑向上蔓延高度与穗位高之比)2 个指标共检测到18 个抗性QTL。Li 等[67]通过全基因组关联分析鉴定了与纹枯病抗性相关的28 个SNP,并克隆了位于4 号染色体上抗病基因ZmFBL41,该基因定位于细胞质,编码F-box 蛋白,通过与ZmCAD 相互作用调节对纹枯病的抗性。
1.3 穗部真菌病害
1.3.1 丝黑穗病 丝黑穗病是由丝孢堆黑粉菌玉米专化型(Sporisorium reilianum)侵染引起的病害[7],常发生在玉米雌穗和雄穗上,刘玲玲等[68]以抗、感自交系吉846 和掖3189 为亲本鉴定了10 个抗丝黑穗病QTL,其中bin2.09 和bin9.04 上的QTL具有较高的表型贡献率,且bin9.04 上鉴定的QTL能够在3 年内稳定表达。Weng 等[69]以Mo17 和黄早四构建群体将主效QTL qHS2.09 精细定位在1.1Mb 的区间,与抗性最显著相关的SNP PZE 102187611 可解释39.7%~44.4%的表型变异;Li等[70]研究表明,丝黑穗病的抗性由加性和上位效应控制,并以齐319 和黄早四为亲本鉴定了q2.09HR和q5.03HR。Chen 等[71]分别以吉1037 和黄早4 构建群体在玉米染色体bin2.09 上鉴定了抗丝黑穗病主效QTL qHSR1,可将病害发生率降低约1/4。Li等[72]以Mo17 和黄早四构建群体鉴定到5 个QTL,其中主效QTL qHSR1 可解释43.7%的表型变异;Zuo 等[73]图位克隆了qHSR1 的抗病候选基因ZmWAK,该基因为编码细胞壁相关激酶的数量性状基因。
1.3.2 穗腐病 穗腐病可以由多种病原菌引起,常见的病原菌有轮枝镰孢(Fusarium verticillioides)、禾谷镰孢(Fusarium graminearum)、黄曲霉(Aspergillus flavus)及绿色木霉(Trichoderma viride)等[7]。Li 等[74]以BT-1 和N6 构建群体检测到4 个抗穗腐病QTL,其中4 号染色体上的bin4.06效应最大。Ding 等[75]以87-1 和综3 构建群体,在bin3.04 上鉴定的QTL 可解释13.0%~22.0%的表型变异。Wen 等[76]利用3 个高抗穗腐病的自交系承351、丹598 和吉V203 分别与感病品系ZW18 杂交形成的3 个F2群体,共检测到20 个穗腐病抗性相关QTL,其中qRfer1、qRfer10 和qRfer17 占表型变异的比例分别高达26.58%~43.36%、11.76%~18.02%和12.02%~21.81%。Guo 等[77]通过全基因组关联分析(GWAS)在509 个不同的自交系中鉴定了23 个与穗腐病抗性相关的SNP,并鉴定到1 个可能包含穗腐病重要抗性基因的关键位点bin10.03,该位点在之前研究[75,78]中已有报道。Kebede 等[79]利用B73 和CO441 构建的含410 个家系的重组自交系检测到可提高禾谷镰孢穗腐病抗性和改善籽粒干枯率的多效性QTL。Butrón 等[80]研究表明,3 号染色体上210~220Mb 区域和7 号染色体上166~173Mb 区域是包含抗病QTL 的关键区域。Gao 等[81-82]研究表明,植物脂肪氧化酶LOX控制的寄主-病原物互作具有特异性,通过玉米LOX 表达序列标签在自交系B73 上鉴定的9-LOX抗病基因cssap 92(ZmLOX3)对黄曲霉穗腐病具有特异抗性,插入转座子产生的ZmLOX3 突变体受拟轮枝镰孢菌侵染时,产生的分生孢子与毒素均显著减少,然而ZmLOX3 被破坏的lox3-4 突变体被黄曲霉侵染时,在籽粒上会产生更多的分生孢子和黄曲霉毒素;Christensen 等[83]在自交系B73 上成功鉴定并克隆了抗拟轮枝镰孢的9-LOX 基因ZmLOX12。
2 玉米真菌病害抗性机制
随着高通量基因组测序、组装及转录组研究的不断深入,越来越多的抗病基因被成功克隆,对病原菌致病与玉米抗病互作机制的研究也越来越深入。当病原菌侵染植物时,植物会形成一系列复杂的防御机制来阻止病原菌的侵染,病程相关分子模式触发的免疫反应(PAMP-triggered immunity,PTI)与效应因子触发的免疫反应(effector-triggered immunity,ETI)是2 种主要抗性机制。PTI 是病原物分泌的PAMPs 被植物中的模式识别受体PRR 特异性结合并激活植物抗病信号阻止病原菌侵染的过程,植物中的PRRs 主要包括受体类激酶及细胞壁相关激酶等;ETI 是当PTI 反应产生后,病原菌为继续侵染寄主会分泌一些效应蛋白干扰识别受体对PAMPs 的识别,此时植物体胞内受体会直接或间接识别病原菌特异性的效应蛋白,激活寄主特异的免疫机制[84-85]。2 种机制往往协同作用共同抵御病原菌的侵染,在PTI 机制中常伴随细胞壁功能增强及次生代谢物的合成等来阻止病原菌侵染与定植,而ETI 机制则通过在侵染点形成过敏性坏死反应等限制病原菌生长与繁殖,另外抗病蛋白还可以直接或间接识别病原菌分泌的特异效应蛋白而引起ETI 免疫反应,但在PTI 和ETI 机制中也会产生一些重叠的免疫反应,如活性氧的产生及通过植物激素信号激发抗性反应等,目前常见的植物激素包括水杨酸、茉莉酸和乙烯等[86-89]。
2.1 细胞壁相关激酶基因等激发的免疫反应
编码细胞壁相关的受体类激酶基因可以识别病原菌效应分子,跨越质膜感知与转导细胞外信号分子激活免疫反应。定位于质膜的大斑病抗性基因Htn1(ZmWAK-RLK1)及等位基因Ht2/Ht3 即通过该机制发挥作用,另外它们还通过减少病原体渗入宿主组织以及减少BX 次生代谢产物等来增强玉米对大斑病的抗性[20-21,90]。玉米抗灰斑病功能基因ZmWAK-RLK 定位在细胞膜上,也作为受体激酶来识别胞外信号。玉米抗丝黑穗病基因ZmWAK 编码细胞壁相关激酶,当病原菌从玉米幼根侵入韧皮部组织后,ZmWAK 在围绕韧皮部的薄壁细胞中高表达,激活水杨酸依赖的抗病基因,抑制病原菌的顶向生长,从而达到最佳的抗病效果[73]。
2.2 植物组织结构的变化
植物细胞壁形态的改变可以提高植物抗病能力,木质素渗入细胞壁中可促进机械组织形成及水分疏导,增强植物抵御病原菌侵害的能力。小斑病和灰斑病的微效持久性抗病基因ZmCCoAOMT2 会在病原菌侵染后诱导表达,通过参与苯丙素通路影响木质素的合成,从而增强细胞壁功能,提高植株抵御病原菌侵染的能力,同时在拟南芥中,该基因的同源基因同样也通过类似的机制参与多种抗性过程[51]。纹枯病抗病基因ZmFBL41 编码蛋白的LRR 结构域通过泛素化等蛋白修饰作用发生遗传变异后,丧失了与木质素合成关键酶-肉桂醇脱氢酶ZmCAD 的互作能力,从而保证细胞壁木质素正常合成,增强玉米抗病性[67]。
2.3 植物保卫素的合成与积累
次生代谢物合成等是植物抗病的重要途径,植物抗病基因可以通过影响代谢物的合成或调控代谢物表达量触发植物免疫反应,增强植物抗病性。位于叶绿体的基质中的茎腐病抗病基因ZmAuxRP1 通过影响吲哚-3-乙酸(IAA)和苯并恶唑嗪酮类化合物(BXs)的生物合成调节植物生长与防御的平衡,ZmAuxRP1 高表达时促进植物生长,当病原菌侵染时,其表达量下降利于BXs 的合成,提高抗病性,但会导致根生长停滞[61]。脂氧化酶代谢通路中的产物会以植物激素信号等方式参与植物防御反应,qMdr9.02 在受到小斑病菌的侵染后抗性植株中会积累更多的氧脂含量,而感病植株中肉桂酸等植物激素的含量更高[51]。另外,维生素代谢、苯丙烷生物代谢途径等也直接或间接在玉米抗病免疫调控中起关键作用,次生代谢物萜类植物抗毒素、幼苗中形成的含盐化学防御素BXs、玉米倍半萜化合物类植保素(zealexins)、二萜植保素类物质(kauralexin)和倍半萜烯合成酶和细胞色素P450 等在抵御病原菌侵染过程中也发挥重要作用,不同基因簇还可能相互作用提高植物抗病性[91-93]。
2.4 植物抗病基因的直接或间接识别
LRR 类植物R 基因及含有特殊结构域的抗病基因能直接或间接识别病原菌激发植物抗性反应,如克隆的第1 个抗病基因玉米圆斑病抗性基因Hm1[10],目前克隆的NBS-LRR 类植物R 基因还有抗玉米锈病的基因Rp1-D 及抗南方锈病的RppCML496 等[37,49]。
2.5 水杨酸和茉莉酸等信号分子介导的防御反应
水杨酸和茉莉酸作为防御反应中的信号分子,可以诱导植物系统获得抗性,调控防御基因的表达,抑制或延缓病原菌的生长与发育,增强植物抗性。Wang 等[94]研究表明,ZmREM1.3 通过水杨酸/茉莉酸介导的防御信号通路来积极调节玉米对锈菌的防御,过量表达ZmREM1.3 会导致水杨酸和茉莉酸的积累。小斑病抗病基因ZmNBS42 在受到小斑病病原菌侵染或水杨酸处理的诱导时表达会显著上升,在拟南芥中过表达该基因可以提高水杨酸的含量及防御基因的表达[27]。在抗拟轮枝镰孢的9-LOX 基因ZmLOX12 中插入转座子产生的突变体更易受到拟轮枝镰孢的侵染,并伴随着茉莉酸前体及生物合成基因表达水平的降低[83]。
2.6 活性氧迸发
活性氧及H2O2等过氧化物的积累可以造成局部组织坏死,从而阻止病原菌的扩散,植物的NLR蛋白还可通过与转录因子的相互作用来调控活性氧的生成,激活植物免疫反应。大斑病、小斑病和灰斑病广谱抗性基因ZmMM1 通过抑制ZmMT3的转录水平,增强植物体内活性氧的积累,从而增强植物对多种病害的广谱抗病性[52]。
3 玉米抗真菌病害的主要基因资源
国内外学者通过玉米种质资源抗病性鉴定筛选出了针对各种病害的抗病资源,并在此基础上挖掘了众多的抗病QTL 或基因,各病害主要抗病基因位点及自交系来源见表1,上述抗病位点或基因主要来源于具有热带或亚热带血缘的自交系材料,这些位点或基因优良单倍型的鉴定为玉米抗病分子育种利用提供了资源。
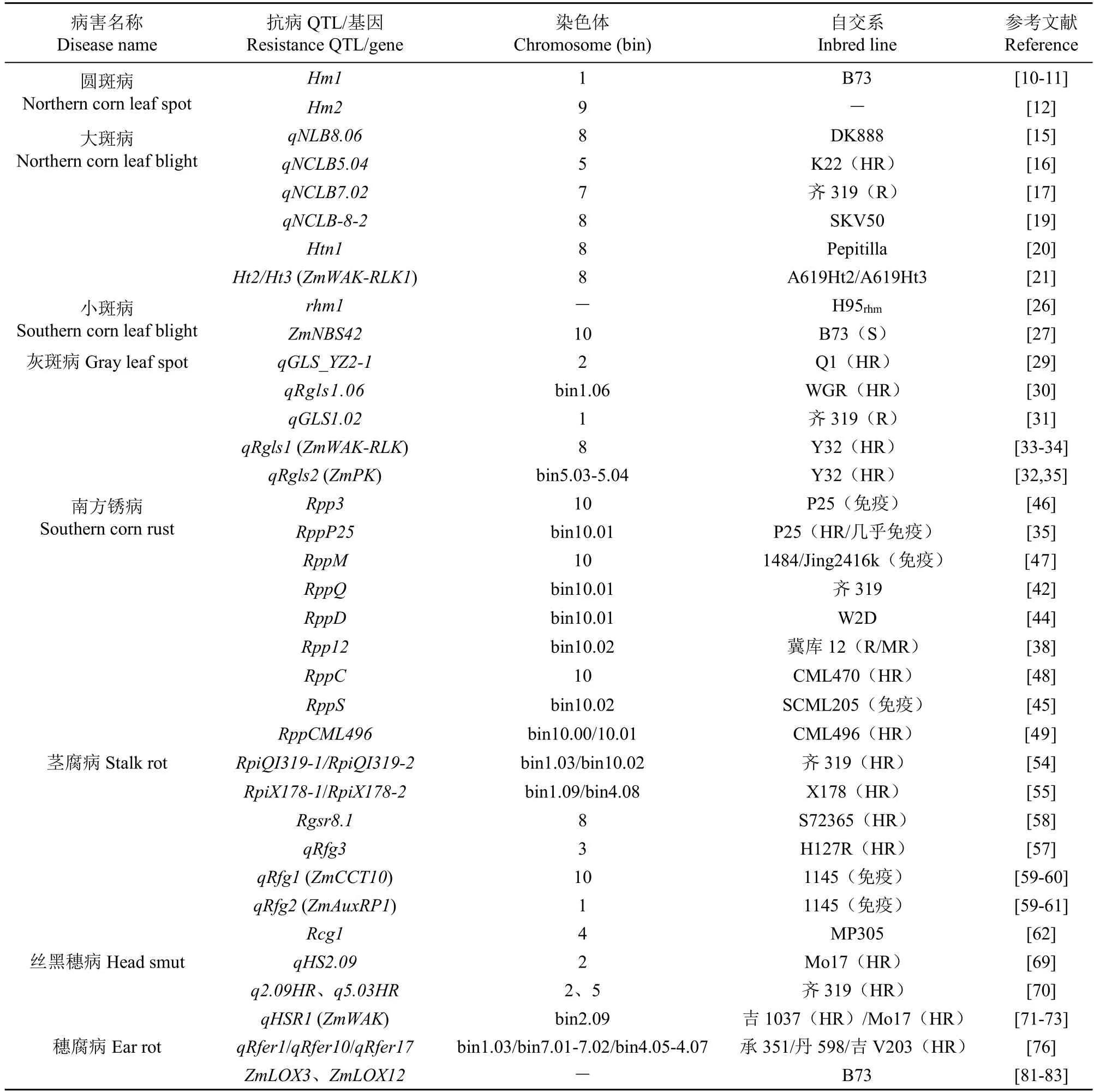
表1 玉米抗真菌病害主要基因自交系资源Table 1 Inbred line resources of resistance genes of fungal diseases in maize
4 玉米抗真菌病害分子育种应用与展望
培育和种植抗病品种是解决病害最经济有效的措施,抗性资源的筛选、抗病基因的定位与克隆为抗病育种奠定了基础。随着单一抗病品种的大面积种植,品种抗性逐渐减弱,同时新的病害生理小种不断出现,广谱持久抗病基因及其优良抗病单体型相对匮乏,抗病基因的研究与利用仍有以下几个方面亟待解决。
4.1 抗性资源的筛选鉴定
应加大玉米种质抗病鉴定与评价力度,筛选优异抗性资源,挖掘新的优异抗病等位基因。目前大量的玉米种质资源尚未开展抗病鉴定,或仅针对部分病害进行抗性评价。因此,需进一步加强玉米种质资源对不同病害的抗性鉴定评价,同时积极引进国外优良抗病自交系,拓展抗性种质资源。加快构建病害生理小种的标准鉴别体系,加强对玉米主产区田间病害种群结构及生理小种变异的监测,加强对不同生理小种抗病种质资源的筛选鉴定及生理小种遗传研究。
4.2 广谱抗性基因的挖掘与利用
大斑病、圆斑病和小斑病等病害的病原菌生理小种复杂多变,随着全球气候变暖,病原菌生理小种会出现较大的变异,不同地区优势小种也在逐渐变化。目前已鉴定的抗病基因大多只对单一病原菌具有抗性,或只对病原菌群体中的一个或几个特定小种具有抗性,培育的抗性品种很难同时抵御多种病原菌或多个生理小种的侵染。广谱持久抗病基因的严重匮乏限制了多抗优质品种的培育,因此加快挖掘广谱抗性的调控基因意义重大;GWAS 等多组学技术的发展与应用也为抗性基因的快速鉴定提供了技术支撑。
4.3 植物抗病基因与病原菌无毒基因互作的分子机理解析
病原菌侵染寄主包括识别、侵染和繁殖等多个阶段,每个阶段寄主与病原菌之间的协同进化、共同生存涉及复杂的生物学途径及调控机制;另外植物抗病反应是由包括外界环境在内的多种因素共同作用的结果,其抗病基因通过各种不同的生理生化途径引起抗病,植物广谱持久抗病性的表现与生长发育等其他农艺性状也存在复杂的联系,因此通过组学深入研究抗病基因与病原菌无毒蛋白之间的互作关系,明确植物受体识别病原菌及抗病基因激发免疫反应的分子机制、解析PTI 与ETI 的协同抗病机制与广谱抗性的分子机制等对于抗病基因的挖掘和育种利用具有重要意义。
4.4 玉米抗病分子育种体系
4.4.1 分子标记辅助选择技术 玉米常规育种需要依赖育种者的经验,根据表型特征选择,而且会受到基因型和环境相互作用的影响,因此,选择优良的基因型和杂交组合较难,分子标记辅助选择(molecular marker assisted selection,MAS)等生物技术的发展为改良玉米抗病性状提供了重要方式,在丝黑穗病和茎腐病等病害的品种改良中已得到广泛的应用,但其容易受到QTL 的精细定位以及与目标基因紧密连锁的分子标记开发的限制。余辉等[95]利用回交转育与分子标记辅助育种相结合的技术成功选育了一批单抗丝黑穗病与单抗茎腐病的抗病改良材料。Zhao 等[96]将主要丝黑穗病抗病基因通过MAS 渗入10 个感病自交系,均表现出对丝黑穗病的抗性,且其他农艺性状不变。李莉等[97]利用MAS 技术与传统育种相结合,对骨干自交系8902、昌7-2 和吉853 等进行了改良,显著提高了抗丝黑穗病效果。邸宏等[98]通过回交及分子标记辅助选择技术改良了塘四平头类群的自交系昌7-2,在田间可以降低丝黑穗病发病率约89%。Sun等[30]利用分子标记辅助选择技术将灰斑病抗病基因qRgls1.06运用于自交系改良,显著提高了7 个玉米自交系的抗性,其中改良系DZ01RR/SL06 比改良前减少病害损失约22%。李少博等[99]以高抗南方锈病的齐319 自交系作为供体亲本,通过MAS与回交转育相结合,提高了京24 对南方锈病的抗性。张斌[100]利用MAS 技术将玉米自交系90110 携带的抗粗缩病基因与自交系齐319 携带的抗南方锈病基因RppQ聚合在一起,获得了同时抗2 种病害的材料。杨华等[101]通过分子标记辅助选择获得了高抗纹枯病的材料,并选育了渝单24 等抗性杂交种。
4.4.2 全基因组选择的分子育种技术的建立 目前使用的分子标记辅助选择常与回交转育相结合,需要考虑背景选择、回交次数、群体大小、标记数目和基因型数据等多种因素,在选择过程中一些复杂性状QTL 的表达易受环境等外在因素影响,因此建立简单规范的操作体系,提高MAS 技术应用的效益和效率具有重要意义。建立基于全基因组选择的分子育种技术,有针对性地将目标性状基因进行聚合以拓宽植物抗性是加速育种进程的关键。利用分子标记对种质资源进行杂种优势群划分,有针对性地进行杂交种组配,将遗传距离远、遗传多样性高的组合合理配置,提高新抗病系的利用效率;通过分子标记辅助选择、遗传修饰及基因编辑等技术结合单倍体诱导技术利用抗病基因改良品种已逐渐成为培育高抗优质品种必不可少的方式;通过覆盖整个基因组的分子标记来捕获变异,将基因型与表型进行全基因组关联分析,联合分析群体中的所有标记,建立模型计算育种值可以高效选择优良株系,尤其在由多个微效基因控制的数量性状改良中有重要意义。
4.4.3 基因编辑技术 随着基因编辑技术的开发与利用,通过抗病基因的插入、启动子编辑、功能位点定向编辑和感病基因敲除等方式获得抗病株系已逐渐成为分子育种新的趋势。CRISPR/Cas 技术在玉米基因组定向编辑中已有应用,Dong 等[102]利用CRISPR/Cas9 基因编辑技术培育出了甜、糯及甜糯玉米,丰富了特用玉米资源。Gao 等[103]通过CRISPR/Cas9 系统促进复杂性状基因座(complex traits of loci,CTL)的堆叠,证明位于CTL 内不同位点的2 个性状可以通过基因重组进行组合,促进了多性状玉米杂交种的培育,未来应加强CRISPR/Cas9 基因编辑技术在玉米抗病育种中的利用。目前,基因编辑技术在其他病原菌诱导的禾本科植物病害如水稻白叶枯病、条斑病、稻瘟病及小麦白粉病等抗病育种中被广泛应用。通过TALEN 诱导突变及CRISPR/Cas9 技术在3 个MLO蛋白的同源等位基因中引入靶向突变,增强了小麦白粉病的可遗传广谱抗性,并产生了携带突变的转基因小麦[104]。通过CRISPR/Cas9 基因编辑技术敲除感病基因Pi21或Bsr-d1可增强对稻瘟病的抗性,而敲除感病基因Xa5增强对白叶枯病的抗性,同时敲除这3 个感病基因可获得对稻瘟病与白叶枯病均具有抗性的株系[105]。抗水稻白叶枯病基因Xa23是多数水稻携带的基因,但其广谱抗性的表达需要EBEAvrxa23元件,通过CRISPR/Cas9 技术将EBEAvrxa23元件插入感病品种ORFxa23的启动子区,创制出了其他农艺性状不受影响、但对20 个白叶枯病病原菌小种高抗的株系[106]。Oliva 等[107]也通过CRISPR/Cas9 技术在易感基因启动子区引入突变培育了广谱抗性水稻品系。上述研究为玉米抗病分子育种提供了新思路。

