球磨改性的氟化石墨烯/玻璃离子水门汀的力学性能、抗菌效果和生物相容性研究
孙莉 赵忠芳 司庆宗
1972 年,Wilson等[1]将玻璃离子水门汀(GICs)引入牙科行业,因为它能与牙体组织形成化学性粘结,具有释氟性及好的生物相容性[2],而得到广泛应用。然而,GICs在力学性能方面的局限性也限制的其应用,尤其在一些受力区域[3]。为了克服 GICs的缺点,学者们研究出强度高于GICs的树脂改性GICs[4]。此外,不同的填料,如金属[5]和生物活性玻璃[6],也被添加至GICs中改善其力学性能。
近年来,纳米技术带动了技术革命。Moshaverini等[7]研究发现,纳米粒子占据了GICs颗粒之间的空隙,充当增强材料提高材料的力学性能。Dowling等[8]和Chalissery等[9]分别将纳米二氧化钛和纳米氧化锆添加至GICs中,发现其力学性能和抗菌效果增强。
石墨烯及其衍生物具有优异的力学性能,生物相容性和良好的抗菌性能[10]等,在生物医学领域具有极好的应用前景。Dubey等[11]研究发现,石墨烯加入生物活性硅酸钙水门汀中可以提高材料的硬度。Sun等[12]将1 mg/mL的氧化石墨烯(graphene oxide,GO)与钛结合,显示出优异的细胞粘附和抗菌特性。作为石墨烯的一种新型的衍生物,氟化石墨烯(FG)具有类似石墨烯的机械强度[13],还具有氟基材料的特性。C-F键的强极性被认为可以诱导生物反应[14]。界面作用力和氟的共同作用使FG表现出对大肠杆菌良好的抗菌性能[15]。FG的C-F键通过与界面基体的共价和非共价相互作用,有效地克服了石墨烯在复合材料中的团聚效应[16]。基于这些研究,可以合理地假设,在不影响生物相容性的前提下,FG可能有助于增强GICs的机械和抗菌性能。
本研究拟用FG增强传统型的GICs,评估复合材料的力学性能、抗菌性和细胞毒性,为提高GICs的力学性能和抗菌作用的相关研究提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料 氧化石墨烯(GO,南京新丰),Fuji II GICs(而至,日本),金黄色葡萄球菌(S.aureus,ATCC 25923)和大肠杆菌(E.coli,ATCC 25922)、L929细胞(武汉Procell);DMEM培养基(GIBCO,美国);CCK-8试剂盒(日本株式会社同仁化学研究所,日本)。
1.1.2 主要仪器 电子万能材料试验机(INSTRON,美国),扫描电镜(JEOL,日本),维氏硬度计(Matsuzawa,日本),酶标仪(Bio-tek,美国)。
1.2 FG的制备
水热法制备FG[17]。已发表的实验中已制得FG[18]。
1.3 GICs/FG复合材料试件制备
在GICs粉中按质量比分别加入不同质量的FG(FG质量分数分别为0%、1%、2%和4%)球磨法混匀。将此混合物按照厂家说明书的要求粉液质量比为2∶1与GICs液体混合、调拌。按照实验要求制作不同尺寸的试样。测试前,试样依次用400、800目、1200目砂纸打磨、抛光。
基于前期预实验情况确定了GICs中加入FG的质量分数,实验共计分4 组:对照组GICs(不含FG),实验组分别含1%、2%和4%FG质量分数的FG。为了便于实验组描述,分别于GICs、1%FG/GICs、2%FG/GICs、4%FG/GICs表示。
1.4 表征
1.4.1 FG和FG/GICs复合材料的表征 前研究中已对FG进行TEM形貌分析、Raman图谱分析和XPS成分分析[18,24]。SEM观察FG/GICs复合材料的形貌。将对GICs/FG复合材料试件固定于细铜片后真空镀膜,电镜下观察GICs/FG复合材料的微观结构。
1.4.2 FG/GICs复合材料的力学性能测试 力学性能测试按照表1所示的方法和要求。
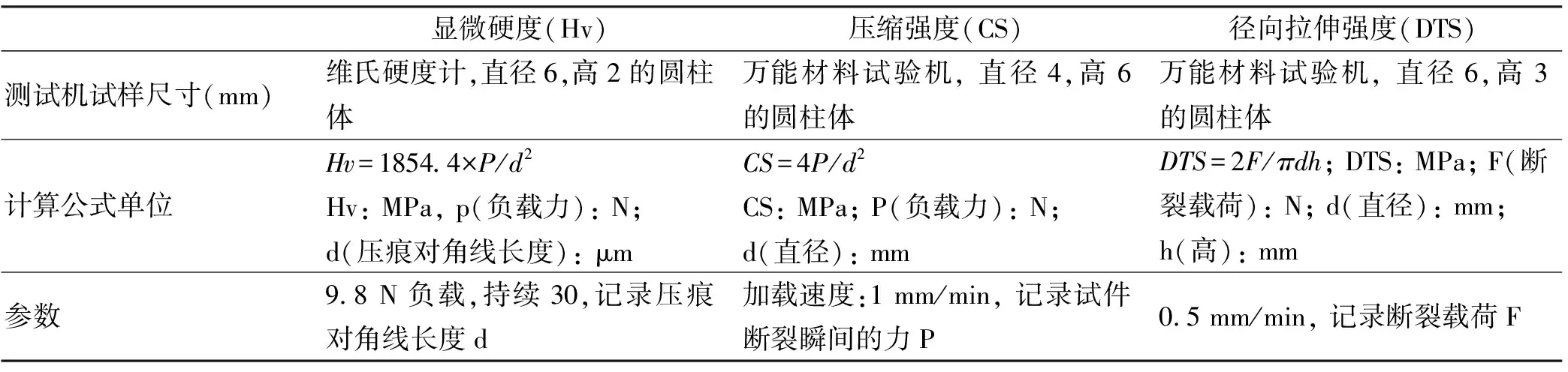
表1 力学性能测试实验参数 (n=10)
1.4.3 抗菌性测试 选用薄膜密贴法,S.aureus和E.coli作为测试菌株。每组6 个试样,尺寸为10 mm×10 mm×2 mm。试样表面灭菌后滴加50 μL测试菌液(106CFU/mL),贴覆PE膜。置于相对湿度大于90%、37 ℃培养24 h。用20 mL PBS反复冲洗试样表面和PE膜。混合均匀,倍比稀释。取100 μL接种于培养基,空白对照组中为100 μL原始菌液,37 ℃倒置培养24 h后菌落计数。实验重复3 次求平均值。抑菌率R的计算公式:R=(N0-Nx)/N0×100%。N0表示空白对照组的菌落数量,Nx表示各组的菌落数量,抗菌实验方法见图1。
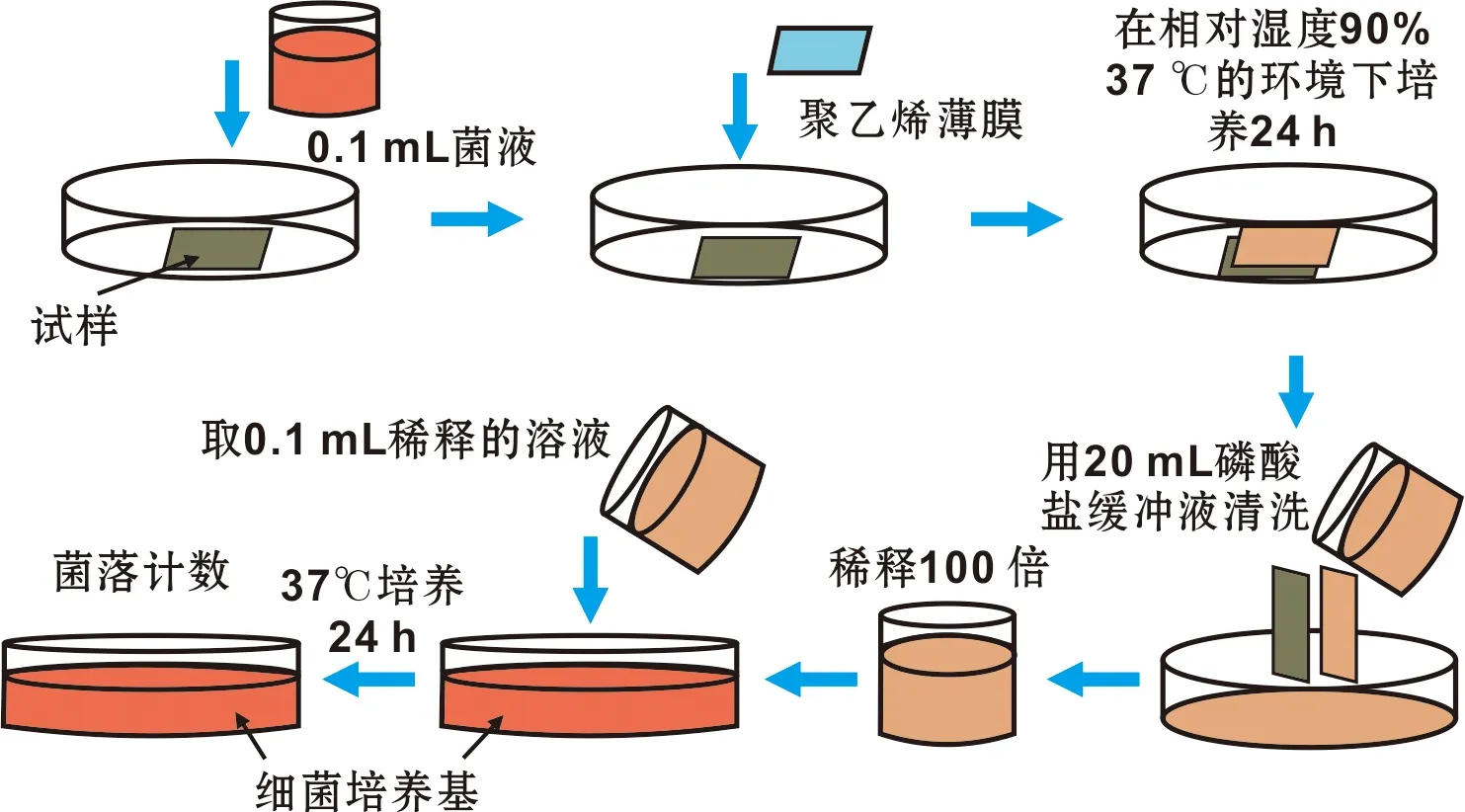
图1 抗菌实验方法示意图
1.4.4 细胞毒性测定(CCK-8) 将制备好的4组FG/GICs试样制成片状灭菌后置于96 孔板中。L929细胞在含10%的胎牛血清的DMEM中复苏,3 次传代后,将处于对数生长期的细胞用胰蛋白酶消化,制成2×104个/mL的细胞悬液。每孔100 μL接种于放置各组试样的96 孔板中培养。空白组加入细胞培养液100 μL,37 ℃培养。1、3和5 d后移除试样和培养液,加入新鲜培养液,用CCK-8试剂盒按说明书进行检测。用酶标仪在波长450 nm处测量吸光度(A)。
细胞相对增殖率(%)为=[(A实验组-A空白对照组)/A阴性对照组]× 100%。
根据细胞相对增值率判断试样细胞毒性,见表2。
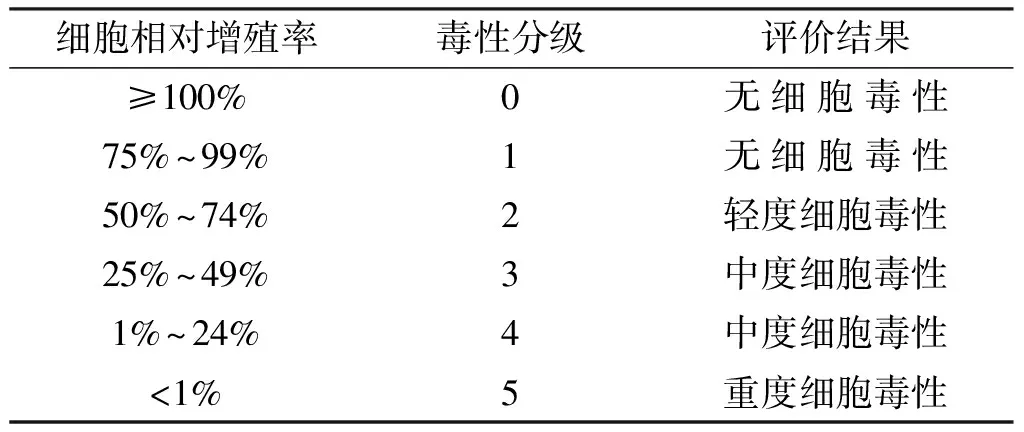
表2 细胞毒性评价分级
1.5 结果评价
采用单因素方差分析(ANOVA)和Tukey HSD来确定各组材料之间测试性能的显著差异。显著性水准α=0.05。
2 结 果
2.1 对FG/GICs复合材料的表征
电镜下可见FG在GICs中分散均匀,未见明显团聚现象。所有试样的断口表面均有裂纹和气孔,但实验组的比对照组中孔隙少(图2)。

图2 复合材料断面的SEM图像
2.2 FG/GICs复合材料的力学性能
FG的加入使FG/GICs的Hv,CS和DTS增加。实验组均高于对照组(P<0.05)(除1%FG/GICs组的CS外)。组间比较,1%FG/GICs,2%FG/GICs组的Hv,2%FG/GICs(c),4%FG/GICs组的DTS无明显差异(P>0.05)。其中,2%FG/GICs表现出最佳的性能(图3)。
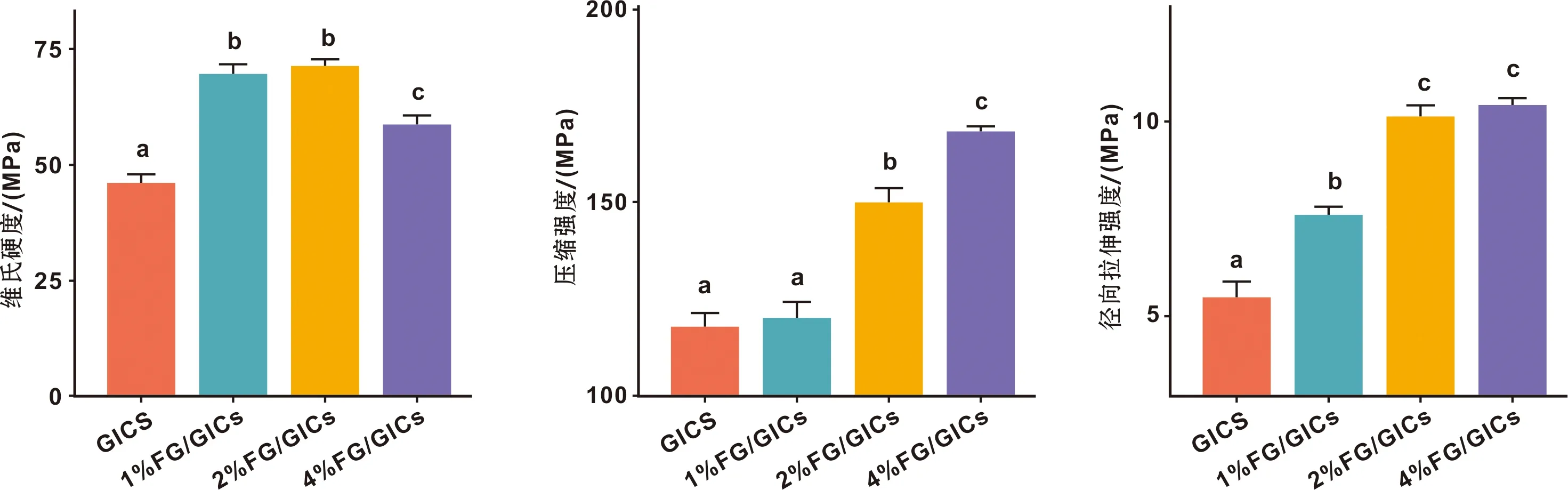
图3 4 组复合材料的维氏显微硬度、压缩强度和径向拉伸强度比较(不同标注表示两组之间的差异,P<0.05)
GICs对S.aureus和E.coli能发挥一定的抗菌作用,而实验组的抗菌效果更强(P<0.05)。随着FG的添加量的增加,复合材料对S.aureus和E.coli抗菌效果增强(图4~5)。
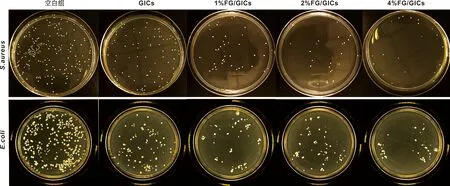
图4 4 组复合材料抗菌性能测定的S.aureus和 E. coli菌落生长情况
CCK-8 实验结果显示:培养1 d时,各组细胞相对增值率相比差异无显著性意义(P>0.05);培养3、5 d时,4%FG/GICs组细胞相对增值率低于其他组(P<0.05)(图5)。根据细胞毒性评价分级,不同组试样与L929细胞培养1、3和5 d天均无细胞毒性(图5)见。因此认为FG/GICs对细胞不会产生明显的毒性,具有良好的生物相容性。
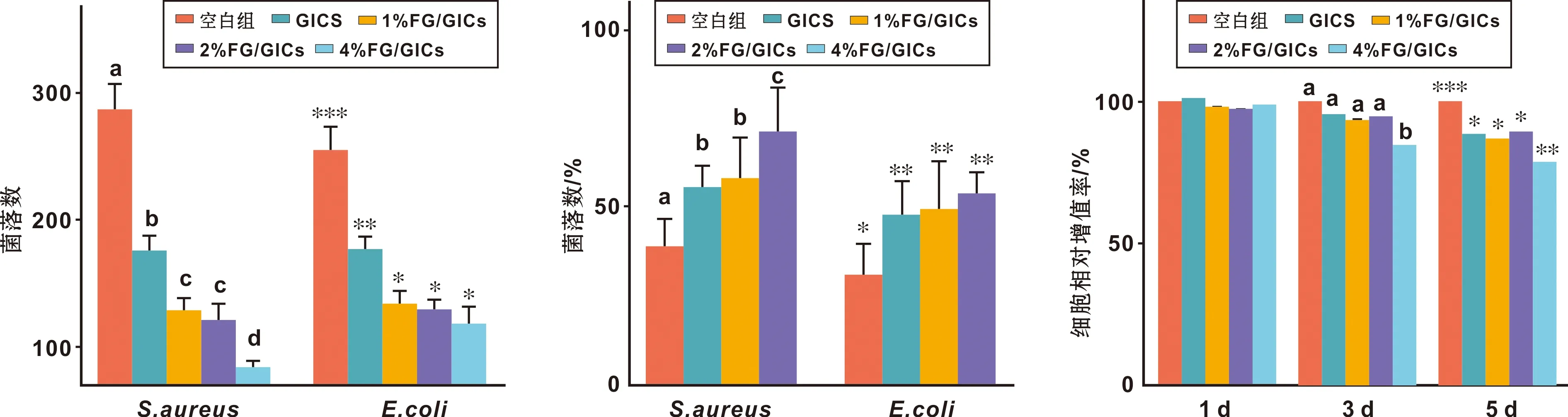
图5 各组复合材料的菌落计数、抗菌率、细胞毒性(不同标注表示两组之间的差异,P<0.05)
3 讨 论
本研究利用GO水热反应制备了FG[18],用球磨法制备了FG/GICs复合材料。在扫描电镜下可以看到FG均匀分散在GICs中,未见FG团聚。因为FG中C-F键的存在,通过与界面基体的共价和非共价相互作用,有效地克服了石墨烯的团聚效应[16]。本实验中扫描电镜显示所有的样品中都有小气孔,实验组气孔更少。随着FG含量增高,形成更加均匀的断面。FG占据GICs颗粒之间的空隙,当裂纹形成时,它可以吸收断裂能量从而阻止裂纹的传播[18]。
GICs是一种脆性材料,易因为材料中的气孔和裂纹而失效。Nomoto等[19]认为,GICs基质中的孔隙率可能是影响材料力学性能的重要因素之一。有研究发现,1%的石墨烯的加入使羟基磷灰石的显微硬度提高了30%[20],在硅酸盐水门汀中添加GO可使其力学性能大大提高[21]。本实验发现,与GICs相比,实验组的的显微硬度、压缩强度和径向拉伸强度均有明显提高。原因是:一方面,FG具有较高力学性能[17];另一方面,石墨烯材料的小尺寸效应[22]使之填充于GICs大分子之间的间隙,FG的二维结构和高比表面积使其与基体发生机械锁结,由于弹性模量的差异,当断裂发生时,载荷从基体转移到FG上[20]。这种现象可以用裂纹分解机制[23]解释。该机理包括裂纹桥接、裂纹拔出、裂纹偏转和裂纹尖端屏蔽四个方面[23]。此外,FG为GICs粉液结合提供更多结合位点,使反应更充分。但是FG的添加量必须限定在一定的范围内,否则会影响GICs的聚合。
继发龋是导致修复材料寿命有限的重要原因之一。研究发现,GICs的抗菌作用来源于其释放氟离子扰乱细菌的定植和生物膜的形成,抑制糖酵解从而影响细菌的代谢,以及固化时的酸性环境[24]。本研究中,抗菌性实验结果表明GICs自身对于S.aureus和E.coli具有一定的抗菌作用。石墨烯材料的抗菌机制来源于以下几个方面:首先,石墨烯材料锋利的边缘破坏细菌胞膜,内容物外露,导致细菌死亡。第二,石墨烯覆盖于细菌的表面,将其与外界隔离,细菌缺乏营养和呼吸活动而丧失活力[25]。再之,石墨烯产生活性氧引起细菌的氧化应激,造成损伤甚至死亡[26]。Zhao等[27]研究发现GO 以浓度依赖性方式对浮游和生物膜形式的变形链球菌表现出优异的抗菌作用。本研究将实验菌液与不同组FG/GICs接触培养,抗菌测试结果显示各实验组对S.aureus和E.coli均有更强的抑制作用。而且,FG/GICs复合材料对革兰氏阳性菌S.aureus的抗菌效果更强,这很大程度上受细胞壁结构的影响[28]。作为石墨烯的衍生物之一,FG具有类似GO的抗菌作用。另一方面,石墨烯类材料能与聚合物基质结合,在复合材料上形成亲水表面,该表面吸引水分子形成水合层[29]。此水合层将会对微生物在材料表面的粘附和定植造成抑制[30]。
医用材料应用于临床必须具有良好的生物相容性。研究发现,石墨烯材料通过不同的暴露途径在许多组织和器官中积累,并进一步引起毒性,表现为损伤或功能障碍[31]。也有学者[32]研究发现氟化石墨烯对大鼠间充质干细胞表现出良好的黏附作用。本研究中,在共培养的第5天,相比于对照组,实验组的细胞相对增值率较低;在第3和第5 天,4% FG/GICs组的细胞相对增值率下降较多。但不同组试样与L929细胞培养1、3和5 d的细胞相对增值率均在80%以上。因此,一定剂量的FG添加至GICs中不会影响其生物相容性。
综上,在不影响生物相容性的前提下,在传统型GICs中加入一定量的FG,可以提高其硬度,压缩强度,拉伸强度,表现出对S.aureus和E.coli更强的抗菌效果,为拓宽GICs的临床应用提供依据。

