miR-17-5p通过靶向HDAC4抑制PMEC细胞凋亡及促进EMT
霍寅萍 褚庆霞
人肺黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)是一种起源于气管和支气管黏膜下库尔奇斯基(Kurchisky)细胞的罕见肺唾液腺癌,主要表达MAML2(mastermind like transcriptional coactivator 2) 基因重排[1]。据细胞形态分为低级和高级,其中高级别侵袭强、易转移[2-3]。PMEC的治疗与非小细胞肺癌相同,但PMEC的生存率却较低[1]。因此,探索PMEC的新靶点具有重要意义。MicroRNA (miRNA)是一种单链非编码小RNA,能调节基因表达[4]。研究发现血清中miR-17-5p高表达与肺癌患者存活率差相关[5]。本研究中miR-17-5p在PMEC中高表达,促进细胞增殖、迁移和侵袭,抑制细胞凋亡。经生物信息学预测HDAC4(histone deacetylase 4)是miR-17-5p可能的靶标。并发现miR-17-5p 靶向 HDAC4调控 EMT (epithelial-mesenchymal transition) 和细胞凋亡。综上,在PMEC中miR-17-5p可作为一种癌基因,为PMEC发病的潜在分子机制和可能的靶向治疗提供了新的见解。
资料与方法
一、组织标本
收集2016 年1月至 2021 年12月,从江苏省人民医院浦口分院接受手术治疗的PMEC患者中获取15对癌组织及其匹配的邻近非癌组织。均未接受术前治疗,通过组织病理学确诊。收集新鲜的组织标本立即储存在液氮中。该研究是根据世界医学协会的赫尔辛基宣言(2008年)进行的。本研究经江苏省人民医院浦口分院医学伦理委员会批准(2016-SR-003),并获得每位患者的书面知情同意。
二、细胞培养和转染
NCI-H292细胞系(人肺黏液表皮样癌细胞系)、BEAS-2B细胞系(人正常支气管上皮细胞系)和HEK-293T(人胚肾细胞系)具有STR细胞鉴定,均购自中国科学院典型培养物保藏委员会细胞库,实验前通过支原体检测。用含有 10% FBS(Gibco-BRL,美国)和 1% 青霉素/链霉素(Gibco-BRL,美国)的 RPMI-1640(Gibco-BRL,美国)培养,置于 37 ℃ 的含5 % 二氧化碳加湿细胞培养箱中。使用 Lipofectamine 3000(Invitrogen,Carlsbad,CA)将 miR-17-5p 抑制剂(inhibitor)、模拟物(mimic)、miRNA 对照组(ctrl)、HDAC4小干扰(siHDAC4)或其对照组(siNC)(吉玛,上海,中国)转染到 NCI-H292 细胞中,48 小时后收集细胞 RNA, 72 小时后收集细胞蛋白。
三、RNA 提取和定量
使用 Trizol 试剂(Life Technologies,美国)从组织和细胞中提取总 RNA。 MMLV 逆转录酶(Takara,大连,中国)进行逆转录,并使用 TB Green®Premix Ex TaqTM(Takara,大连,中国)通过qPCR 定量 miR-17-5p 和 HDAC4 mRNA 的相对表达水平,以U6为内参,通过2-ΔΔCt计算进行归一化。使用引物序列如下:hsa-miR-17-5p:RT GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTACCT,正向:5′-GCGCAAAGTGCTTTACAGTGC-3′,反向:5′-AGTGCAGGGTCCGAGGTATT-3′; HDAC4:正向:5′-GCCTGGGAGCACTGCCCCTCCACGCACA-3′,反向:5′-CTTGTTCATCTGCAGTTGCTGCTGC-3′; U6:正向:5′-CGCTTCGGCAGCACATATAC-3′,反向:5′-AATATGGAACGCTTCACGA-3′。
四、细胞增殖测定
96孔板中每孔接种3000个细胞,细胞增殖试剂盒-8(CCK-8,中国大连)连续3天评估细胞活力。用酶标仪(BioTek,Epoch,USA)在 450 nm 处读取吸光度值。进行三次独立的实验。
五、Transwell试验
细胞转染24 h后将细胞接种于无血清培养的上室,下室700 μL含10%FBS的培养基。侵袭实验中需要先将稀释的基质胶(1 ∶6 无血清培养基)(BD Biosciences CA,美国)铺在上室。迁移实验中细胞接种于上室后培养 24 h,而侵袭实验细胞中培养48 h。甲醇固定,结晶紫染色,倒置显微镜(Carl Zeiss,德国)随机选取3个不重叠的区域进行细胞计数。独立实验进行3次。
六、细胞凋亡检测
细胞转染 48 h后收集细胞,细胞重悬于磷酸盐缓冲液 (PBS) 中并与 Annexin V-FITC 室温避光孵育 15 min,在流式细胞仪检测前5分钟加入碘化丙啶 (PI),在半小时内上流式检测仪(Mloflox xdp,Beckman, San Jose, CA,美国)进行检测,实验独立完成3次。
七、蛋白印迹分析
细胞转染72 h后,用RIPA(碧云天,中国)收集细胞提取蛋白,用BCA检测试剂盒(碧云天,中国)测定蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳后,等量蛋白湿转到聚偏二氟乙烯(PVDF,Millipore Corporation,Billerica,MA,美国)膜上。PVDF膜用5%脱脂牛奶室温封闭1小时,加入适量一抗4℃孵育过夜(抗HDAC4,1:2000;抗N-cadherin,1 ∶1 000;抗Vimentin,1 ∶1 000;抗 Bcl-2,1 ∶1 000;抗 Bax,1 ∶1 000;抗 Cleaved-Caspase 3,1 ∶1 000;抗 GAPDH,1 ∶1 000;以上均来自 CST,Beverly,MA,美国)。 用含有 Tween 20的 Tris 缓冲盐溶液(TBST)清洗膜半小时,在室温下用兔二抗(1:2000,CST,Beverly,MA,美国)孵育 1 小时,再洗膜半小时。后用ImmobilobTMWestern 化学发光 HRP 底物(Millipore,Billerica,MA,美国)在全自动化学发光成像分析系统曝光成像。
八、荧光素酶报告基因检测
miR-17-5p mimic或其阴性对照和 HDAC4-MUT 或 HDAC4-WT 报告质粒(吉玛,上海,中国)使用 Lipofectamine 3000 共转染到 HEK-293T 细胞中,48 h后 PBS 洗涤细胞加入被动裂解液,室温轻摇15 min充分裂解细胞。使用荧光素酶报告基因检测系统(Promega,美国)评估荧光素酶活性,进行3次独立实验。
九、统计学处理

结 果
一、miR-17-5p在人 PMEC 组织和细胞系中高表达
15 组 PMEC 组织及其邻近非癌组织中提取 RNA,qPCR检测miR-17-5p,发现肿瘤组织中miR-17-5p的表达较邻近非癌组织显著上调(见图1A)。 与人支气管上皮细胞相比,PMEC细胞(NCI-H292)中miR-17-5p 的表达也明显升高(见图 1B)。结果表明miR-17-5p可能与人PMEC的发生发展有关。

图1 miR-17-5p在PMEC组织和细胞中的表达A:miR-17-5p在PMEC及其邻近非癌组织中的表达差异(n=15); B:BEAS-2B及NCI-H292细胞中miR-17-5p的表达差异(***P<0.001)
二、miR-17-5p促进NCI-H292细胞增殖
为了确定 miR-17-5p在PMEC中的作用,我们合成了miR-17-5p inhibitor和mimic。将miR-17-5p inhibitor或mimic转染NCI-H292细胞后48小时收集细胞RNA,通过qPCR分析转染效率(见图2A)。CCK-8实验表明,miR-17-5p inhibitor组的细胞增殖降低,但 miR-17-5p mimic组的细胞增殖明显增加(见图2B)。对72h细胞增殖活性结果的进一步分析表明,这种增殖差异具有显著统计学意义(见图2C)。结果表明 miR-17-5p 促进 NCI-H292 细胞增殖。
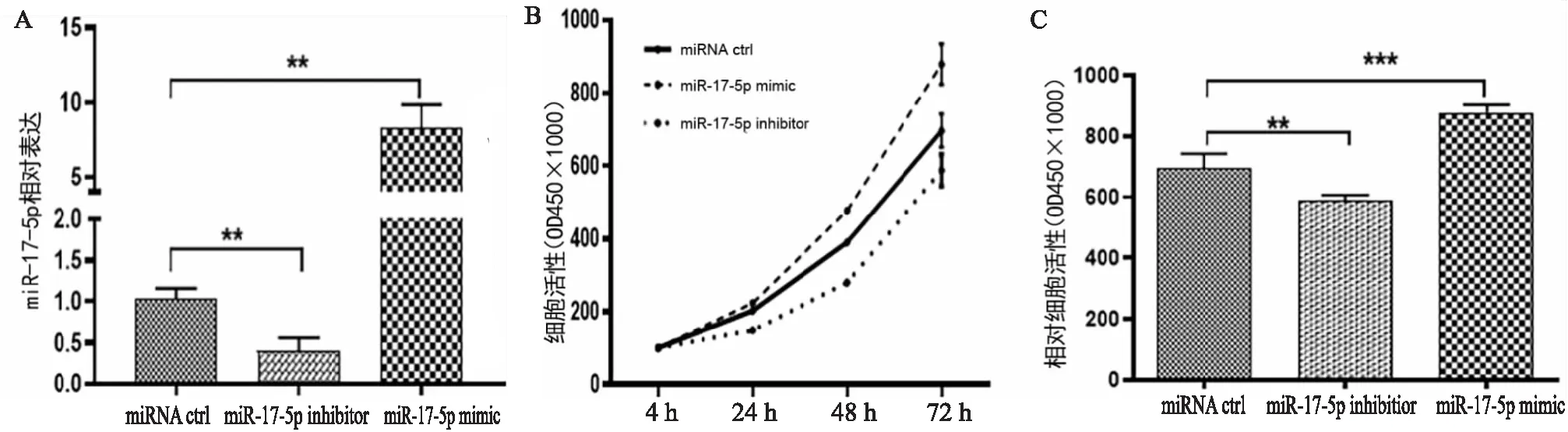
图2 miR-17-5p对NCI-H292细胞的增殖影响A:miR-17-5p在NCI-H292细胞中的转染效率;B:miR-17-5p转染NCI-H292细胞后的细胞增殖对比;C:miR-17-5p转染NCI-H292细胞72小时后的细胞增殖比较(**P<0.01,***P<0.001)
三、miR-17-5p抑制NCI-H292细胞凋亡
使用流式细胞仪检测 NCI-H292 细胞的凋亡,发现 miR-17-5p inhibitor组的细胞凋亡显著增加,而 miR-17-5p mimic组的细胞凋亡明显减少(见图3A,3B)。 提示miR-17-5p在NCI-H292中具有抑制细胞凋亡的作用。

图3 miR-17-5p对NCI-H292细胞凋亡的影响A:miR-17-5p转染NCI-H292细胞后的细胞凋亡图;B:miR-17-5p转染NCI-H292细胞后的细胞凋亡对比(*P<0.05, **P<0.01)
四、miR-17-5p 促进 NCI-H292 细胞的迁移和侵袭
进一步研究miR-17-5p 对PMEC 细胞迁移和侵袭的影响。Transwell 迁移和侵袭实验表明,miR-17-5p mimic组中迁移和侵袭的细胞数量显著增加,而inhibitor组的结果则相反(见图4A、4B、4C)。结果证实miR-17-5p能促进NCI-H292细胞的迁移和侵袭。

图4 miR-17-5p对NCI-H292细胞迁移和侵袭的影响A:miR-17-5p转染NCI-H292细胞后的迁移和侵袭图(放大倍数×100,标尺=20μm);B:miR-17-5p转染NCI-H292细胞后的迁移对比;C:miR-17-5p转染NCI-H292细胞后的侵袭比较 (*P<0.05, **P<0.01)
五、HDAC4在PMEC中上调,miR-17-5p正向调节HDAC4的表达
为确定miR-17-5p的主要靶基因,我们使用三个数据库(TargetScan、PicTar和miRDB)进行预测并发现组蛋白去乙酰化酶HDAC4可能是miR-17-5p 的靶标,且 miR-17-5p 可以与 HDAC4 的 3′UTR 结合(见图5A)。为进一步验证我们生成了编码 HDAC4 3′UTR 的报告基因构建体,该构建体包含预测的 miR-17-5p 结合序列(HDAC4-WT)或突变序列(HDAC4-MUT)(见图5A),并与合成的 miR-17-5p mimic或对照共转染到 HEK-293T 细胞中,48 小时后使用荧光素酶报告基因检测系统检测荧光素酶活性,结果显示miR-17-5p mimic能增加HDAC4-WT组荧光素酶活性(见图5B)。同时发现,抑制 miR-17-5p 会降低 HDAC4 mRNA 的表达,而过表达 miR-17-5p 则增加 HDAC4 mRNA 的表达(见图5C)。在 PMEC 组织和细胞系中也检测到 HDAC4 mRNA均显著上调(见图5D、5E),从而证明 miR-17-5p通过锚定 HDAC4 的 3′UTR 直接上调 HDAC4。
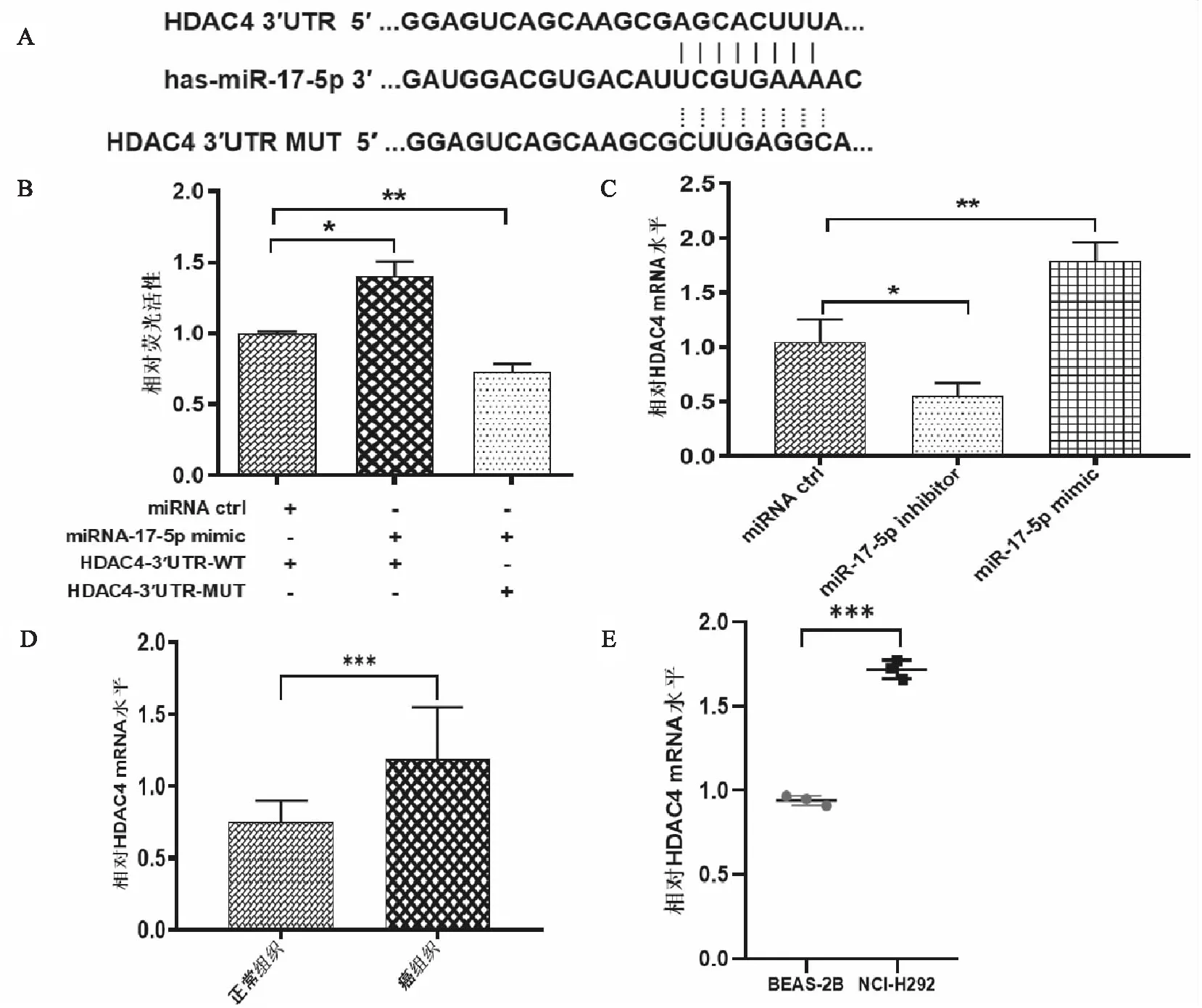
图5 miR-17-5p结合HDAC4 3′UTR对HDAC4表达影响及HDAC4在PMEC中的表达A:miR-17-5p与HDAC4 3′UTR的结合序列及突变序列;B:miR-17-5p与HDAC4 3′UTR结合的荧光素酶活性检测;C:miR-17-5p转染NCI-H292细胞后HDAC4 mRNA表达情况;D:PMEC组织及其邻近非癌组织中HDAC4 mRNA表达对比;E:BEAS-2B及NCI-H292细胞中HDAC4 mRNA表达对比(*P<0.05,**P<0.01,***P<0.001)
六、miR-17-5p靶向HDAC4促进EMT,并抑制细胞凋亡
众所周知,EMT在多种生理和病理过程中对肿瘤转移起着重要的调节作用。接下来,使用蛋白印迹(WB)检测 EMT 相关的信号分子。有趣的是,我们发现用 miR-17-5p inhibitor处理NCI-H292 细胞中,随着 HDAC4 的减少,N-钙黏蛋白和波形蛋白被下调,而转染 miR-17-5p mimic的 NCI-H292 细胞中结果相反(见图6A)。我们还检测了与细胞凋亡相关的信号分子,随着抑制miR-17-5p后HDAC4的减少,抗凋亡因子Bcl-2下调,促凋亡因子Bax和Cleaved Caspase-3 明显上调,而miR-17-5p过表达后结果相反。同时我们发现使用siHDAC4可以逆转miR-17-5p mimic的上述结果(见图6B)。这些结果表明miR-17-5p通过靶向HDAC4促进EMT并抑制细胞凋亡。
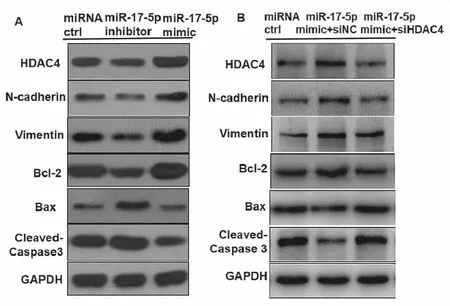
图6 miR-17-5p靶向HDAC4影响EMT及凋亡相关蛋白的表达A:miR-17-5p转染NCI-H292细胞后蛋白表达图;B:miR-17-5p及HDAC4共转染NCI-H292细胞后蛋白表达图
讨 论
miR-17-5p 已被证实在肿瘤进展中起关键作用,如乳腺癌、骨肉瘤、胰腺癌和胃癌[6-8]。miR-17-5p 在 PMEC 中的作用尚不明确,我们的研究发现 miR-17-5p 促进 PMEC细胞的增殖、迁移和侵袭,并抑制细胞凋亡,表明 miR-17-5p 在 PMEC 的发展中起着重要作用。通过生物信息学分析发现HDAC4 是miR-17-5p 的潜在靶标,荧光素酶报告基因分析和蛋白质印迹分析证实了miR-17-5p 能与 HDAC4 3′UTR 结合以调控HDAC4的表达。HDAC4是Ⅱ类组蛋白去乙酰酶 (HDAC) 的关键成员之一。据以往的研究,HDAC4被多种miRNAs靶向,参与了多种恶性肿瘤的增殖、迁移侵袭和凋亡。
据统计超过 90% 的癌症相关死亡是由转移性疾病而不是相应的原发肿瘤引起的,这表明转移仍然是癌症患者最危及生命的风险因素[9-10]。与间充质细胞状态相关的运动性/侵袭性的增加将 EMT与转移联系起来。我们检测了与 EMT 相关的信号分子以进行进一步验证。将miR-17-5p 模拟物处理 PMEC 细胞后,HDAC4 表达增加,同时EMT 相关信号分子 N-钙黏蛋白和波形蛋白的表达也随之增加,并促进了凋亡抑制因子Bax的表达,抑制了促凋亡因子Bcl-2和Cleaved-Caspase 3的表达,而干扰HDAC4后可逆转上述作用。
HDAC4是如何影响EMT和凋亡相关蛋白,需要进一步阐明,HDAC4 是一类组蛋白去乙酰酶,参与表观遗传调控。表观遗传修饰主要通过组蛋白乙酰化调节肿瘤相关miRNA的表达,同时miRNA 还可以调节表观遗传学,两者的相互调节可调控肿瘤基因表达并在体内诱导恶性肿瘤[11]。我们推测HDAC4是通过去乙酰化EMT和凋亡相关的信号分子中的组蛋白,进而参与了它们的表观遗传调控。总之,我们首次报道了 miR-17-5p 在人PMEC 中上调并具有致癌基因效应,miR-17-5p 通过直接作用于其靶标HDAC4基因,促进人PMEC 细胞增殖、EMT并抑制细胞凋亡。我们的研究为人PMEC的发病机制提供了新的见解,并强调了miR-17-5p/HDAC4 通路介导的 EMT 和细胞凋亡在 PMEC 进展中的作用,miR-17-5p有望成为治疗人PMEC新的突破点。

