CT影像组学在非小细胞肺癌病理分级中的应用
唐聪聪,陈艾琪,曹胜男,李 伟,李 想,杜小萌,马宜传
肺癌是高发病率和高死亡率的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的85%,5年生存率约为15%[1-3]。NSCLC病理分级可分为Ⅰ、Ⅱ、Ⅲ级[4-5],依据NSCLC的分化程度、异型性、核分裂象的多少,将Ⅰ、Ⅱ级归为低级别组,Ⅲ级归为高级别组。以往肺癌的筛查方法多种多样,包括支气管镜、穿刺活检、术前确诊等。这些方法具有一定损害性且复杂繁琐,且在术前进行肿瘤穿刺可能会导致出血、感染以及肿瘤细胞向周围播散的可能。同时这些技术是有限的,它们需要活检或侵入性手术来提取和分析肿瘤组织的一小部分,缺乏对肿瘤完整性的表述[6]。目前,影像组学具有鉴别病理分级的能力,定量分析这些参数可以为病理分级提供一种高效、无创的方法[7]。常用的影像检查方式包括X线平片、CT等。X线平片常用于肺癌的筛查,由于X线密度分辨率较低,易造成肺小结节的误诊或漏诊。对于肺部可疑病变,会进一步采用CT检查,CT检查密度分辨率较高,清楚显示病灶的位置、大小、边缘及密度等直接征象,但对于病理分级的诊断能力尚不足,且检查费用较高,辐射性较强。与上述检查方式相比,256排Revolution CT扫描机可很大程度上减少病人受到的辐射剂量,提高肺小结节的检出率,经能谱CT的后处理,可实现多参数成像,在病理分级的判断上具有更高的应用价值。影像组学是一种新的研究方法,可高通量地获取和分析大量描述肿瘤特征的影像特征,并在解析相关肿瘤的病理分级中发挥重要作用[8]。故本文对CT影像组学在NSCLC病理分级中的应用价值进行研究,现作报道。
1 资料与方法
1.1 一般资料 收集蚌埠医学院第一附属医院2018年6月至2021年1月67例经病理证实为NSCLC且病理分级明确的病人临床资料,纳入标准:(1)入院前未接受任何治疗;(2)接受能谱CT平扫(管电压为70 kVp及120 kVp);(3)病灶的实性部分较大且足够测量;(4)经病理活检已确定病理分级。排除标准:(1)所获得的影像图像质量差或存在运动伪影、病人影像资料不全;(2)NSCLC伴有阻塞性肺部炎症及肺结核;(3)病灶中有较大的囊变坏死、空洞干扰实性部分的测量。67例病人中低级别组(病理分级Ⅰ、Ⅱ级)共46例,Ⅰ级 7例,Ⅱ级 39例,男29例,女17例,年龄47~82岁,平均(64.92±8.74)岁;高级别组(病例分级Ⅲ级)21例,男13例,女8例,年龄42~76岁,平均(63.79±7.99)岁。2组在年龄和性别方面均具有可比性。
1.2 方法
1.2.1 影像学检查 采用美国通用电器(GE)公司生产的 256排Revolution CT对所有病人进行胸部平扫,扫描前确认病人有无相应的检查禁忌证,同时对病人进行常规的呼吸训练。检查时病人需仰卧,双臂上举,自胸廓上口到足侧进行扫描,使肺部病灶完全被扫描到。
能谱CT扫描条件为:管电压瞬时切换70 kVp、120 kVp,管电流最大限值为630 mA,自动毫安技术以0.5 ms瞬时切换,层厚及层距均为5 mm,准直宽度为0.625×64,螺距为0.984,窗宽400 Hu,窗位40 Hu。应用能谱CT的成像模式,将扫描获得的单能量图像行0.625 mm薄层重建,并传至ADW4.7工作站,所有病人的CT图像以DICOM格式从工作站导出。
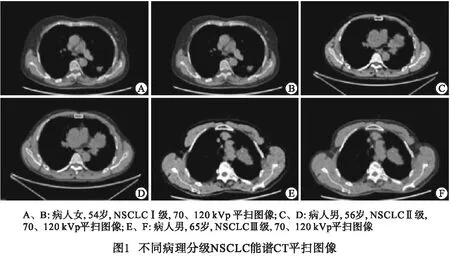
1.2.2 图像处理及数据采集 由2名具有3年以上工作经历的放射科医生从PACS上筛选图像,意见不一致时由第三名高年资主任医师决定。将经过后处理技术后获得的层厚和层距都为0.625 ms的影像图像上传至达尔文智能科研平台上(http://122.115.38.132:7043/manage/project-manage),由2名高年资放射科医生进行双盲法手动进行感兴趣区(ROI)的勾画,进行勾画时要注意避开明显的血管支气管影、坏死、钙化、空洞及肺不张等,尽量选取图像中ROI的最大层面进行勾画,勾画时尽量包括肿瘤的边界(见图1)。通过达尔文智能科研平台(http://122.115.38.132:7043/manage/project-manage)共提取1 878个影像组学特征,通过最大最小值归一化将每一维度特征曲线拉伸到指定的区间内用于对原始的特征向量进行拉伸、标准化或者归一化操作。以支持向量机构建影像组学模型,绘制ROC曲线评估模型诊断效果,P<0.05认为差异有统计学意义。
1.3 统计学方法 采用t检验和χ2检验,通过绘制受试者操作特征曲线(ROC),计算曲线下面积(AUC),评价影像组学特征在NSCLC病理分级中的应用价值。
2 结果
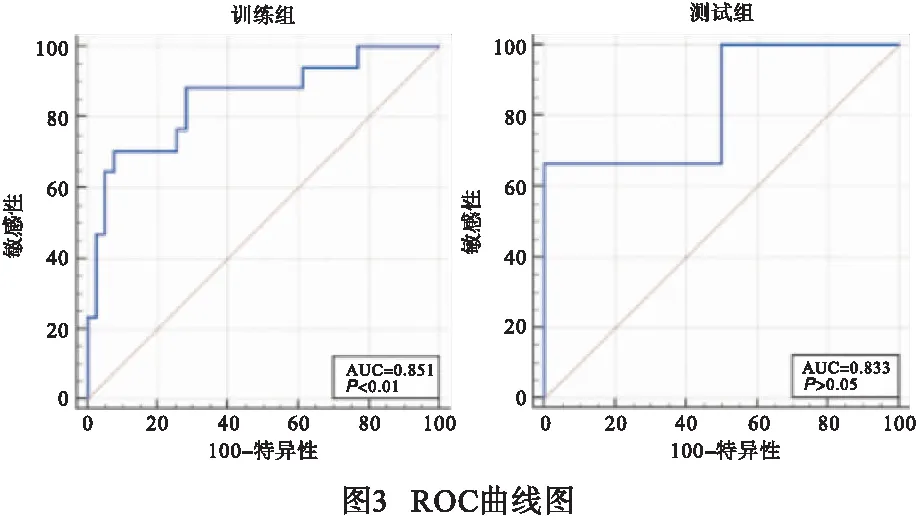
将67例病人按照5∶1的比例随机分为训练组56例,验证组11例,通过达尔文智能科研平台在CT图像上共提取1 878个影像组学特征,经过第一次降维获得1 871个特征维度,通过最大值归一化、最优特征筛选(百分比)及支持向量机对特征进行筛选,该组影像组学模型提取出的特征标签见图2。联合模型筛选出20个影像组学特征,以支持向量机构建影像组学模型,绘制ROC曲线评估模型诊断效果(见图3、表1)。对建立的影像组学特征进行分析,结果显示训练组CT影像组学模型在NSCLC病理分级间的差异具有统计学意义(P<0.01)。同时采用5折交叉实验评估预测模型和实际的理论频数分布是否相符,结果见图4。

表1 CT影像组学模型对NSCLC病理分级的诊断效果

3 讨论
肺癌是最常见的恶性肿瘤之一,在我国发病率及死亡率呈逐年上升趋势,并居各类恶性肿瘤首位[9-10]。NSCLC的组织学分级可表现其恶性程度[11-12],一般来说NSCLC依其分化程度、异型性、核分裂象多少等作为主要的分级依据,多项研究[13-15]证明肿瘤的分化程度越差,其恶性程度越高,生物学侵袭行为和治疗抵抗力就越强,更易发生坏死及淋巴结转移,病人的预后及生存率就越低。因此早发现、早诊断、早治疗对提高NSCLC病人生存率至关重要。病理活检常是确定NSCLC病理分级的金标准,但由于侵入性的检测方法,不仅费用昂贵,取样的偏差且有创,给病人增加身体负担,因此,术前影像学手段确定病理分级,将更有利于临床医生作出适合病人个体情况的治疗方式。作为非侵入性、精准的检查方法,影像组学通过转换图像中灰度亮度值获取病变组织的异质信息,定量分析肿瘤的影像特征,多种影像特征相结合,可以更好地用于NSCLC病理分级的预测,以往研究[16-18]表明,影像组学不仅可以反映肿瘤分化程度间差异,且具有诊断价值和成为诊断工具的潜力。
本研究模型选取67例NSCLC病人,通过达尔文智能科研平台对能谱CT平扫图像进行感兴趣区勾画、影像组学特征提取、筛选及建模,并通过SVM对特征的重要性进行评估,以支持向量机构建影像组学模型,并绘制ROC曲线对训练组及测试组的预测效能进行验证,证实CT影像组学可以有效的预测NSCLC高级别组与低级别组之间的差异。本研究模型共纳入20个影像组学特征对NSCLC病理分级状态进行预测,所提取的组学特征中,峰度特征与模型的相关性最高,峰度作为一阶特征(First order),主要描述灰度分布的平缓程度,峰度越大,代表分布越陡峭;本次研究发现NSCLC不同病理分级之间的差异较显著,这与尹娣等[19]的研究结果较一致。根据文献[20-21]报道NSCLC的侵袭性与病灶灰度峰值在直方图中的位置有关,这也与本研究结果相符。在训练组及测试组中AUC值分别为0.851(0.68~1.00)和0.833(0.28~1.00);训练组中预测病理分级状态的特异度及敏感性分别为92.31%、70.59%,测试组中预测病理分级状态的特异度及敏感性分别为85.20%、71.35%,本研究结果发现基于CT影像组学在非小细胞肺癌病理分级中具有较好的预测价值。有研究[22]基于常规CT影像组学模型得到的训练组及测试组AUC值为0.84、0.83,敏感性为59.6%、75.0%,本研究与之相比结果较优,这可能与所建立的模型采用能谱CT平扫图像有关,能谱CT在疾病的评估上提供了多方面的信息,实现多参数成像,包括单能量及混合能量图像、物质定量分析和有效原子系数等,较常规CT可获得更多的信息,其影像组学数据避免受到X线硬化伪影的影响,可获得更佳的预测效能。
本研究仍有以下局限性:在CT平扫上有时病灶边界与周围肺部炎症分界不清,导致勾画ROI主观性较大;搜集的病例数有限,后续研究需要更大样本量进行完善影像特征与其他相关临床特征的关系。
综上所述,CT影像组学突破了传统影像只能提供基本影像特征的局限性,在NSCLC病理分级上的鉴别具有较高的准确性及特异性,可为肿瘤病人临床治疗及预后提供新思路。

