长沙地区血小板供者基因数据库理论建模分析*
蒋义,阳智芬,曹丽群,陈洁,杨妞,康甜,谢毓滨(长沙血液中心输血研究所,长沙410001)
单采血小板输注主要用于预防和治疗血小板减少或血小板功能异常引起的出血,然而免疫性血小板无效输注(platelet transfusion refractoriness,PTR)在长期血小板输注的患者中发生率为10%~70%,远高于其他输血不良反应的发生率[1]。免疫性PTR主要由人类白细胞抗原(human leukocyte antigen,HLA)抗体及人类血小板抗原(human platelet antigen,HPA)抗体引起,而HLA及HPA抗原具有遗传多态性,在不同地区和不同人群中分布有所差异[2]。因此,建立本地区血小板供者已知HLA/HPA基因数据库,可为临床提供与患者HLA/HPA相匹配的单采血小板,大大降低免疫性PTR的发生,提高临床血小板输注的有效性。目前,长沙地区已建立了血小板供者已知HLA/HPA基因数据库,但建立多大的库存规模可满足本地区临床基因匹配单采血小板的供应尚在摸索实践中,本研究通过对已知数据进行分析,探讨建设规模与匹配程度的关系。
1 资料与方法
1.1研究对象 长沙地区无亲缘关系的单采血小板捐献者1 029名,年龄18~45岁,所有志愿者均签署加入血小板资料库知情同意书。本研究已通过长沙血液中心伦理委员会批准。
1.2主要仪器与试剂 Ion Gene StudioTMS5二代测序仪,A24811 PCR仪、Q5荧光定量PCR仪及AllTypeTMNGS HLA分型试剂(美国赛默飞世尔科技公司),Epoch酶标仪(美国BioTek公司)。全血基因组DNA提取试剂盒(北京天根公司),荧光PCR法HPA基因分型试剂盒(江苏伟禾公司)。
1.3方法
1.3.1DNA提取 按照试剂盒说明书提取外周血DNA,其浓度≥30 ng/μL,A260 nm/A280 nm值1.6~2.0。
1.3.2HPA基因分型 采用多重荧光PCR法,按照试剂说明书进行HPA-1~6、10、15及21的基因分型,针对HPA系统多态性位点设计扩增引物和荧光探针,利用Taq酶5′端外切的特性,分离探针上的淬灭荧光基团和报告荧光基团,依据荧光强度直接分析产物情况。使用配套软件(WeHelpReportV1.0.0.26),内标无异常,扩增曲线呈典型S型且CT值<35判断HPA基因相应亚型阳性。
1.3.3HLA基因分型 采用二代测序法,按照标准流程进行HLA基因测序,测序产生的数据使用配套TSV软件分析基因型。
1.4统计学分析 采用SHESIS软件进行Hardy-Weinberg equilibrium(HWE)检验,HLA-A、B位点及HPA等位基因观察频率及理论频率之间的比较采用χ2检验,检验水准设为0.05。
采用直接计算法计算HLA-A、B位点及HPA等位基因频率(allele frequency,AF):AF=(aa+ab/2)/总人数,a、b等位基因。基因型频率(genotype frequency,GF):GF=阳性数(aa或ab或bb)/总人数,采用MATLAB软件评估血小板库HLA、HPA表型匹配概率及最小库容:如果用fi表示第i种表型的频率,在由n个供者组成的血小板库中,任何患者都能找到至少1例HLA表型或HPA表型相同供者的概率为P,P=∑fi×[1-(1-fi)n],i代表所有可能的表型[3]。P值与血小板库中的供者数N以及表型频率相关,如果以N为横坐标,以计算求得的P值为纵坐标,可得到一条P值随N变化的曲线,通过对数转化可导出表型匹配概率曲线的回归方程式,计算得到一定供者数情况下找到≥1例HLA表型匹配供者的概率及最小库容。
计算CREG(cross-reactive groups,交叉反应组)各组频率及不配合率:根据CREG血清学特点,将HLA-A、B抗原分成9个组(1C、2C、4C、5C、6C、7C、8C、10C和12C)[4],CREG基因频率为其对应的HLA-A、B抗原频率之和,CREG不配合概率(Punmatch,Pu),Pu=2xy(1-xy),x和y为CREG基因频率。
2 结果
2.1Hardy-Weinberg平衡吻合度检验 1 029名血小板基因数据库捐献者的HLA-A、B位点,HPA基因型的观察频率与理论频率比较差异无统计学意义(HLA-A:χ2=32.329,P=0.18;HLA-B:χ2=40.563,P=0.35;HPA:χ2=26.563,P=0.12,Pc>0.05),该研究对象HLA-A、B,HPA等位基因的分布均符合Hardy-Weinberg平衡。
2.2长沙地区血小板基因数据库HLA等位基因多态性 1 029名血小板捐献者中,检出HLA-A等位基因34个(见表1),其中频率大于1%的13个,最高的依次为A*11:01、A*24:02、A*02:07、A*02:01、A*33:03,累计频率占A位点的75.02%;检出HLA-B等位基因75个(见表2),其中频率大于1%的19个,最高的依次为B*40:01、B*46:01、B*13:01、B*58:01、B*15:02,累计频率占B位点的51.11%;根据等位基因分布推出对应抗原分布情况,见表3。检出HLA抗原表型619种,其中频率大于1%的6种,分别为A2-A11-B60-B46(2.33%)、A2-A2-B46-B46(1.46%)、A2-A11-B75-B46(1.46%)、A2-A33-B46-B58(1.36%)、A2-A24-B60-B46(1.07%)、A11-A11-B13-B60(1.07%)。
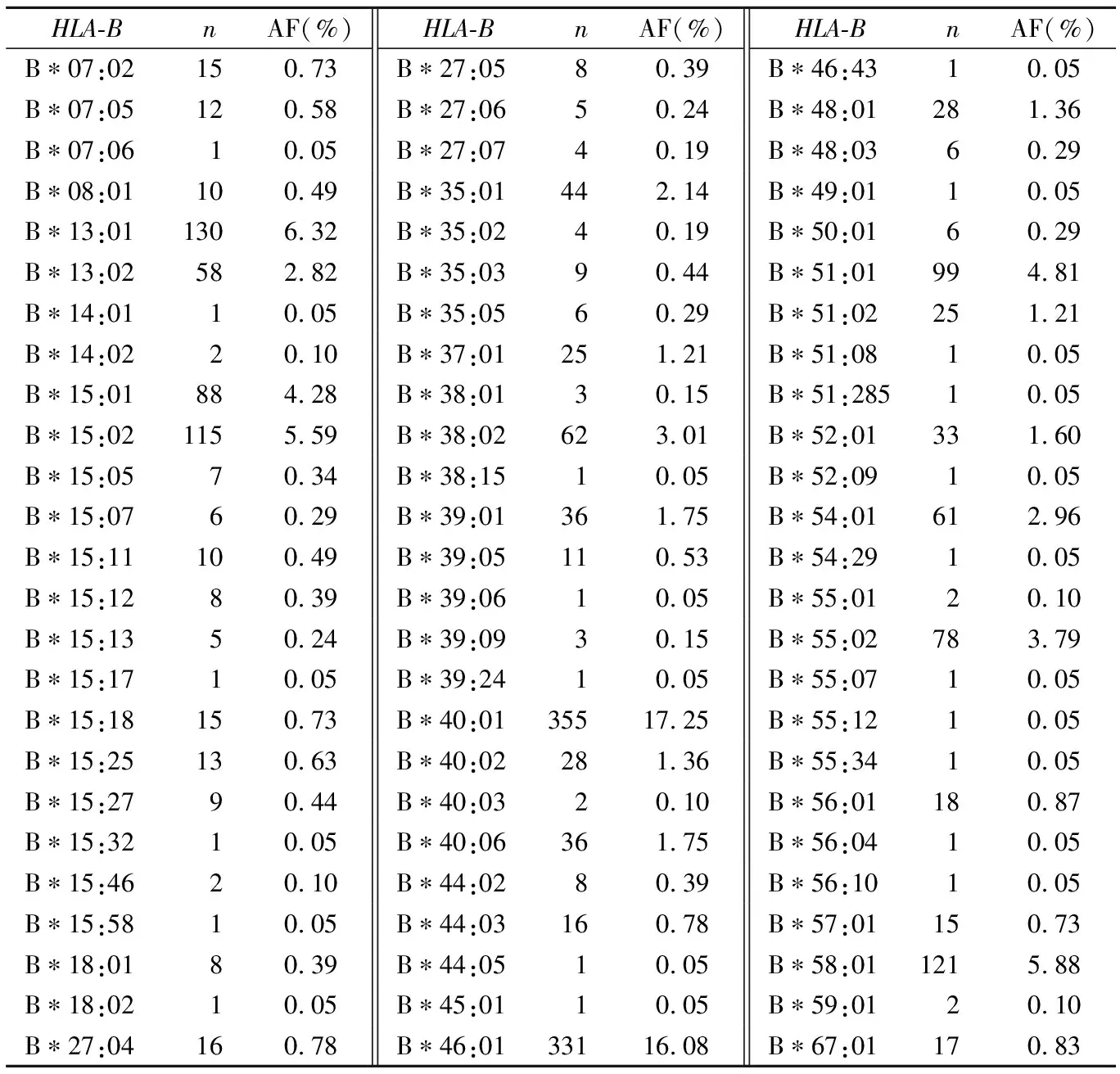
表2 HLA-B等位基因分布
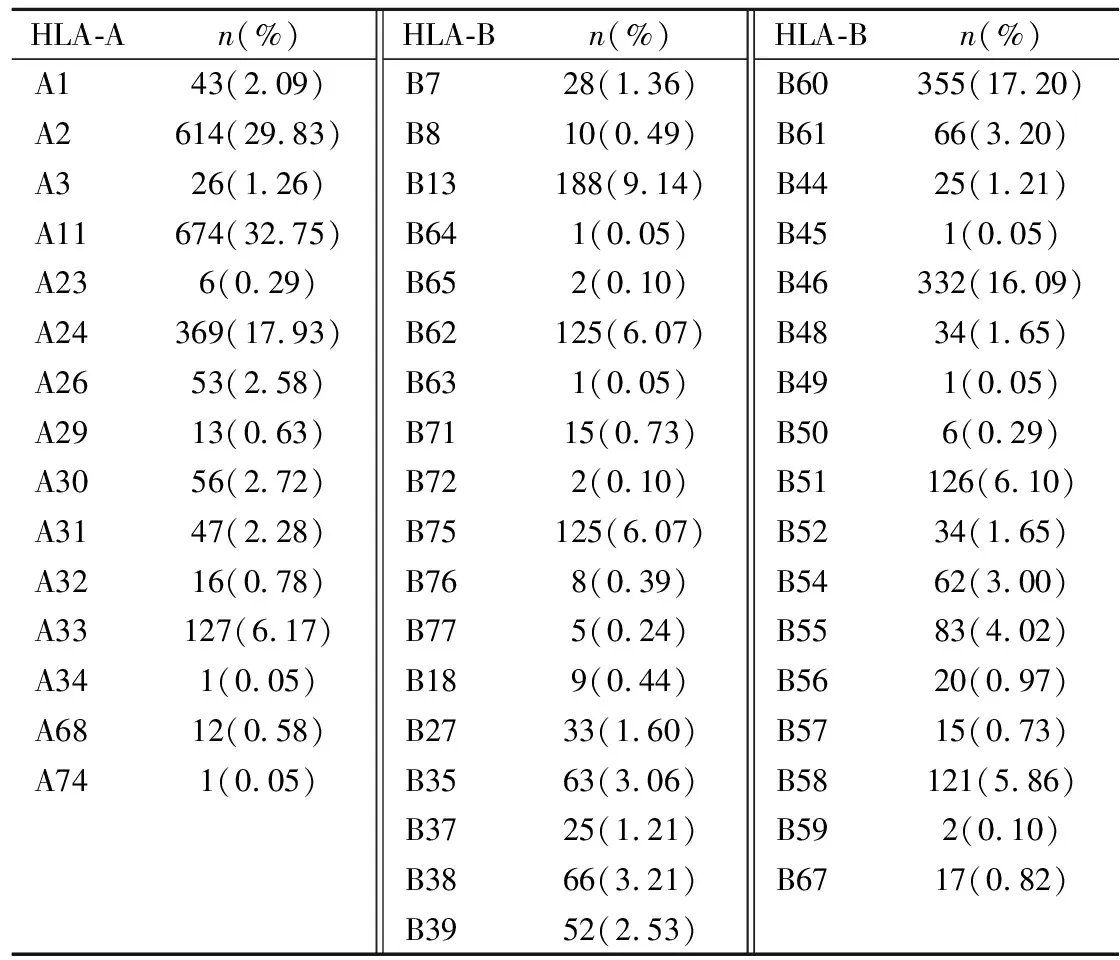
表3 长沙地区血小板基因数据库HLA-A、B位点抗原分布
2.3长沙地区血小板基因数据库HPA等位基因多态性 1 029名血小板基因数据库捐献者HPA 1~6、10、15、21中,HPA-3和HPA-15杂合度较高,HPA 2a频率为95.72%,HPA-1a、HPA-4a、HPA-5a、HPA-6a、HPA-10a、HPA-21a频率均高于98%,未检出HPA-10b,HPA基因型及等位基因频率见表4。共检出59种HPA表型,其中频率大于1%的13种,最常见的表型为HPA 1aa-2aa-3ab-4aa-5aa-6aa-10aa-15ab-21aa(20.89%),其次为HPA 1aa-2aa-3aa-4aa-5aa-6aa-10aa-15ab-21aa(15.45%)和HPA 1aa-2aa-3ab-4aa-5aa-6aa-10aa-15aa-21aa(10.79%)。
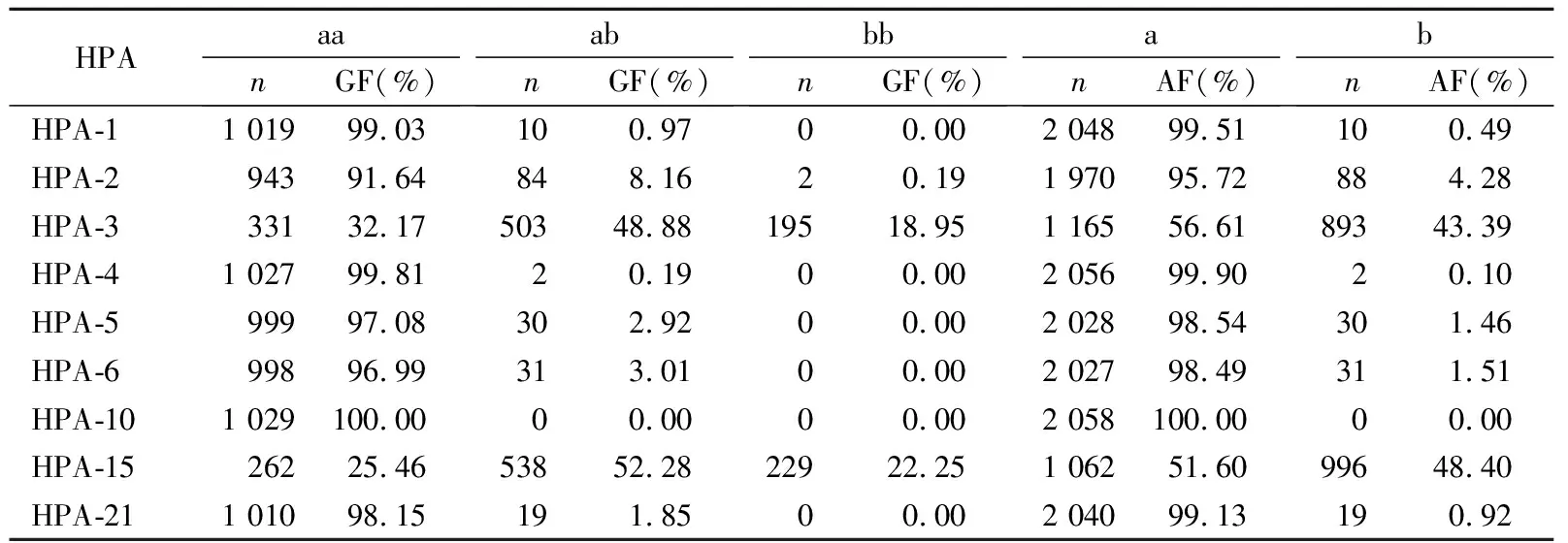
表4 长沙地区血小板基因数据库HPA基因型分布
2.4长沙地区血小板基因数据库HLA、HPA表型匹配概率 HLA和HPA表型匹配概率(P)与库容(N)的关系见表5,当库容为1 065人,80%的患者可以在长沙地区血小板基因数据库找到至少1名HLA-A、B位点表型一致的供者;当库容为2 127人,匹配概率为95%;目前库容为1 029人,匹配概率为79.25%。当库容为207人的时候,95%的患者在长沙地区血小板基因数据库找到至少1名HPA表型一致的供者。血小板基因数据库人数与HLA及HPA表型匹配概率拟合曲线图见图1。
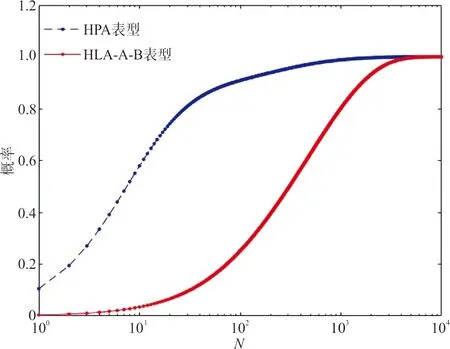
图1 血小板基因数据库人数与HLA及HPA表型匹配概率曲线

表5 HLA和HPA表型匹配概率(P)与库容(N)的关系
2.5长沙地区血小板基因数据库CREGs不配合率 长沙地区血小板基因数据库CREGs频率见表6,HLA-A抗原CREG表位发生的1C与2C不配合的概率(44.31%)最高;1C与10C、2C与10不配合率分别为38.24%、36.20%。HLA-B抗原CREG表位发生的7C与5C不配合的概率(33.12%)最高;5C与12C、7C与12C不配合率分别为26.24%、24.25%。Broad CREG中4C与6C的不配合概率为42.24%;4C与8C、8C与10C不配合率分别为6.61%、10.01%。
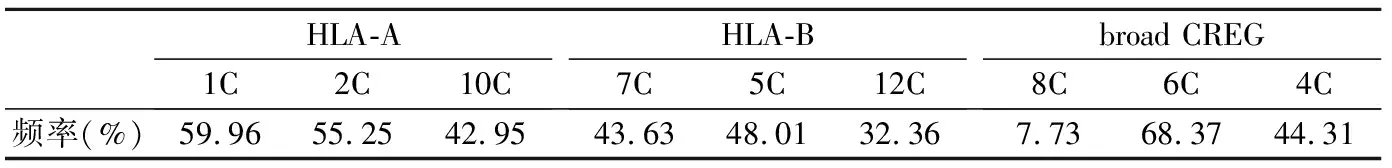
表6 长沙地区血小板基因数据库CREGs频率
3 讨论
估计HLA-Ⅰ匹配供者的血小板捐献者库的大小,通常需要准确计算HLA表型频率,了解人群中HLA表型的分布情况[5-6]。长沙地区HLA A/B抗原表型相对集中,13种HLA-A频率大于0.01,累计频率75.02%,19种HLA-B频率大于0.01,累计频率的51.11%。本研究中统计的HLA等位基因多态性、高频表型与文献中长沙地区HLA等位基因多态性及表型报道接近[7],结合Hardy-Weinberg平衡结果可知长沙地区献血人群群体遗传稳定,更利于后续建库寻找相合供者。
HPA系统中对偶抗原不配合的比例越高,产生HPA抗体的机会越多,造成PTR的可能性越大[8-9]。作为供者,患者产生HPA同种免疫性抗体后,有效的供者应与患者具有相同的HPA-aa或bb纯合子基因型。本研究结果可见,长沙地区除HPA-3、15杂合较高外,其余98%以a基因为主,说明长沙地区人群HPA系统组合分布相对集中,找到上述HPA系统相符供者基因库容也相对较小。
计算长沙地区单采血小板捐献者HLA-A、B等位基因频率,表型频率并推导出最大限度满足等待血小板输注患者需求库容。根据本研究实验数据,在不考虑ABO血型的情况下,理论预测长沙地区血小板供者资料库库容为1 029人,约有79.25%的患者能在该库中找到≥1名HLA-A、-B表型匹配的供者。当库容为207人的时候,95%的患者在长沙地区血小板基因数据库找到至少1名HPA表型一致的供者。
精准匹配与输注对临床应用而言却更加缩小了供体选择范围,针对患者存在抗HLA的情形,可利用不完全相合供、受体即交叉反应组CREG抗原相合、HLA-Matchmaker表位匹配法等[10]。故了解本地区单采血小板捐献者CREGs基因频率及表位不配合率对供者的选择和减少因CREG抗原免疫产生CREG抗体所导致的PTR具有重要意义[11]。本研究中发现HLA-A抗原CREG表位的1C与2C、HLA-B抗原CREG表位的7C与5C,Broad CREG的4C与6C的不配合概率均较高,在临床血小板输注时选择供者应予以关注。
抗原已知型血小板供者库的建立可为各类免疫性血小板减少患者快速找抗原相配合血小板供者[12-13]。在未能找到抗原阴性相合患者时,可结合CREG特异性分析。理论上库容越大,找到供者的可能性就越大,但也需考虑建库成本和效益,当库容量达到一定大小时,增加供者获得的效益将降低[14]。实际工作中,因选择的献血者在需要的规定时间内无法捐献[1],比如仍在献血间隔期,暂时无合适时间、失去联系等;另外ABO血型匹配、临床患者对血小板制品的需求时间紧迫,无法等候配合血小板各流程所需时间,因此配合需要考虑患者有多次需求和供者的及时性问题,国外学者有建议理论库容选择至少有5个以上完全兼容供者[15]。因此,我们在后续血小板配型的临床应用时,结合ABO血型匹配性,在扩大有效库容的同时将进一步验证理论建模的适用性和匹配概率的符合性。

