异常血红蛋白Q-Thailand合并缺失型β-地中海贫血的实验室分析*
张蕾,黎杏苹,李博红,尹珊珊,冯晴,吴维青(南方医科大学附属深圳妇幼保健院医学遗传中心,广东深圳 518017)
血红蛋白病是一组常见的遗传性血液病,其中珠蛋白链分子结构异常者为异常血红蛋白病,珠蛋白链合成量减少者为地中海贫血(简称“地贫”)。目前广泛实施的地贫防控措施是根据血常规和血红蛋白组分表型的筛查结果[1],通过DNA检测进行基因分型确诊,从而对夫妇双方均为同型地贫基因携带的高风险胎儿进行产前基因诊断,防止重型地贫患儿的出生。
异常血红蛋白Q-Thailand(HbQ-Thailand)是中国南方地区常见的异常血红蛋白之一[2],1958年由Vella等[3]在1个中国人家庭中发现并报道[4-5]。HbQ-Thailand是由于HBA1基因第74密码子上发生GAC>CAC(HBA1: c.223G>C)突变,导致所编码的天门冬氨酸变成谷氨酸,血红蛋白毛细管电泳检测有其特异图谱,表现为Z7区出现高比例的可疑HbQ-Thailand带、在Z1区出现HbQA2带。研究显示,HbQ-Thailand常与α-地贫-α4.2缺失连锁遗传[6]。β-地贫基因以点突变为主,亦包含HBB基因大片段缺失[7]。缺失型β-地贫的血液学表型表现为小细胞低色素性贫血,并以HbF明显增高为显著特征,而血红蛋白毛细管电泳检测的HbF也位于Z7区,与HbQ-Thailand带重叠。本研究报道2个HbQ-Thailand杂合子中检出缺失型β-地贫基因的病例,分析总结其血液学参数表型特征,为此类复杂血红蛋白病的实验室检测、临床诊断和遗传咨询提供参考。
1 资料与方法
1.1研究对象 来我院进行地贫筛查者2例:患者1,女性,30岁,就诊日期2019年10月10日;患者2,女性,27岁,就诊日期2019年2月13日。2例患者的血常规检测结果均表现为轻度小细胞低色素性贫血,毛细管血红蛋白电泳结果均于Z7区出现高比例的可疑HbQ-Thailand带、在Z1区出现HbQA2带,即呈现HbQ-Thailand特征图谱。2位研究对象均签署知情同意书。
1.2标本采集与处理 采集患者静脉血2管(EDTA-K3抗凝,每管2 mL),一管用于血常规及血红蛋白电泳检测,另一管4 ℃保存用于基因检测。
1.3血液学分析 用XS-800i全血细胞分析仪(日本Sysmex公司)及配套试剂进行血常规检测,以获取红细胞计数(RBC)、血红蛋白(hemoglobin, Hb)、红细胞平均体积(mean corpuscular volume,MCV)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin,MCH)等血液学表型参数。用SebiaCapillarys 2全自动毛细管血红蛋白电泳仪(法国Sebia公司)及配套试剂进行血红蛋白组分分析。
1.4常见地贫基因突变检测 用Lab-Aid824核酸提取仪及配套试剂(厦门致善公司)从抗凝全血中提取基因组DNA(gDNA)。采用缺失型α、非缺失型α和β点突变地贫基因检测试剂盒(深圳亚能生物公司)检测中国人群常见的3种缺失型α-地贫基因(--SEA/、-α4.2/、-α3.7/),3种α非缺失型α-地贫基因(αCSα/、αWSα/、αQSα/),17种β-地贫基因(HBB:c.126_129delCTTT、c.52A>T、c.130G>T、c.216 _217insT、c.92+1G>T、c.92+ 5G>C、c.316-197C>T、c.-78A>C、c.-79A>G、c.-80T>C、c.-82C>A、c.-11_-8delAAAC、c.2T>G、c.45_46insG、c.84_85insC、c.79G>A、c.94delC)。
1.5Sanger测序 HbQ-Thailand是由于α1珠蛋白基因发生点突变。据此,特异性扩增HBA1基因序列并进行Sanger测序分析。扩增及测序的上游引物(F)为5′-GGAGGGTGGAGACGTCCTG-3′,下游引物(R)为5′-CAAAGACCACGGGGGTACG-3′。将测序结果与HBA1基因参考序列进行对比分析,以确定突变碱基及突变位置。
1.6跨越断裂点聚合酶链反应(Gap-PCR)检测β珠蛋白基因缺失 采用缺失型β-地贫基因检测试剂盒(Gap-PCR法,深圳亚能生物公司),按操作说明检测Gγ+(Aγδβ)0型、Taiwanese型及SEA-HPFH型β-地贫基因缺失。
2 结果
2.1血液学表型结果 如表1和图1所示,2例患者均表现为MCV和MCH降低的小细胞低色素表型特征;血红蛋白毛细管电泳结果显示Z7区条带(Hb或Hb Variants)明显增高,且于Z1区出现异常带。此血红蛋白特异性图谱提示很可能为HbQ-Thailand变异体,须进一步基因检测确认。
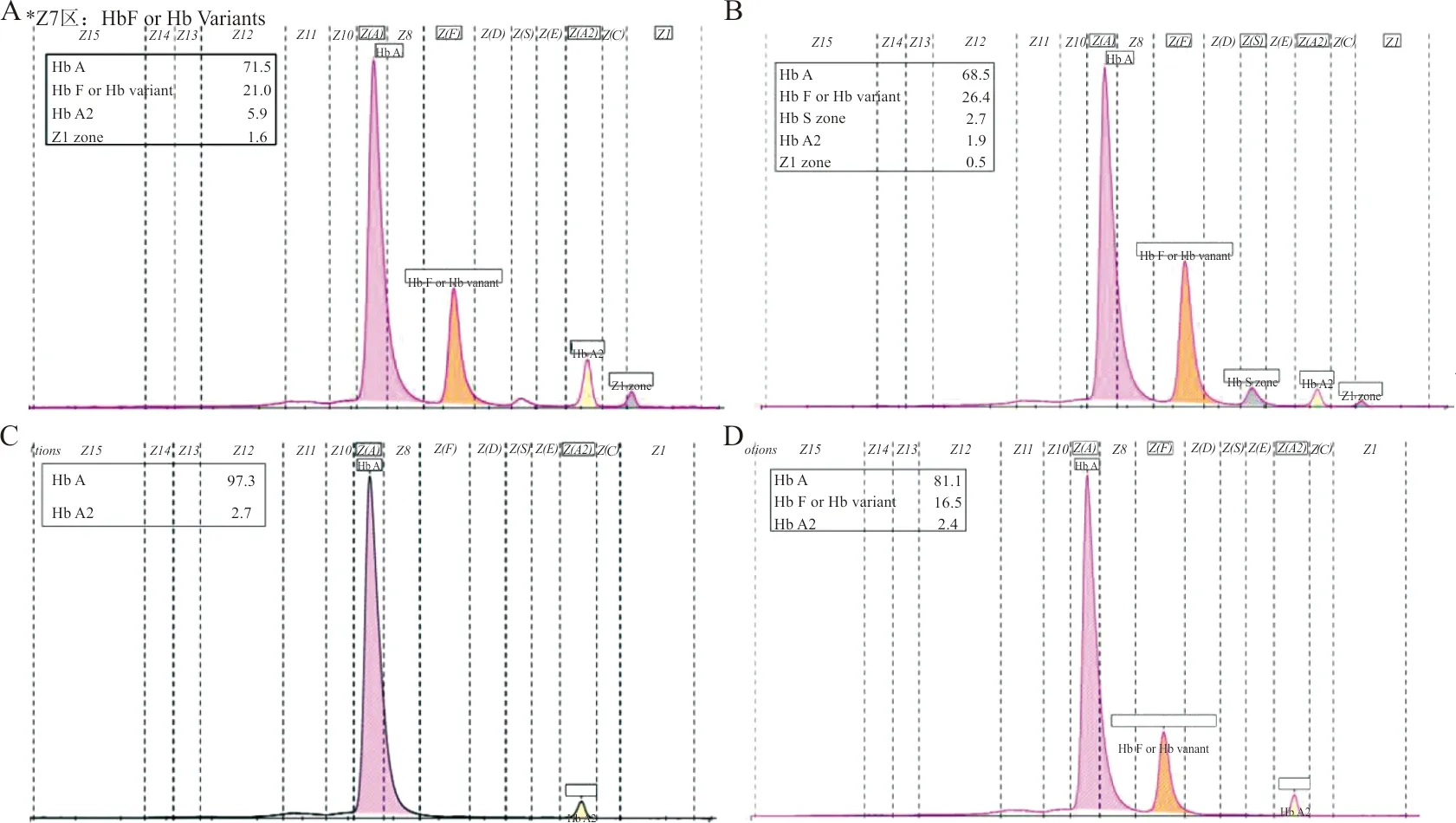
注:A为患者1;B为患者2;均出现Z7区(HbF或Hb Variant)明显增高,且于Z1区检出变异体。C为正常样本;D为β-地贫基因缺失杂合子样本。

表1 2例患者血液学表型结果
2.2常见地贫基因突变检测结果 经地贫基因检测常规试剂盒,2例患者均只检出α-地贫基因-α4.2缺失。按表型与基因型一致的诊断原则,此病例的基因型结果与其表型特征不符,提示需进一步检测其他少见或罕见珠蛋白基因突变以明确诊断。
2.3Sanger测序检测结果 血红蛋白毛细管电泳结果提示为异常血红蛋白HbQ-Thailand特征性图谱,经α1珠蛋白基因测序,2例患者均验证为HBA1:c.223G>C(p.74 Asp>His)的HbQ-Thailand异常血红蛋白变异杂合子。测序结果见图2。
2.4β-地贫基因缺失突变检测结果 缺失型β-地贫基因检测试剂盒(Gap-PCR法)的PCR产物琼脂糖凝胶电泳结果显示:患者1为β-地贫基因Taiwanese缺失杂合,患者2为β-地贫基因Gγ+(Aγδβ)0缺失杂合。此基因型结果与Z7区HbF明显增加的表型特征相符。见图3。

注:190 bp为内参条带,250 bp为正常条带,330 bp是Gγ+(Aγδβ)0型缺失突变条带,420 bp是SEA-HPFH型缺失突变条带,670 bp是Taiwanese型缺失突变条带。1,DL 2000 DNA Marker;2,Gγ+(Aγδβ)0缺失杂合阳性质控;3,SEA-HPFH缺失杂合阳性质控;4,Taiwanese型缺失杂合质控;5,正常样本;6,患者1样本(Taiwanese型缺失杂合);7,患者2样本[Gγ+(Aγδβ)0型缺失杂合]。
2.5患者样本确定基因型 综合以上DNA分析检测结果,患者1的基因型为异常血红蛋白HbQ-Thailand杂合,合并α-地贫-α4.2缺失杂合和β-地贫Taiwanese型缺失杂合(αα/-α4.2,βTaiwanese/βN);患者2为HbQ-Thailand杂合,合并α-地贫-α4.2缺失杂合和β-地贫Gγ+(Aγδβ)0型缺失杂合(αα/-α4.2,βGγ+(Aγδβ)0/βN)。
3 讨论
目前广泛实施的地贫分子筛查通用方案是通过血常规和血红蛋白组分进行表型分析,对表型筛查阳性者进行基因分型而明确诊断。除小部分静止型外,地贫基因携带者的红细胞参数表现为MCV<80 fL和/或MCH<27 pg的小细胞低色素的表型特征[7-8]。血红蛋白组分分析的HbA2>3.5%和HbF>2%特征常提示为β-地贫基因携带。另外,血红蛋白组分分析中出现其他异常条带即提示异常血红蛋白的可能。简言之,红细胞参数和血红蛋白组分的表型特征为地贫和异常血红蛋白病的进一步基因确诊提供最重要的线索和依据。
此研究中2例患者的血红蛋白组分分析结果均显示Z7区高比例、Z1区Hb QA2异常带的HbQ-Thailand特征性毛细管电泳结果,也均检出连锁遗传的α-地贫-α4.2缺失,与已报道的HbQ-Thailand一致[9-10]。HbF明显增高是β-地贫基因缺失的典型特征,而血红蛋白组分毛细管电泳检测的HbF和HbQ-Thailand为Z7区重叠。Z7区条带的高比例虽然提示为HbQ-Thailand,但也有可能包含HbF增高的β-地贫基因缺失。本研究的2例患者样本中均检出β-地贫基因缺失突变,由此证实高比例HbQ-Thailand掩盖了同时明显增高的HbF。此结果也提示,当血红蛋白组分毛细管电泳分析出现Z7区高比例,则有必要采用其他方法(如血红蛋白高效液相色谱法、琼脂糖凝胶电泳法)对HbF和HbQ-Thailand进行甄别,或同时进行β-地贫基因缺失检测以防漏检。
本研究中2例患者的血液学表型均无贫血症状(Hb正常),仅表现为MCV、MCH轻度降低,降低程度也小于单纯的β-地贫基因缺失杂合子[4,11-12],这很可能是β-地贫基因缺失合并α-地贫-α4.2缺失,从而在一定程度上缓解了α-/β-珠蛋白失衡。另外,患者1为未涉及δ(HBD)基因的β-地贫Taiwanese型缺失,HbA2(α2δ2)增高;而患者2为涉及δ(HBD)基因的β-地贫Gγ+(Aγδβ)0型缺失,故HbA2不增高。
HbQ-Thailand是中国南方人群中较为多见的血红蛋白病类型[2],但是关于HbQ-Thailand合并β-地贫基因缺失的报道不多。本研究结果提示,很可能是当前临床上广泛使用的血红蛋白毛细管电泳结果中Z7区的HbQ-Thailand与HbF重叠,导致β-地贫基因缺失的漏检。本研究还有待通过更多样本进一步分析总结,为此类复杂血红蛋白病的遗传咨询和基因诊断提供参考和指导。

