基于转录组学探讨何首乌不同炮制品的肝细胞毒性作用机制
黄超文 刘艳娟 王璐 包晴 蒋宇 杨磊
〔摘要〕 目的 探討何首乌(Polygonum Multiflorum, PM)炮制后降低肝毒性的作用机制。方法 通过使用生何首乌(raw Polygonum Multiflorum, RPM)与制何首乌(processed Polygonum Multiflorum, PPM)处理L02肝细胞,采用CCK-8与EdU试剂检测L02肝细胞的细胞活力与增殖能力;运用转录组学技术分析正常组、RPM、PPM组之间的差异基因,并对差异基因进行富集分析,在此基础上采用Western blot和免疫荧光验证相关通路上关键蛋白的表达水平。结果 CCK-8和EdU实验中发现,与正常组相比,RPM组能够显著抑制肝细胞的细胞活力与增殖能力(P<0.01),与RPM组相比,PPM组的肝细胞活力与增殖能力明显升高(P<0.01)。RNA测序结果发现,与正常组相比,RPM组有3449个上调基因、3793个下调基因。与RPM组相比,PPM组有3788个基因上调、3515个基因下调。将正常组与RPM组的差异基因和RPM组与PPM组的差异基因进一步取交集,得到6854个共同差异基因;GO分析类结果显示主要参与细胞杀伤、细胞聚集、新陈代谢、生长等生物过程;KEGG富集分析结果显示,这些差异基因主要富集在内吞作用、溶酶体、自噬作用等细胞过程。Western blot与免疫荧光结果显示,与正常组相比,RPM组中自噬相关基因LC3蛋白水平显著上调(P<0.01),P62蛋白水平显著降低(P<0.01);与RPM组相比,PPM组中LC3蛋白水平显著降低(P<0.01),P62蛋白水平显著升高(P<0.01)。结论 何首乌炮制后能够降低肝细胞毒性,其机制可能与减少细胞自噬有关,为降低何首乌毒性提供了新的干预措施。
〔关键词〕 何首乌;炮制;自噬;肝毒性;转录组学
〔中图分类号〕R283 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.010
〔Abstract〕 Objective To investigate the mechanism of action of the processed Heshouwu (Polygoni Multiflori) (PM) in reducing hepatocytotoxicity. Methods By treating L02 hepatocytes with raw Heshouwu (Polygonum Multiflora) (RPM) and processed Heshouwu (Polygoni Multiflori) (PPM), cell viability and proliferative capacity of L02 hepatocytes were detected using CCK-8 with EdU reagent; the gene differences among the normal, RPM and PPM groups were analyzed and the gene set enrichment analysis was performed by transcriptomics. Finally, Western blot and immunofluorescence were used to verify the expression levels of key proteins on the relevant pathways. Results CCK-8 and EdU experiments showed that RPM significantly inhibited cell viability and proliferative capacity of hepatocyte compared to the normal group (P<0.01), hepatocyte viability and proliferative capacity in the PPM group were significantly highercompared to the RPM group(P<0.01). The RNA sequencing revealed: 3449 up-regulated and 3793 down-regulated genes in RPM group compared with normal group; 3788 up-regulated and 3515 down-regulated genes in PPM group compared with RPM group. GO classification showed that the genes were mainly involved in cell killing, cell aggregation, metabolism, growth and other biological processes; KEGG classification suggested that these genes were mainly enriched in endocytosis, lysosome, autophagy and other cellular processes. The Western blot and immunofluorescence analyses showed the significantly higher protein level of LC3 (P<0.01) and lower protein level of P62 (P<0.01) in RPM group than in normal group; PPM group had the significantly lower protein level of LC3 (P<0.01) and higher level of P62 (P<0.01) than RPM group. Conclusion PPM is able to alleviate hepatocytotoxicity, whose mechanism may be reducing autophagy. The study may provide a new intervention to alleviate the toxicity of PM.
〔Keywords〕 Heshouwu (Polygonum Multiflorum); processing; autophagy; hepatotoxicity; transcriptomics
何首乌作为临床常用中药,具有抗衰老、增强免疫、抗高血脂等多种生物学效应[1]。根据其是否炮制,分为生品与炮制品。近年来国内外关于何首乌肝毒性的报道屡见不鲜[1-2]。临床资料显示患者使用何首乌后易出现肝炎、肝功能异常、药物性肝损伤等损害性疾病[3-4]。何首乌药用安全问题极大地限制了其在临床上的使用,为了使何首乌在临床上发挥其功效的同时避免其可能造成的肝损害,寻找特异性干预手段降低其肝毒性已成为当前科研工作者研究的热点。研究显示,与生何首乌相比,制何首乌肝毒性显著降低[5-6]。刘梦娇等[7]用L02肝细胞评估何首乌炮制前后肝毒性,结果发现,制首乌组的肝细胞抑制率低于生首乌组。尽管已有部分学者对何首乌的肝毒性进行深入研究,但其具体分子机制仍不清楚。因此,进一步阐明何首乌炮制后降低肝毒性的作用机制,有望为寻找降低何首乌肝毒性提供特异性干预靶点。
自噬是细胞降解有害成分并通过将其降解后的产物回收以实现细胞代谢和某些细胞器更新的生理过程[8-9]。在对乙酰氨基酚诱导的小鼠肝损伤中,人参皂苷Rk3通过激活自噬产生肝脏保护作用[10]。此外,自噬也可能促进肝细胞死亡而诱导肝损伤[11-12]。研究显示,马兜铃酸通过促进P53蛋白表达,诱导自噬,从而导致大鼠肝脏细胞损伤[13]。刀豆蛋白A通过增强自噬诱导树突状细胞活化,从而加剧自身免疫性肝炎[14]。综上所述,自噬在肝脏中起着双重作用:一方面,激活自噬可以保护肝脏免受损伤;另一方面,过度自噬又会导致肝脏功能受损。
本文通过实验评价生何首乌和制何首乌的肝毒性作用,采用何首乌提取物处理L02细胞,观察其对L02肝细胞活力、增殖的影响;利用转录组学技术分析生何首乌与制何首乌处理的L02肝细胞的表达谱差异,探讨其可能的分子机制,并进一步采用Western blot、免疫荧光分子实验技术对筛选的差异基因及通路进行验证,以期从分子水平为生何首乌与制何首乌肝毒性差异提供实验依据。
1 材料
1.1 药物与试剂
何首乌购自湖南中医药大学第一附属医院,经湖南中医药大学第一附属医院张志国教授鉴定为正品。生何首乌:何首乌未经加工处理。制何首乌:将黑豆汁浸泡的何首乌蒸制4 h,晒制4 h,蒸晒9次,即得;CCK-8试剂盒(C0037),购自中国碧云天公司;EdU增殖试剂(CX002),购自中国雅酶生物医药科技公司;LC3抗体(ab128025)、P62抗体(ab91526),均购自英国Abcam公司。
1.2 仪器
高速离心机(型号:Sorvall ST 8)、酶标仪(型号:Multiskan FC)均购自美国Thermo Fisher公司;恒温水浴锅(北京长风仪器仪表公司);荧光显微镜(日本Olympus公司,型号:X51);化学发光成像系统(美国Beckman公司,型号:UniCel DxI 800)。
2 方法
2.1 何首乌供试液制备
取适量的生何首乌和制何首乌,粉碎后用70%乙醇提取。第1次加10倍量70%乙醇加热回流提取2 h,第2次加8倍量70%乙醇加热回流提取1.5 h,共提取2次,合并提取液,减压浓缩回收乙醇,得到相应的生药浓度。
2.2 细胞培养
L02人肝细胞株,在含10%胎牛血清(FBS)、1%双抗的1640完全培养基、37 ℃、5% CO2及饱和湿度条件下进行常规培养,所有实验均在细胞对数生长期进行。
2.3 细胞活力检测
采用CCK-8试剂测定生何首乌、制何首乌对L02肝细胞的细胞毒性。将细胞接种(5×103个/孔)在96孔板中,并在37 ℃、5% CO2培养箱中培养24 h至对数生长期。分为正常组、生何首乌(raw Polygonum Multiflorum, RPM)组、制何首乌(processed Polygonum Multiflorum, PPM)组。正常组不作任何处理,RPM组和PPM组分别加入不同浓度的生何首乌、制何首乌(0、1.25、2.5、5、10、20 mg/mL)处理L02肝细胞,继续在培养箱中培养24 h,随后在每孔中加入10 μL CCK-8试剂,孵育1.5 h,通过酶标仪测量450 nm处OD值。
细胞活力=(给药组OD值-空白对照组OD值)/(正常組OD值-空白对照组OD值)×100%。
2.4 EdU增殖实验
将L02肝细胞接种在12孔板中,分为正常组、RPM组、PPM组,其中RPM组和PPM组分别用5 mg/mL的生何首乌、制何首乌处理24 h,并根据制造商的说明用EdU-488细胞增殖检测试剂盒染色。首先将细胞用EdU标记,然后进行EdU检测及细胞核染色,最后通过荧光显微镜在40倍镜下拍摄图像并保存,计算细胞增殖率。细胞增殖率=EdU细胞数/DAPI细胞数×100%。
2.5 转录组测序
6孔板中接种5×105个/孔,在培养箱中培养24 h分为正常组、RPM组、PPM组,各组细胞处理方式同“2.4”项,除去所有培养基,并用冷的PBS洗涤细胞2次。TRIzol用于分离总RNA,检测RNA样品的纯度、浓度和完整性,以保障使用合格的样品进行转录组测序。样品检测合格后,进行文库构建,最后用Illumina平台进行测序。使用DESeq2软件分析正常组、生何首乌组、制何首乌组三者之间的差异表达基因。将FC≥2且FDR<0.01的基因认为是差异表达基因(differential expressed genes, DEGs)。对DEGs进行GO和KEGG分析。
2.6 免疫荧光检测L02肝细胞中LC3和P62的荧光信号
将细胞爬片分为正常组、RPM组、PPM组。各组细胞漂洗一次,4%多聚甲醛固定30 min,0.1%Triton-X100室温下破膜15 min,PBS洗2次,10% FBS室温封闭30 min,加入一抗(LC3和P62抗体1∶100),4 ℃孵育过夜;TBST洗3次,加入二抗室温孵育1 h;室温避光孵育核染色15 min,荧光显微镜下观察。
2.7 Western blot检测L02肝细胞中LC3和P62的蛋白表达
用RIPA裂解液处理样品获得蛋白提取物,通过SDS-聚丙烯酰胺凝胶电泳分离样品并转移到聚偏二氟乙烯膜,在室温下用5%的脱脂牛奶封闭1.5 h,然后将膜与一抗LC3、P62在4 ℃孵育过夜,然后与二抗抗兔IgG 37 ℃孵育1 h。使用ImageJ通过荧光读数进行检测,并通过ImageJ进行定量。
2.8 统计学分析
实验数据显示为“x±s”,采用GraphPad Prism 8进行统计学分析,两组间比较采用t检验。使用单因素方差分析(ANOVA)和最小显著性差异(LSD)检验进行多组之间的比较。以P<0.05表示差异有统计学意义。
3 结果
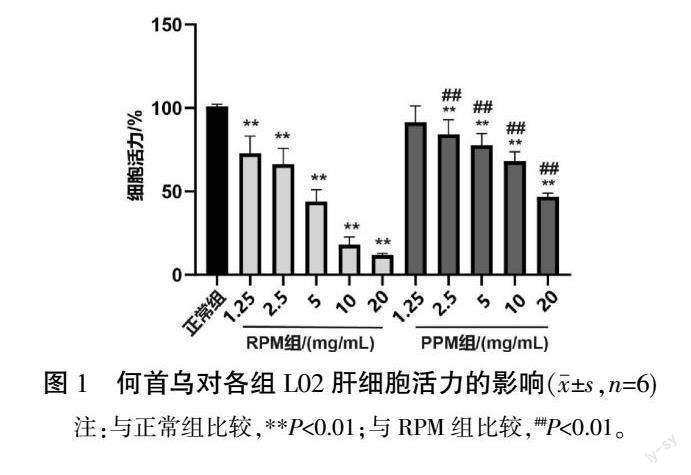
3.1 何首乌炮制前后对L02肝细胞活力的影响
与正常组相比,RPM组各个浓度组的细胞活力显著降低(P<0.01),PPM组中除1.25 mg/mL浓度组外,其余各个浓度组细胞活力显著降低(P<0.01);与RPM组相比,PPM组各个浓度(除1.25 mg/mL)组的细胞活力明显升高(P<0.01)。详见图1。
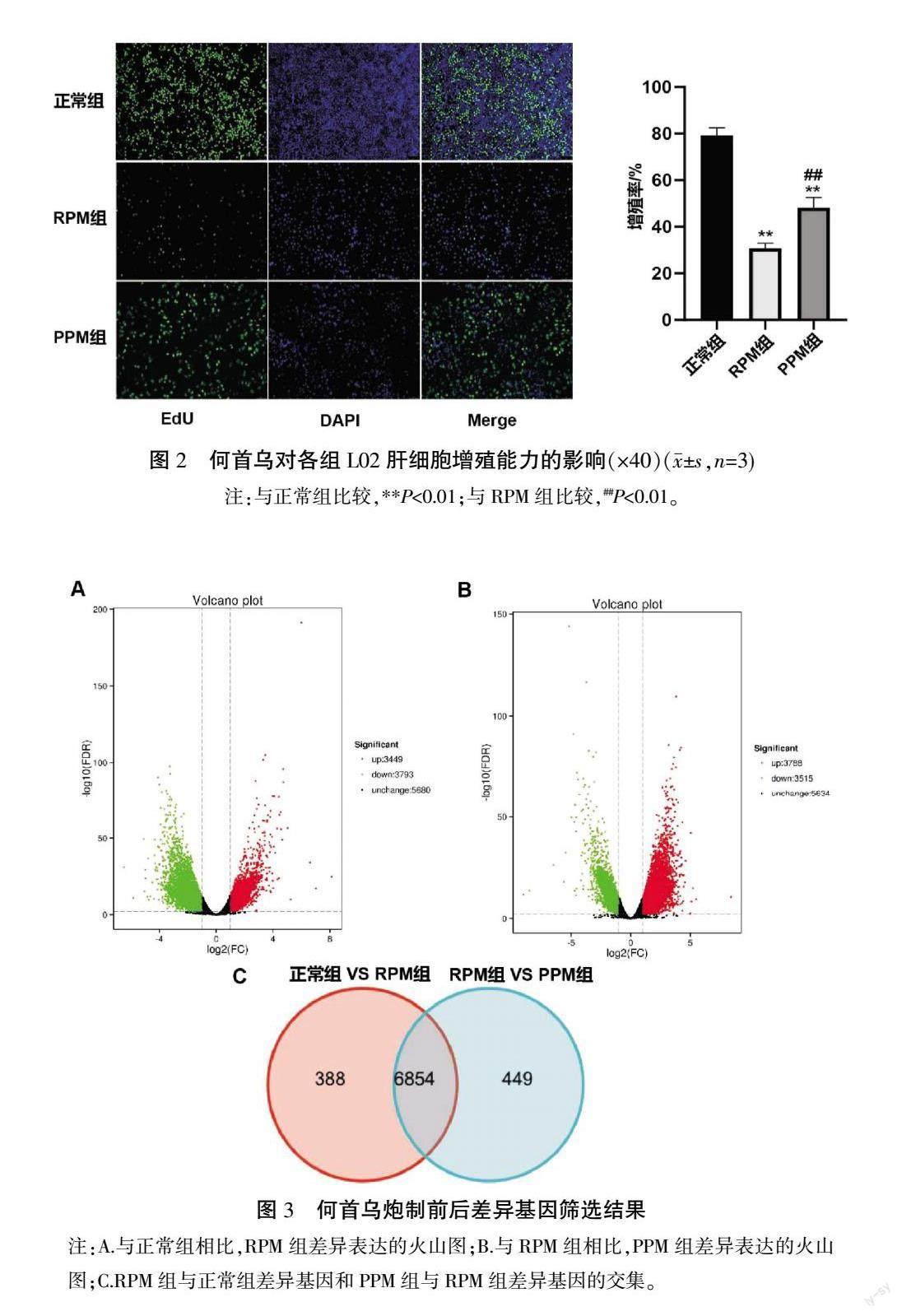
3.2 何首乌炮制前后对L02肝细胞增殖能力的影响
与正常组相比,RPM组及PPM组的肝细胞增殖能力显著降低(P<0.01);与RPM组相比,PPM组中肝细胞增殖能力显著升高(P<0.01)。详见图2。
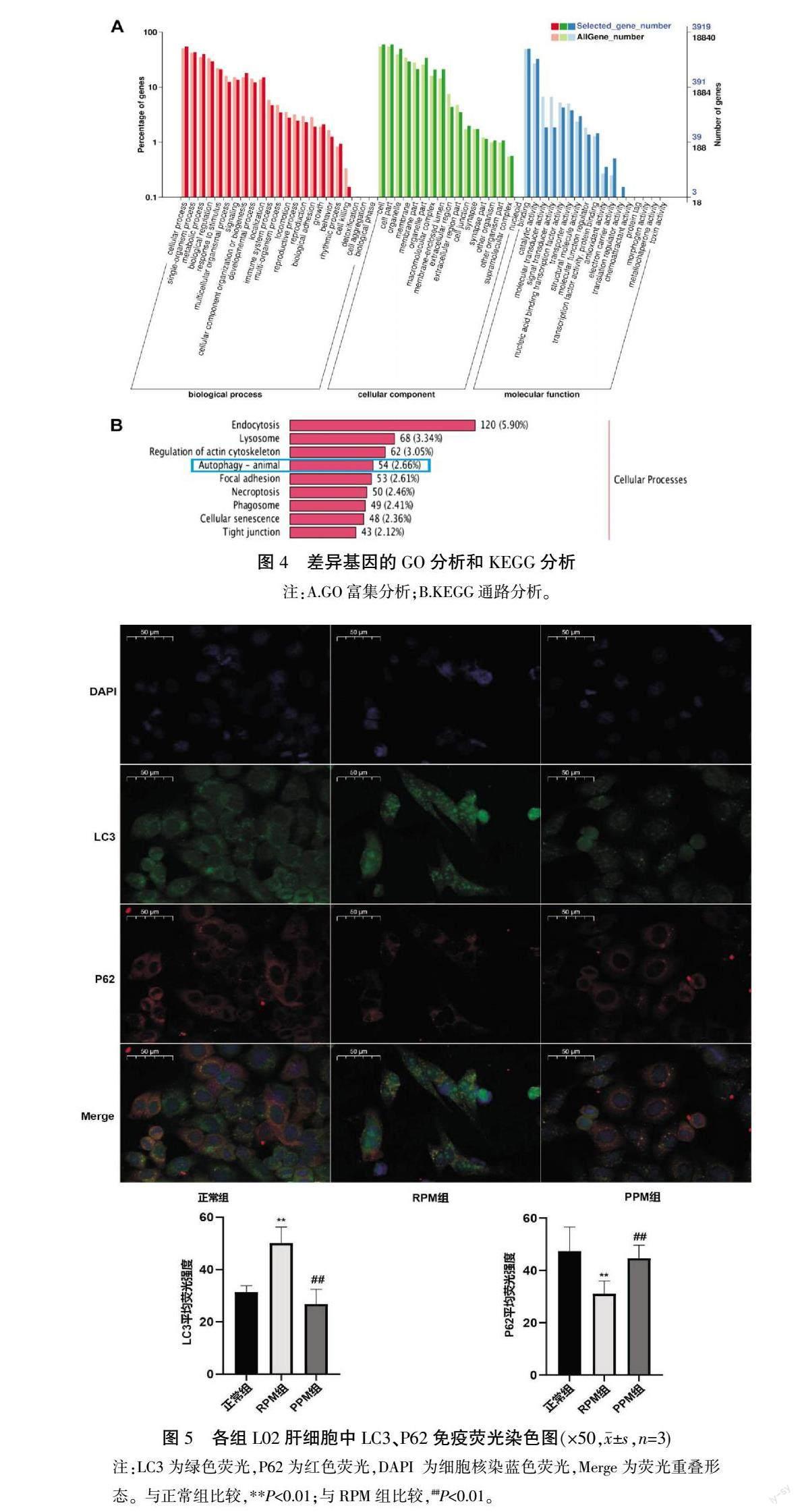
3.3 何首乌炮制前后对L02肝细胞转录组基因的影响
与正常组相比,RPM组有3449个上调基因、3793个下调基因。与RPM相比,PPM组有3788个基因上调、3515个基因下调。将正常组、RPM组的差异基因与RPM组、PPM组的差异基因进一步取交集,得到6854个共同差异基因(图3)。对6854个差异基因中表达量大于1的4216个基因进行GO分析和KEGG分析。GO分析结果显示主要参与细胞杀伤、细胞聚集、新陈代谢、生长等生物过程;KEGG分析结果显示,这些差异基因主要富集在内吞作用、溶酶体、自噬作用等细胞过程。详见图4。
3.4 何首乌炮制前后对L02肝细胞中LC3、P62荧光信号的影响
与正常组相比,RPM组中的LC3荧光信号增强(P<0.01),P62荧光信号减弱(P<0.01);与RPM组相比,PPM组中LC3荧光信号减弱(P<0.01),P62荧光信号增强(P<0.01)。详见图5。
3.5 何首乌炮制前后对L02肝细胞中LC3、P62蛋白表达的影响
与正常组相比,RPM组中LC3Ⅱ/Ⅰ蛋白水平上调,P62蛋白水平下调(P<0.01);与RPM组相比,PPM组中LC3Ⅱ/Ⅰ蛋白水平下调,P62蛋白水平上升(P<0.01)。详见图6。
4 讨论
何首乌是一种我国常用的传统中药,在临床中广泛使用,但随着其临床肝毒性报道的增加,人们对何首乌的肝毒性研究也越来越多[2,15-16]。本研究采用CCK-8与EdU评估了何首乌炮制前后对肝细胞活力和增殖能力的影响,发现何首乌炮制后能够降低对肝细胞的毒性。然而,在大多数情况下何首乌致肝损伤的作用机制仍然不太明确。因此,阐明何首乌肝毒性的相关分子机制、寻找特异性干预靶点、降低其毒副作用是推广其临床应用的关键手段。
自噬在维持肝脏稳态和消除细胞内有害物质中起主要作用[17-18]。然而在某些情况下,肝细胞中的过度自噬也是导致肝损伤的重要因素。LC3、P62为自噬过程中的关键蛋白。LC3具有2种形式:LC3-Ⅰ和LC3-Ⅱ,在各种细胞中翻译后产生。且LC3-Ⅱ的量与自噬水平相关[19]。P62是一种选择性自噬受体,可通过自噬溶酶体途径招募和递送细胞内底物以进行大量清除,当自噬被激活时,聚泛素结合蛋白P62通过自噬降解[20]。杨李旺等[21]研究显示,黄连解毒汤通过上调Beclin1及LC3-Ⅱ/Ⅰ的表达,从而诱导脓毒症小鼠发生自噬,降低肝损伤。吴欣妍等[22]在研究中发现,同型半胱氨酸通过促进PSMD10表达增加,诱导肝细胞过度自噬从而导致肝损伤。LIU等[23]发现高浓度的斑蝥素激活自噬,上调LC3,增加肝細胞毒性。有研究[24]发现芦荟大黄素能够诱导自噬,促进ABBC2蛋白降解,从而导致小鼠肝损伤。然而,何首乌肝毒性与自噬之间是否存在联系尚不清楚。本实验通过转录组技术对4216个共同差异表达基因进行GO分析和KEGG分析,提示内吞作用、溶酶体、自噬作用与何首乌引起的肝损伤机制有关。研究结果显示,生何首乌能够上调LC3Ⅱ/Ⅰ的比值,下调P62表达;何首乌炮制后能够降低对肝细胞中LC3、P62蛋白表达的影响。
综上所述,在我们的研究中发现何首乌炮制后能够降低肝细胞毒性,且何首乌能够通过影响LC3、P62蛋白的表达来增加肝细胞自噬,从而导致肝损伤。尽管我们发现何首乌通过自噬诱导肝损伤,但其具体影响机制尚不明确,特别是自噬与其他因素相互作用导致何首乌肝损伤有待更多深入探讨,为寻找和发现调节自噬干预何首乌肝损伤提供新的思路。
参考文献
[1] LIU Y, WANG Q, YANG J B, et al. Polygonum multiflorum Thunb.: A review on chemical analysis, processing mechanism, quality evaluation, and hepatotoxicity[J]. Frontiers in Pharmacology, 2018, 9: 364.
[2] DONG H H, SLAIN D, CHENG J C, et al. Eighteen cases of liver injury following ingestion of Polygonum multiflorum[J]. Complementary Therapies in Medicine, 2014, 22(1): 70-74.
[3] LIN L F, NI B R, LIN H M, et al. Traditional usages, botany, phytochemistry, pharmacology and toxicology of Polygonum multiflorum Thunb.: A review[J]. Journal of Ethnopharmacology, 2015, 159: 158-183.
[4] JIANG L L, ZHAO D S, FAN Y X, et al. Transcriptome analysis to assess the cholestatic hepatotoxicity induced by Polygoni Multiflori Radix: Up-regulation of key enzymes of cholesterol and bile acid biosynthesis[J]. Journal of Proteomics, 2018, 177: 40-47.
[5] LEI X, CHEN J, REN J T, et al. Liver damage associated with Polygonum multiflorum Thunb.: A systematic review of case reports and case series[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2015, 2015: 459749.
[6] XUE X Y, QUAN Y Y, GONG L H, et al. A review of the processed Polygonum multiflorum (Thunb.) for hepatoprotection: Clinical use, pharmacology and toxicology[J]. Journal of Ethnopharmacology, 2020, 261: 113121.
[7] 劉梦娇, 蒲俊安, 戴 冰, 等. 何首乌“九蒸九晒”炮制工艺优选及对L02肝细胞生长的影响[J]. 中国中医药信息杂志, 2020, 27(4): 70-73.
[8] FAN Z H, LI Y X, CHEN S S, et al. Magnesium isoglycyrrhizinate ameliorates concanavalin A-induced liver injury by inhibiting autophagy[J]. Frontiers in Pharmacology, 2021, 12: 794319.
[9] LI W, HE P C, HUANG Y G, et al. Selective autophagy of intracellular organelles: Recent research advances[J]. Theranostics, 2021, 11(1): 222-256.
[10] QU L L, FU R Z, MA X X, et al. Hepatoprotective effects of ginsenoside Rk3 in acetaminophen-induced liver injury in mice by activation of autophagy[J]. Food & Function, 2021, 12(19): 9128-9140.
[11] QIAN H, CHAO X J, WILLIAMS J, et al. Autophagy in liver diseases: A review[J]. Molecular Aspects of Medicine, 2021, 82: 100973.
[12] ALLAIRE M, RAUTOU P E, CODOGNO P, et al. Autophagy in liver diseases: Time for translation?[J]. Journal of Hepatology, 2019, 70(5): 985-998.
[13] 陈佳靓, 徐嘉若, 周月华, 等. 马兜铃酸致大鼠肝脏损伤及对自噬因素的影响[J]. 上海中医药大学学报, 2021, 35(5): 44-51.
[14] FAN X L, MEN R T, HUANG C, et al. Critical roles of conventional dendritic cells in autoimmune hepatitis via autophagy regulation[J]. Cell Death & Disease, 2020, 11(1): 23.
[15] LIU Y, WANG W P, SUN M Y, et al. Polygonum multiflorum-induced liver injury: Clinical characteristics, risk factors, material basis, action mechanism and current challenges[J]. Frontiers in Pharmacology, 2019, 10: 1467.
[16] ZHANG Y, DING T, DIAO T T, et al. Effects of Polygonum multiflorum on the activity of cytochrome P450 isoforms in rats[J]. Die Pharmazie, 2015, 70(1): 47-54.
[17] UENO T, KOMATSU M. Autophagy in the liver: Functions in health and disease[J]. Nature Reviews Gastroenterology & Hepatology, 2017, 14(3): 170-184.
[18] KE P Y. Diverse functions of autophagy in liver physiology and liver diseases[J]. International Journal of Molecular Sciences, 2019, 20(2): 300.
[19] KABEYA Y, MIZUSHIMA N, UENO T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. The EMBO Journal, 2000, 19(21): 5720-5728.
[20] PANKIV S, CLAUSEN T H, LAMARK T, et al. P62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J]. The Journal of Biological Chemistry, 2007, 282(33): 24131-24145.
[21] 楊李旺, 杨 蓉, 赵焕新, 等. 黄连解毒汤通过诱导自噬减轻脓毒症小鼠肝损伤[J]. 中国实验方剂学杂志, 2022, 28(5): 71-76.
[22] 吴欣妍, 焦 运, 王青青, 等. PSMD10在同型半胱氨酸激活肝细胞自噬促进肝脏损伤中的作用机制研究[J]. 中国药理学通报, 2021, 37(4): 535-541.
[23] LIU F, DUAN C C, ZHANG J Y, et al. Cantharidin-induced LO2 cell autophagy and apoptosis via endoplasmic reticulum stress pathway in vitro[J]. Journal of Applied Toxicology, 2020, 40(12): 1622-1635.
[24] LIU D M, YANG D, ZHOU C Y, et al. Aloe-emodin induces hepatotoxicity by the inhibition of multidrug resistance protein 2[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2020, 68: 153148.

