从肝治心组方对氧糖剥夺/复灌H9c2心肌细胞模型铁代谢的调节作用
曾阳 王瑾茜 陈亚 胡国恒 张程程 何飘 朴美虹

〔摘要〕 目的 研究大鼠心肌缺血/再灌注(myocardial ischemia/reperfusion, MI/R)损伤后心肌细胞的铁代谢及从肝治心组方干预对铁死亡的调节作用。方法 选择体外培养的大鼠H9c2心肌細胞,并采用氧糖剥夺/复灌(oxygen glucose deprivation/reperfusion, OGD/R)法建立体外MI/R模型。将细胞分为正常组、模型组、中药组、抑制剂组、激动剂组、联合组、空白血清组。除正常组外,其余各组均予以OGD/R诱导损伤,在复灌时分别给予完全培养基、含15%含药血清的高糖DMEM培养基、含铁死亡抑制剂Ferrostatin-1(Fer-1)(0.5 μmol/L)的完全培养基、含爱拉斯汀(Erastin)(10 μmol/L)的完全培养基、含Erastin(10 μmol/L)的15%含药血清培养基、含15%空白血清的高糖DMEM培养基。采用CCK-8检测细胞存活率,TMRE荧光探针检测线粒体膜电位,FerroOrange检测细胞内Fe2+水平,DCFH-DA荧光探针检测活性氧(reactive oxygen species, ROS)水平。结果 与正常组比较,模型组与空白血清组细胞存活率及线粒体膜电位显著下降(P<0.01),Fe2+及ROS水平显著升高(P<0.01)。模型组与空白血清组线粒体膜电位、Fe2+水平差异无统计学意义(P>0.05)。与模型组比较,中药组及抑制剂组细胞存活率及线粒体膜电位显著升高(P<0.01),Fe2+及ROS水平显著降低(P<0.01)。中药组与抑制剂组线粒体膜电位、Fe2+及ROS水平差异无统计学意义(P>0.05)。与模型组相比,激动剂组细胞存活率及线粒体膜电位显著下降(P<0.01),Fe2+及ROS水平显著升高(P<0.01)。与激动剂组相比,联合组细胞存活率及线粒体膜电位显著升高(P<0.01),Fe2+及ROS水平显著降低(P<0.01)。结论 从肝治心组方可以减少MI/R损伤,其机制可能与调节心肌细胞铁代谢、抑制铁死亡有关。
〔关键词〕 从肝治心组方;心肌细胞;铁代谢;铁死亡;氧糖剥夺/复灌;心肌缺血/再灌注损伤
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.009
〔Abstract〕 Objective To investigate the iron metabolism of cardiomyocyte after myocardial ischemia-reperfusion (MI/R) injury in rats and the regulatory effects of Conggan Zhixin Compound Formula on ferroptosis. Methods H9c2 cardiomyocytes of rats cultured in vitro were selected and an in vitro MI/R model was established by oxygen glucose deprivation/reperfusion (OGD/R) modeling. The cells were divided into normal group, model group, Chinese medicine group, inhibitor group, agonist group, joint group, and blank serum group. Except for the normal group, all other groups were subjected to OGD/R induced injury. During reperfusion, complete medium, high-glucose DMEM medium containing 15% drug-containing serum, complete medium containing Ferrostatin-1 (0.5 μmol/L), complete medium containing Erastin (10 μmol/L), 15% drug-containing serum medium containing Erastin (10 μmol/L), and high-glucose DMEM medium containing 15% blank serum were administered according to different groups. CCK-8 was used to measure cell survival rate, TMRE fluorescent probe was used to examine mitochondrial membrane potential, FerroOrange was used to determine intracellular Fe2+ level, and DCFH-DA fluorescent probe was used to identify reactive oxygen species (ROS) level in each group. Results Compared with the normal group, the cell survival rates and mitochondrial membrane potential in the model group and the blank serum group decreased significantly (P<0.01), and the levels of Fe2+ and ROS increased significantly (P<0.01). There was no significant difference in mitochondrial membrane potential and Fe2+ levels between the model group and the blank serum group (P>0.05). Compared with the model group, the cell survival rates and mitochondrial membrane potential in the Chinese medicine group and the inhibitor group increased significantly (P<0.01), and the levels of Fe2+ and ROS decreased significantly (P<0.01). There was no significant difference in mitochondrial membrane potential, Fe2+ and ROS levels between the Chinese medicine group and the inhibitor group (P>0.05). Compared with the model group, the cell survival rate and mitochondrial membrane potential in the agonist group decreased significantly (P<0.01), and the levels of Fe2+ and ROS increased significantly (P<0.01). Compared with the agonist group, the cell survival rate and mitochondrial membrane potential in the joint group were significantly higher (P<0.01), and the levels of Fe2+ and ROS were significantly lower (P<0.01). Conclusion Conggan Zhixin Compound Formula can reduce MI/R injury, and its mechanisms may be related to regulating iron metabolism of myocardial cells and inhibiting ferroptosis.
〔Keywords〕 Conggan Zhixin Compound Formula; cardiomyocyte; iron metabolism; ferroptosis; oxygen glucose deprivation/reperfusion; myocardial ischemia/reperfusion injury
近年来,我国心肌缺血性疾病发病率持续增高,急性心肌梗死已成为人类死亡的重要原因[1]。再灌注是治疗心肌缺血的有效措施,但血供恢复后可能出现心肌损伤进行性加重,这种现象称为心肌缺血/再灌注(myocardial ischemia/reperfusion, MI/R)损伤[2]。MI/R损伤是血运重建后造成心肌梗死范围扩大、心律失常、猝死等严重后果的重要原因。因此,减轻血管重建后MI/R损伤成为治疗心肌缺血性疾病的关键。研究表明,在MI/R损伤过程中,铁死亡是一个重要的发病机制,靶向铁死亡有望治疗MI/R损伤[3]。铁死亡是一种新型细胞死亡方式,以铁超载导致细胞抗氧化能力耗竭、活性氧(reactive oxygen species,ROS)累积、脂质过氧化增加为主要特征[4-5]。因此,寻找有效药物抑制MI/R损伤后心肌细胞铁死亡,避免心肌损伤进一步加重,成为治疗心肌缺血性疾病的新靶向。从肝治心组方(在心痛灵I号基础上增加疏肝解郁之药)为中药复方,具有多成分、多靶点、多通路的特点,主要用于治疗胸痹、心痛[6]。前期研究表明,从肝治心组方对缺血心肌具有保护作用[7-8],其是否抑制铁死亡进程尚未可知。本研究以大鼠H9c2心肌细胞为研究对象,从体外的角度探讨从肝治心组方对心肌细胞铁代谢是否具有调节作用,为MI/R损伤的中医药治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞 细胞株为大鼠H9c2心肌细胞(武汉普诺赛生命科技有限公司,批号:CL-0089)。将大鼠H9c2心肌细胞置于含10%胎牛血清、1%青链霉素混合液的培养基中,放入37 ℃、5% CO2的培养箱培养,24 h后换液。待细胞融合至80%~90%时,用0.25%胰蛋白酶消化,按1∶2传代,达到基本融合后再次消化传代,进行扩增和富集。
1.1.2 動物 12只Sprague-Dawley雄性大鼠,体质量250~280 g,SPF级,饲养于湖南中医药大学实验动物中心,用于血清制备。动物购自湖南省斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004,动物质量合格证号:430727211100716862,动物伦理审批号:20201010-3。
1.1.3 主要试剂 胎牛血清、高糖DMEM培养基、0.25%胰蛋白酶溶液(含0.02% EDTA)(美国Gibco公司,批号:42G3099K、8121033、2185855);无糖DMEM培养基(上海源培生物科技股份有限公司,批号:L210804);PBS(武汉普诺赛生命科技有限公司,批号:WH01132103XP04);青链霉素混合液(北京索莱宝科技有限公司,批号:P1400);细胞增殖及毒性检测试剂盒(北京博奥森生物技术有限公司,批号:BA02247076);线粒体膜电位检测试剂盒、ROS检测试剂盒(碧云天生物技术有限公司,批号:051021210518、011521210429);二价铁离子检测探针-FerroOrange[东仁化学科技(上海)有限公司,批号:SZ759]。
1.1.4 主要仪器 旋转蒸发仪(德国Heidolph公司,型号:Hei-vapAdv antage);CO2培养箱(美国赛默飞世尔科技公司,型号:Forma CO2 3111);倒置生物显微镜(广州粤显光学仪器有限责任公司,型号:XDS-1);多功能酶标仪(美国PerkinElmer公司,型号:EnSpire);激光共聚焦显微镜(美国蔡司公司,型号:LSM800)。
1.2 方法
1.2.1 模型制备 取大鼠H9c2心肌细胞构建氧糖剥夺/复灌(oxygen glucose deprivation/reperfusion, OGD/R)模型[9]。将大鼠H9c2心肌细胞接种于细胞板后,先用完全培养基(含10%胎牛血清的高糖DMEM培养基)进行常规培养(37 ℃,5%CO2)。24 h后选用无血清的低糖DMEM培养基替换完全培养基,并置于提前设置缺氧环境的三气培养箱(37 ℃,1%O2,5% CO2,94%N2)中培养12 h,模拟氧糖剥夺环境。最后更换为完全培养基,置于37 ℃、5%CO2培养箱中复灌2 h。
1.2.2 分组及给药 动物实验分组及给药:从肝治心组方由红参10 g、当归10 g、丹参10 g、柴胡10 g、姜黄10 g、郁金10 g、白芥子5 g、九香虫5 g组成。中药购自湖南中医药大学第一附属医院,采用自动煎药壶煎煮,煎煮方法:一煎加水500 mL,煎汁200 mL,二煎加水300 mL,煎汁150 mL。将两次煎汁混合,转移至旋转蒸发仪中浓缩,浓缩至生药浓度为1.5 g/mL,待冷却后置于4 ℃冰箱冷藏备用。将12只雄性SPF级SD大鼠随机分为两组,其中空白组4只、中药组8只。分别对两组大鼠进行灌胃,灌胃量参照《药理实验方法学(第4版)》[10]换算。以60 kg成年人每日剂量70 g原药材为依据,大鼠剂量按体表面积计算,按人等效面积的2倍剂量给药。空白组给予等体积蒸馏水,每日灌胃1次,连续1周。末次给药1 h后腹主动脉采血,室温静置1 h后离心(3000 r/min,10 min,离心半径7 cm)。取上清液,在56 ℃水浴下灭活30 min,过滤、分装并冻存于-20 ℃冰箱备用。
细胞实验分组及给药:取对数生长期的大鼠H9c2心肌细胞,按密度1×105个/孔接种于6孔板,待细胞贴壁生长后,随机将细胞分为7组:正常组(正常培养)、模型组(OGD/R)、中药组(OGD/R+含药血清)、抑制剂组(OGD/R+铁死亡抑制剂)、激动剂组(OGD/R+铁死亡激动剂)、联合组(OGD/R+铁死亡激动剂+含药血清)、空白血清组(OGD/R+空白血清)。在复灌时,模型组使用完全培养基;中药组使用含15%含药血清的高糖DMEM培养基;抑制剂组使用含铁死亡抑制剂Ferrostatin-1(Fer-1)(0.5 μmol/L)的完全培养基;激动剂组使用含爱拉斯汀(Erastin)(10 μmol/L)的完全培养基;联合组使用含Erastin(10 μmol/L)的15%含药血清培养基;空白组使用含15%空白血清的高糖DMEM培养基。
1.3 检测指标
1.3.1 细胞存活率检测 将处于对数生长期的大鼠H9c2心肌细胞制成单细胞悬液,按密度5×103个/孔接种于96孔板内,每孔体积100 μL,每组设3个复孔。96孔板最外面一圈易产生边缘效应,不接种细胞。待细胞贴壁后按“1.2.1”“1.2.2”项进行造模、分组及给药。待OGD/R处理完成后,向每孔内加入100 μL的CCK-8反应混合液(1 mL CCK-8溶液+10 mL完全培养基),置于37 ℃、5%CO2培养箱继续孵育4 h。孵育完成后将96孔板置于酶联免疫检测仪中,于450 nm波长下,检测各孔吸光度(OD)值,计算细胞存活率。
1.3.2 线粒体膜电位检测 将对数生长期的大鼠H9c2心肌细胞按密度1×105个/孔接种于6孔板,待细胞贴壁生长后按“1.2.1”“1.2.2”项进行造模、分组及给药。按试剂盒说明书配制线粒体膜电位检测工作液,各组OGD/R处理后,去除培养基,用PBS洗涤1次,然后每孔加入1 mL染色工作液,置于37 ℃、5%CO2细胞培养箱中孵育30 min。待孵育结束后,吸除上清液,用预热的细胞培养基洗涤2次。最后加入2 mL预热的细胞培养基,置于激光共聚焦显微镜下观察拍照。
1.3.3 细胞内铁離子检测 以DMSO溶解FerroOrange,制成1 mmol/L的FerroOrange溶液,用HBSS溶液将FerroOrange溶液稀释为1 μmol/L的FerroOrange工作液。将大鼠H9c2心肌细胞造模、分组、给药,OGD/R处理后,去除培养基,用无血清培养基清洗3次。加入1 μmol/L的FerroOrange工作液,在37 ℃、5%CO2培养箱中培养30 min后置于激光共聚焦显微镜下观察拍照。
1.3.4 ROS水平检测 用无血清培养基稀释DCFH-DA,使终浓度为10 μmol/L。细胞经分组处理后,去除培养基,加入1 mL DCFH-DA工作液,置于37 ℃、5%CO2细胞培养箱内孵育20 min。孵育完成后用无血清细胞培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。最后置于激光共聚焦显微镜下观察拍照。
1.4 统计学方法
采用统计学软件SPSS 25.0分析数据。计量资料以“x±s”表示,多组比较,同时满足正态性及方差齐性者,采用单因素方差分析(one-way ANOVA),若不满足正态性者采用多个独立样本比较的秩和检验(Kruskal-Wallis H test),以P<0.05为差异具有统计学意义。
2 结果
2.1 不同处理对心肌细胞存活率的影响
与正常组相比,模型组细胞存活率显著下降(P<0.01),提示造模成功。抑制剂组、中药组和联合组细胞存活率较模型组显著提高(P<0.01)。空白血清组细胞存活率较正常组显著下降(P<0.01),与模型组比较差异无统计学意义(P>0.05)。详见表1。
2.2 不同处理对心肌细胞线粒体膜电位的影响
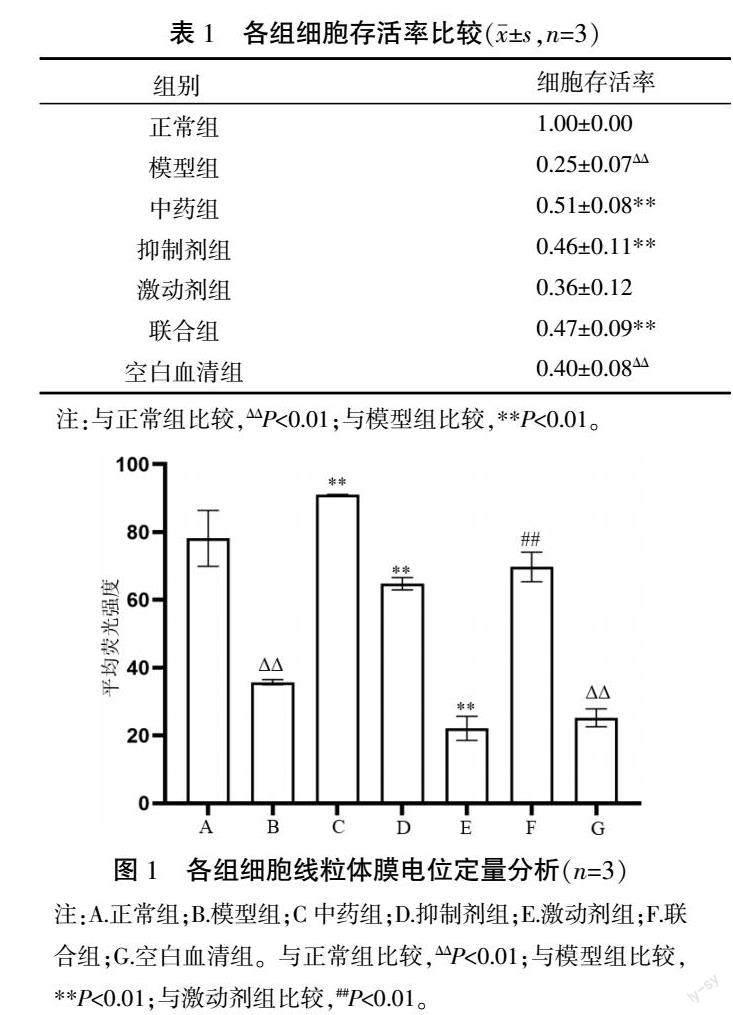
与正常组相比,模型组及空白血清组线粒体膜电位显著下降(P<0.01)。空白血清组与模型组线粒体膜电位差异无统计学意义(P>0.05)。与模型组相比,中药组及抑制剂组线粒体膜电位显著升高(P<0.01);激动剂组线粒体膜电位显著降低(P<0.01)。联合组线粒体膜电位水平较激动剂组明显升高(P<0.01)。中药组和抑制剂组线粒体膜电位差异无统计学意义(P>0.05)。详见图1—2。
2.3 不同处理对心肌细胞Fe2+水平的影响
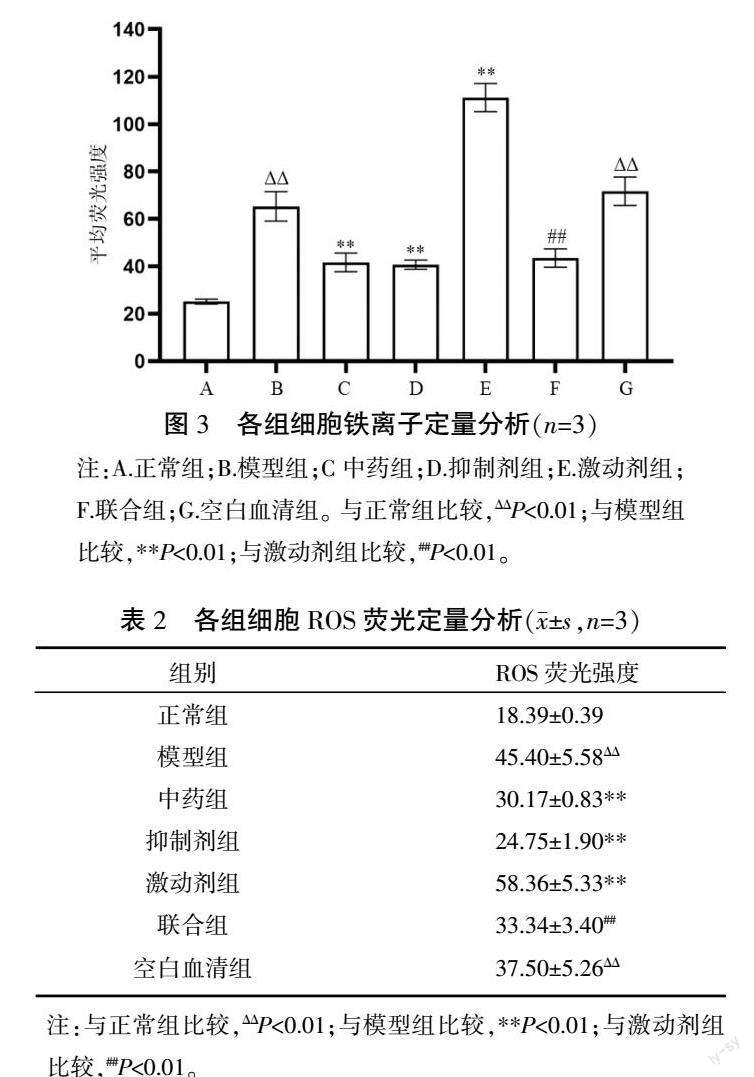
正常组细胞内Fe2+呈较低水平,模型组和空白血清组Fe2+水平较正常组显著升高(P<0.01)。空白血清组与模型组Fe2+水平差异无统计学意义(P>0.05)。中药组及抑制剂组Fe2+较模型组显著下降(P<0.01);激动剂组Fe2+较模型组显著升高(P<0.01);联合组Fe2+水平较激动剂组显著下降(P<0.01)。中药组和抑制剂组Fe2+水平差异无统计学意义(P>0.05)。详见图3—4。
2.4 不同处理对心肌细胞ROS水平的影响
正常组细胞内ROS呈较低水平,模型组和空白血清组ROS水平较正常组显著升高(P<0.01)。中药组及抑制剂组ROS水平较模型组显著下降(P<0.01),激动剂组ROS水平较模型组显著升高(P<0.01),联合剂组ROS水平较激动剂组显著下降(P<0.01)。中药组和抑制剂组ROS水平差异无统计学意义(P>0.05)。详见表2、图5。
3 讨论
急性心肌梗死在临床上属于常见的危急重症,尽早恢复心脏血液供应是有效的治疗方法。但血供恢复后,MI/R是造成心肌损伤进一步加重的主要原因。因此,如何减轻MI/R损伤是临床治疗心肌梗死的研究重点。近期研究表明,在MI/R损伤中,存在一种新的细胞死亡方式,称为铁死亡[11]。铁死亡是2012年由Dixon等提出的新型调节性细胞死亡方式,其过程为亚铁离子蓄积引发芬顿反应,造成细胞抗氧化能力耗竭、脂质过氧化,最终引起细胞死亡[12]。其主要特征是Fe2+水平升高、ROS堆积、GSH合成下降、脂质过氧化产物如MDA等含量增加,导致细胞膜破损,甚至细胞死亡。铁死亡的提出,为MI/R损伤的治疗提供了新的思路[13]。
追溯中医经典,MI/R损伤属于中医“胸痹心痛”范畴,多由寒邪内侵、饮食失调、情志失节、年老体虚等因素引起肝、脾、肾等脏器功能失调所致。其病机多为本虚标实,气虚、阳虚引起气机不畅,血行无力,痰瘀互结,心脉痹阻,发为胸痹心痛,所以气虚痰瘀为其基本病机[14]。从肝治心组方基于“从肝治心、心肝双治”理论,以补气养营、疏肝理气、豁痰化瘀为法,在临床上具有较好疗效[15]。红参、当归为方中君药。红参具有大补元气、安神益智、滋养心营之功效。研究表明,红参多糖能调控Nrf2/HO-1信号通路,抗心肌细胞凋亡,减轻小鼠心肌缺血损伤[16]。當归能养血补血活血,为“血药之主帅”。寿晔等[17]研究发现,当归挥发油能够抑制氧化应激和炎症反应,起到对MI/R损伤的保护作用。丹参、柴胡、郁金、姜黄共为方中臣药。丹参味苦微寒,专调经脉,能生新血、去恶血,起入心养血、调血通脉之功。柴胡辛行苦泄,性善调达,具有疏肝散郁之功;郁金辛散苦泄,能清心散郁、活血祛瘀。姜黄“苦能泄热,辛能散结,为破血下气,血分气分之要药”,能理气中之血又能行血中之气。四药合用,使肝气通,心气和。白芥子为方中佐药,其性味辛温,为利气疏痰、温中去滞之要药。九香虫为方中使药,性味咸温,有宣胸膈、理气滞之功,使气血双宣、络通痛止。诸药配伍,共奏益气营、疏肝气、化痰瘀、通心络之效。课题组前期实验研究表明,从肝治心组方对缺血心肌有保护作用,但其对心肌细胞铁代谢是否具有调节作用尚不清楚[18]。因此,本研究以大鼠H9c2心肌细胞为研究对象进行体外实验,观察从肝治心组方对心肌细胞铁代谢的作用。
本研究选用Erastin作为铁死亡激动剂,Fer-1作为铁死亡抑制剂。有研究表明,还原型谷胱甘肽(glutathione, GSH)可以防止脂质过氧化,抑制铁死亡的发生[19]。GSH的合成需要胱氨酸,而胱氨酸进入细胞内的过程依赖于胱氨酸/谷氨酸逆向转运体(System Xc-)。System Xc-由糖基化的重链SLC3A2和非糖基化的轻链xCT(SLC7A11)组成,是胱氨酸和谷氨酸交换的主要途径[20]。因此,阻断System Xc-可使GSH合成受阻,细胞抗氧化能力下降,最终导致铁死亡的发生[21-23]。Erastin是一种高效的铁死亡诱导剂,其作用机制为抑制System Xc-,从而诱导铁死亡的发生[24]。Erastin可诱导包括心肌细胞[25]、神经元细胞[26]、癌症细胞[27]等在内的多种离体细胞铁死亡的发生,表现为细胞内Fe2+浓度升高,ROS生成增多、脂质过氧化物含量增加等。Fer-1是人为合成的芳烷基胺,为一种特异性铁死亡抑制剂,主要通过还原反应发挥抗氧化作用,减少ROS蓄积,抑制铁死亡的发生[28]。
本实验通过OGD/R模型模拟心肌细胞MI/R损伤,用CCK-8法检测细胞存活率。模型组细胞存活率较正常组显著下降,表明OGD/R可使大鼠H9c2心肌细胞明显死亡,提示造模成功。CCK-8实验结果提示,抑制剂组细胞存活率较模型组显著提高,提示心肌细胞OGD/R处理后可能存在铁死亡。而Fer-1通过抑制铁死亡途径,降低心肌细胞的死亡率,起到保护心肌的作用。为进一步研究MI/R损伤后心肌细胞铁代谢以及从肝治心组方干预对铁代谢的调节作用,选用TMRE荧光探针检测线粒体膜电位,FerroOrange检测细胞内Fe2+水平,DCFH-DA荧光探针检测各组细胞ROS水平。与模型组比较,抑制剂组线粒体膜电位显著升高,Fe2+水平显著降低,ROS水平显著下降。提示Fer-1能抑制OGD/R后心肌细胞铁死亡,起到减轻心肌细胞损伤的作用,进一步验证了心肌细胞OGD/R后存在铁死亡。与模型组相比,中药组线粒体膜电位显著升高,Fe2+水平显著降低,ROS水平显著下降。提示从肝治心组方可能通过减少细胞内Fe2+堆积或减少Fe2+形成、降低细胞内ROS水平、改善线粒体活性等抑制铁死亡,发挥对OGD/R处理后心肌细胞的保护作用。激动剂组与模型组相比,线粒体膜电位显著降低,Fe2+水平显著升高,ROS水平显著升高,提示Erastin可能通过抑制System Xc-,促进心肌细胞铁死亡。联合组与激动剂组相比,线粒体膜电位显著升高,Fe2+水平显著下降,ROS水平显著下降,提示从肝治心组方可能通过激活System Xc-发挥对铁死亡的抑制作用。
综上所述,本实验初步研究发现MI/R损伤后心肌细胞存在铁死亡,从肝治心组方可以改善线粒体活性,降低细胞内Fe2+和ROS水平,从而抑制铁死亡途径,减少心肌细胞损伤。但具体机制仍需进一步研究。
参考文献
[1] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2021概要[J]. 心脑血管病防治, 2022, 22(4): 20-36, 40.
[2] GUNATA M, PARLAKPINAR H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment[J]. Cell Biochemistry and Function, 2021, 39(2): 190-217.
[3] WU X G, LI Y, ZHANG S C, et al. Ferroptosis as a novel therapeutic target for cardiovascular disease[J]. Theranostics, 2021, 11(7): 3052-3059.
[4] PAN Y H, WANG X K, LIU X W, et al. Targeting ferroptosis as a promising therapeutic strategy for ischemia-reperfusion injury[J]. Antioxidants, 2022, 11(11): 2196.
[5] CHEN X, COMISH P B, TANG D L, et al. Characteristics and biomarkers of ferroptosis[J]. Frontiers in Cell and Developmental Biology, 2021, 9: 637162.
[6] 李金洋, 范金茹, 叶铭泉, 等. 名老中医王行宽肝心同治心系病遣方经验探讨[J]. 湖南中医药大学学报, 2014, 34(6): 19-22.
[7] 刘小雨, 王行宽, 杨孝芳. 从肝治心组方对实验性心肌梗死大鼠心肌血管新生的影响[J]. 中国中医急症, 2004, 13(6): 379-380, 338.
[8] 刘小雨, 王行宽, 杨孝芳. 从肝治心组方对急性心肌梗死大鼠心肌毛细血管密度的影响[J]. 中国中西医结合急救杂志, 2004, 11(1): 17-20.
[9] WANG S, GE L, ZHANG D W, et al. MiR-181c-5p promotes inflammatory response during hypoxia/reoxygenation injury by downregulating protein tyrosine phosphatase nonreceptor type 4 in H9C2 cardiomyocytes[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 7913418.
[10] 魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010.
[11] 方 瑾, 黄 鹤. 铁代谢在心肌缺血再灌注损伤及心脏保护中的作用及机制[J]. 医学综述, 2022, 28(6): 1046-1050.
[12] DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072.
[13] ZHAO W K, ZHOU Y, XU T T, et al. Ferroptosis: Opportunities and challenges in myocardial ischemia-reperfusion injury[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 9929687.
[14] 王子焱, 歐阳青兰, 谭 超. 基于数据挖掘的国医大师熊继柏治疗胸痹心痛方药规律研究[J]. 湖南中医药大学学报, 2023, 43(2): 189-196.
[15] 伍 瑶, 范金茹, 王行宽, 等. 全国名中医王行宽肝心同治胸痹心痛的验方及经验传承[J]. 中医药临床杂志, 2019, 31(9): 1631-1634.
[16] LIAN Y P, ZHU M M, YANG B, et al. Characterization of a novel polysaccharide from red ginseng and its ameliorative effect on oxidative stress injury in myocardial ischemia[J]. Chinese Medicine, 2022, 17(1): 111.
[17] 寿 晔, 秦宇芬. 当归挥发油对缺血再灌注致心肌损伤大鼠的心肌保护作用[J]. 浙江中医杂志, 2022, 57(2): 99-100.
[18] 胡国恒, 陈 亚, 张 婷, 等. 从肝治心组方对大鼠缺血心肌血管新生因子Ang-1/Ang-2表达的影响[J]. 中国中医急症, 2013, 22(11): 1830-1833.
[19] URSINI F, MAIORINO M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4[J]. Free Radical Biology & Medicine, 2020, 152: 175-185.
[20] LI F J, LONG H Z, ZHOU Z W, et al. System Xc-/GSH/GPX4 axis: An important antioxidant system for the ferroptosis in drug-resistant solid tumor therapy[J]. Frontiers in Pharmacology, 2022, 13: 910292.
[21] CHEN L, QIAO L L, BIAN Y, et al. GDF15 knockdown promotes erastin-induced ferroptosis by decreasing SLC7A11 expression[J]. Biochemical and Biophysical Research Communications, 2020, 526(2): 293-299.
[22] WANG L Y, LIU Y C, DU T T, et al. ATF3 promotes erastin-induced ferroptosis by suppressing system Xc[J]. Cell Death and Differentiation, 2020, 27(2): 662-675.
[23] PARKER J L, DEME J C, KOLOKOURIS D, et al. Molecular basis for redox control by the human cystine/glutamate antiporter system Xc[J]. Nature Communications, 2021, 12(1): 7147.
[24] DIXON S J, PATEL D N, WELSCH M, et al. Pharmacological inhibition of cystine-glutamate exchange induces endoplasmic reticulum stress and ferroptosis[J]. eLife, 2014, 3: e02523.
[25] 趙述傲, 朱仪章, 濮雨凌, 等. 铁死亡在大鼠心肌缺血-再灌注损伤中的作用[J]. 中国急救医学, 2022, 42(1): 53-57.
[26] WEI N, LU T, YANG L B, et al. Lipoxin A4 protects primary spinal cord neurons from Erastin-induced ferroptosis by activating the Akt/Nrf2/HO-1 signaling pathway[J]. FEBS Open Bio, 2021, 11(8): 2118-2126.
[27] ZHANG Y, TAN H, DANIELS J D, et al. Imidazole ketone erastin induces ferroptosis and slows tumor growth in a mouse lymphoma model[J]. Cell Chemical Biology, 2019, 26(5): 623-633.
[28] MIOTTO G, ROSSETTO M, DI PAOLO M L, et al. Insight into the mechanism of ferroptosis inhibition by ferrostatin-1[J]. Redox Biology, 2020, 28: 101328.

