基于TLR4/MyD88/NF-κB信号轴探讨闹羊花毒素Ⅲ对类风湿关节炎的影响
刘笑蓉 李硕夫 刘湘丹 王志辉 曾娟 周日宝


〔摘要〕 目的 本研究旨在探討闹羊花毒素Ⅲ调控TLR4、MyD88和NF-κB的机制,以及闹羊花毒素Ⅲ对类风湿关节炎(rheumatoid arthritis, RA)的影响。方法 RA大鼠模型通过Ⅱ型胶原诱导构建。随机将Wistar大鼠分成6组(n=8):假手术组(Sham组)、RA模型组(Model组)、阳性药物雷公藤组[TWG组,50 mg·(kg·d)-1]、闹羊花毒素Ⅲ低剂量组[R-Ⅲ Lo组,0.06 mg·(kg·d)-1]、中剂量[R-Ⅲ Mi组,0.12 mg·(kg·d)-1]和高剂量组[R-Ⅲ Hi组,0.24 mg·(kg·d)-1]。测定各组大鼠的关节炎指数(arthritis index, AI);采用HE染色、ELISA、Western blot和RT-qPCR检测闹羊花毒素Ⅲ对TLR4/MyD88/NF-κB信号轴及RA的影响。结果 与Model组比较,闹羊花毒素Ⅲ处理显著降低了RA大鼠的AI评分(P<0.05)。闹羊花毒素Ⅲ对滑膜组织的恶性增生和炎症细胞浸润有明显的抑制作用。与Model组比,闹羊花毒素Ⅲ各剂量组的TNF-α、IL-1β、IL-6、IL-17、VEGF、MMP-2、MMP-9、TLR4、MyD88、p-NF-κB/NF-κB因子的水平降低且呈浓度依赖性(P<0.05)。与TWG组比,R-Ⅲ Lo和R-Ⅲ Mi组的。TNF-α、IL-1β、IL-6、IL-17、VEGF、MMP-2、MMP-9、TLR4、MyD88、p-NF-κB/NF-κB因子的水平升高(P<0.05),而R-Ⅲ Hi组无显著差异(P>0.05)。结论 闹羊花毒素Ⅲ可以通过下调TLR4、MyD88、NF-κB因子的表达水平来改善RA。本研究为利用闹羊花毒素Ⅲ治疗RA提供了一定的实验基础。
〔关键词〕 闹羊花毒素Ⅲ;TLR4/MyD88/NF-κB信号轴;类风湿关节炎;羊踯躅;炎症;血管生成
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.005
〔Abstract〕 Objective To investigate the effects of rhodojaponin Ⅲ on rheumatoid arthritis (RA) by regulating toll-likereceptor 4 (TLR4), myeloid differentiation factor 88 (MyD88), and nuclear factor-kappa-B (NF-κB). Methods Type Ⅱ collagen was used to construct the RA rat model. Wistar rats were randomly divided into 6 groups, with 8 rats in each group: normal feeding group (sham group), RA model group (Model group), positive drug tripterygium wilfordii group [TWG group, 50 mg·(kg·d)-1], low-dose Rhodojaponin Ⅲ group [R-Ⅲ Lo group, 0.06 mg·(kg·d)-1], medium-dose group [R-Ⅲ Mi group, 0.12 mg·(kg·d)-1], and high-dose group [Rhodojaponin Ⅲ Hi group, 0.24 mg·(kg·d)-1]. The arthritis index (AI) of the rats was scored. Meanwhile, HE ELISA, Western blot, and real-time quantitative PCR (RT-qPCR) were used to detect the effects of Rhodojaponin Ⅲ on TLR4/MyD88/NF-κB signal axis and RA. Results Rhodojaponin Ⅲ significantly reduced the AI scores of RA rats compared with model group (P<0.05) and it effectively inhibited the development of malignant hyperplasia and inflammatory cell infiltration into synovial tissue. Meanwhile, compared with model group, the expresson levels of the tumor necrosis facor-α (TNF-α), interleukin-1β (IL-1β), interleukin-6 (IL-6), interleukin-17 (IL-17), vascular endothelial growth factor (VEGF), matrix metallopeptidase-2 (MMP-2), matrix metallopeptidase-9 (MMP-9), TLR4, MyD88, and phosphor-nuclear factor-kappa-B (p-NF-κB)/NF-κB were reduced in R-Ⅲ Lo, Mi, and Hi groups (P<0.05). Compared with the TWG group, the levels of TNF-α, IL-1β, IL-6, IL-17, VEGF, MMP-2, MMP-9, TLR4, MyD88, p-NF-κB/NF-κB factors increased in the R-Ⅲ Lo and R-Ⅲ Mi groups (P<0.05), while no significant differences were observed in the R-Ⅲ Hi group (P>0.05). Conclusion Rhodojaponin Ⅲ can improve RA by down-regulating the expression levels of TLR4, MyD88, and NF-κB. This paper offered a solid experimental foundation for the use of Rhodojaponin Ⅲ in the treatment of RA.
〔Keywords〕 Rhodojaponin Ⅲ; TLR4/MyD88/NF-κB signal axis; rheumatoid arthritis; Yangzhizhu [Rhododendron molle (Blum) G.Don]; inflammation; angiogenesis
类风湿关节炎(rheumatoid arthritis, RA)是一种常见的自身免疫性疾病[1]。目前,全国有0.5%的人患有RA[2]。RA的主要特征有:滑膜炎、血管翳形成、邻近骨侵蚀、以及关节肿胀和疼痛等[3-6]。虽然多种抗风湿药物具有良好临床治疗效果,但RA患者与正常人仍相差了10~15年的预期寿命[7]。因此,我们需要进一步探索治疗RA的药物。
人体内各种炎性细胞因子(IL-1β、IL-6、IL-7、TNF-α等)能够促进炎症反应,加重邻近骨破坏,这表明炎症因子可能影响RA的发展[8-12]。有研究表明,阻断TNF-α、IL-1、IL-6和IL-7等炎症因子释放,可以减缓RA相关炎症反应[13-14]。TLR4能够接收外界刺激并将其转化为信号分子,从而传导相关炎症和免疫信号[15-16]。例如,TLR4通过依赖MyD88途径激活NF-κB信号[17],促进TNF-α、IL-1、IL-7、IL-6等下游炎性因子的合成与分泌[18],从而导致RA炎症和免疫反应发生[17-20]。多项研究表明,控制TLR4/MyD88/NF-κB信号轴有助于减轻RA症状[21-22]。因此,为缓解RA的发展,我们亟须探索阻断TLR4/MyD88/NF-κB信号轴的新药物。
羊踯躅Rhododendron molle (Blum) G.Don是中医用来治疗RA的常用药物,其提取物具有镇痛、消炎和免疫抑制的作用[23]。目前研究发现,羊踯躅中的主要活性成分之一闹羊花毒素Ⅲ具有抑炎作用,能够抑制TNF-α和IL-1β释放[24]。前期的研究报道了闹羊花毒素Ⅲ通过介导Wnt1/Dvl1/β-catenin信号通路来抑制滑膜细胞增殖和细胞炎症的产生,从而缓解RA[25]。而闹羊花毒素Ⅱ能抑制TLR4/MyD88/NF-κB信号轴,抑制细胞炎症反应改善RA[26-27]。闹羊花毒素Ⅲ和Ⅱ均为羊踯躅的二萜类化合物,具有相似的化学结构[28]。因此,我们将进一步探讨闹羊花毒素Ⅲ是否也能通过TLR4/MyD88/NF-κB轴来改善RA。本研究拟通过研究闹羊花毒素Ⅲ对RA的调节作用,以期为闹羊花毒素Ⅲ临床治疗RA提供可靠的理论依据。
1 材料和方法
1.1 实验动物
48只Wistar雄性大鼠(200±20) g购自长沙市天勤生物技术有限公司。许可证号:SYXK(湘)2022-0007。实验伦理审批编号:LL2022061401。实验前先适应性饲养1周。
1.2 主要试剂及仪器
生物样品均质仪(杭州奥盛仪器有限公司,型号:BioPrep-24);化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100);荧光定量PCR仪(Thermo Fisher Scientific,型号:PIKOREAL96)。
闹羊花毒素Ⅲ(上海联迈生物工程有限公司,批号:LM20895);雷公藤多苷片(贵州汉方药业有限公司,批号:2003006);牛Ⅱ型胶原和完全弗氏佐剂购自美国Chondrex公司(批号分别为:20022和7001);RIPA裂解液(长沙艾碧维生物科技有限公司,批号:AWB0136);BCA蛋白定量试剂盒(Thermo Fisher Scientific,批号:23225);TRIzon总RNA提取试剂盒和mRNA逆转录试剂盒均购自北京康为世纪生物科技有限公司(批号分别为:CW0580S和CW2569);一抗VEGF、MMP-2、MMP-9、MyD88、p-NF-κB均购买自英国Abcam公司(批号分别为:ab32152、ab92536、ab76003、ab219413、ab76302);TLR4抗体、核转录因子-κB(NF-κB)抗体、β-actin抗体、HRP goat anti-mouse IgG和HRP goat anti-rabbit IgG抗体以及IL-1β、IL-6、IL-17和TNF-α ELISA试剂盒均购自美国Proteintech公司(批号分别为:19811-1-AP、10745-1-AP、66009-1-Ig、SA00001-1、SA00001-2、KE00021、KE10007、KE10020、KE10002)。
1.3 方法
1.3.1 Ⅱ型胶原诱导建立RA大鼠模型 RA大鼠模型采用Ⅱ型胶原诱导进行构建[27,29]。具体操作如下:将终浓度为2 mg/mL的牛Ⅱ型胶原溶液与完全弗氏佐剂以1∶1混合制成Ⅱ型胶原乳剂。于大鼠尾根部皮下注射300 μL制好的Ⅱ型胶原乳剂。7天后,同剂量二次注射Ⅱ型胶原乳剂。同时设置假手术组(Sham组),对该组大鼠注射等剂量生理盐水作为对照。每日观察大鼠关节肿胀情况。实验期间每4天根据关节肿胀程度评估关节炎指数(arthritis index, AI)。以AI作为判断RA大鼠模型构建成功与否的标准。AI评分每4天统计一次,根据关节肿胀程度进行评价。总共分为4个等级:未出现任何发红、肿胀状况,计为0分;趾关节出现轻微发红、肿胀状况,计为1分;趾或者足趾关节出现发红、肿胀状况,计为2分;除踝关节外,全部后肢关节出现发红、肿胀状况,计为3分;所有后肢关节出现发红、肿胀状况,计为4分[30]。由于前爪炎症的发生率很低,后足关节更容易出现严重肿胀,因此,选用两后肢之和來评价大鼠的发病机制[31]。所有关节肿胀评分之和即为AI值。当AI≥4时,RA大鼠模型构建成功[32]。
1.3.2 分组与给药 雷公藤疗法是当前治疗RA最有效和关键的疗法之一[33]。因此,本研究用雷公藤作为阳性对照药物。随机将48只Wistar雄性大鼠分成Sham组、RA模型组(Model组)、阳性药物雷公藤组[TWG组,50 mg·(kg·d)-1]、闹羊花毒素Ⅲ低剂量组[R-Ⅲ Lo组,0.06 mg·(kg·d)-1]、闹羊花毒素Ⅲ中剂量组[R-Ⅲ Mi组,0.12 mg·(kg·d)-1]、闹羊花毒素Ⅲ高剂量组[R-Ⅲ Hi组,0.24 mg·(kg·d)-1],每组8只,灌胃给药。Sham组和Model组灌胃等剂量的生理盐水。28 d后,将大鼠麻醉,固定四肢,然后剪开腹壁,腹主动脉采血。最后,剪开皮肤,从邻近肌肉中分离踝关节,剪短两侧韧带,暴露滑膜位置,取出滑膜,并用于后续实验。
1.3.3 HE染色观察滑膜组织形态 用4%多聚甲醛固定大鼠踝关节滑膜组织。随后经石蜡包埋、切片、烘烤二甲苯脱蜡、梯度乙醇水化、苏木精和伊红染液染色、脱水、封片等过程,在光学显微镜下观察大鼠踝关节滑膜组织形态病变情况。
1.3.4 ELISA检测血清中促炎因子含量 取腹主动脉全血,在4 ℃下,1000×g离心15 min,取上层血清用于检测。分别按照试剂盒操作步骤,检测血清中促炎因子含量的变化。
1.3.5 Western blot检测血管生成、TLR4/MyD88/NF-κB轴相关蛋白 用RIPA裂解缓冲液提取大鼠踝关节滑膜组织中的总蛋白。再用BCA蛋白定量试剂盒进行蛋白质定量。随着SDS-PAGE电泳后,将总蛋白转移至硝化纤维素膜上。将膜与一抗4 ℃孵育过夜,再与二抗孵育90 min。内参蛋白为β-actin。最后,分析蛋白VEGF、MMP-2、MMP-9、TLR4、MyD88、p-NF-κB、NF-κB的相对表达量。
1.3.6 RT-qPCR检测TLR4/MyD88/NF-κB轴相关基因表达 按照试剂盒说明,用TRIzon试剂提取踝关节滑膜组织总RNA。然后,用紫外分光光度计测定260 nm与280 nm处的吸光度值,并计算其浓度跟纯度。再用mRNA反转录试剂盒将mRNA反转录为cDNA。接下来,将cDNA直接用于荧光定量PCR反应。运用Primer 5软件设计引物,结果见表1。最后,以β-actin为内参基因,用2-ΔΔCT法计算基因相对表达量。
1.4 统计学分析
本研究使用GraphPad Prism 9对实验数据进行评估。数据均用“x±s”表示。数据差异比较采用单因素方差分析(one-way ANOVA)和多因素方差分析(two-way ANOVA)。以P<0.05表示差异具有统计学意义。
2 实验结果
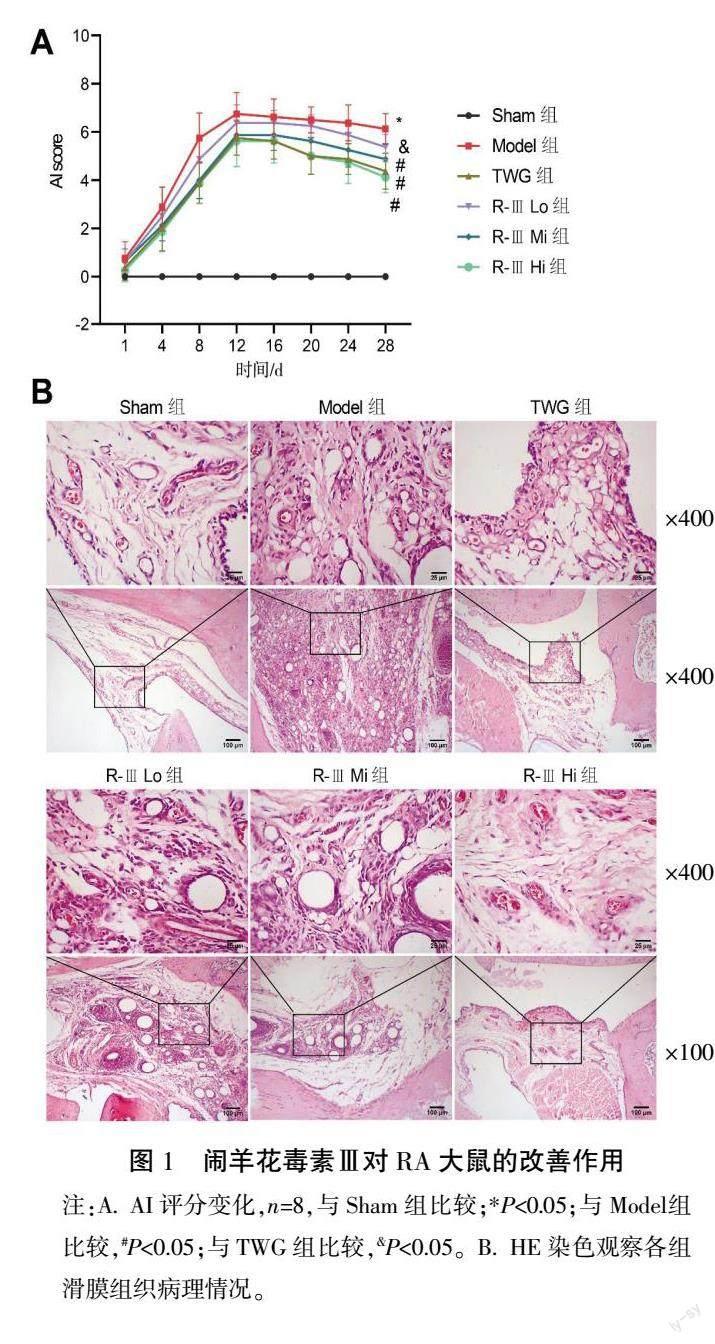
2.1 闹羊花毒素Ⅲ对RA大鼠的改善作用
首先,我们评估了不同时间点的AI评分变化。随着天数的变化,Sham组中AI评分无显著变化(P>0.05)。随着天数的变化,Model组AI评分逐渐升高,在第12天达到最高值(P<0.05),12 d以后无显著变化(P>0.05)。随着天数的变化,TWG、R-Ⅲ Lo组、R-Ⅲ Mi组、R-Ⅲ Hi组AI评分逐渐升高,在第12天 达到最高值,12 d以后AI评分逐渐降低(P>0.05)。此外,我们比较了不同组间的AI评分。在4 d后,Model组大鼠AI评分显著高于Sham组(P<0.05)。8 d后,TWG组、R-Ⅲ Mi组、R-Ⅲ Hi组与Model组比较,AI评分显著降低(P<0.05),且R-Ⅲ Hi组和TWG组AI评分基本一致(P>0.05)。见图1A。Sham组大鼠滑膜组织结构正常,表面光滑无增生;Model组、R-Ⅲ Lo组、R-Ⅲ Mi组大鼠滑膜组织增生,层次模糊,伴有大量炎性细胞浸润;TWG组、R-Ⅲ Hi组大鼠滑膜组织表面光滑,且层次清晰,见图1B。
2.2 闹羊花毒素Ⅲ抑制RA大鼠的炎症反应
如图2所示,相比于Sham组,Model组中TNF-α、IL-1β、IL-6和IL-17含量显著升高(P<0.05)。相比于Model组,R-Ⅲ Lo、R-Ⅲ Mi、R-Ⅲ Hi组中TNF-α、IL-1β、IL-6、IL-17含量呈浓度依赖性降低(P<0.05)。与TWG组比较,R-Ⅲ Lo、R-Ⅲ Mi组中TNF-α、IL-1β、IL-6、IL-17含量显著升高(P<0.05),而R-Ⅲ Hi组中TNF-α、IL-1β、IL-6、IL-17含量无显著变化(P>0.05)。
2.3 闹羊花毒素Ⅲ抑制RA大鼠的血管生成
与Sham组相比,Model组中VEGF、MMP-2、MMP-9蛋白表达量显著升高(P<0.05);TWG组、R-Ⅲ Lo组、R-Ⅲ Mi组、R-Ⅲ Hi组中VEGF、MMP-2、MMP-9蛋白表达水平相比于Model组,呈剂量依赖性降低(P<0.05)。R-Ⅲ Lo组、R-Ⅲ Mi组中VEGF、MMP-2、MMP-9蛋白表达水平显著升高于TWG组(P<0.05),而R-Ⅲ Hi组中VEGF、MMP-2、MMP-9蛋白表达水平与TWG组无显著差异详见图3。
2.4 闹羊花毒素Ⅲ抑制RA大鼠的TLR4/MyD88/NF-κB信号轴激活
如圖4A所示,相较于Sham组,Model组中TLR4、MyD88、NF-κB基因的相对表达水平均显著上升(P<0.05)。R-Ⅲ Mi组、R-Ⅲ Hi组中TLR4、MyD88、NF-κB基因的相对表达水平相比于Model组,均显著降低(P<0.05)。而R-Ⅲ Lo组与Model组相比,差异无统计学意义(P>0.05)。R-Ⅲ Lo组中TLR4、MyD88、NF-κB基因的相对表达水平显著高于TWG组(P<0.05)而R-Ⅲ Mi组、R-Ⅲ Hi组中TLR4、MyD88、NF-κB基因的相对表达水平与TWG组比,无显著性差异(P>0.05)。相比于Sham组,Model组中TLR4、MyD88、NF-κB蛋白表达量显著增加(P<0.05)。R-Ⅲ Lo组、R-Ⅲ Mi组、R-Ⅲ Hi组中TLR4、MyD88、p-NF-κB/NF-κB蛋白表达水平相比于Model组,均呈浓度依赖性降低(P<0.05)。R-Ⅲ Lo组中TLR4、MyD88、NF-κB蛋白表达量显著高于TWG组(P<0.05)而R-Ⅲ Mi组、R-Ⅲ Hi组中TLR4、MyD88、NF-κB基因的蛋白表达量与TWG组比,无显著性差异(P>0.05),见图4B。
3 討论
RA的发展与机体分泌的炎症因子[34]密切相关。例如,TNF-α、IL-1β、IL-6、IL-17等炎症因子的释放能够加重滑膜炎症反应[35]。本研究发现在RA造模后,大鼠AI评分显著增加,血清中促炎症因子表达水平显著上升。同时,在闹羊花毒素Ⅲ的干预下,大鼠血清中促炎因子的释放被抑制。这些结果表明,闹羊花毒素Ⅲ能够抑制促炎症因子的释放,产生抑炎作用。综上,闹羊花毒素Ⅲ可能是通过抑制促炎因子TNF-α、IL-1β、IL-6、IL-17等的释放,缓解RA。
滑膜组织炎症和骨关节破坏的另一原因可能是血管生成[36]。研究表明VEGF能够调控血管生成,促进RA疾病发展[37]。同时,VEGF因子表达与RA患者病症也呈正相关的调控趋势,因此,可以选用VEGF检测RA病变程度[38-39]。基质金属蛋白酶(MMP),影响骨关节破坏,RA滑膜液中MMP-2和MMP-9[39]水平升高具有触发血管生成的能力[40-42]。本研究结果显示,RA大鼠中促血管因子(MMP-2、MMP-9和VEGF)表达量显著升高,闹羊花毒素Ⅲ的干预显著下调了RA大鼠促血管生成因子VEGF、MMP-2和MMP-9的表达。这些结果说明,闹羊花毒素Ⅲ可通过下调促血管生成因子(MMP-2、MMP-9和VEGF)的表达来改善RA。
TLR4-MyD88-NF-κB通路是常见于RA并调控相关炎性反应的信号通路[43]。TLR4蛋白监控先天免疫与后天免疫,并在RA患者中表达异常升高[44-45]。TLR4蛋白可以上调MyD88蛋白表达,促进NF-κB因子积累,进而诱导促炎因子的分泌,加剧RA滑膜炎症反应和骨破坏[46-49]。抑制该通路可以减缓相关炎性反应,从而改善RA[50]。本研究表明,在RA大鼠中,TLR4、MyD88、p-NF-κB/NF-κB等相关因子含量显著上升,且闹羊花毒素Ⅲ能显著抑制RA滑膜组织TLR4、MyD88、p-NF-κB/NF-κB等相关因子水平的上升。由此,我们得出,闹羊花毒素Ⅲ可以通过抑制TLR4、MyD88、p-NF-κB/NF-κB因子表达上调,减少促炎因子的分泌,抑制关节滑膜恶性增生,从而改善RA大鼠相关病症。这将为闹羊花毒素Ⅲ治疗RA提供实验基础。
综上所述,本研究表明闹羊花毒Ⅲ具有改善RA的作用。其主要作用机制可能是通过下调促血管生成相关因子(MMP-2、MMP-9和VEGF)和TLR4/MyD88/NF-κB信号轴相关蛋白的表达,抑制促炎因子诱导的炎症反应和抑制滑膜增生。
总之,闹羊花毒Ⅲ可通过调节TLR4/MyD88/NF-κB信号轴改善RA,这将为闹羊花毒素Ⅲ应用于RA的临床治疗提供可靠的实验依据。
参考文献
[1] EVANGELATOS G, FRAGOULIS G E, KOULOURI V, et al. MicroRNAs in rheumatoid arthritis: From pathogenesis to clinical impact[J]. Autoimmunity Reviews, 2019, 18(11): 102391.
[2] ALETAHA D, SMOLEN J S. Diagnosis and management of rheumatoid arthritis: A review[J]. JAMA, 2018, 320(13): 1360-1372.
[3] BI X, GUO X H, MO B Y, et al. LncRNA PICSAR promotes cell proliferation, migration and invasion of fibroblast-like synoviocytes by sponging miRNA-4701-5p in rheumatoid arthritis[J]. EBioMedicine, 2019, 50: 408-420.
[4] LIU H, ZHU Y L, GAO Y T, et al. NR1D1 modulates synovial inflammation and bone destruction in rheumatoid arthritis[J]. Cell Death & Disease, 2020, 11(2): 129.
[5] RANA A K, LI Y, DANG Q J, et al. Monocytes in rheumatoid arthritis: Circulating precursors of macrophages and osteoclasts and, their heterogeneity and plasticity role in RA pathogenesis[J]. International Immunopharmacology, 2018, 65: 348-359.
[6] MATTHIJSSEN X M E, WOUTERS F, SIDHU N, et al. Tenosynovitis has a high sensitivity for early ACPA-positive and ACPA-negative RA: A large cross-sectional MRI study[J]. Annals of the Rheumatic Diseases, 2021, 80(8): 974-980.
[7] VAN DEN HOEK J, BOSHUIZEN H C, ROORDA L D, et al. Mortality in patients with rheumatoid arthritis: A 15-year prospective cohort study[J]. Rheumatology International, 2017, 37(4): 487-493.
[8] TAN Q, HUANG Q, MA Y L, et al. Potential roles of IL-1 subfamily members in glycolysis in disease[J]. Cytokine & Growth Factor Reviews, 2018, 44: 18-27.
[9] 许 艳, 崔海虹, 朱静媛. 金线莲苷对TNF-α诱导的人类风湿关节炎滑膜细胞增殖及炎症因子、MMPs产生的影响[J]. 湖北中医药大学学报, 2022, 24(2): 38-42.
[10] YOKOTA K, SATO K, MIYAZAKI T, et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis[J]. Arthritis & Rheumatology, 2021, 73(7): 1145-1154.
[11] AKRAM M, DANIYAL M, SULTANA S, et al. Traditional and modern management strategies for rheumatoid arthritis[J]. Clinica Chimica Acta, 2021, 512: 142-155.
[12] KOPER-LENKIEWICZ O M, SUTKOWSKA K, WAWRUSIEWICZ-KURYLONEK N, et al. Proinflammatory cytokines (IL-1, -6, -8, -15, -17, -18, -23, TNF-α) single nucleotide polymorphisms in rheumatoid arthritis-a literature review[J]. International Journal of Molecular Sciences, 2022, 23(4): 2106.
[13] MALHOTRA H, GARG V, SINGH G. Biomarker approach towards rheumatoid arthritis treatment[J]. Current Rheumatology Reviews, 2021, 17(2): 162-175.
[14] ALAM J, JANTAN I, BUKHARI S N A. Rheumatoid arthritis: Recent advances on its etiology, role of cytokines and pharmacotherapy[J]. Biomedicine & Pharmacotherapy, 2017, 92: 615-633.
[15] ARENAS-PADILLA M, MATA-HARO V. Regulation of TLR signaling pathways by microRNAs: Implications in inflammatory diseases[J]. Central-European Journal of Immunology, 2018, 43(4): 482-489.
[16] QUERO L, TIADEN A N, HANSER E, et al. MiR-221-3p drives the shift of M2-macrophages to a pro-inflammatory function by suppressing JAK3/STAT3 activation[J]. Frontiers in Immunology, 2019, 10: 3087.
[17] WANG Q, ZHOU X, ZHAO Y J, et al. Polyphyllin I ameliorates collagen-induced arthritis by suppressing the inflammation response in macrophages through the NF-κB pathway[J]. Frontiers in Immunology, 2018, 9: 2091.
[18] ICHISE Y, SAEGUSA J, TANAKA-NATSUI S, et al. Soluble CD14 induces pro-inflammatory cytokines in rheumatoid arthritis fibroblast-like synovial cells via toll-like receptor 4[J]. Cells, 2020, 9(7): 1689.
[19] 袁 娟, 胡 玲, 宋小鴿, 等. 艾灸对类风湿性关节炎大鼠关节滑膜组织Toll样受体4-骨髓样分化因子88-核转录因子-κB信号通路的影响[J]. 针刺研究, 2015, 40(3): 199-204.
[20] LI Y, XU J Z, GU C X, et al. Carvacrol suppresses inflammatory responses in rheumatoid arthritis fibroblast-like synoviocytes[J]. Journal of Cellular Biochemistry, 2019, 120(5): 8169-8176.
[21] SAMARPITA S, KIM J Y, RASOOL M K, et al. Investigation of toll-like receptor (TLR) 4 inhibitor TAK-242 as a new potential anti-rheumatoid arthritis drug[J]. Arthritis Research & Therapy, 2020, 22(1): 16.
[22] HEGEWALD A B, BREITWIESER K, OTTINGER S M, et al. Extracellular miR-574-5p induces osteoclast differentiation via TLR 7/8 in rheumatoid arthritis[J]. Frontiers in Immunology, 2020, 11: 585282.
[23] 姚禹民, 房 鑫, 李 俊, 等. 羊躑躅二萜类成分和各极性部位的体内外抗炎活性研究[J]. 上海中医药大学学报, 2019, 33(4): 84-88.
[24] HE Y C, YAO Y M, XUE Q W, et al. Anti-rheumatoid arthritis potential of diterpenoid fraction derived from Rhododendron molle fruits[J]. Chinese Journal of Natural Medicines, 2021, 19(3): 181-187.
[25] 刘笑蓉, 刘湘丹, 王 智, 等. 闹羊花毒素Ⅲ通过调控Wnt1/Dvl1/β-catenin通路影响成纤维样滑膜细胞增殖凋亡的实验研究[J]. 中国中西医结合杂志, 2022, 42(10): 1199-1206.
[26] 阚玉娜, 谢佳明, 马立威, 等. 中药活性成分改善类风湿性关节炎作用机制研究进展[J]. 辽宁中医药大学学报, 2021, 23(10): 139-145.
[27] KONG L L, WANG L F, ZHAO Q, et al. Rhodojaponin II inhibits TNF-α-induced inflammatory cytokine secretion in MH7A human rheumatoid arthritis fibroblast-like synoviocytes[J]. Journal of Biochemical and Molecular Toxicology, 2020, 34(10): e22551.
[28] 夏德超, 杨天明, 朱景申, 等. 羊踯躅的研究进展[J]. 中药材, 2002, 25(11): 829-832.
[29] HU X M, TANG J H, ZENG G, et al. RGS1 silencing inhibits the inflammatory response and angiogenesis in rheumatoid arthritis rats through the inactivation of Toll-like receptor signaling pathway[J]. Journal of Cellular Physiology, 2019, 234(11): 20432-20442.
[30] DA SILVEIRA K L, DA SILVEIRA L L, THORSTENBERG M L, et al. Free and nanoencapsulated vitamin D3: Effects on E-NTPDase and E-ADA activities in an animal model with induced arthritis[J]. Cell Biochemistry and Function, 2016, 34(4): 262-273.
[31] ZHANG Q, PENG W, WEI S, et al. Guizhi-Shaoyao-Zhimu decoction possesses anti-arthritic effects on type II collagen-induced arthritis in rats via suppression of inflammatory reactions, inhibition of invasion & migration and induction of apoptosis in synovial fibroblasts. Biomed Pharmacother, 2019, 118: 109367.
[32] HU X, TANG J, ZENG G, et al. RGS1 silencing inhibits the inflammatory response and angiogenesis in rheumatoid arthritis rats through the inactivation of Toll-like receptor signaling pathway. J Cell Physiol, 2019, 234(11): 20432-20442.
[33] ZHANG Y Q, MAO X, LI W J, et al. Tripterygium wilfordii: An inspiring resource for rheumatoid arthritis treatment[J]. Medicinal Research Reviews, 2021, 41(3): 1337-1374.
[34] SHEN P, LIN W J, BA X, et al. Quercetin-mediated SIRT1 activation attenuates collagen-induced mice arthritis[J]. Journal of Ethnopharmacology, 2021, 279: 114213.
[35] FIGUS F A, PIGA M, AZZOLIN I, et al. Rheumatoid arthritis: Extra-articular manifestations and comorbidities[J]. Autoimmunity Reviews, 2021, 20(4): 102776.
[36] CHEN Z, WANG H Q, XIA Y, et al. Therapeutic potential of mesenchymal cell-derived miRNA-150-5p-expressing exosomes in rheumatoid arthritis mediated by the modulation of MMP14 and VEGF[J]. Journal of Immunology, 2018, 201(8): 2472-2482.
[37] DAI C Q, KUO S J, HU S L, et al. VEGF-C gene polymorphisms increase susceptibility to rheumatoid arthritis[J]. International Journal of Medical Sciences, 2019, 16(10): 1397-1403.
[38] LEE Y H, BAE S C. Correlation between circulating VEGF levels and disease activity in rheumatoid arthritis: A meta-analysis[J]. Zeitschrift Für Rheumatologie, 2018, 77(3): 240-248.
[39] MELINCOVICI C S, BO[S][5]CA A B, [S][5]U[S][5]MAN S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Revue Roumaine De Morphologie et Embryologie, 2018, 59(2): 455-467.
[40] TATEMATSU N, WAGURI-NAGAYA Y, KAWAGUCHI Y, et al. Mithramycin has inhibitory effects on gliostatin and matrix metalloproteinase expression induced by gliostatin in rheumatoid fibroblast-like synoviocytes[J]. Modern Rheumatology, 2018, 28(3): 495-505.
[41] DU H Y, ZHANG X, ZENG Y C, et al. A novel phytochemical, DIM, inhibits proliferation, migration, invasion and TNF-α induced inflammatory cytokine production of synovial fibroblasts from rheumatoid arthritis patients by targeting MAPK and AKT/mTOR signal pathway[J]. Frontiers in Immunology, 2019, 10: 1620.
[42] DAS S, AMIN S A, JHA T. Inhibitors of gelatinases (MMP-2 and MMP-9) for the management of hematological malignancies[J]. European Journal of Medicinal Chemistry, 2021, 223: 113623.
[43] 井維尧, 杜小正, 田杰祥, 等. 基于TLR4/NF-KB通路的类风湿性关节炎滑膜炎症发病机制及中医药治疗研究进展[J]. 甘肃中医药大学学报, 2022, 39(2): 84-89.
[44] BAHRAMI A, PARSAMANESH N, ATKIN S L, et al. Effect of statins on toll-like receptors: A new insight to pleiotropic effects[J]. Pharmacological Research, 2018, 135: 230-238.
[45] ZHANG Y D, JI T F, MA S, et al. MLL1 promotes migration and invasion of fibroblast-like synoviocytes in rheumatoid arthritis by activating the TRIF/NF-κB signaling pathway via H3K4me3 enrichment in the TLR4 promoter region[J]. International Immunopharmacology, 2020, 82: 106220.
[46] GOMES DA SILVA I I F, LIMA C A D, SILVA J E A, et al. Is there an inflammation role for MYD88 in rheumatoid arthritis?[J]. Inflammation, 2021, 44(3): 1014-1022.
[47] MITCHELL J P, CARMODY R J. NF-κB and the transcriptional control of inflammation[M]//International Review of Cell and Molecular Biology. Amsterdam: Elsevier, 2018: 41-84.
[48] 李 梅, 蒋锦梅, 欧大明, 等. 白术多糖对类风湿性关节炎大鼠的抗炎作用及TLR4/NF-κB信号通路的影响[J]. 安徽医科大学学报, 2022, 57(4): 552-557
[49] 张传英, 胡 玲, 蔡荣林, 等. 艾灸对类风湿性关节炎大鼠踝关节滑膜组织Toll样受体4/核因子-κB信号通路的影响[J]. 针刺研究, 2018, 43(11): 687-691.
[50] 李宗祥, 肖 凯. 基于TLR4/NF-κB信号通路探讨通痹胶囊对胶原诱导型关节炎治疗机制的研究[J]. 中国免疫学杂志, 2019, 35(12): 1453-1457.

