纳差,黄疸,血糖升高,血清IgG4水平升高
张 宁,武 娟,孙晓红,康 琳,袁 灵,杨华夏,罗 玲, 芦 波,周 翔,张 文
中国医学科学院北京协和医院 1老年医学科 2内科学系 3放射科 4风湿免疫科 5感染内科 6消化内科 7内分泌科,北京 100730
1 病历简介
患者男性,68岁,主诉“纳差2个月,皮肤及巩膜黄染1个月”,于2022年7月28日收住北京协和医院老年医学科。
1.1 现病史
2022年6月,患者出现皮肤、巩膜黄染,尿色加深,进行性加重,否认腹痛、呕吐、发热、大便颜色及性状改变。进食量减少,体质量下降7.5 kg。患者于外院查血常规:白细胞(white blood cell,WBC)7.75×109/L,中性粒细胞(neutrophil,Neut)68.2%,血红蛋白(hemoglobin,HGB)111 g/L,血小板(platelet,PLT)213×109/L;肝功能:谷丙转氨酶(alanine aminotransferase,ALT)61 U/L↑,谷草转氨酶(aspartate aminotransferase,AST)59 U/L↑,白蛋白(albumin,ALB)28 g/L↓,总胆红素(total bilirubin,TBIL)306 μmol/L↑,直接胆红素(direct bilirubin,DBIL)178.12 μmol/L↑,谷氨酰转移酶(glutamyltransferase,GGT)372 U/L↑,碱性磷酸酶(alkaline phosphatase,ALP)442 U/L↑;血清肿瘤标志物:CA19-9 3996 U/mL↑(参考值:≤34 U/mL),甲胎蛋白(alpha-fetoprotein,AFP)、CA12-5、SCCAg均正常。腹部超声检查示肝内外胆管扩张伴胆管壁局限性增厚,胰腺体积增大伴弥漫性病变。腹部增强CT检查示肝内外胆管扩张伴胆管壁增厚,胰腺形态饱满。患者于2022年7月13日行经皮经肝穿刺胆管引流(percutaneous transhepatic cholangial drainage,PTCD)后植入胆道支架,每日引流出黄色胆汁约300 mL。纳差、皮肤及巩膜黄染稍减轻。同期检查血糖升高,空腹血糖(fasting blood glucose,FBG)10~14.3 mmol/L,餐后2 h血糖(2h-postprandial blood glucose,2h-PBG)18~24 mmol/L,Hb1Ac 9.9%。诊断为糖尿病,睡前给予德谷胰岛素(8 U)皮下注射,三餐前给予门冬胰岛素(7 U)皮下注射,治疗后监测FBG 7~8 mmol/L,2h-PBG 10~18 mmol/L。发病以来,否认口干和眼干、腮腺肿大、眼睑肿胀、烦渴、多尿。
1.2 既往史、个人史、家族史
2012年患者因“胆囊炎”行胆囊切除术,白癜风7年,未治疗。无病毒性肝炎史。吸烟30余年,7~8支/d,戒烟2个月。婚育史、家族史无特殊。
1.3 入院查体
体温36.5 ℃,脉搏64次/min,呼吸21次/min,室温下脉搏血氧饱和度(pulse oxygen saturation,SpO2)96%;双上肢血压对称 138/73 mm Hg(1 mm Hg=0.133 kPa),身高 172 cm,体质量 62 kg,体质量指数(body mass index,BMI)21 kg/m2。全身皮肤及巩膜黄染(图1),散在色素缺失,未见肝掌及蜘蛛痣。心律齐,双肺呼吸音清,右上腹可见手术瘢痕,腹软,无压痛、反跳痛,双下肢无水肿。老年综合评估(comprehensive geriatric assessment,CGA)示日常生活活动(activity of daily living,ADL)6分;工具性日常生活活动(instrumental activity of daily living,IADL)8分;握力 24.7 kg;营养风险评估(nutrition risk screening 2022,NRS 2002)4分;简易智能状态评估量表(mini-mental State Examination,MMSE)30分。

图1 患者皮肤及巩膜黄染
1.4 实验室检查
血常规:WBC 9.12×109/L,Neut 78.2%,HGB 110 g/L,平均红细胞体积(mean corpuscular volume,MCV)90.1 fL,红细胞压积(hematocrit,Hct)34.1%,PLT 169×109/L;尿常规+沉渣:胆红素 LARGE μmol/L↑,余未见异常;粪便常规+潜血阴性,粪便苏丹Ⅲ染色(+)。
血生化:血钾3.2 mmol/L↓,ALB 28 g/L,AST 45 U/L,TBIL 215.6 μmol/L↑,DBIL 161.8 μmol/L↑,GGT 79 U/L↑,ALP 192 U/L↑,Cr 67 μmol/L;血清淀粉酶、脂肪酶阴性;红细胞沉降率(erythrocyte sedimentation rate,ESR)40 mm/h↑,超敏C反应蛋白108.16 mg/L↑;血清肿瘤标志物:CA19-9180.0 U/mL↑(参考值:≤34 U/mL),AFP、癌胚抗原(carcinoembryonic antigen,CEA)、CA 15-3、CA 242、CA 72-4均正常;血清IgG亚类测定:IgG4 6212 mg/L↑(参考范围:36~2090 mg/L)。
免疫相关检验:免疫球蛋白3项:IgG 19.01 g/L↑,补体C3、C4正常;抗核抗体谱:均为阴性;自身免疫性肝炎相关自身抗体谱、1型糖尿病相关自身抗体谱均无殊。
内分泌相关检验:HbA1c 8.2%;FBG 6.0 mmol/L,C肽0.73 μg/L ↓(参考范围:0.8~4.2 μg/L);2h-PBG 12.2 mmol/L,C肽 0.39 μg/L;促甲状腺激素(thyroid-stimulating hormone,TSH)4.482 μIU/mL↑,FT3、FT4均正常。
感染相关检验:结核T细胞检测(T-SPOT.TB):早期分泌抗原6(early secretory antigen-6,ESAT-6)1368FC/10S6MC↑(参考值:<24),培养滤液蛋白10(culture filtrate protein 10,CFP-10)204FC/10S6MC↑(参考值:<24);布氏杆菌凝集试验、结核菌素试验、尿抗酸染色、尿结核/非结核分枝杆菌核酸测定均为阴性。
1.5 影像学检查
腹部及胰腺增强磁共振成像(magnetic resonance imaging,MRI)+磁共振胰胆管成像(magnetic resonance cholangio pancreatography,MRCP):胰腺弥漫性病变,胰头受累为著;胆总管胰内段明显狭窄。超声内镜:胰腺实质弥漫回声减低,内部散在点片状强回声,胰头肿胀,未见明确占位性病变。PET/CT躯干断层显像:胰头代谢增高灶[最大标准摄取值(maximum standard uptake value,SUVmax)5.9](图2);胰体尾代谢弥漫轻度增高(SUVmax 3.7);胆总管上段管壁增厚,代谢增高(SUVmax 4.9);胆总管及肝内胆管扩张;心膈角、右侧肋膈角、肝门区、胰周、腹膜后多发代谢增高淋巴结(SUVmax 6.0);左侧颌下、左锁骨上下区多发代谢增高淋巴结(SUVmax 4.2);双肺门及纵隔、右腋下多发代谢增高淋巴结(SUVmax 3.8)。泌尿系超声:右肾萎缩(大小约6.6 cm×3.3 cm×3.1 cm),左肾代偿性增大,左肾集合系统稍分离。胃镜:慢性浅表萎缩性胃炎。结肠镜:结直肠多发息肉(较大者直径为0.8 cm),部分钳除,病理结果为腺管状腺瘤。涎腺超声:双侧腮腺、颌下腺回声轻度不均,双侧腮腺内、腮腺旁、颌下腺旁多发淋巴结皮质增厚,考虑反应性增生可能。
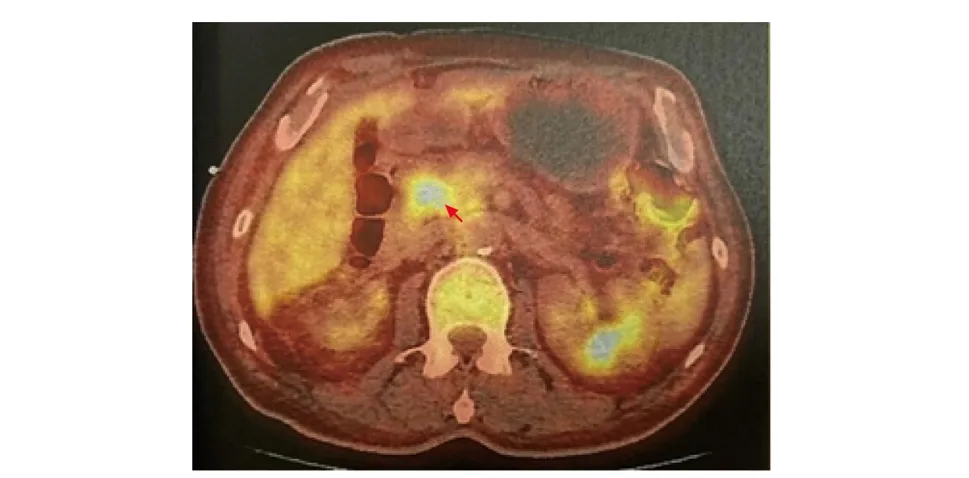
图2 患者PET/CT显像示胰头代谢增高灶(箭头)
1.6 诊疗经过
入院后继续经皮肝穿刺胆道引流(percutaneous transphepatic cholangial drainage,PTCD)管行胆汁引流,每日引流量为200~300 mL。患者黄疸、血糖高、炎性指标升高,结合血清IgG4水平显著升高及胰腺增粗、胆管狭窄、腹腔淋巴结肿大等影像学表现,考虑诊断为IgG4相关性疾病(IgG4-related disease,IgG4-RD)。
2022年8月4日起给予甲泼尼龙治疗(48 mg,1次/d),1周后TBIL 54.0 μmol/L,DBIL 44.6 μmol/L。2022年8月12日夹闭PTCD引流管,3 d后拔除PTCD引流管。给予少油低脂软食及肠内营养制剂(瑞代)450 kcal/d。2022年8月15日复查血清肿瘤标志物CA19-9由180.0 U/mL降至15.7 U/mL,体质量较入院时增加2 kg,复测握力25.4 kg。患者病情好转,于2022年8月18日出院。
2 多学科讨论(2022年8月31日)
患者出院后,组织多学科专家对该患者的进一步治疗方案进行讨论。
2.1 放射科
患者腹部及胰腺增强MRI检查结果提示胰头肿大,胰体尾相对纤细、短缩,胰腺小叶间隔消失;胰腺实质T1WI-fs信号不均匀减低,DWI信号不均匀增高,均以胰头为著;胰腺实质可见显著延迟强化;肝内多发胆管扩张,肝总管、左右肝管及其一级分支可见管壁环周增厚,DWI信号增高,增强后显著延迟强化(图3A)。MRCP检查结果提示肝内多发胆管扩张,以外周小胆管为著,与肝门部胆管管径不成比例;胆总管胰内段明显狭窄,上游肝外胆管稍扩张,与下段胆管狭窄程度不成比例;主胰管断续显影,多节段狭窄,且狭窄节段上游无明显扩张(图3B,3C)。综合影像学检查结果,符合IgG4-RD胰腺(弥漫型)及胆道(近端及远端)受累表现。
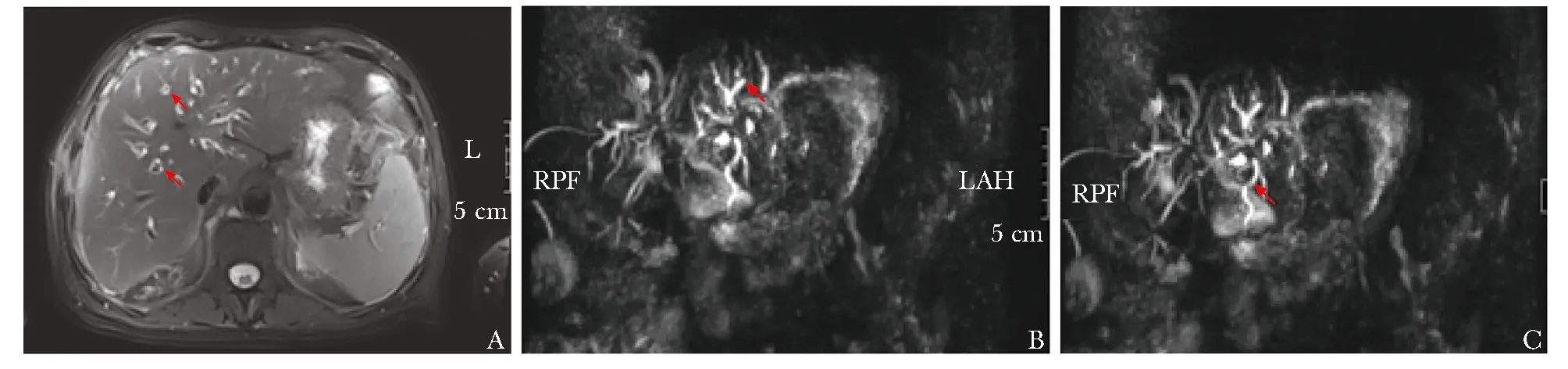
图3 患者腹部及胰腺增强MRI检查示DWI信号增强(A),MRCP检查示肝内多发胆管扩张(B,C)
2.2 老年医学科
患者老年男性,亚急性病程,主要表现包括:(1)黄疸:皮肤及巩膜黄染、尿色加深,TBIL及DBIL显著升高,伴微胆管酶升高;(2)血清IgG4水平显著升高;(3)炎症指标升高;(4)影像学检查提示胰腺弥漫性病变,以胰头为著;胆总管胰内段明显狭窄;胰头代谢增高灶;血清CA 19-9显著升高、CA242正常;(5)新发糖尿病;(6)外周血T-SPOT.TB水平显著升高。患者血清IgG4水平显著升高伴胰腺、胆管病变,需考虑IgG4-RD。IgG4-RD是一种免疫介导的慢性炎症伴纤维化疾病,可累及多个器官。常见表现类型包括:1型(IgG4相关性)自身免疫性胰腺炎(autoimmune pancreatitis,AIP);IgG4相关性硬化性胆管炎,通常与1型AIP同时发生;大唾液腺肿大或硬化性涎腺炎;泪腺、腮腺和下颌下腺肿大同时存在时,为IgG4相关性Mikulicz病;眼眶疾病,常伴有眼球突出;腹膜后纤维化,常伴有慢性主动脉周围炎,通常累及输尿管,导致肾积水和肾损伤[1]。特征性表现:以IgG4+浆细胞和小淋巴细胞为主的淋巴浆细胞组织浸润,可能伴有纤维化、闭塞性静脉炎以及组织嗜酸性粒细胞轻度增多。IgG4-RD相关性纤维化通常具有“席纹状”特征,典型表现为成纤维细胞和炎症细胞排列呈车轮状外观。大多数患者的血清IgG4水平升高。 IgG4相关性硬化性胆管炎多见于中老年男性,以梗阻性黄疸及上腹部不适为主要症状,其特征性病理改变为胆管壁全层大量IgG4+浆细胞和淋巴细胞浸润、广泛席纹状纤维化、闭塞性静脉炎等。因实际内镜操作中较难获取足够的组织样本,病理诊断存在困难,故影像学检查包括内镜下逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)、MRI等在诊断中具有重要意义。目前多采用日本《2020年更新版IgG4-RD综合诊断标准》作为诊断依据[2],标准包括:(1)临床及影像学特征:一个或多个器官显示特征性的弥漫性/局限性肿大;(2)血清学诊断:血清IgG4水平升高(>1350 mg/L);(3)病理学诊断:①大量淋巴细胞和浆细胞浸润,伴纤维化;②组织中浸润的IgG4+浆细胞与IgG+浆细胞比值>40%,且每高倍镜视野下IgG4+浆细胞>10个;③典型的组织纤维化,尤其是席纹状纤维化或闭塞性静脉炎;同时符合上述3条标准可确诊;符合①+③为可能诊断;符合①+②为可疑诊断[3]。
本例患者符合①+②,以黄疸为首发症状,同时存在AIP及硬化性胆管炎,经糖皮质激素治疗后胆红素水平快速下降,符合IgG4-RD临床诊断。针对我院既往收治的346例IgG4-RD患者的临床研究结果显示,17.1%的患者以黄疸为首发症状[4]。鉴别诊断方面,需要与胰腺及胆管肿瘤相鉴别:(1)胰腺癌:胰腺癌可引发无痛性黄疸,部分胰腺癌患者亦出现血清IgG4水平升高(通常<2倍正常上限),故不能仅凭血清IgG4水平升高而排除胰腺肿瘤。AIP的部分影像学特征有助于将其与胰腺癌区分,包括胰腺弥漫性增大,呈香肠状;胰腺周围环状水肿,伴门静脉期和静脉期出现均匀延迟强化[5]。术中或超声内镜活检是鉴别AIP与胰腺癌的金标准,通过内镜获得的活检样本相对较小。如难以通过临床特征鉴别,且活检存在困难,可尝试短程糖皮质激素治疗,经验性治疗通常可使1型AIP出现显著的影像学改变和临床改善[6]。(2)胆管细胞癌:与IgG4相关性硬化性胆管炎相比,胆管细胞癌更易出现梗阻性黄疸、胰腺肿大和淋巴结肿大。胆管细胞癌患者的血清胆红素和CA19-9水平往往更高,ERCP检查结果示肝门或胆管完全梗阻。对于本例患者,是否需进行超声内镜下胰头穿刺活检应综合评估风险/获益,以及患者自主意愿后决定。
本例患者入院后采用CGA评估其躯体情况、认知功能状态、心理健康和社会支持状况等,结果提示患者躯体及认知功能良好,肌肉力量无下降,但经NRS 2002量表筛查,提示有营养风险。根据欧洲肠外肠内营养学会(European Society of Parenteral and Enteral Nutrition,ESPEN)发布的《营养不良诊断标准的专家共识》[7],评估患者有营养风险,且病程中体质量下降>10%,存在营养不良。考虑到患者合并高血糖,给予补充糖尿病专用型肠内营养制剂,出院前患者体质量及握力均增加,提示营养干预有效。
患者既往无糖尿病史,病程中发现血糖、糖化血红蛋白显著升高,是否存在胰腺炎症继发胰岛β细胞破坏,导致胰源性糖尿病可能?请内分泌科医师予以指导。患者T-SPOT.TB水平显著升高,但无活动性结核感染证据。因目前使用糖皮质激素,是否给予预防性抗结核治疗?请感染科医师予以指导。
2.3 风湿免疫科
患者血清IgG4水平升高合并多系统受累,包括:(1)胆道病变:梗阻性黄疸,硬化性胆管炎;(2)胰腺病变:AIP,新发糖尿病;(3)多发腹腔淋巴结病变。2019年美国风湿病学会(American College of Rheumatology,ACR)/欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)发布的IgG4-RD分类标准,将IgG4-RD的诊断分为入选、排除及评分3个步骤。入选标准为典型器官(如胰腺、唾液腺、胆管、眼眶、肾等)出现特征性临床或放射学表现,或上述器官之一出现炎症伴有不明病因的淋巴浆细胞浸润的病理证据。排除标准包括临床、血清学、影像学和病理学指标共32项,符合上述任意一条标准,则不考虑进一步评分。若患者满足入选标准但不满足任意一条排除标准,则进行评分。根据组织病理学、免疫组化染色、血清IgG4水平、组织/器官受累情况进行相应积分,总积分≥20分则符合IgG4-RD分类[8]。该患者血清IgG4水平升高>2倍正常上限累积6分,胰腺和胆管树受累积19分,总积分为25分,且经入院详细排查不满足任意一条排除标准,符合IgG4-RD诊断。患者同时存在IgG4相关AIP及硬化性胆管炎。IgG4相关性硬化性胆管炎需与原发性胆汁性胆管炎(primary sclerosing cholangitis,PSC)鉴别,后者亦可引起肝内外胆管狭窄。PSC为一类原因不明的慢性胆汁淤积性肝病,导致门静脉区域及其周围炎症,胆管损伤、肝纤维化、肝硬化,与免疫学和遗传因素相关。典型PSC的胆管病理表现为淋巴细胞浸润、胆管细胞多形性损害及上皮细胞肉芽肿形成,又称“花绽样”胆管损害。在疾病早期(肝功能正常期)可出现抗核抗体(antinuclear antibody,ANA)、抗线粒体抗体(anti-mitochondrial antibody,AMA)等自身抗体。但若同时存在胆管受累和胰腺疾病(AIP的典型表现),IgG4-RD的可能性则较高[9]。结合该患者同时存在胆管、胰腺及多发淋巴结病变,且无阳性自身抗体,PSC可能性较小。
3 多学科讨论后处理
建议予患者甲泼尼龙48 mg/d(0.8 mg/kg),服用满3周后逐渐减量,每周减量4 mg,减至24 mg/d后,每2周减量4 mg,减至12 mg/d时复诊。考虑患者胰腺及胆道受累,激素减量过程中加用吗替麦考酚酯(mycophenolate mofetil,MMF)0.5 g(2次/d,口服)。同时关注患者合并老年综合征的情况。
4 最终诊断
IgG4-RD[AIP(弥漫型)]、胰源性糖尿病、硬化性胆管炎、梗阻性黄疸;营养不良。
5 进一步治疗与转归
出院后激素按计划减量,于2022年8月29日复查,TBIL 36.1 μmol/L,DBIL 26.8 μmol/L,ALB 32 g/L,ESR、超敏C反应蛋白均正常。皮肤及巩膜黄染基本消退。继续服用肠内营养制剂(瑞代),每3~4天服用500 mL。自2022年9月20日起加用MMF 0.5 g、2次/d。2022年12月初进行电话随访,患者精神佳,每日可外出行走约1000步,体质量较出院时增加4 kg。于2022年12月6日复查T-SPOT.TB:ESAT-6 932FC/10S6MC↑(参考值:<24),CFP-10 72FC/10S6MC↑(参考值:<24),患者无发热、盗汗、咳痰等结核感染症状。远期转归有待进一步随访。
6 讨论
对于合并重要脏器受累的IgG4-RD,如胰腺、胆道、肾脏、主动脉、纵隔、腹膜后和肠系膜等,可能导致严重不良结局时需积极治疗。中等剂量糖皮质激素为一线治疗方案,可根据病情调整剂量。免疫抑制剂或生物治疗可作为糖皮质激素效果不佳时的二线治疗。患者经CGA提示存在营养不良,其与老年患者不良临床结局密切相关,导致住院日延长、急性疾病后恢复期延长、术后并发症增加、再入院率增加,感染、压疮、跌倒、骨质疏松发生风险及死亡率升高[10]。经补充口服肠内营养后患者体质量增加、体力改善。对于老年患者,应在诊疗的同时进行CGA,以全面、定量化了解患者的功能状态、营养、认知、情绪状况及社会支持情况。对于通过评估发现的老年相关问题(如衰弱、肌少症、营养不良),应积极纠正其中的可逆因素。在疾病管理的同时维持或改善患者的功能状态,改善患者生活质量。
对于老年患者,还应注意临床决策的复杂性。尤其对于高龄、多病共存、衰弱、失能的老年患者,临床决策多为倾向敏感性决策,即尚无足够的证据或需主观权衡,缺乏确切的最佳治疗方案,因此,治疗团队应在运用医学专业知识,与患者充分讨论治疗选择、获益与损伤等各种可能情况,并考虑到患者的价值观、倾向性及处境后,由医生及患者共同决定最适合患者个体的治疗方案,又称医患共同决策。在原发病治疗方面,考虑到患者年龄及血糖情况,最终选择中等剂量糖皮质激素及快速减量,并联合小剂量MMF的治疗方案。MMF可选择性抑制T和B淋巴细胞增殖,骨髓抑制作用及肝毒性均小于传统免疫抑制剂[11]。糖皮质激素联合MMF方案亦有循证医学证据支持。对于本例患者,于胰头代谢增高处穿刺活检有助于明确病理,但存在较大的出血及继发胰腺损伤风险,且患者及家属对穿刺的顾虑亦很大,经医患共同决策,最终选择密切随访观察。
在该患者诊疗过程中,多学科团队共同参与和讨论,逐步厘清病因,释疑解惑,体现了多学科协作在老年疑难病诊疗中的重要作用。
7 专家点评
北京协和医院老年医学科孙晓红教授
该患者老年男性,以黄疸起病,多系统受累,经多学科团队查房,最终诊断为IgG4-RD,胰腺及胆管受累,继发梗阻性黄疸。经中等剂量糖皮质激素联合MMF,以及营养支持治疗后黄疸消退、体质量增加、躯体功能改善。回顾整个诊疗过程,值得关注的要点包括:(1)需注意IgG4-RD的鉴别诊断。IgG4-RD是一类具有很强“伪装性”的疾病。临床上,IgG4水平升高还可见于自身免疫性疾病、消化系统疾病、淋巴增殖性疾病、实体肿瘤以及过敏性疾病等。多种疾病均可出现类似IgG4-RD的典型部位受累,甚至组织病理也可表现为IgG4+浆细胞浸润;而IgG4-RD也因可累及多个脏器/系统,常被误诊为胰腺/胆管/肾盂肿瘤等疾病,对此需要加以鉴别。(2)注重CGA在诊疗中的价值。通过CGA可及时识别老年患者合并的老年综合征并纠正其中的可逆性因素。在治疗原发病的同时,需注意维持患者的营养和功能状态。(3)医患共同决策。老年患者常多病共存,同时合并衰弱、躯体功能下降、易损性增加等老年问题。对于病情复杂老年患者的医疗决策,应综合权衡风险/获益、预期生存并与患者及家属共同作出决策。
作者贡献:张宁、武娟负责病例整理、论文撰写及修订;孙晓红负责论文构思及修订;康琳、袁灵、杨华夏、罗玲、芦波、周翔、张文负责参与多学科讨论并提供诊疗思路。
利益冲突:所有作者均声明不存在利益冲突
注:本文发表已获得患者本人知情同意。

