放射性药物联合免疫检查点抑制剂协同抗肿瘤研究新进展
曾馨莹,文雪君,郭志德,张现忠
1厦门大学公共卫生学院分子影像暨转化医学研究中心 分子疫苗学与分子诊断学国家重点实验室,福建厦门 361102 2中国医学科学院北京协和医院核医学科,北京 100730 3中国医学科学院临床医学研究所,北京 100730
近10年来,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)在肿瘤治疗领域取得了重大突破。2011年,第一个靶向细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte antigen 4,CTLA-4)的ICI伊匹单抗(Ipilimumab)获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于晚期黑色素瘤的治疗,此后多个靶向程序性死亡受体1及其配体(programmed death-1/ligand 1,PD-1/PD-L1)及淋巴细胞激活基因-3(lymphocyte activation gene-3,LAG-3)的ICI陆续上市[1-2]。虽然ICI在多种转移性、难治性恶性肿瘤中获得了持久反应性,但患者对于ICI单药的响应率仅为20%~40%[3-4]。而ICI治疗产生的免疫相关不良事件及获得性耐药均可导致疾病进展[4],因此,与其他治疗方式联合成为ICI治疗的新方向[2]。
研究表明,外照射放疗(external beam radiation therapy,EBRT)可引起肿瘤细胞DNA损伤、信号转导调节以及肿瘤免疫微环境(tumor immune microenvironment,TIME)重塑[5]。EBRT通过均匀的低传能线密度(linear energy transfer,LET)射线,包括X射线及γ射线(0.2 keV/μm),以高吸收剂量率(1~2 Gy/min)靶向照射部位[6],导致肿瘤细胞DNA损伤,激活cGAS-STING-IRF3-Type Ⅰ干扰素(interferon,IFN)信号级联反应,招募调节性T细胞(regulatory T cells,Tregs)、髓源性抑制细胞(myeloid-derived suppressor cells,MDSC)等免疫抑制细胞,诱导适应性免疫反应[7-8],同时引起TIME中PD-L1表达上调,负性调节肿瘤浸润T细胞引起肿瘤耐药或复发[5,9]。因此,多个研究证明了EBRT与ICI的协同作用[10-11]。Twyman-Saint等[12]发现,PD-L1抗体的加入可逆转EBRT联合CTLA-4抗体引起的T细胞耗竭,增加黑色素瘤对联合治疗的响应率。然而EBRT作为一种局部治疗方式,即便通过免疫介导引起“远隔效应”,也仅有少数患者能因此获益[13-14]。
靶向放射性核素治疗(targeted radionuclide therapy,TRT)是一种内放射治疗,其中放射性药物通过全身给药特异性定位于靶点,向肿瘤传递细胞毒性辐射。TRT以低吸收剂量率(<1 Gy/h)长时间照射靶部位,射线的类型与放射性核素有关,包括α、β粒子及俄歇电子。LET及最大穿透深度也与核素衰变类型相关,α粒子具有较高的LET(50~230 keV/μm)和较小的穿透深度(50~100 μm);β粒子则具有更低的LET(0.2 keV/μm)和几十至数百个细胞(mm级别)的穿透距离;俄歇电子的LET为4~25 keV/μm,组织穿透最大深度<1 μm[6]。因此,EBRT对于TIME的调节作用不能简单地外推至TRT[15-16]。研究发现,高剂量TRT诱导DNA双链断裂,可上调膜联蛋白A1及钙网蛋白[17],激活Ⅰ型IFN,其幅度和时间过程与EBRT相当,而低剂量的TRT则表现出明显的免疫调节作用,包括促炎细胞因子及细胞毒性T细胞(cytotoxic T lymphocytes,CTLs)的浸润[18-19]。然而,EBRT通过同源重组、非同源末端连接及碱基切除修复诱导DNA双链修复,TRT却通过跨损伤合成修复受损的DNA[20]。同时,Grzmil等[20]通过蛋白质组学研究发现,EBRT与TRT诱导了不同信号通路的激活,TRT主要影响表皮生长因子受体、丝裂原活化蛋白激酶、整合素和雌激素受体的信号转导。
本文将聚焦于该领域最新研究进展,对TRT联合PD-L1抗体治疗的模式及其机制进行综述,以期指导临床实践。
1 靶向治疗放射性药物联合ICI治疗
1.1 β核素放射性药物联合ICI治疗
1.1.1 碘[131I]
131I衰变发射β粒子及γ光子,是最早用于TRT的放射性核素。Rouanet等[17]比较了131I-ICF01012与ICI的不同组合方案,发现无论是否加入PD-1/PD-L1抗体,对于治疗效果均无显著影响,但观察到了TRT联合CTLA-4抗体后T细胞衰竭相关基因CD274、LAG3和Eomes增加。而131I-MnO2-BSA作为一种放射增敏剂,可改善肿瘤乏氧,诱导肿瘤细胞免疫原性死亡,上调PD-L1的表达,抑制原发及转移瘤的生长[21]。
1.1.2 钇[90Y]
90Y具有纯β发射、能量强、半衰期短的特点,在Patel等[19]的研究中,发现中等剂量的EBRT与低剂量90Y-NM600(1.85 MBq)对于提高ICI疗效的作用是互补的。具体来说,联合治疗增加了总免疫细胞、CTLs、效应记忆T细胞(effector memory T cell,TEM)和γδ T细胞的数量,进而增加IFN-γ分泌,起到缓解肿瘤负担及减少自发转移的作用,联合中等剂量EBRT诱导远隔效应,可进一步缓解原发及转移瘤负担[19]。另有研究将此策略应用于Lewis肺癌模型治疗,仅用EBRT联合CTLA-4抗体治疗能够减少肿瘤转移,但在联合了90Y-NM600治疗后,能达到肿瘤完全缓解并诱导免疫记忆[22]。但Potluri等[23]研究发现,90Y-NM600联合PD-1抗体治疗对前列腺癌无效,其原因是PD-1抗体激活了Tregs,从而可导致免疫抑制。
1.1.3 镥[177Lu]
177Lu是最常用的TRT核素,其标记的探针177Lu-DOTATATE[24]和177Lu-PSMA-617[25]已获得美国FDA批准分别用于神经内分泌瘤及转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)。其中177Lu-DOTATATE联合纳武单抗(Nivolumab)的Ⅰ期临床试验证明了其安全性,在晚期神经内分泌肿瘤及广泛期小细胞肺癌中显示出抗肿瘤效果,总缓解率为14.3%(NCT03325816)[26]。177Lu-DOTATATE与伊匹单抗、纳武单抗联合使用在转移性Merkel细胞癌[27]、侵袭性垂体瘤患者[28]中能够安全且有效地缓解肿瘤进展。目前仍有几项177Lu-DOTATATE联合PD-1/PD-L1抗体治疗多种恶性肿瘤的临床试验(NCT04261855,NCT03457948,NCT05583708,NCT05142696,NCT04525638)正在进行中。
Prasad 等[29]在帕博利珠单抗(Pembrolizumab)或奥拉帕尼(olaparib)治疗无效的前列腺癌患者中,联合使用177Lu-PSMA-617治疗后前列腺特异性抗原水平趋于稳定。目前联合177Lu-PSMA-617及ICI用于mCRPC患者治疗的多项临床试验(NCT03805594,NCT03658447,NCT05150236)正在开展中。
Chen等[30]用177Lu-EB-RGD联合多剂量PD-L1抗体在鼠结直肠癌模型中诱导CD8+T细胞浸润,显著抑制了肿瘤生长,且提出TRT与ICI的给药时间窗对于治疗效果至关重要的观点。在此基础上,本研究团队进一步探索了177Lu-DOTA-EB-cRGDfK(177Lu-DER)联合治疗的给药策略,在体内外证明了放射性核素刺激后PD-L1表达呈时间及剂量依赖性上调,在TRT后4 h通过尾静脉注射PD-L1抗体能够大大提高联合治疗的疗效,联合治疗组小鼠血清促炎细胞因子、CTLs及CD4+辅助T细胞(helper T cells,Th1)浸润增加,肿瘤完全缓解并获得特异性免疫记忆效应[31]。随后用64Cu-DOTA-EB-cRGDfK(64Cu-DER)验证了该给药策略的有效性,提示该策略可推广至不同的放射性核素标记的探针中[32]。
此外,177Lu-DOTA-Folate[33]、177Lu-DOTA-Y003[34]、177Lu-h8C3[35]、177Lu-LLP2A[36]及177Lu-DNP-DOTA-BSA[37]联合ICI治疗均可抑制肿瘤生长并延长荷瘤小鼠生存期。
1.2 α核素放射性药物联合ICI治疗
1.2.1 锕[225Ac]
由于α射线独特的优势,包括能量高、射程短、能够诱导DNA双链不可修复的断裂等[38],α-TRT成为新的研究热点。与β-TRT相比,α-TRT剂量极低,225Ac-PSMA-617(30 kBq)联合PD-1抗体在RM1-PGLS模型中能够抑制肿瘤生长,达到部分完全缓解[39]。然而225Ac-DOTA-anti-PD-L1 Ab (14.8 kBq)联合PD-L1抗体(322 μg)同时给药却降低了小鼠的生存率[40]。
1999年,第一代BMW X5正式与公众见面。出色的外形与先进的车辆配置让第一代X5成为了豪华运动型多功能车(SAV)细分市场的开辟者和领导者,人们第一次意识到,原来运动也可以与体型庞大的全轮驱动车型紧密联系在一起。强大的产品性能和品牌魅力是BMW X5赢得消费者青睐的根本,三代车型用超过210万辆的总销量证明了自己雄厚的实力。在刚刚结束的第18届广州车展上,全面升级的第四代车型正式来到了中国消费者身边。这一次,BMW希望用全新X5彰显SAV车型的设计初衷:引人注目的越野性能,在崎岖地形中的可靠表现,BMW的豪华特色以及标志性动态性能。
1.2.2 砹[211At]
多聚ADP核糖聚合酶靶向的探针211At-MM4导致的DNA损伤,激活了先天免疫反应,CD4+、CD8+T细胞及巨噬细胞浸润增加,联合PD-1抗体治疗U87MG脑胶质瘤模型达到了完全缓解,65 d无进展[41]。Zhang等[42]开发的基于锰基纳米的放射免疫治疗促进剂211At-ATE-MnO2-BSA,联合了α-TRT、化学动力治疗及PD-L1抗体治疗。研究发现,211At-ATE-MnO2-BSA激活了树突状细胞(dendritic cells,DCs),与PD-L1抗体联合使用可进一步增加CTLs、促炎细胞因子及 TEM浸润,有效抑制了肿瘤的生长、转移及复发[42]。
1.2.3 镭[223Ra]
二氯化镭(Xofigo,223RaCl2)经美国FDA批准已用于治疗mCRPC的骨转移,223Ra处理后促进了CTLs的杀伤作用,增加了主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅰ和钙网蛋白的表达[43]。在临床研究中发现,经223Ra治疗的患者免疫抑制性T细胞(表达TIM-3、PD-L1和PD-1)比例增加,同时Tregs及MDSC浸润增加,联合PD-L1抗体能够改善治疗效果[44-45]。在一项Ⅰb期临床研究(NCT02814669)中,评估了223Ra联合阿替利珠单抗(Atezolizumab)在mCRPC患者中的安全性和有效性,但联合治疗并未表现出更好的疗效,所有治疗组的中位总生存期为16.3个月,中位无进展生存期为3个月,但却增加了治疗相关毒性[46]。同时研究也发现产生治疗相关不良反应主要与阿替利珠单抗有关,因此目前正在进行的其他临床研究将Xofigo与帕博利珠单抗(NCT03996473)、纳武单抗(NCT04109729)或阿维单抗(NCT04071236)联合使用,用于晚期前列腺癌及非小细胞肺癌的骨转移治疗。
1.2.4 其他α核素
联合治疗的给药策略也是影响疗效的重要因素,剂量分割是提高EBRT联合ICI的常见方案,而对于α-TRT,一次给药效果优于多次给药。212Pb-VMT01联合CTLA-4及PD-1抗体治疗后,43%的肿瘤完全缓解,而接受多次给药方案的肿瘤最终发生进展[47]。
Nosanchuk等[48]则发现,基于213Bi的α-TRT与联合CTLA-4抗体的治疗效果无差异。213Bi的免疫调节作用依赖于损伤相关的分子模式(damage associa-ted molecular patterns,DAMPs)的释放并激活DCs,治疗后肿瘤组织Tregs下调,白细胞介素(interleukin,IL)-2、趋化因子C-C-基元配体 (chemokine C-C-motif ligand,CCL)-5及IFN-γ短暂上调,产生肿瘤杀伤作用[49-50]。
2 靶向诊断放射性药物联合ICI治疗
据文献报道,高剂量的经典诊断探针2-[18F]FDG (74-148 MBq)治疗可抑制肿瘤生长并适度延长生存期,提示诊断核素在肿瘤治疗中具有较大潜力[53-55]。如图1所示,本研究团队创新性地采用2-[18F]FDG联合PD-L1抗体治疗荷瘤小鼠,以静脉注射37 MBq或18.5 MBq 2-[18F]FDG后4 h联合400 μg PD-L1抗体治疗为一个疗程,两个疗程后(d0及d4)部分肿瘤完全缓解(5/8或4/8),且治愈后再次接种肿瘤细胞未发现肿瘤生长[56]。进一步研究发现,联合治疗组小鼠脾脏内的TEM(CD8+/CD4+CD44highCD62Llow)维持在较高水平,提示小鼠有免疫记忆产生;在治疗过程中,血清中促炎细胞因子IFN-γ、肿瘤坏死因子(tumor necrosis factor,TNF)-α及IL-6,TIME中Th1及CTLs于7 d内维持在较高水平,而单独2-[18F]FDG或PD-L1治疗组的细胞因子水平和CTLs水平轻度增高并于7 d内耗竭。Tregs(CD45+CD4+FOXP3+)、M2型巨噬细胞(CD206+F4/80+)及MDSC(CD45+CD11b+Gr-1+)仅在联合治疗组中下降,M1型巨噬细胞(iNOS+F4/80+)和DCs(CD80+CD86+)则显著上调。以上发现提示联合治疗对TIME的调控作用,相比于单独治疗组,联合治疗不仅更大程度地激活了小鼠的适应性免疫,还降低了免疫抑制性细胞水平,改善了免疫治疗的耐药性。
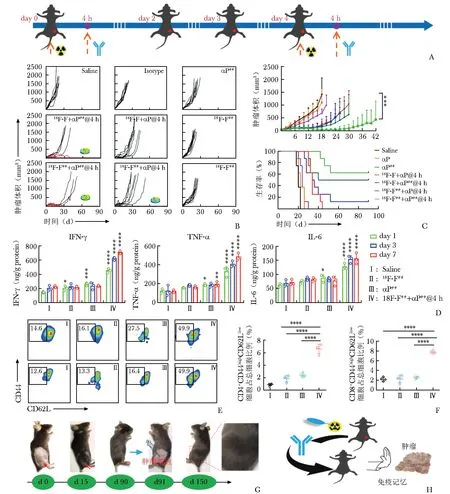
图1 2-[18F]FDG联合PD-L1 ICI治疗可显著延缓肿瘤生长,提高荷瘤小鼠总生存期
本课题组进一步探究了2-[18F]FDG的免疫调节作用,发现2-[18F]FDG在体外可导致DNA损伤,但仍保持复制及自我修复能力(图2A,2B)。同时,2-[18F]FDG通过激活NF-κB P65通路,与IRF3相互作用,促进PD-L1的转录,在体外呈时间及剂量依赖性上调;进一步研究发现,STAT1、STAT3和IRF1的敲低影响NF-κB P65的磷酸化(图2C,2D及图3),因此PD-L1的上调也受STAT1/3-IRF1通路调控[56]。
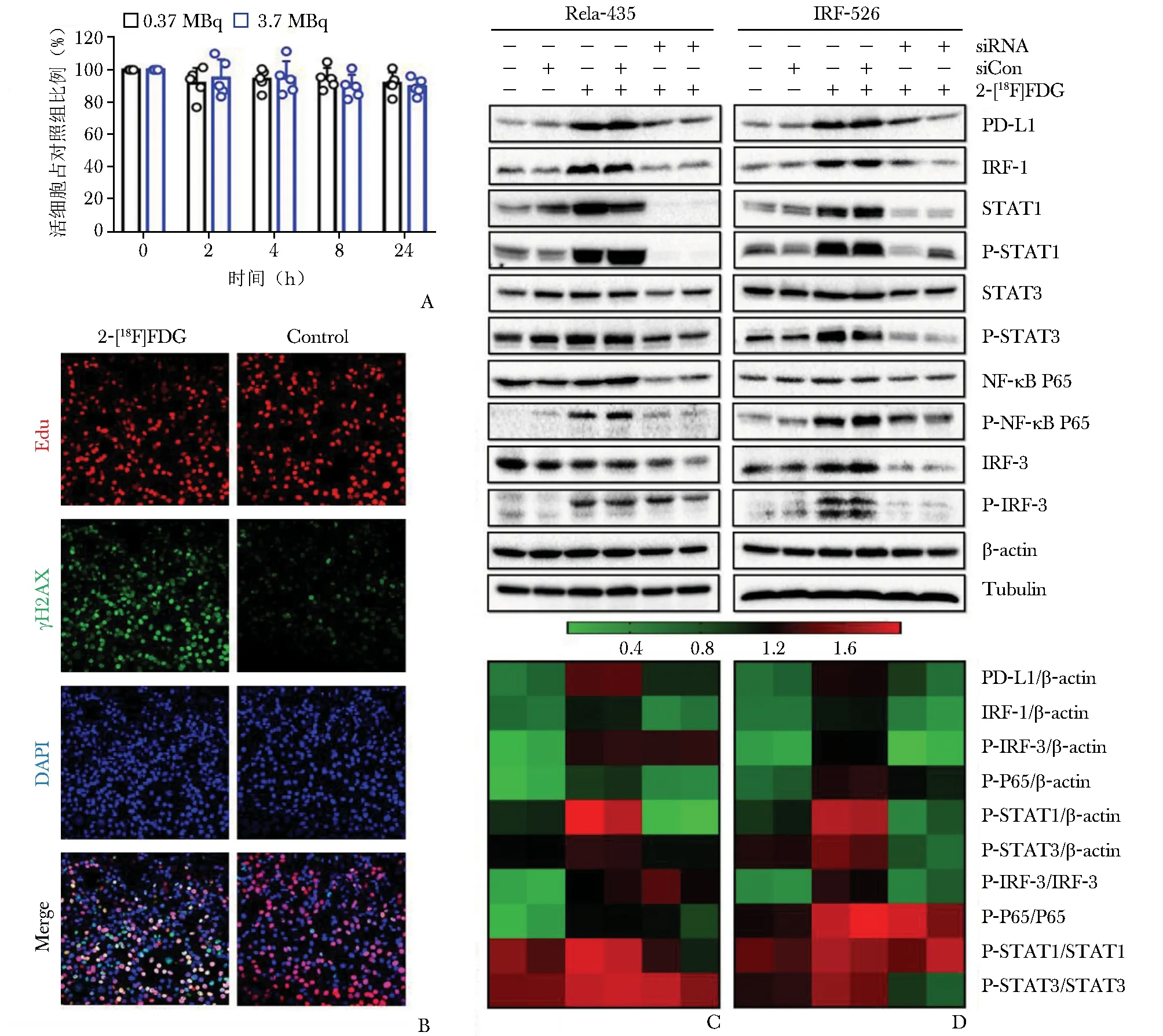
图2 2-[18F]FDG诱导的PD-L1上调通过NF-κB/IRF3途径介导
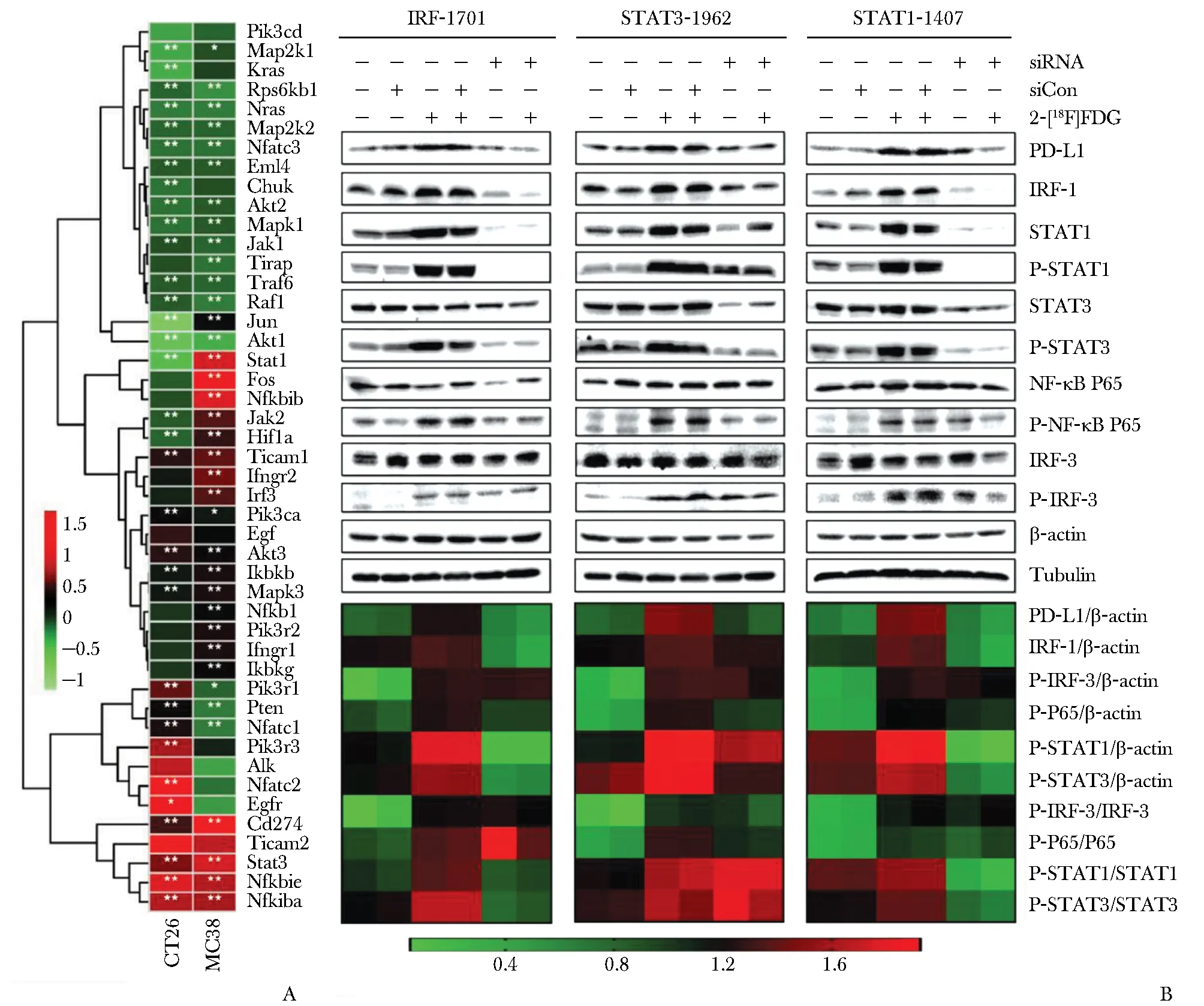
图3 2-[18F]FDG诱导的PD-L1上调与经典STAT1/3-IRF1通路相关
本课题组亦探索了纯发射γ射线的核素99mTc标记的RGD对TIME的调节作用,发现同2-[18F]FDG一样,99mTc刺激PD-L1在多种肿瘤细胞系中上调。随后比较了不同联合治疗方案的疗效,发现18.5 MBq或37 MBq99mTc-RGD联合400 μg PD-L1抗体在4 h时间窗给药效果最佳,部分小鼠的肿瘤完全治愈(6/8)且90 d内无复发[57]。
3 小结与展望
总结近5年发表的放射性药物联合ICI协同抗肿瘤治疗的临床前研究发现,该类研究主要围绕治疗核素展开,包括经典的β核素(177Lu、90Y)以及α核素(211At、225Ac)等(表1)。TRT上调了PD-L1表达,增加CTLs及Th1细胞浸润,为后续ICI治疗提供了免疫原性微环境。联合治疗可进一步调控TIME,增加促炎细胞因子、TEM、M1巨噬细胞等浸润,下调Tregs及MDSC,有效抑制肿瘤生长,延长生存期,产生免疫记忆效应,部分研究甚至达到完全缓解。然而,也有研究指出,联合治疗未能正向调控TIME,未能提高TRT的疗效[23,35,48]。
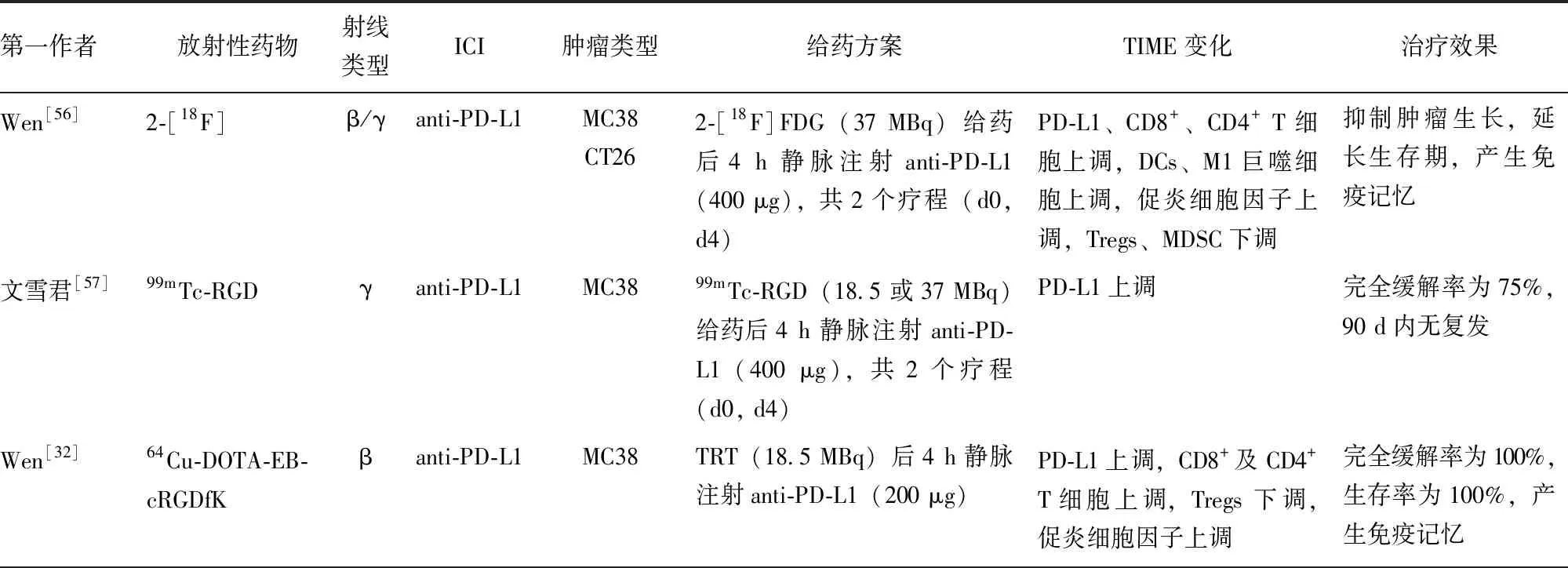
表1 近5年发表的放射性药物联合ICI治疗的临床前研究
本团队既往研究发现,131I刺激了肿瘤细胞PD-L1表达呈时间及剂量依赖性上调[58]。故在此基础上,进一步选用β核素177Lu及64Cu进行探索,发现64Cu不仅可用于诊断,还具有治疗潜力[59],用64Cu-DER联合PD-L1抗体的协同抗肿瘤治疗大大提升了64Cu-TRT的疗效[32]。此外,基于2-[18F]FDG的相关研究结果[53-55],本研究团队发现,2-[18F]FDG诱导PD-L1的表达上调由NF-κB/IRF3和STAT1/3-IRF1信号通路介导,与DNA损伤通路激活有关,且放射性刺激与PD-L1抗体的给药时间窗对于治疗效果至关重要。在2-[18F]FDG刺激下,PD-L1上调需要一定时间,而18F半衰期短,难以长时间诱导PD-L1上调,因此4 h的时间窗最为合适[56]。
综上所述,诊断放射性药物联合PD-L1抗体的免疫治疗新范式可以调控TIME,显著提高疗效。与TRT相比,诊断放射性药物具有多种优势,包括可及性高,制备简单及血液毒性小等,如能将诊断性核素标记的PET/SPECT示踪剂应用于肿瘤联合治疗,将极大拓宽其应用范围,改善现有治疗性核素产量有限,特别是我国目前严重依赖进口的现状,拓展传统的肿瘤治疗模式。因此,未来研究中应进一步拓展诊断放射性药物联合免疫治疗的组合,探索不同核素对肿瘤细胞及微环境中其他细胞的影响,促进此种治疗新范式的临床转化。
作者贡献:曾馨莹、文雪君负责文献检索、 论文撰写及修订;郭志德、 张现忠负责论文选题和审校。
利益冲突:所有作者均声明不存在利益冲突

