白藜芦醇治疗溃疡性结肠炎的网络药理学研究及实验验证
曹刘菁,吴与伦,张欣然,魏丽慧,沈阿灵,3,彭军,陈友琴
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.福建中医药大学科技创新与转化中心,福建 福州 350122;4.美国凯斯西储大学医学院,俄亥俄州 克利夫兰 44106)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性肠道炎症性疾病,是引起结肠炎相关性结肠癌的高危因素[1]。早期防治UC对降低结肠癌的发病率具有重要意义。中医药在治疗UC中优势显著,疗效确切,抗炎效果明显[2]。临床常用中药虎杖、桑白皮、土茯苓等具有抗炎作用[3-5],白藜芦醇是三者重要的活性成分,研究证实白藜芦醇具有抗炎、调节免疫等作用[6],可减轻UC患者的炎症[7-8],但其治疗UC的作用机制尚有待进一步探讨。本研究拟采用网络药理学研究探讨白藜芦醇治疗溃疡性结肠炎的相关机制并开展体内实验验证,以期阐明白藜芦醇治疗UC的新机制和新靶点,为临床治疗UC药物的研发提供更多的思路和方向。
1 实验材料
1.1 实验动物 6~8周龄SPF级雄性C57BL/6小鼠18只,体质量(21±3 g)购自上海斯莱克实验动物有限责任公司,饲养于福建中医药大学实验动物中心屏障系统,使用许可证号:SYXK(闽)2020-0002。
1.2 实验药物的配制 通过文献调研,小鼠按照100 mg/(kg/d)的剂量经口服给药。白藜芦醇加入蒸馏水配置成25 mg/mL的混悬液,现配现用。
1.3 实验试剂 白藜芦醇(上海阿拉丁生化科技股份有限公司,批号:501-36-0);葡聚糖硫酸钠(DSS)(美国MP Biomedicals公司,批号:0216011080-100 g),便血(OB)试剂(珠海贝索生物技术有限公司,批号:BA2020B);苏木素溶液、伊红溶液、4%多聚甲醛固定液(北京Solarbio公司,批号:G1140、G1100、LA0427);Western blot及IP细胞裂解液、ECL发光试剂盒、PMSF(南京碧云天公司,批号:P0013、P0018、P0100);PhosSTOPTM(德国Roche公司,批号:4906837001);蛋白Marker、BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司,批号:26617、23225);PVDF膜(德国Millipore公司,批号:ISEQ 00010);PI3K、p-Akt、Akt抗体(美国Cell Signaling Technology公司,批号:4257、4060、4691);GAPDH抗体(中国Abbkine公司,批号:ABL1021)。
1.4 实验仪器 自动脱水机与石蜡包埋机(湖北孝感亚光医用电子技术有限公司);全自动石蜡切片机、DM4000B显微镜(德国Leica公司);组织研磨机(上海净信实业发展有限公司);Western blot电泳仪、转膜仪、化学成像系统(美国Bio-Rad公司)。
2 实验方法
2.1 UC疾病靶点的收集 在DisGenet(http://www.disgenet.org/)数据库中,输入“ulcerative colitis”为检索词,搜集UC的相关靶点。
2.2 白藜芦醇作用靶点预测 在中药系统药理学平台(TCMSP,https://tcmspw.com/tcmsp.php)、Swiss Target Prediction(http://www.swisstargetprediction.ch/)、SymMap(http://www.symmap.org/)、BATMANTCM(http://bionet.ncpsb.org.cn/batman-tcm/)中获取白藜芦醇对应的蛋白靶点,在Unitprot数据库(http://www.Unitprot.org/)中查找蛋白统一的基因名,以此对检索得到的蛋白进行校正,从而获得白藜芦醇的作用靶点,去掉重复项后,与UC的作用靶点相映射,得到白藜芦醇治疗UC的共同靶点,即为白藜芦醇治疗UC的潜在靶点。
2.3 GO和KEGG富集分析 将预测的作用靶点导入DAVID数据库(https://david.ncifcrf.gov/)中进行GO(gene ontology)生物学过程富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)信号通路富集分析,得到并保存结果。以P<0.001为筛选条件,并且依据富集基因数的大小进行排序,选择KEGG通路富集分析中排名前20的通路及GO分类富集分析中排名前10的通路,采用R-Studio软件中的ggplot2来绘制气泡图。
2.4 构建靶点相互作用(PPI)网络 将白藜芦醇治疗UC的作用靶点导入STRING网络平台,物种选择“homo sapiens”,置信度设定>0.9,获取靶点的相互作用关系的信息表格。通过Cytoscape 3.7.2软件绘制潜在靶点PPI网络,同时对网络进行拓扑结构分析,确定白藜芦醇治疗UC的核心靶点。
2.5 小鼠溃疡性结肠炎模型的构建 通过周期性的自由饮用2%葡聚糖硫酸钠(DSS)溶液建立慢性UC模型,以21 d为1个周期循环,第1~7天给予2% DSS溶液让小鼠自由饮用,DSS溶液每2天更换1次,第8~21天更替为蒸馏水,重复2个周期,第43~49天继续自由饮用2% DSS溶液7天[9],第50天取材。
2.6 分组与干预 将18只C57BL/6小鼠适应性喂养1周后,随机分为对照组、模型组和白藜芦醇组,每组6只。采用“2.5”所示造模法构建慢性UC模型,造模的同时对小鼠进行给药处理,造模期间白藜芦醇组给予100 mg/(kg/d)混悬液经口服给药。对照组和模型组经口服给予等体积的蒸馏水。
2.7 疾病活动指数(disease activity index,DAI)评分计算 造模期间观察小鼠的体质量、大便的性状及便血情况,参照JACKSON等[10]的评估标准,计算DAI评分。同时记录小鼠体质量变化,制作百分比统计图,体质量均与给药第1天比较[11-12]。
2.8 组织取材与结肠长度测量 小鼠先经由2%异氟烷麻醉,之后脱颈处死小鼠,在冰上采集结肠组织(从肛门到回盲部为结肠位置),将其分离后拍照、测量,随后将其剪为3段,将靠近肛门的第1段浸泡于4%多聚甲醛中固定,剩余组织保存至-80 ℃超低温冰箱。
2.9 结肠组织病理学检测 取材后的结肠组织,4%的多聚甲醛溶液固定24 h后,经过脱水、透明、浸蜡处理后进行包埋,并将组织切成4 µm的薄片,用载破片承载后烘烤6 h,将其脱蜡至水,进行苏木精-伊红(HE)染色,镜下观察并拍照。
2.10 组织病理学评分 使用光学显微镜观察HE染色的组织切片并拍照分析,按照表1所示的评分标准从4个方面评估结肠组织病理情况,将每个部分评分相加得到的总分即为组织病理学评分。

表1 组织病理学评分标准
2.11 结肠组织Western blot检测 取材后的结肠组织样本加入适量的裂解液,置于组织研磨机上研磨,充分裂解后离心,收集上清,采用BCA法测定蛋白的总浓度,按相同质量的蛋白量进行SDS-PAGE电泳,转至PVDF膜上,用封闭液室温封闭1 h。将其置于p-Akt(1∶1 000)、Akt(1∶1 000)、PI3k(1∶1 000)和GAPDH(1∶5 000)一抗中,4 ℃摇床过夜,用含0.2% Tween的TBST洗膜15 min,加入相对应的二抗(1∶5 000)室温孵育1 h,TBST洗膜15 min,随后滴加1∶1的ECL发光液,用Bio-Rad凝胶成像仪器扫描成像。
2.12 统计学方法 采用SPSS 26.0统计软件进行数据处理。计量资料服从正态分布以()表示,2组间比较采用两独立样本t检验,3组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
3 结 果
3.1 白藜芦醇治疗UC的潜在靶点 采用DisGenet数据库检索疾病靶点,得到UC疾病靶点1 458个,TCMSP数据库,Swiss Target Prediction数据库、Sym-Map数据库、BATMAN-TCM数据库中获取白藜芦醇作用靶点358个。将白藜芦醇作用靶点与UC疾病靶点相映射,获得白藜芦醇可能作用于UC的潜在靶点127个,见图1。

图1 白藜芦醇潜在靶点
3.2 GO功能富集分析 运用DAVID数据库对白藜芦醇治疗UC的潜在靶点进行GO功能富集分析,通过设定P<0.001的指标,并根据富集基因数的大小进行排序,整理出排名前10项。GO富集功能分析显示涉及生物过程(biological process,BP)272个,包括药物反应、凋亡过程的负调控、衰老、对外界刺激的反应、基因表达、凋亡过程的正调控、细胞迁移的正调控、缺氧反应及过氧化氢反应等,见图2。细胞组分(cellular component,CC)28个,包括高分子复合物、细胞质、胞质溶胶、细胞外液、膜性小腔、膜筏、细胞表面、细胞外区、细胞核及细胞质膜等,见图3。分子功能(molecular function,MF)40个,包括酶结合、相同蛋白质结合、转录因子结合、血红素结合、蛋白质结合等,见图4。
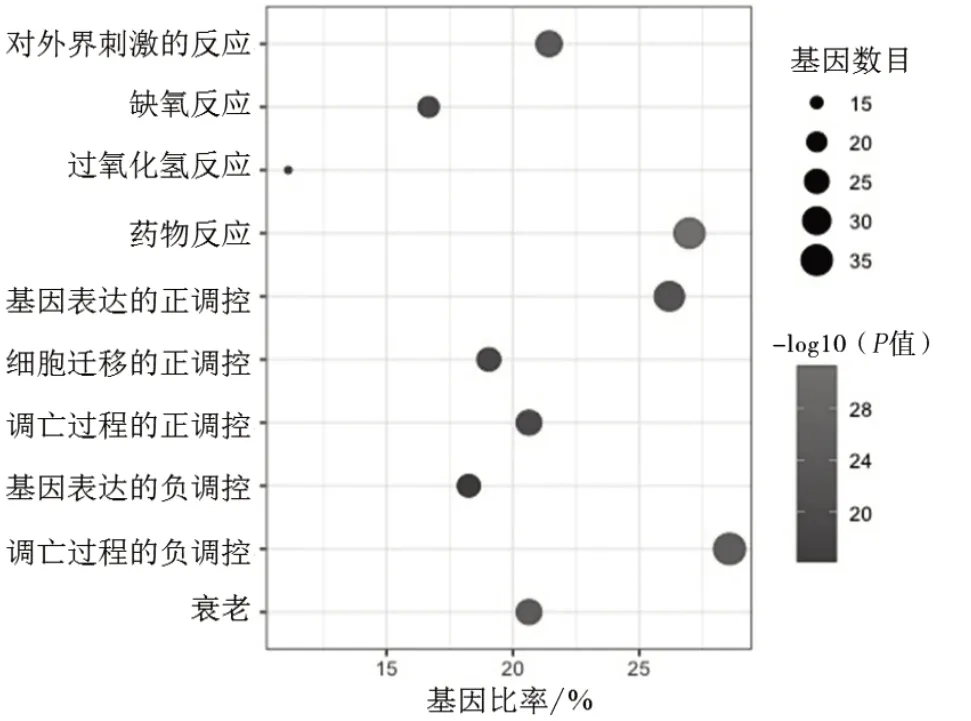
图2 白藜芦醇生物过程分析

图3 白藜芦醇细胞组分分析

图4 白藜芦醇分子功能分析
3.3 KEGG通路分析 采用 DAVID 数据库对交集靶点进行KEGG通路分析,共得到131条通路,以P<0.001作为筛选条件,依据富集基因数的大小进行排序,筛选得到了排名前20的通路。这些交集靶点主要富集在PI3K-Akt信号通路、脂质与动脉粥样硬化、乙型肝炎、糖尿病并发症的AGE-RAGE通路、TNF信号通路等通路。见图5。

图5 KEGG信号通路富集分析结果(前20名)
3.4 潜在靶点PPI网络的构建与分析 将白藜芦醇治疗UC的127个潜在靶点蛋白录入到STRING数据库中,构建蛋白相互作用PPI网络,得到127个节点,2 627条相互作用关系。使用Cytoscape 3.7.2软件对PPI网络数据进行绘制,节点度值的均值为41.37,≥均值的节点有59个;节点介数中心性的均值为0.006 044,≥该介数中心性2倍中位数的节点有35个。共有30个节点的度值和介数中心性均高于均值,包括Akt1、TNF、IL-6、TP53、STAT3、IL-1B、MAPK3和PTGS2等,这些靶点即为白藜芦醇的核心靶点。见图6。

图6 白藜芦醇核心靶点相互作用网络
3.5 白藜芦醇对UC小鼠体质量的影响 对照组小鼠正常饲养,体质量增加;与对照组相比,模型组小鼠体质量显著降低(P<0.05);与模型组小鼠相比,白藜芦组小鼠体质量显著升高(P<0.05)。见图7。

图7 白藜芦醇对UC小鼠体质量的影响
3.6 白藜芦醇对UC小鼠DAI评分的影响 3组小鼠取材前的DAI评分结果显示,对照组小鼠DAI评分为0分。与对照组比较,模型组小鼠的DAI评分显著提高(P<0.05);与模型组比较,白藜芦醇组小鼠DAI评分显著下降(P<0.05)。见图8。

图8 白藜芦醇对UC小鼠DAI评分的影响
3.7 白藜芦醇对UC小鼠结肠长度的影响 与对照组比较,模型组小鼠结肠的长度明显缩短(P<0.05);与模型组比较,白藜芦醇组小鼠结肠的长度的缩短明显缓解(P<0.05)。见图9。

图9 白藜芦醇对UC小鼠结肠长度的影响
3.8 白藜芦醇对UC小鼠结肠组织病理学的影响 对照组小鼠结肠的黏膜完整,腺体排列规则,未发现炎性细胞浸润,病理组织学评分为0分。与对照组比较,模型组小鼠结肠组织结构紊乱,腺体排列不规则,出现大量炎性细胞浸润,病理组织学评分显著增加(P<0.05)。与模型组比较,白藜芦醇组小鼠结肠组织结构趋向正常,腺体排列趋向整齐,炎性细胞浸润情况明显减轻,病理组织学评分明显降低(P<0.05)。见图10。

图10 白藜芦醇对UC小鼠结肠组织病理学损伤的影响
3.9 白藜芦醇对UC小鼠结肠组织中PI3K、p-Akt、Akt蛋白的影响 与对照组比较,模型组小鼠结肠组织蛋白中p-Akt/Akt比率明显升高(P<0.05),PI3K蛋白表达升高。与模型组比较,白藜芦醇组小鼠结肠组织蛋白p-Akt/Akt比率明显下降(P<0.05),PI3K蛋白表达降低。见图11。

图11 白藜芦醇对UC小鼠结肠组织中PI3K、p-Akt、Akt蛋白的影响
4 讨 论
白藜芦醇具有多种生物活性,可缓解UC症状,本研究通过TCMSP、BATMAN-TCM、Swiss Target Prediction、SymMap、DisGenet等多个数据库的挖掘,筛选并确定白藜芦醇可能作用于UC的潜在靶点127个。通过KEGG通路分析,富集到PI3K/Akt信号通路、HIF-1信号通路、FOXO信号通路等信号通路。战晶玉等[13]发现PI3K/Akt信号通路活化后对其下游mTOR的活化有促进作用,从而调控细胞的增殖、凋亡、炎症因子的分泌和肠道炎症反应来治疗UC。杨显娟等[14]研究结果证实,PI3K/Akt通路活化后可通过调控Bcl-2和cleaved Caspase-3蛋白的表达,影响细胞凋亡,从而影响UC的进展。PAZMANDI等[15]研究表明,HIF是缺氧应激应答的转录因子,HIF-1α在炎症性肠病(IBD)发病机制中发挥重要作用,影响先天性和适应性肠道免疫,它的普遍激活通过STAT3的活性增加RORγt的表达和FOXP3的抑制来促进Th17的极化,从而促进分泌促炎细胞因子IL-17、IFN-γ、TNF-α和TNF-β,随后通过刺激巨噬细胞产生IL-1、IL-6、IL-8、IL-12和IL-18进而促进炎症的发生,此外HIF-1α活化可增强糖酵解和葡萄糖摄取,促进炎症反应[16]。WANG等[17]研究表明,FOXOs转录激活或抑制下游靶基因,在增殖、凋亡、自噬、代谢、炎症、分化和抗应激等方面发挥重要作用。FOXO4的整体缺失可加剧结肠炎对炎症刺激的反应,另外FOXO转录因子可介导部LPS诱导的炎性细胞因子表达,其中FOXO1通过增强成熟巨噬细胞中由TLR4介导的对LPS的信号传导来促进炎症。
通过构建白藜芦醇治疗UC的潜在靶点PPI网络,发现Akt1、TNF、IL-6、TP53、STAT3和PTGS2等核心靶点。研究证实,Akt1可调节细胞增殖、分化,活化的Akt可以促进NF-κB的磷酸化,促进TNF-α等炎性因子的转录,造成细胞因子失衡,从而调控炎症反应[18]。在肠黏膜中,TNF-α和IL-6的活化可促进NF-κB的活化,随后通过正反馈调节进一步增加IL-6及TNF-α的分泌,由此发生级联反应,不断扩大炎症过程[19]。p53可以通过抑制NF-κB的活化抑制体内炎症的发生[20];也可通过调节巨噬细胞在M1方向的极化,抑制体内广泛的促炎基因的表达而发挥抗炎的作用,在炎症性肠病等慢性炎症向癌症的转化中发挥重要作用[21]。STAT3是IL-10下游的转录因子,可调节慢性肠道疾病,STAT3的激活可以刺激抗炎特性基因的表达,抑制促炎基因的表达进而发挥抗炎作用[22]。前列腺素-内过氧化物合酶2(PTGS2)是一种在炎症反应中具有特殊作用的关键基因,在肠上皮细胞和单核细胞中表达,对结肠黏膜愈合过程至关重要[23],另外PTGS2 mRNA水平升高是细胞铁死亡的关键特征[24],有助于UC的发展。
本研究体内实验结果提示白藜芦醇可明显改善慢性UC小鼠体质量下降、结肠长度缩短、DAI评分升高等状况;在病理学研究中,白藜芦醇干预后的小鼠结肠组织病理学评分显著降低;Western blot检测证实白藜芦醇干预后,小鼠结肠组织中PI3K、p-Akt/Akt蛋白表达降低,这些结果提示我们白藜芦醇可能通过调控PI3K/Akt通路发挥治疗UC的作用。
综上所述,本研究通过网络药理学探讨白藜芦醇治疗UC的分子机制,通过体内实验验证白藜芦醇可能通过调控PI3K/Akt信号通路缓解UC,为临床治疗UC药物的研发提供了思路和方向。本研究仅对PI3K/Akt这一信号通路进行了探索研究,未来可对网络药理学筛选的其他通路进一步验证。

